Похожие презентации:
Ковалентная связь. 11 класс
1. Самостоятельная работа
САМОСТОЯТЕЛЬНАЯ РАБОТАПриведите схему образования связи между элементами:
ВАРИАНТ 1
ВАРИАНТ 2
Калием и
азотом
Кальцием и
фосфором
Магнием и
фосфором
Алюминием и
фтором
2. г. кемерово МбоУ СОШ №92
Г. КЕМЕРОВО МБОУ СОШ №92Ковалентная
связь
11класс
Учитель химии высшей квалификационной категории
Барсуков Дмитрий Борисович
3.
Цели:Образовательная: 1. обобщить и систематизировать знания учащихся о видах
химической связи, в частности ковалентной связи.
2.Рассмотреть основные способы образования ковалентной связи
Развивающая:способствовать развитию навыков составления электронных
схем образования химических связей, соединений с ковалентным типом
связи и определения количества электронов в связи; развитию умений
определять типы связи на основании анализа состава химического
соединения, развитию интеллектуальных умений и навыков, диалектического
мышления, памяти.
Воспитывающая: продолжить формирование интереса к предмету и
химического видения мира, воспитывать самостоятельность, умение
сотрудничать с учителем и другими учащимися
4.
Интеграционные связи: физика – строение вещества , понятия«молекула», «атом» .
Методы: частично-поисковые, практические, наглядные.
Форма проведения урока: коммуникативно-диалоговая.
Формы организации деятельности учащихся: индивидуальная,
групповая, общеклассная.
Средства: таблицы «Периодическая система химических элементов
Д.И.Менделеева», таблицы: «Типы химических связей», «Неполярная
ковалентная связь», «Полярная ковалентная связь».
Тип урока: учебное занятие по изучению нового материала, оценки и
коррекции знаний и способов деятельности.
Мотивация – самостоятельное выполнение заданий – самоконтрольконтроль-анализ, оценка-коррекция-рефлексия.
5.
I. Актуализация знаний1. Особенности строения атомов химических
элементов неметаллов
2.Понятие химическая связь (из курса 8 класса)
3. Виды химической связи
4. Ковалентная связь (из курса 8 класса)
6.
II. Изучение темы урокаКовалентная связь- это химическая связь, возникающая в
результате образования электронных пар, общих для
взаимодействующих атомов.
Ковалентная связь может образовываться по обменному и
донорно-акцепторному механизму.
Обменный механизм образования связи-это механизм, при
котором каждый атом представляет на образование общей
электронной пары по одному неспаренному электрону.
А*+ В*= А : В
7.
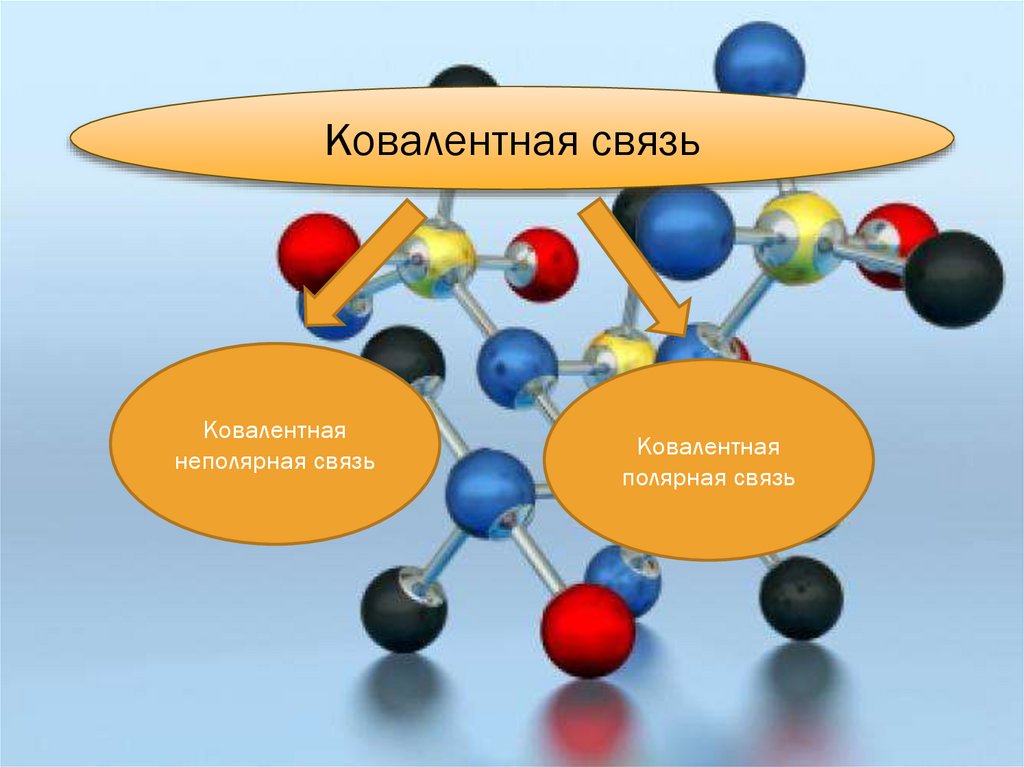
Ковалентная связьКовалентная
неполярная связь
Ковалентная
полярная связь
8.
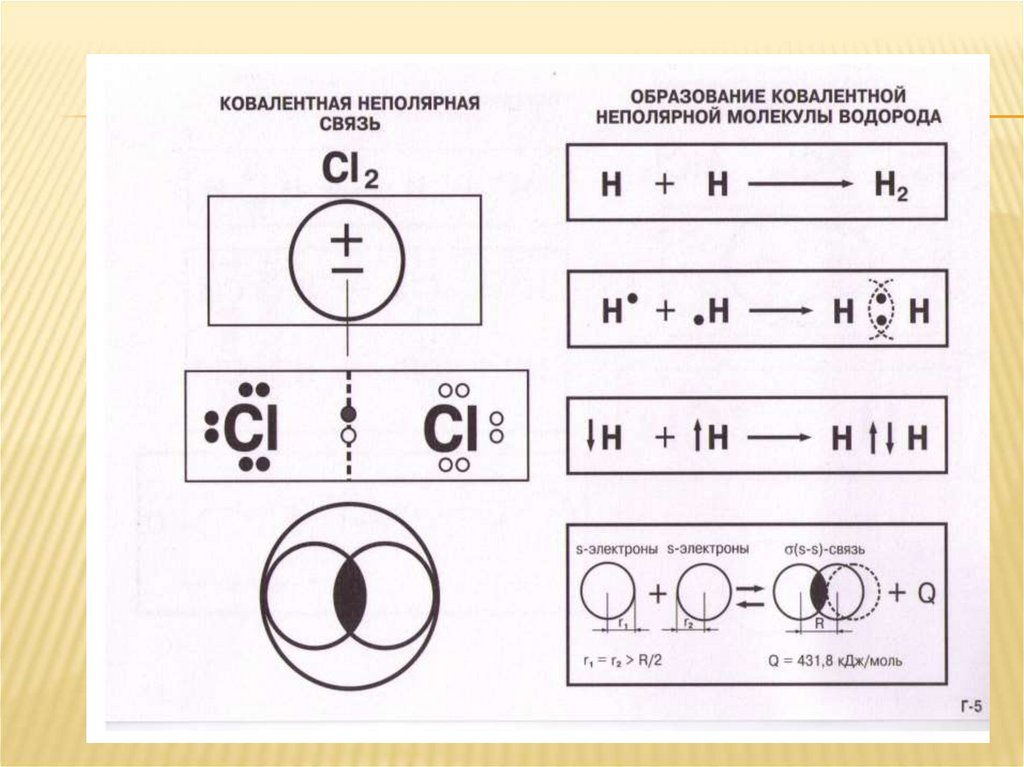
Ковалентная неполярная связьКовалентная неполярная химическая связь образуется
между атомами с одинаковой электроотрицательностью.
В таких молекулах(Н2, О2) общие электронные пары,
которые образуют связь, в равной степени принадлежат
обоим соединяющимся атомам.
9.
10.
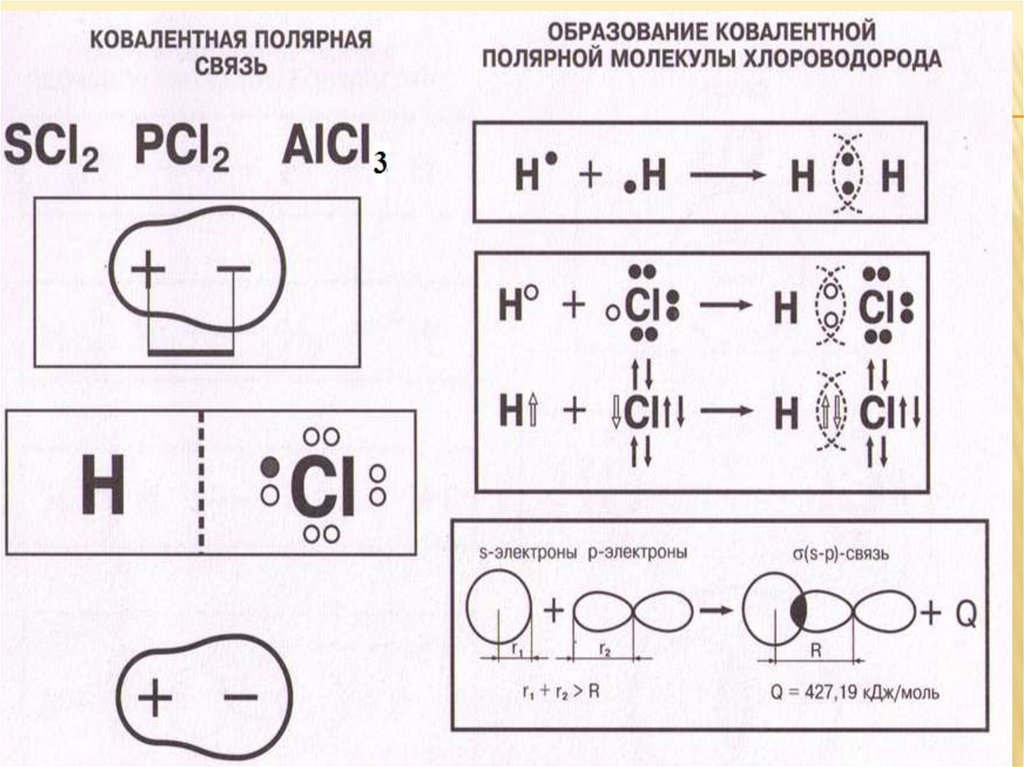
Ковалентная полярная связьКовалентная полярная химическая связь образуется между атомами ,
которые незначительно отличаются по электроотрицательности. В таких
молекулах(Н2О, СО2) общая электронная пара, которая образует связь,
смещается к атому более электроотрицательного элемента, на атомах
возникают частичные заряды.
Чем больше разность электроотрицательностей атомов элементов, тем
выше абсолютное значение заряда и тем более полярна ковалентная
связь.
11.
12.
13.
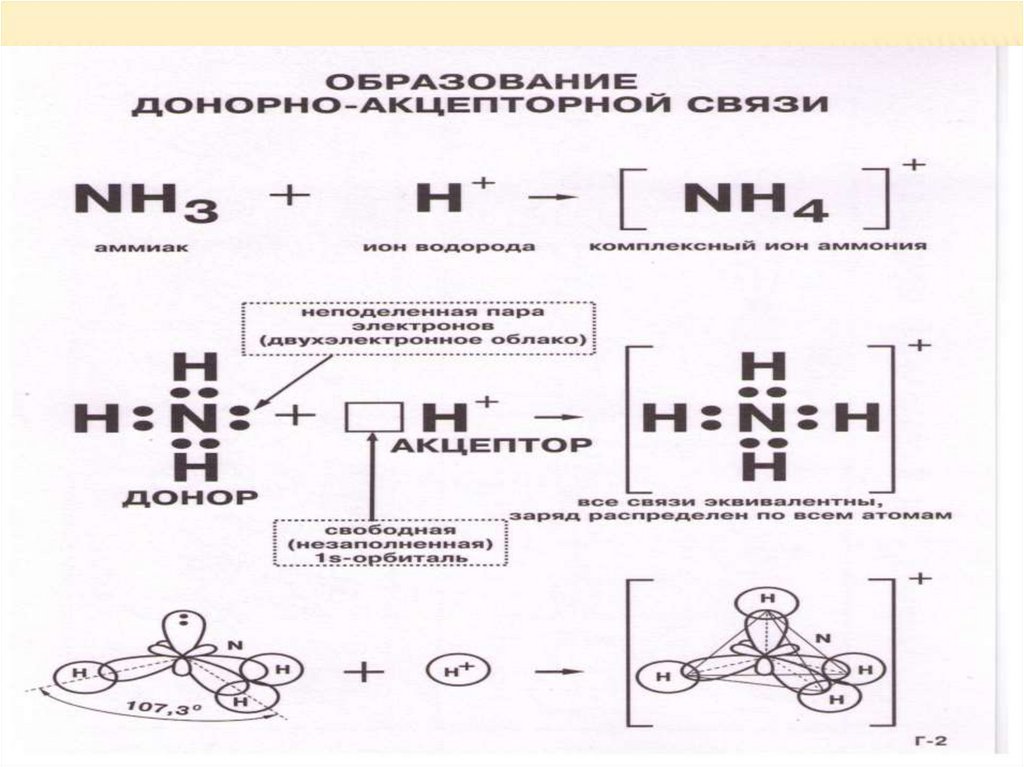
Донорно- акцепторная связьДонорно- акцепторный механизм образования
связи- это механизм, при котором один атом
(донор) предоставляет неподеленную пару
электронов, а другой (акцептор)- свободную
орбиталь:
А:+ В=А:В
Образование химической связи по донорноакцепторному механизму рассмотрим на
примере взаимодействия молекулы аммиака с
ионом водорода.
14.
15.
16.
17.
18.
III. Закрепление изученного материалаРабота у доски.
Задание 1. Изобразить схему образования химической связи в молекулах
следующих веществ: NH3, N2, H2S, О2
Самостоятельная работа в тетради
Задание 2. Установить соответствие. F2, H2S, HCI, О2, H2O, CH4, H2.
А) Ковалентная полярная связь:
В) Ковалентная неполярная связь:
Задание 3. Расположить формулы молекул в порядке возрастания полярности
связи: F2, H2S, HCI, H2O, CH4, BeH2.
19.
Домашнее задание§4 , задание № 5 (не
менее 3х примеров) ,
стр. 37 вопросы после
параграфа














 Химия
Химия








