Похожие презентации:
Кислородсодержащие органические соединения спирты
1.
КИСЛОРОДСОДЕРЖАЩИЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
СПИРТЫ
2.
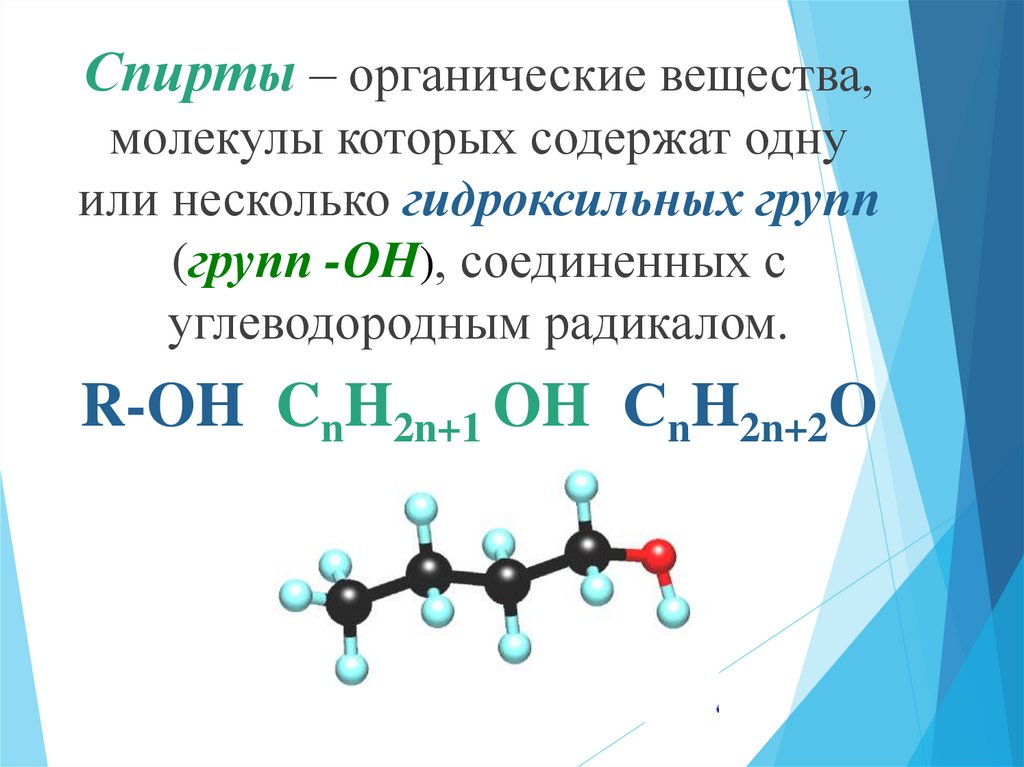
Спирты – органические вещества,молекулы которых содержат одну
или несколько гидроксильных групп
(групп -ОН), соединенных с
углеводородным радикалом.
R-OH CnH2n+1 OH СnH2n+2O
3.
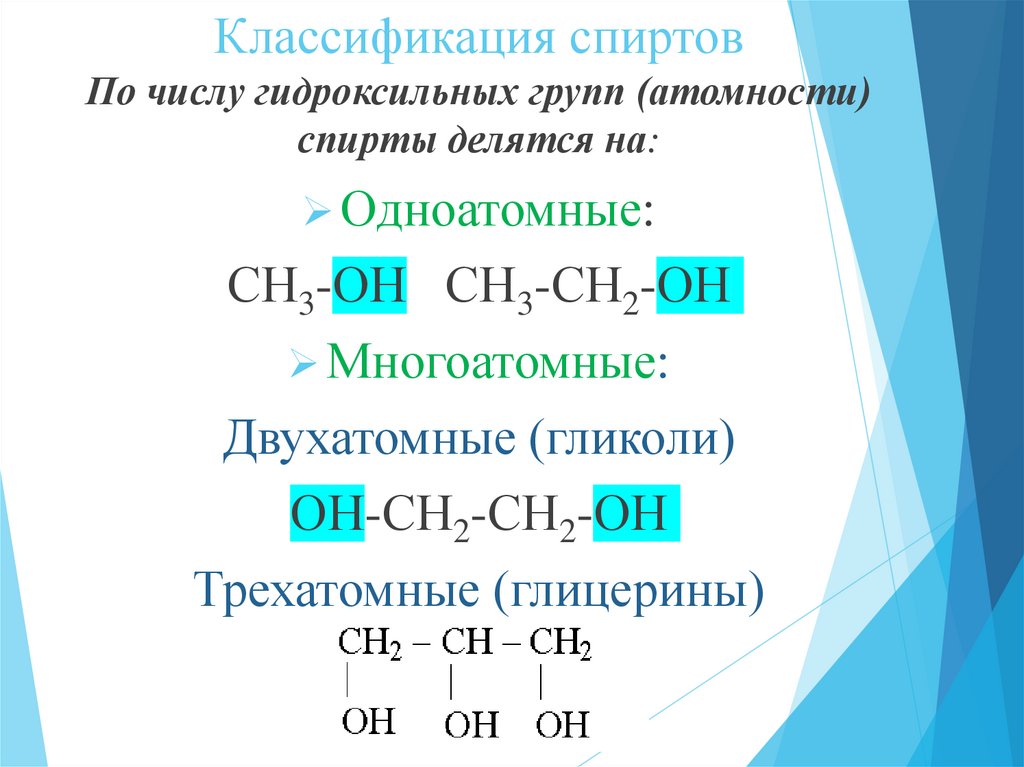
Классификация спиртовПо числу гидроксильных групп (атомности)
спирты делятся на:
Одноатомные:
СН3-ОН СН3-СН2-ОН
Многоатомные:
Двухатомные (гликоли)
ОН-СН2-СН2-ОН
Трехатомные (глицерины)
4.
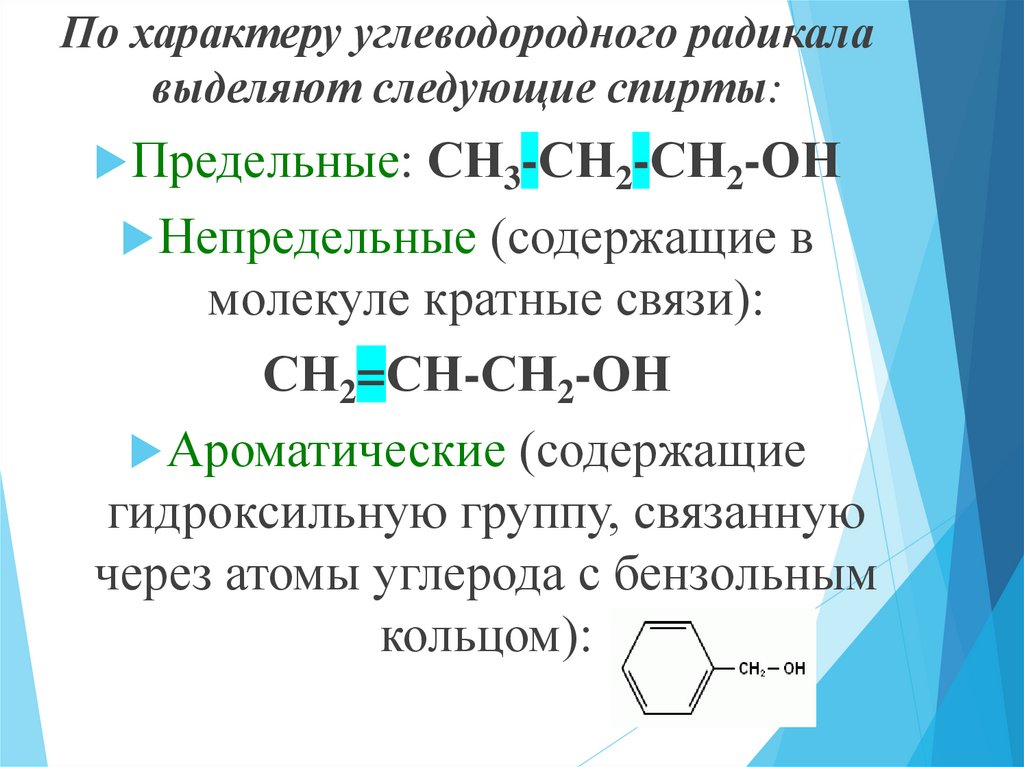
По характеру углеводородного радикалавыделяют следующие спирты:
Предельные: СН3-СН2-СН2-ОН
Непредельные (содержащие в
молекуле кратные связи):
СН2=СН-СН2-ОН
Ароматические (содержащие
гидроксильную группу, связанную
через атомы углерода с бензольным
кольцом):
5.
По характеру атома углерода, с которымсвязана гидроксильная группа, спирты
делятся на:
Первичные, в молекулах которых
гидроксильная группа связана с
первичным атомом углерода:
СН3-СН2-ОН
6.
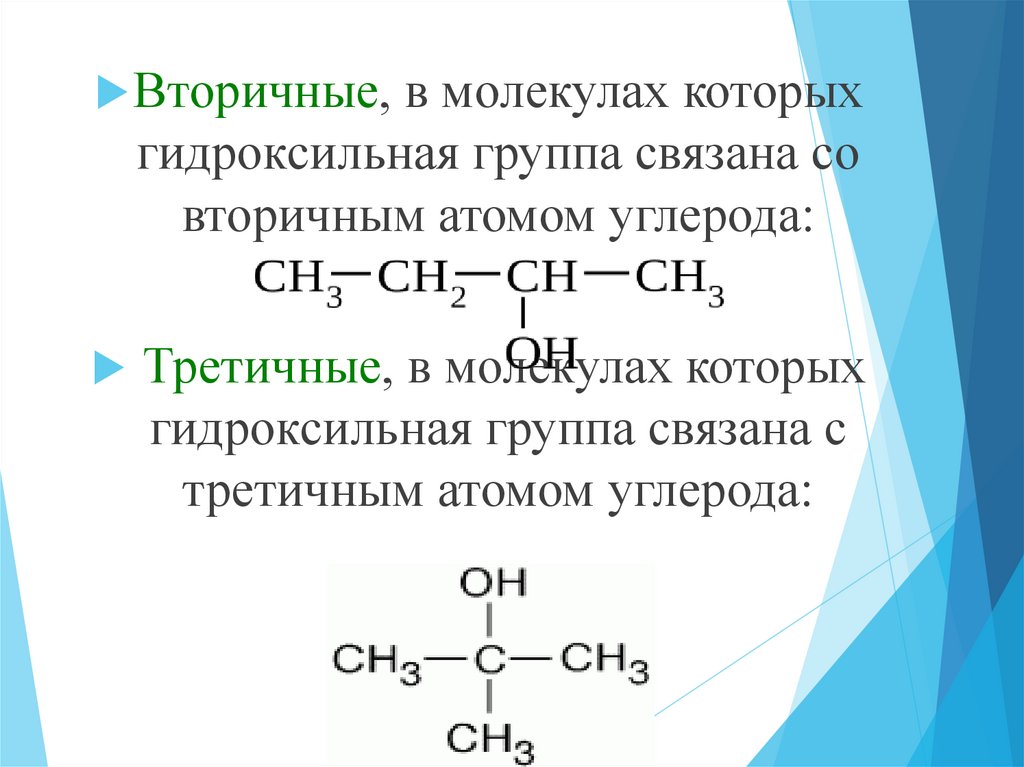
Вторичные, в молекулах которыхгидроксильная группа связана со
вторичным атомом углерода:
Третичные, в молекулах которых
гидроксильная группа связана с
третичным атомом углерода:
7.
Номенклатура и изомерияПри образовании названий спиртов
к названию углеводорода,
соответствующему спирту,
добавляют родовой суффикс –ол.
Цифрами после суффикса
указывают положение
гидроксильной группы в главной
цепи, а префиксами ди-, три-,
тетра- и т.д. – их число.
8.
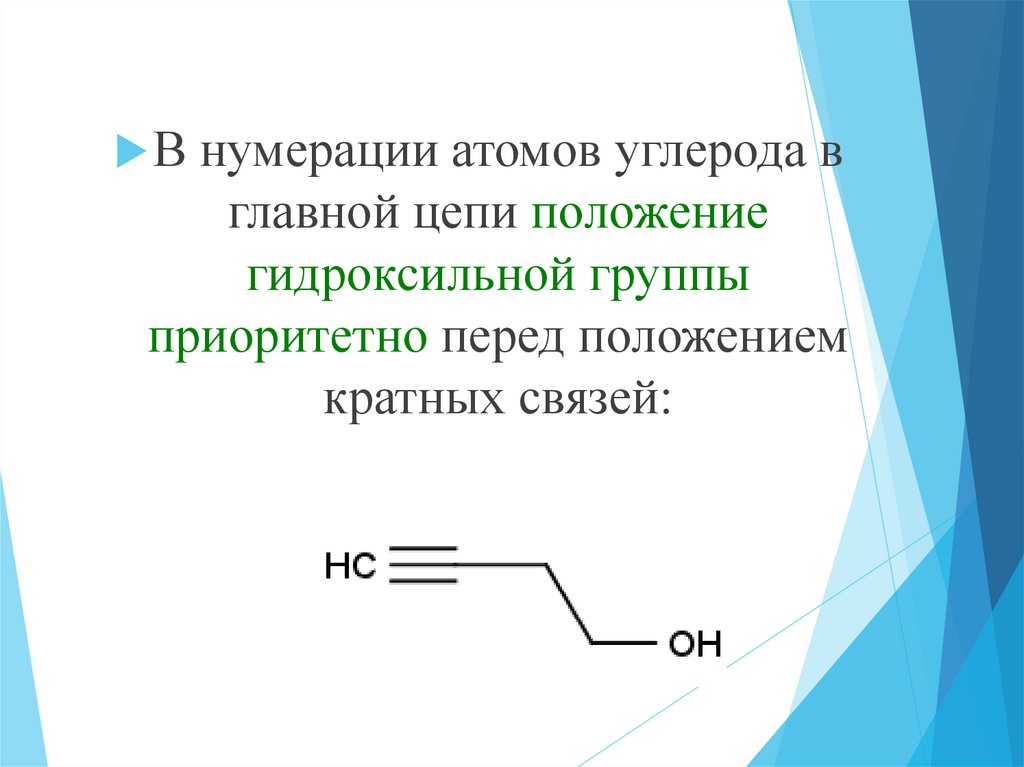
В нумерации атомов углерода вглавной цепи положение
гидроксильной группы
приоритетно перед положением
кратных связей:
9.
Назовите вещества:10.
По заместительной номенклатуреназвание спиртов производится
от названия соответствующего
радикала с добавлением
суффикса –овый и слова спирт:
СН3OH метиловый спирт
C2H5OH этиловый спирт
11.
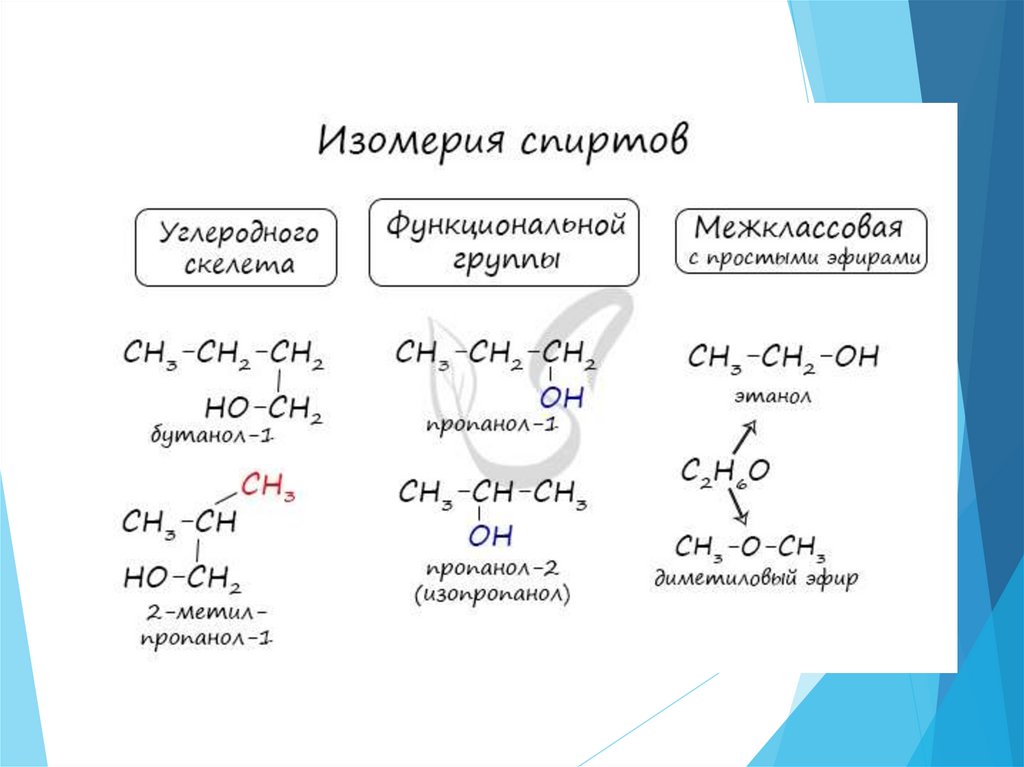
Структурная изомерияИзомерия углеродного скелета
Изомерия положения
функциональной группы
Межклассовая изомерия
12.
13.
Физические свойстваАтом кислорода входящий в состав
гидроксильной группы молекул
спиртов, резко отличается от
атомов водорода и углерода по
способности притягивать и
удерживать электронные пары.
14.
Благодаря этому в молекулахспиртов имеются полярные
связи С-О и О-Н.
15.
Атом кислорода имеет частичныйотрицательный заряд и две
неподеленные электронные пары,
что дает возможность спиртам
образовывать межмолекулярные
водородные связи.
16.
Водородные связи возникают привзаимодействии частично
положительного заряженного атома
водорода одной молекулы спирта и
частично отрицательно
заряженного атома кислорода
другой молекулы.
17.
Благодаря водородным связяммежду молекулами спирты имеют
аномально высокие для своей
молекулярной массы температуры
кипения.
18.
Низшие и средние члены рядапредельных одноатомный
спиртов, содержащие от 1 до 11
атомов углерода, - жидкости.
Высшие спирты при комнатной
температуре - твердые вещества.
19.
Низшие спирты имеютхарактерный алкогольный запах и
жгучий вкус, они хорошо
растворимы в воде. Спирты С4-С5
обладают сладковатым
удушливым запахом.
20.
По мере увеличенияуглеводородного радикала
растворимость спиртов в воде
понижается и увеличивается
температура кипения.
21.
Химические свойстваХарактерные для данного
класса соединений свойства
обусловлены наличием
гидроксильной группы.
22.
1. Взаимодействие с о щелочнымии щелочно-земельными
металлами. Спирты являются
слабыми кислотами, еще более
слабыми, чем вода. Кислотные
свойства наиболее выражены у
первичных спиртов и падают в ряду:
первичные>вторичные>третичные
спирты.
23.
Водород гидроксильной группымолекул спиртов способен
восстанавливаться щелочными и
щелочно-земельными металлами
(замещаться на них):
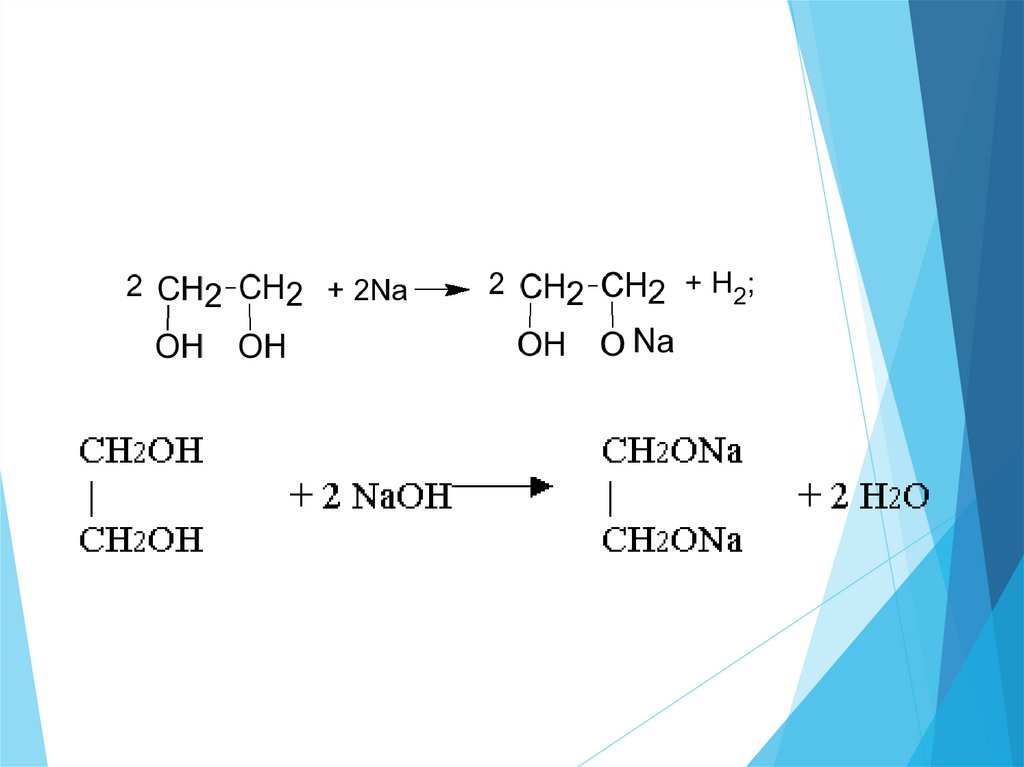
2СН3-СН2-ОН + 2Na → 2CH3-CH2-ONa + H2
24.
Продукты замещения водородагидроксильной группы на
металл называются
алкоголятами.
25.
2. Взаимодействие сгалогеноводородами. В этой
реакции проявляются слабые
основные свойства спиртов.
Замещение гидроксильной группы
на галоген приводит к образованию
галогеналканов:
СН3-ОН + HBr ↔ CH3-Br + HOН
26.
3. Межмолекулярнаядегидратация спиртов –
отщепление молекулы воды от двух
молекул спирта при нагревании
(100-140 С0) в присутствии
водоотнимающих средств (H2SO4):
27.
В результате межмолекулярнойдегидратации спиртов
образуются простые эфиры.
28.
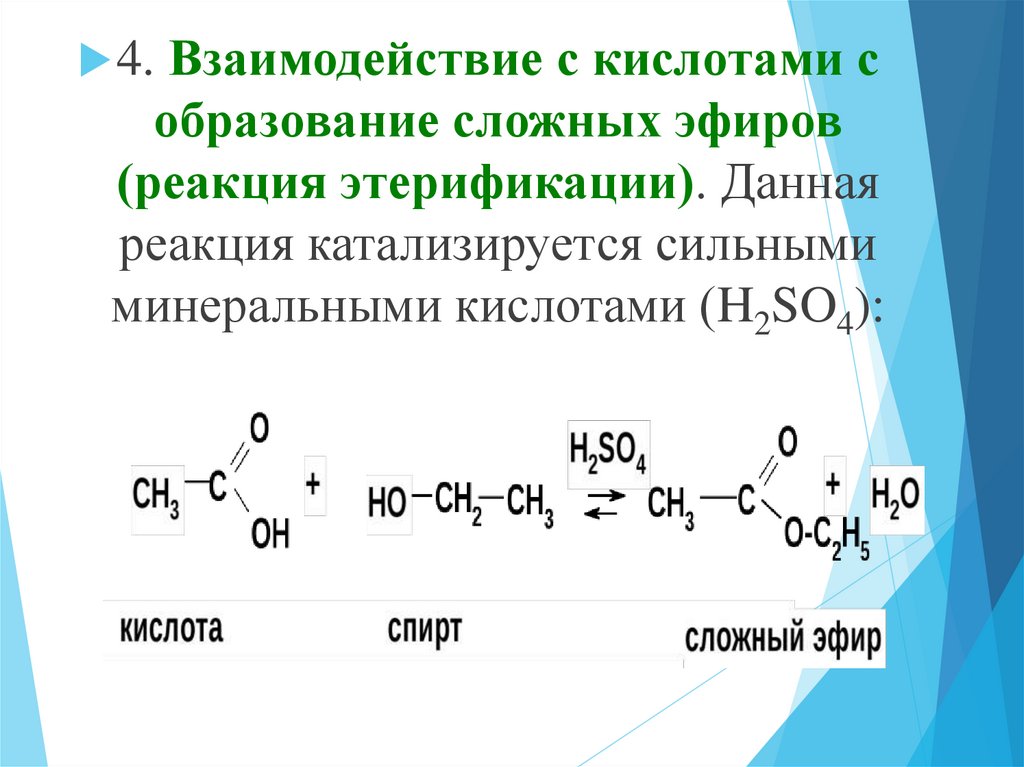
4. Взаимодействие с кислотами собразование сложных эфиров
(реакция этерификации). Данная
реакция катализируется сильными
минеральными кислотами (H2SO4):
29.
5. Внутримолекулярнаядегидратация спиртов происходит
при нагревании спиртов в
присутствии водоотнимающих
средств до более высокой
температуры, чем при
межмолекулярной дегидратации.
30.
В результате этой реакцииобразуются алкены.
Эта реакция протекает в
соответствии с правилом Зайцева:
при отщеплении воды от
вторичного или третичного спирта
атом водорода отрывается от
наименее гидрированного атома
углерода.
31.
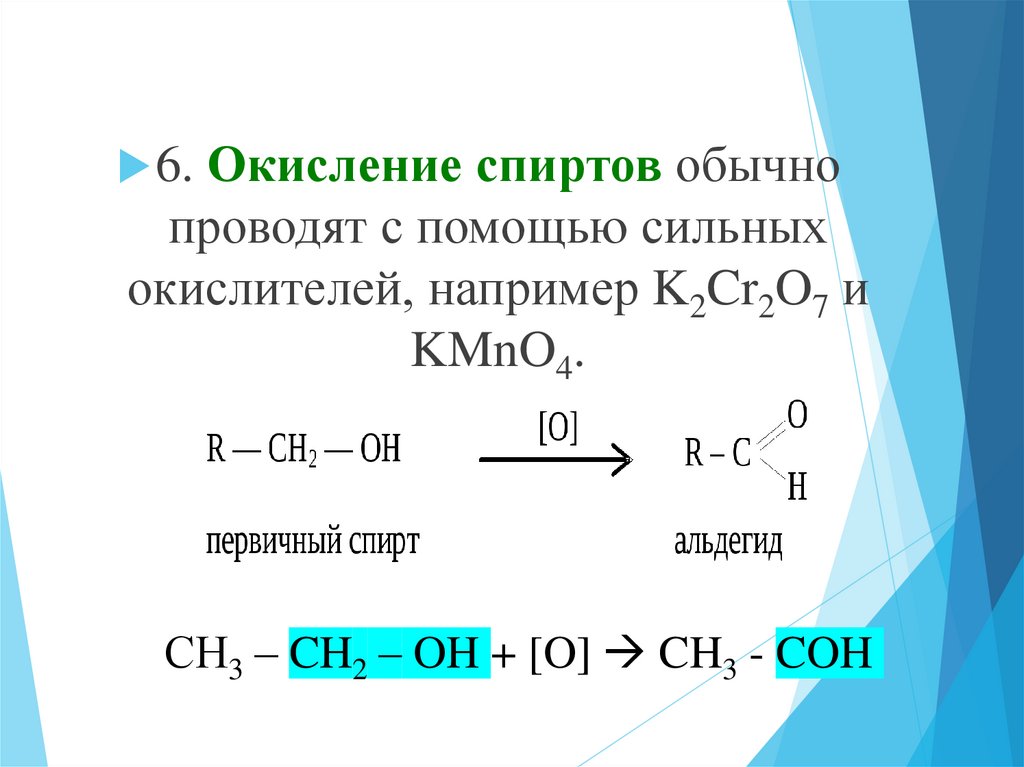
6. Окисление спиртов обычнопроводят с помощью сильных
окислителей, например K2Cr2O7 и
KMnO4.
СH3 – CH2 – OH + [O] CH3 - COH
32.
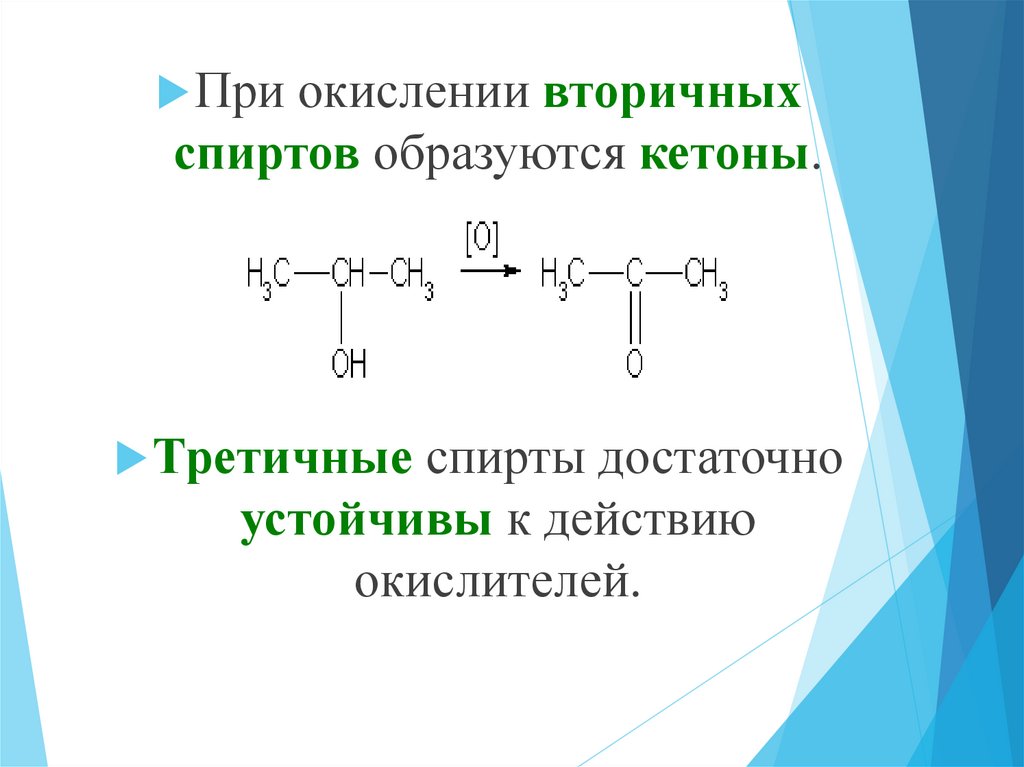
При окислении вторичныхспиртов образуются кетоны.
Третичные спирты достаточно
устойчивы к действию
окислителей.
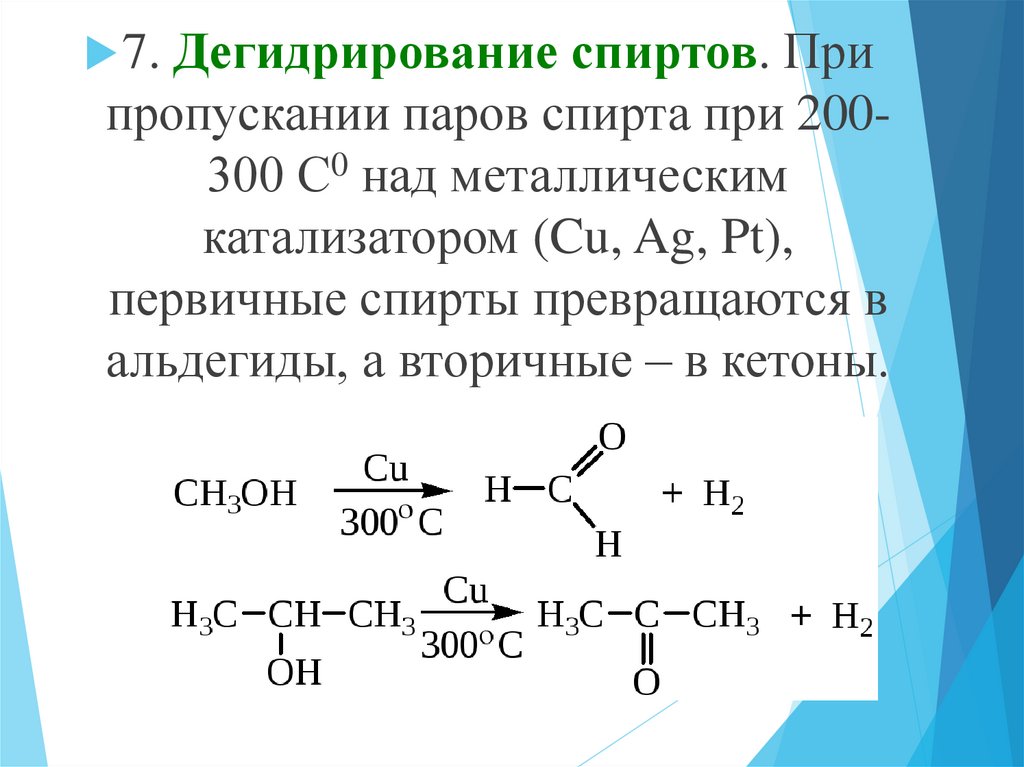
33.
7. Дегидрирование спиртов. Припропускании паров спирта при 200300 С0 над металлическим
катализатором (Cu, Ag, Pt),
первичные спирты превращаются в
альдегиды, а вторичные – в кетоны.
34.
8. Специфические свойствамногоатомных спиртов.
Многоатомные спирты способны
образовывать растворимые в воде
ярко-синие комплексные
соединения при взаимодействии со
свежеполученным осадком
гидроксида меди (II).
35.
Это качественнаяреакция на
многоатомные
спирты.
36.
Для двух- и трехатомныхспиртов характерны все реакции
одноатомных спиртов. Однако в
их химическом поведении есть
особенности, обусловленные
одновременным присутствием в
молекуле двух и более
гидроксильных групп.
37.
У многоатомных спиртовкислотные свойства выражены
сильнее по сравнению с
одноатомными. Поэтому
многоатомные спирты могут
образовывать соли не только с
активными металлами, но и с их
оксидами, гидроксидами, а также
с ионами некоторых тяжелых
металлов.
38.
39.
Способы полученияВ свободном состоянии в
природных условиях встречаются
лишь некоторые спирты, причем в
ничтожных количествах.
40.
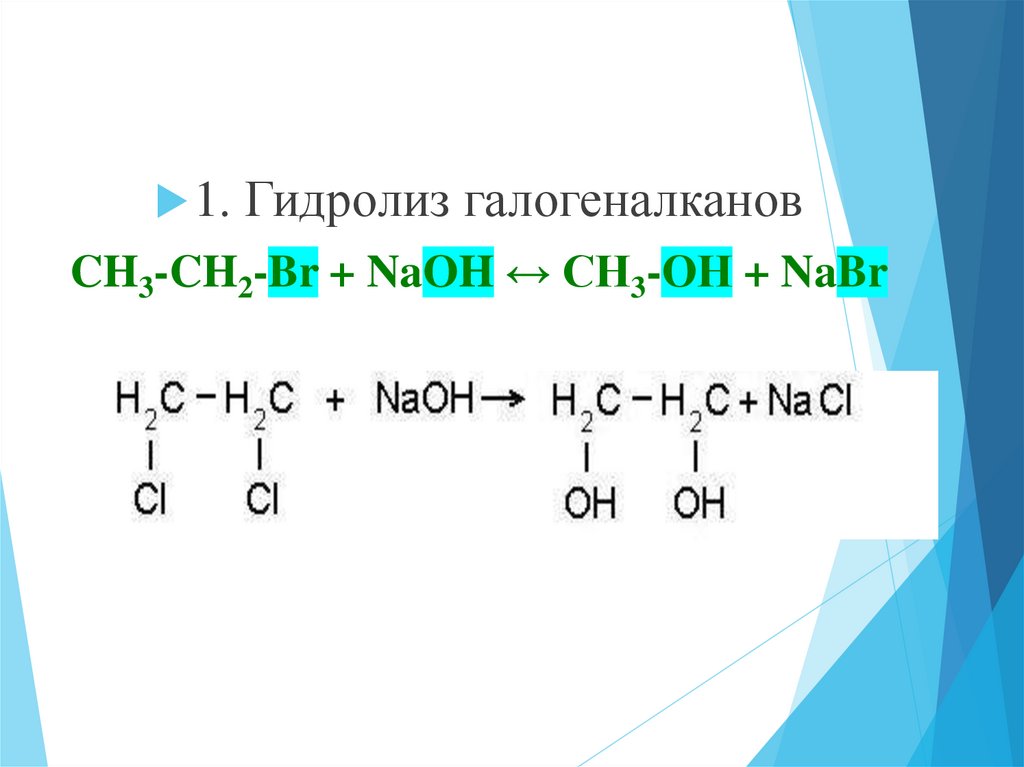
1. Гидролиз галогеналкановCH3-CH2-Br + NaOH ↔ СН3-ОН + NaBr
41.
2. Гидратация алкенов –присоединение воды по π-связи
молекулы алкена протекает в
соответствии с правилом
Марковникова.
42.
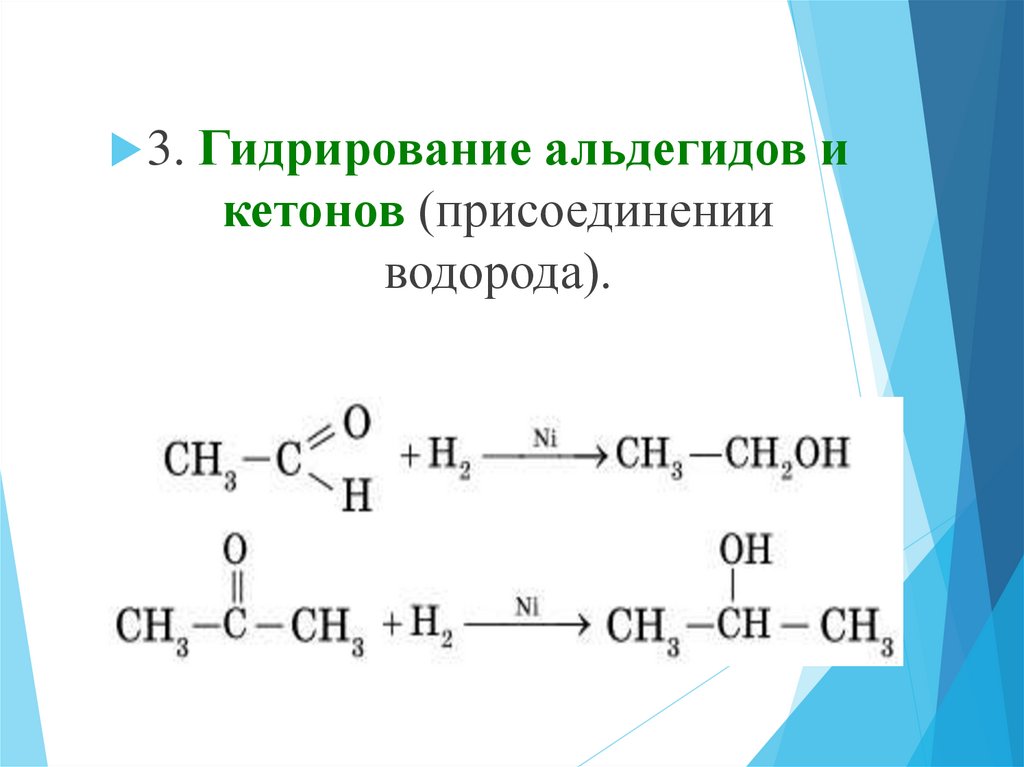
3. Гидрирование альдегидов икетонов (присоединении
водорода).
43.
4. Окисление алкенов (реакцияВагнера – взаимодействие алкенов
с водным раствором перманганата
калия).
44.
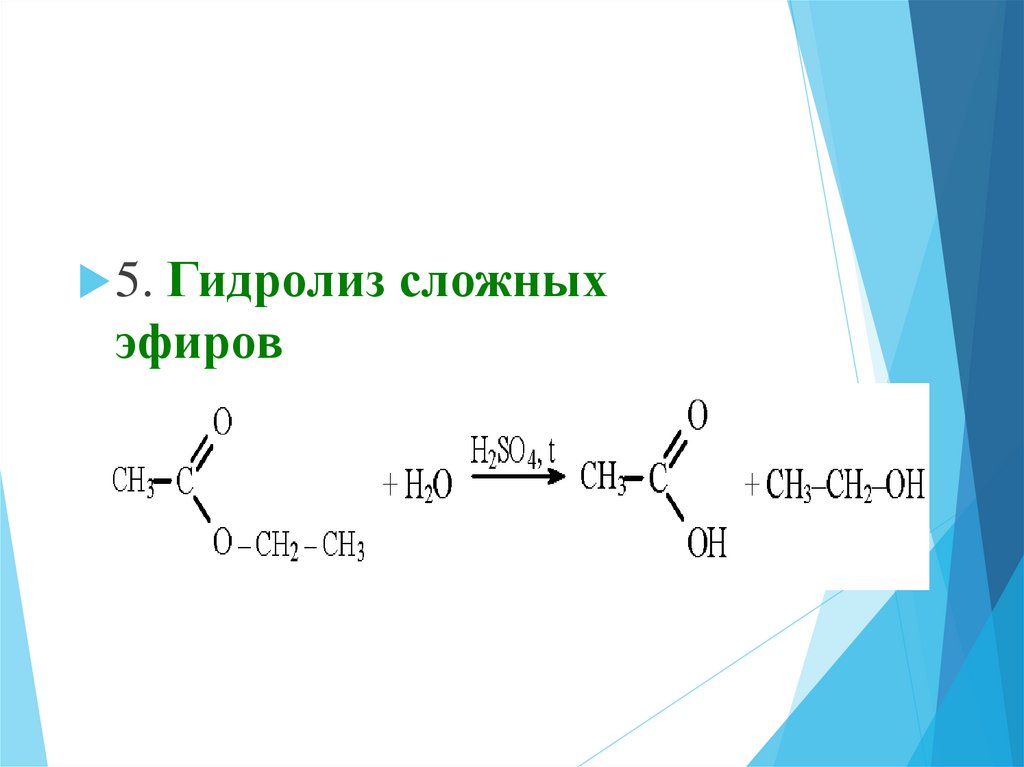
5. Гидролиз сложныхэфиров
45.
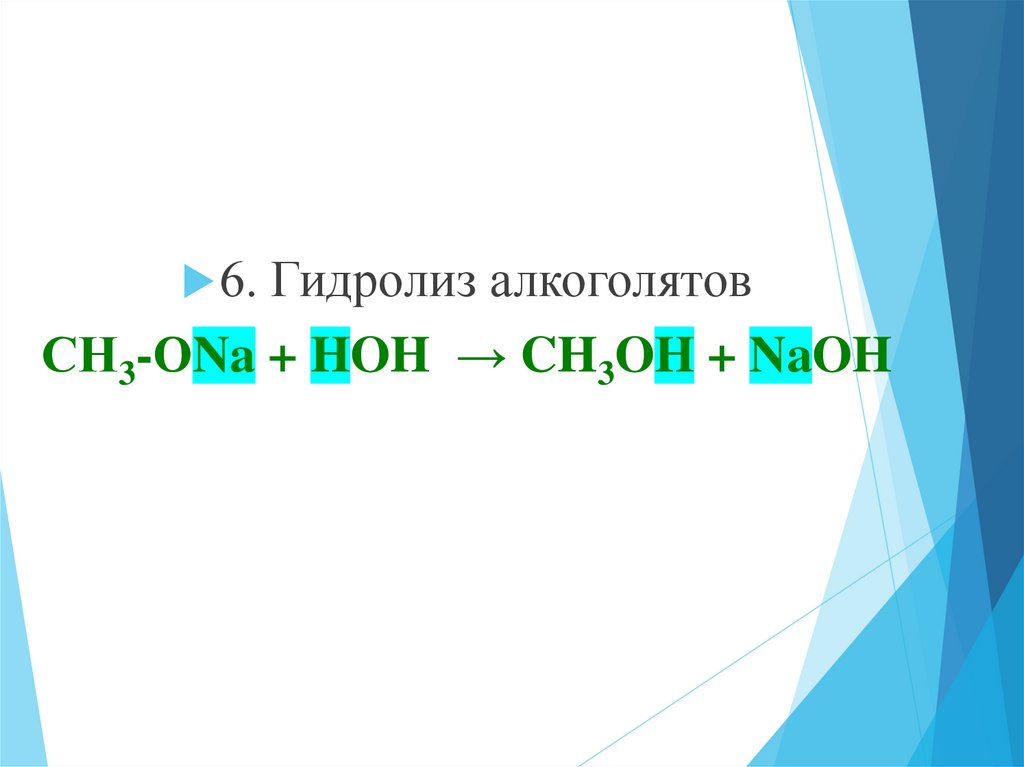
6. Гидролиз алкоголятовСН3-ОNa + HOH → CH3OH + NaOH
46.
7. Специфические способыполучения спиртов
В промышленности метанол
получают при взаимодействии
водорода с оксидом углерода (II)
(синтез-газ) при повышенном
давлении и высокой температуре на
поверхности катализатора (ZnO).
































 Химия
Химия








