Похожие презентации:
Элементы IIIА-группы и их соединения. Алюминий
1. Элементы IIIА-группы и их соединения. Алюминий.
ЭЛЕМЕНТЫ IIIА-ГРУППЫ ИИХ СОЕДИНЕНИЯ.
АЛЮМИНИЙ.
2. Цели обучения:
9.2.1.5-объяснять свойства алюминияна основе строения атома и называть области
применения алюминия и его сплавов;
9.2.1.6-исследовать амфотерные свойства
алюминия, его оксида и гидроксида.
3. Строение
Заряд ядра +13Степень окисления +3
Электронное строение атома 1s22s22p63s23p1
4.
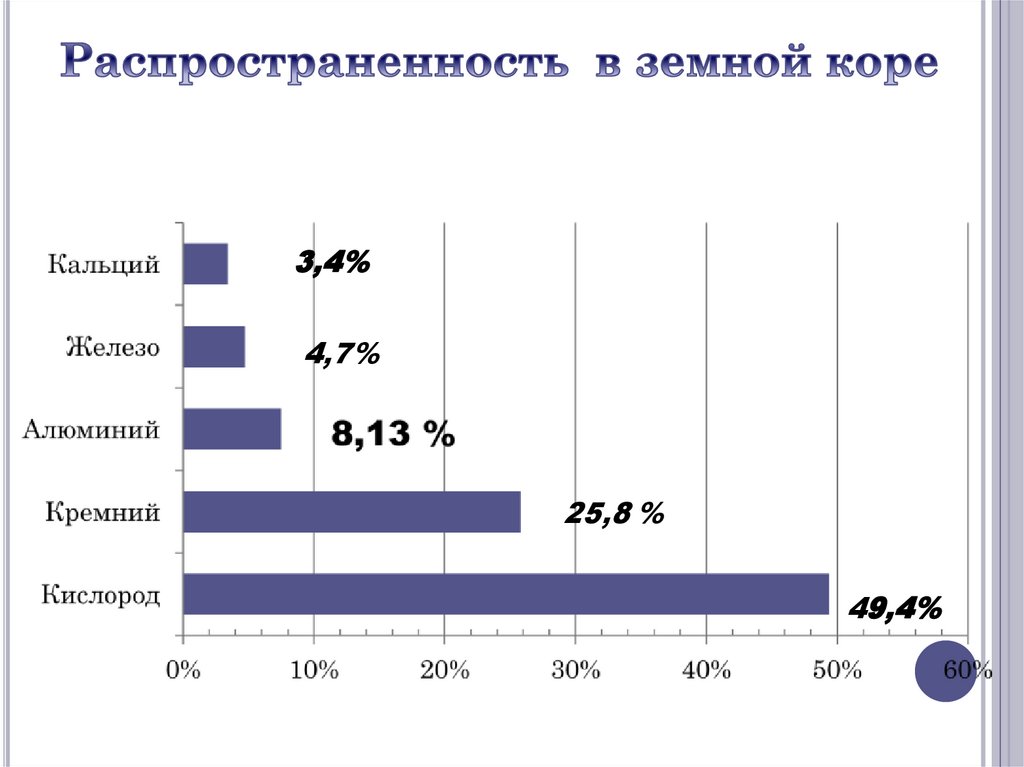
3,4%4,7%
25,8 %
49,4%
5. Нахождение в природе
Алюминий в природе встречается только в виде соединений.Природные соединения алюминия:
Al2O3 • 2SiO2 • 2H2O – каолин (или белая глина),
Al2O3 – корунд,
K2О • Al2O3 • 6SiO2 – полевой шпат,
Al2O3 • nH2O – боксит,
Na2O • Al2O3 • 2SiO2 – нефелин.
6.
ТопазГранат
Рубин
Сапфир
Берилл
7.
1. твёрдый2.серебристый металл
3. его плотность – 2,7 г/ см3
4. tпл = 660 0C, tкип = 2350 0C.
5.высокопластичный
6.алюминий
обладает
высокой
электропроводностью
теплопроводностью, высокой отражающей способностью.
и
8.
1. Впервые получен восстановлением хлорида алюминияметаллическим калием или натрием без доступа воздуха:
AlCl3 + 3Na = Al + 3NaCl
2. В промышленности – электролиз раствора глинозема Al2O3 в
расплаве криолита Na3AlF6 с добавкой CaF2.
Криолит используется как растворитель оксида алюминия, а
добавка фторида кальция позволяет поддерживать температуру
плавления в электролитической ванне не выше 1000 0С.
2Al2O3 = 4Al+3O2
9.
1. С водой. 2Al + 6H2O = 2 Al(OH)3 + 3H2↑2. С кислородом: 4Al + 3O2 = 2Al2O3 + Q оксид алюминия
3. Алюминий обладает амфотерными свойствами,
взаимодействуя с растворам кислот и щелочей:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4(разб.) = Al2(SO4)3 + 3H2↑
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ алюминат натрия
4. Реакции с неметаллами:
2Al + 3I2 = 2AlI3 + Q йодид алюминия
2Al + 3Cl2 = 2AlCl3 хлорид алюминия
2Al + 3S = Al2S3 сульфид алюминия
2Al + N2 = 2AlN - при t- нитрид алюминия
4Al + 3С = Al4С3 - при t- карбид алюминия
5. Вытесняет менее активные металлы из растворов их солей:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
10.
Алюминотермия – получение металлов: Fe, Cr, Mn,Ti, W и других
Металлический алюминий является сильным восстановителем и
восстанавливает другие металлы из их оксидов:
2Al + Cr2O3 = Al2O3 + 2Cr









 Химия
Химия








