Похожие презентации:
Скорость химических реакций. Химическое равновесие
1.
Министерство образования Республики БеларусьГродненский государственный университет
имени Янки Купалы
Специальность: Производство продукции и организ. обществ.питания
Группа:C3C-ППООП-172
Дисциплина:Химия
РЕФЕРАТ
Тема:Скорость химических реакций. Химическое равновесие.
Проверил:____________________________
Выполнил:____________________________
г. Гродно, 2018 г.
2. Скорость химической реакции и химическое равновесие
Скоростью химической реакции называется изменение концентрациивеществ в ходе реакции в единицу времени:
V
dc
d
Кинетическое уравнение реакции:
V = к∙[A]·[B] – выражение ЗДМ
Для обратимой реакции A + B ↔ C + D в соответствии с ЗДМ
V k A B
V k C D
Тогда в момент равновесия
k C D
K
k A B
Концентрационная константа равновесия
aA bB cC dD
c
d
C D
K
A a B b
Основные положения теории растворов электролитов.
Процесс электролитической диссоциации изображают химическими
уравнениями, например:
HCl H Cl
Степень электролитической диссоциации
С
С дисс
(%) дисс 100%
Сисх
Сисх
По способности к диссоциации электролиты разделяют на 3 группы:
1. сильные электролиты (α = 1)
2. слабые электролиты (α < 1)
3. электролиты средней силы.
1
3. Константа диссоциации слабого электролита
Общая концентрация ионов в растворе сici = m∙α∙C
Al2(SO4)3 → 2Al3+ + 3SO42- (α = 1) c(Al3+) = 2∙1∙0,1 = 0,2
моль/л
c(SO42-) = 3∙1∙0,1 = 0,3 моль/л
Константа диссоциации слабого электролита
AB A B
A B
K
AB
Константа равновесия, отвечающая диссоциации слабого
электролита, называется константой диссоциации
CH 3COOH CH 3COO H
H 2CO3 H HCO3
K1
HCO3 CO32 H
H CH COO
Ka
HCO H
K2
3
3
CH 3COOH
H 2CO3
CO H
HCO
2
3
3
H CO K K
K
2
2
3
H 2CO3 2 H CO
2
3
H 2CO3
2
1
2
4. Закон разбавления Оствальда
2с
К
с 1
2
К
с
1
1
К 2 с
К
с
При разбавлении степень диссоциации увеличивается
ai ci i
ai
i
– активность данного иона
– коэффициент активности иона
i 1
1 n
I ci z i2
2 i 1
Ионная сила раствора
Кислотно-основные равновесия в водных растворах
В соответствие с протолитической теорией Бренстеда и Лоури все
частицы, способные при ионизации отщеплять протон,
называются кислотами, все частицы, способные присоединять
протон – основаниями.
Кислоты HCN (к) ↔ H+ + CN- (осн)
HS- (к) ↔ H+ + S2- (осн)
Основания CN- (осн) + H+ ↔ HCN (к)
NН3 (осн) + H+ ↔ NH4+ (к)
Такие кислоты и основания, находящиеся в кислотно-основном
равновесии, называются сопряженными, то есть HCN и CN- сопряженные кислота и основание, аммиак и ион аммония –
сопряженные основание и кислота.
Амфолит (амфотерное вещество)
НСО3- ↔ Н+ + СО32НСО3- + Н+ ↔ Н2СО3
3
5. Кислотно-основные равновесия в водных растворах
согласно современным представлениям в водеосуществляется протолитическое равновесие –
автопротолиз воды:
Н2О + Н2О ↔ Н3О+ + ОН- или упрощенно: Н2О ↔ Н+ + ОНКонцентрационная константа диссоциации
H OH
K
H 2O
При температуре 298 K (250С) значение K 1,6 10 16 , а молярная
концентрация воды в чистой воде
H 2O n H 2O
V
m H 2O
1000г
55,55 моль / л
M H 2O V 18г / моль 1л
KW K H 2O H OH 10 14
Величина KW называется константа автопротолиза воды или ионное
произведение воды. При повышении температуры степень ионизации
воды увеличивается и значение константы автопротолиза растет.
.
Кислотно-основные равновесия в водных растворах
lg K W lg H lg OH
H OH 10
7
pKW pH pOH 14
pH = 7, нейтральная среда
H 10
7
pH < 7, кислая среда
H 10
7
pH > 7, щелочная среда
Для контроля за кислотностью среды при проведении химических
реакций используют кислотно-основные индикаторы
Каждый индикатор характеризуется интервалом перехода окраски
(ИПО), который зависит от природы индикатора, и представляет
собой область рН, в которой происходит изменение окраски
индикатора.
4
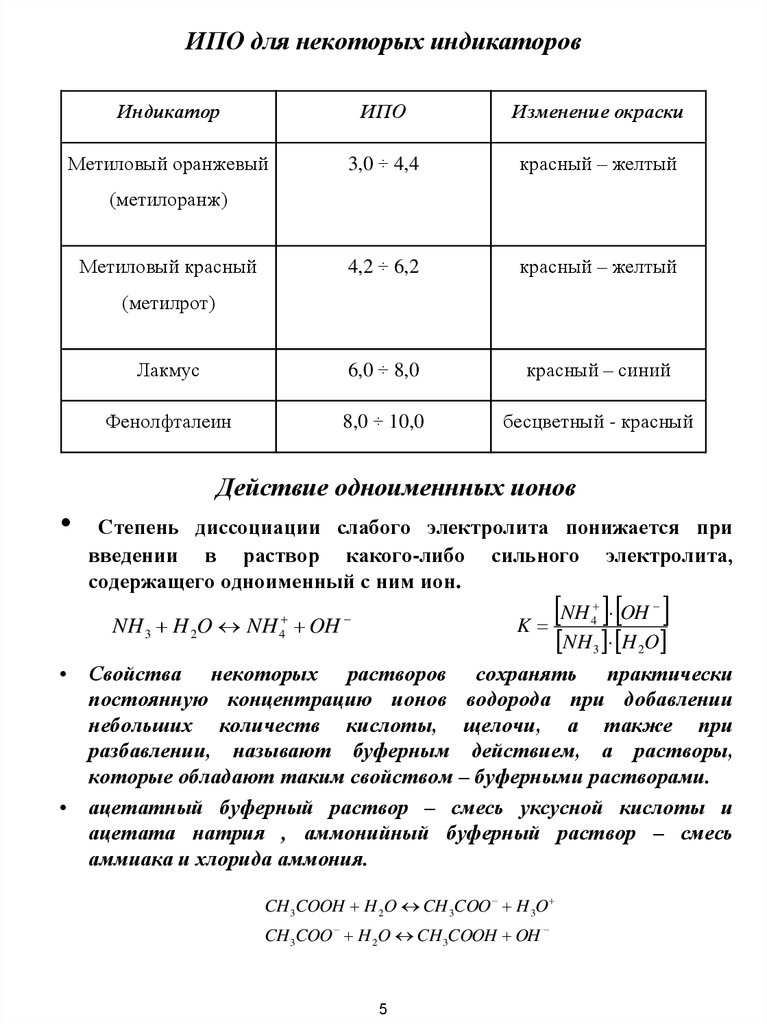
6. ИПО для некоторых индикаторов
ИндикаторИПО
Изменение окраски
Метиловый оранжевый
3,0 ÷ 4,4
красный – желтый
4,2 ÷ 6,2
красный – желтый
Лакмус
6,0 ÷ 8,0
красный – синий
Фенолфталеин
8,0 ÷ 10,0
бесцветный - красный
(метилоранж)
Метиловый красный
(метилрот)
Действие одноименнных ионов
Степень диссоциации слабого электролита понижается при
введении в раствор какого-либо сильного электролита,
содержащего одноименный с ним ион.
NH 4 OH
K
NH 3 H 2O NH 4 OH
NH 3 H 2O
Свойства некоторых растворов сохранять практически
постоянную концентрацию ионов водорода при добавлении
небольших количеств кислоты, щелочи, а также при
разбавлении, называют буферным действием, а растворы,
которые обладают таким свойством – буферными растворами.
ацетатный буферный раствор – смесь уксусной кислоты и
ацетата натрия , аммонийный буферный раствор – смесь
аммиака и хлорида аммония.
CH 3COOH H 2O CH 3COO H 3O
CH 3COO H 2O CH 3COOH OH
5
7. Буферные растворы
Количественной характеристикой способности буферного раствора
поддерживать заданную величину pH является буферная емкость, под
которой понимают количество молей сильной кислоты или сильного
основания, прибавление которого к 1 л буферного раствора изменяет
его pH на единицу.
Протолитические равновесия в растворах солей (гидролиз солей).
Гидролиз солей – это взаимодействие ионов растворенной соли с
молекулами воды (ионами Н+ и ОН-, возникающими при диссоциации
воды Н2О ↔ Н+ + ОН-), в результате которого образуются
малодиссоциированные соединения (слабые кислоты и слабые
основания).
Реакция гидролиза процесс обратимый и в растворе устанавливается
химическое равновесие между продуктами реакции и исходным
соединением, которое характеризуется соответствующей
константой равновесия – константой гидролиза Kh.
Гидролиз солей
Количественно гидролиз характеризуется степенью гидролиза h,
которая равна отношению числа прогидролизровавшихся частиц
nгидр к общему числу исходных ионов nисх и численно выражается в
долях единицы или процентах(%):
h
гидр.
исх.
h %
гидр.
100%
исх.
Степень гидролиза увеличивается с уменьшением концентрации
гидролизующейся соли (разбавлением) и с ростом температуры
(нагревание).
Гидролизу в водных растворах подвергаются соли, содержащие
катионы слабых оснований и анионы слабых кислот.
6
8. Гидролиз солей
1. Гидролиз солей, содержащих катион сильного основания и анионслабой одноосновной кислоты (МА). Такие соли нацело диссоциируют в
водном растворе с образованием катиона сильного основания М+ и
аниона слабой кислоты А-: МА → М+ + ААнион слабой кислоты гидролизуется по уравнению:
А- + Н2О ↔ НА + ОН- (pH > 7)
K
HA OH
A H 2O
Kh
K H 2 O K h
HA OH
HA OH H K W
A
H
A
Ka
При этом, чем слабее образующаяся в результате гидролиза кислота
(меньше Ka), тем более сильным основанием является анион этой
кислоты и тем в большей степени идет гидролиз.
НСООK, СН3СООNa, KNO2, NaF, LiClO, KCN, С6Н5ОNa
2. Гидролиз солей, содержащих катион слабого однокислотного
основания и анион сильной кислоты (ВХ). Такие соли нацело
диссоциируют в водном растворе с образованием катиона слабого
основания В+ и аниона сильной кислоты Х-:
ВХ → В+ + ХKW
K
Катион слабого основания гидролизуется по уравнению:
h
Kb
+
+
В + Н2О ↔ ВОН + Н (pH < 7)
NH4Cl, AgNO3, соли органических аминов (например, CH3NH3NO3,
(C2H5)2NH2Cl, C6H5NH3Cl и др.).
Гидролиз солей
3. Гидролиз солей, содержащих катион слабого однокислотного
основания и анион слабой одноосновной кислоты (ВА). Гидролиз такого
типа солей происходит с участием обоих ионов, входящих в состав
соли:
В+ + А- + Н2О ↔ ВОН + НА
7
9. Гидролиз солей
CH 3COONH 4 K a KbKh
pH pOH 7
KW
K a Kb
NH4CN, NH4ClO, AgNO2, CH3COONH4, C6H5NH3F и др.
4. Гидролиз солей, содержащих катион сильного однокислотного
основания и анион слабой многоосновной кислоты (МnА).
Соли М2А нацело диссоциируют в водном растворе с образованием
катиона сильного основания М+ и аниона слабой двухосновной кислоты
А2-, который гидролизуется ступенчато по уравнениям:
А2- + Н2О ↔ НА- + ОН- (I ступень)
НА- + Н2О ↔ Н2А + ОН- (II ступень) pH > 7
Гидролиз солей
HA OH HA OH H K
A
A H K
K h1
K h2
2
2
W
a2
H 2 A OH H 2 A OH H KW
HA
HA
H
Так как Kа1 > Ka2, то Kh1 > Kh2
Na2S, K2CO3, Na2SO3, Na2C2O4
K3PO4, Na3AsO4, Na3SbO3
8
K a1
10. Произведение растворимости
M n X m т nM m mX n рn
a M m a X n
o
KS
a M n X m ( т )
m
- термодинамическое произведение
растворимости (ПР)
M X
X K - концентрационное
n
K So a M m a X n
KS M
m n
m
m n
n
M
m
X
n m
n
M
m
X
KS
o
S
n m
n
M
m
X
произведение
растворимости (ПР)
Правило
произведения
растворимости:
произведение
активностей ионов в степенях, равных стехиометрическим
коэффициентам, в насыщенном растворе малорастворимого
электролита есть величина постоянная для данного
растворителя, температуры, давления.
Произведение растворимости
M n X m nM m mX n
M nS
X mS
m
n
K S M m
X
n
n m
nS mS
S
n
m n
m
n n m m S m n
KS
n mm
n
Растворимость зависит
1. от природы малорастворимого соединения,
2. природы растворителя,
3. температуры,
4. давления,
5. присутствия в растворе других электролитов (как имеющих, так и не
имеющих одноименные ионы с данным малорастворимым соединением),
6. а также различных веществ, вступающих с ионами осадка в реакции
нейтрализации, комплексообразования и другие химические реакции.
9
11. Произведение растворимости
Произведение растворимости является одной из основныххарактеристик малорастворимых электролитов и по значению ПР:
1. можно рассчитать условия осаждения;
2. определить растворимость данного осадка в данных условиях;
3. выяснить какой осадок будет выпадать первым.
Из всего сказанного вытекают два следствия:
I. а) Если произведение концентрации ионов (ИП) меньше величины
произведения растворимости (ПР), то раствор ненасыщен
относительно данного труднорастворимого соединения и осадок не
образуется;
б) если произведение концентрации ионов (ИП) равно произведению
растворимости (ПР), то раствор насыщен относительно данного
труднорастворимого соединения; в растворе наступает подвижное
равновесие и осадок не выпадает;
в) Если произведение концентрации ионов (ИП) больше произведения
растворимости (ПР), то раствор пересыщен относительно данного
труднорастворимого соединения и осадок образуется. Осадок
выделяется до тех пор, пока не будет достигнута величина ПР.
II. Из двух труднорастворимых соединений в первую очередь
выпадет в осадок тот, чье произведение растворимости (ПР) будет
наименьшим.
10










 Химия
Химия








