Похожие презентации:
Термодинамика и теплопередача. Производство и передача тепловой энергии. Лекция 1
1.
Термодинамика итеплопередача
Производство и передача
тепловой энергии
Миронова Нина Владимировна II-203 а
Консультация: нечетный вторник 12:00
2.
РЕЙТИНГЛабораторные
работы
РГР
Лекции
60
№1
№2
№3
№4
40
Вып
20
Экзамен
Защ
30
10
Максимальный
балл
5
5
5
5
15
15
10
40
Минимальный
балл
2,5
2,5
2,5
2,5
7,5
7,5
5
20
2
3.
3Основные разделы курса
• Техническая термодинамика (идеальные газы)
• Теплопередача
• Теплообменные аппараты
• Техническая термодинамика (реальные газы)
• Термодинамические циклы энергетических
установок
• Тепловые электрические станции
4.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА(основная)
1. Овчинников Ю.В. Основы технической
термодинамики – Новосибрск: Изд-во НГТУ,
292 c.
2010. -
2. Быстрицкий Г.Ф. Общая энергетика: Учеб.
пособие для сред. проф. образования: Учеб.
пособие для студ. высш. учеб. заведений. –
М.: Издательский центр «Академия», 2005. –
208 с.
3. Тепловые электрические станции: учебник
для вузов / В.Д. Буров, Е.В. Дорохов и др. – М:
Издательский дом МЭИ, 2007. – 466 с.: ил.
4
5.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА(дополнительно)
4. Исаченко В.П., Осипова В.А., Сукомел А.С.
Теплопередача – М.: Энергия, 1981. – 440 с.
5. Теплотехнический справочник /
Под ред. В.Н. Юренева, Д.П. Лебедева. Т.1.
– М: Энергоатомиздат, 1975. – 744 с.
6. Теплотехнический справочник /
Под ред. В.Н. Юренева, Д.П. Лебедева. Т.2.
– М: Энергоатомиздат, 1976. – 896 с.
5
6.
6МЕТОДИЧЕСКИЕ ПОСОБИЯ ДЛЯ
ЛАБОРАТОРНЫХ РАБОТ
• Ю.И. Шаров, П.А. Щинников. Основы
теплопередачи. Сборник лабораторных работ.
Методические указания. № 4010 - НГТУ, 2011. – 37 с.
ЛР № 1а «Определение коэффициента теплопроводности
методом цилиндрического слоя»
ЛР № 1б «Определение степени черноты поверхности
методом двух эталонов»
ЛР № 2 «Исследование процесса теплоотдачи от
горизонтального цилиндра к воздуху в условиях
свободной конвекции»
7.
7МЕТОДИЧЕСКИЕ ПОСОБИЯ ДЛЯ
ЛАБОРАТОРНЫХ РАБОТ
• О.К. Григорьева, О.В. Боруш. Исследование
термодинамических процессов поршневого
компрессора. Методические указания. №4262 - НГТУ,
2013. – 16 с.
ЛР № 3 «Исследование термодинамических процессов
поршневого компрессора»
• Ю.И. Шаров. Определение характеристик
холодильной установки. Методические указания.
№3815 - НГТУ, 2010. – 16 с.
ЛР № 4 «Определение характеристик холодильной
установки»
8.
8Лабораторные работы
• Отчет
Титульный лист
Цель работы
Принципиальная схема лабораторной установки
Таблица измерений
Таблица расчетов
Графический материал
Выводы
• Защита в день выполнения лабораторной
работы
• Выполнение и/или защита после
17 недели – max 3 балла
9.
9Правила оформления РГР
• Работу не сшивать. Скрепить скрепкой.
• Титульный лист
• Поля «Обычное»:
верхнее – 2 см
левое – 3 см
нижнее – 2 см
правое – 1,5 см
• Times New Roman – 14;
Междустрочный интервал – 1,5;
Интервал перед и после абзаца – 0;
Красная строка – 1,25.
• Термический КПД ГТУ:
t 1
1
к
k 1
k
1
1
9,96
1,4 1
1,4
48 %.
10.
10Правила оформления РГР
Пояснительная записка
Заголовки выделить (но все одинаково)
Текст выравнивается по ширине, оформляется одинаково по всему
документу
Не должно быть пустых строк
Нумерация (таблиц, рисунков, формул, разделов и т.д.) сквозная
через весь документ (1, 2, 3, … и так до конца документа), либо в
соответствии с номером главы (например, для второй главы (2.1, 2.2,
2.3, …), для третьей главы (3.1, 3.2, 3.3, …)
условие задач, исходные данные
если данные формируете в виде таблицы, то она должна быть
подписана по правилам и иметь заголовок
на каждую таблицу должна быть ссылка в тексте
11.
11Правила оформления РГР
рисунки (схемы и циклы)
рисунки должны быть подписаны (номер и название)
на каждый рисунок должна быть ссылка в тексте
схемы и циклы оформляются самостоятельно по своим
исходным и расчетным данным
рисунки не должны повторяться
расчет
формулы оформляются одинаково по всему документу
выравниваются по центру
вывод в конце каждой задачи
пишется самостоятельно по проделанной работе
список используемой литературы
на все указанные источники должна быть ссылка в тексте
указываются только те источники, которыми пользовались
оформлять по правилам
12.
Техническая термодинамика13.
13ОПРЕДЕЛЕНИЯ
Термодинамика – наука, изучающая энергию и законы ее
превращения из одного вида в другой
Техническая термодинамика (ТТ) – раздел термодинамики,
рассматривающий взаимопревращения тепловой и механической
энергии
Термодинамическая система (ТС) – совокупность тел,
находящихся во взаимодействии между собой и окружающей
средой
Пример ТС: газ сжимающийся в
цилиндре
(окружающая среда – цилиндр,
поршень, воздух, стены
помещения)
13
14.
14ОПРЕДЕЛЕНИЯ
Изолированная система - т/д система не взаимодействующая
с окружающей средой (нет обмена работой и теплотой)
Адиабатная (теплоизолированная) система – система,
исключающая обмен теплотой с окружающей средой
Закрытая система – не допускает обмен своим веществом с
окружающей средой
Открытая система – допускает обмен своим веществом с
окружающей средой
14
15.
15ПАРАМЕТРЫ СОСТОЯНИЯ
Параметры состояния – величины, которые характеризуют
физическое состояние системы
Удельный объем – объем занимаемый массой в 1 кг этого тела
υ=V/m,
[м3/кг]
Плотность вещества
ρ = m / V = 1 / υ,
[кг/м3]
16.
16ПАРАМЕТРЫ СОСТОЯНИЯ
Давление – сила, действующая по нормали к единице
поверхности тела
Р=F/S,
[Н/м2] = [Па]
Внесистемные единицы давления
1 кгс/м2 = 9,81 Па = 1 мм.водн.ст.
1 ат (техн.атмосфера) = 1 кгс/см2 = 98,1 кПа
1 атм (физическая атмосфера) = 101,325 кПа = 760 мм.рт.ст.
1 ат = 0,968 атм
1 мм.рт.ст. = 133,32 Па
1 бар = 0,1 МПа = 100 кПа = 105 Па
17.
17ПАРАМЕТРЫ СОСТОЯНИЯ
Абсолютное давление (Р)– действительное давление рабочего
тела внутри сосуда
Избыточное давление (Ри) – разность между абсолютным
давлением в сосуде и давлением окружающей среды
Абсолютное давление
давление сосуда больше давления окружающей среды
Р = Ри + Ро
давление сосуда меньше давления окружающей среды
Р = Ро – Рв
18.
18ПАРАМЕТРЫ СОСТОЯНИЯ
Прибор измерения
Избыточного давления – манометр
Давления окружающей среды – барометр
Давление разряжения – ваккуметр
Термодинамика
19.
19ПАРАМЕТРЫ СОСТОЯНИЯ
Температура – характеризует степень нагретости тел
Т = t + 273,15
[К]
По шкале Фаренгейта :
t(0F) = (9/5)·t(0С) + 32
Нормальные физические условия
Р = 1 атм (760 мм.рт.ст.), t = 0 0С
20.
20УРАВНЕНИЕ СОСТОЯНИЯ
Уравнение состояния – математическое уравнение, связывающее
основные т/д параметры Р, υ, Т
f (Р, υ, Т) = 0
Равновесное состояние – состояние тела, при котором во всех
его точках объема Р, υ, Т и другие физические свойства одинаковы
Идеальный газ – газ, у которого отсутствуют силы взаимодействия
между молекулами
21.
21УРАВНЕНИЕ ИДЕАЛЬНОГО ГАЗА
Для 1 кг массы газа
Р·υ = R·Т
R – газовая постоянная (для воздуха R = 287 Дж/(кг·К))
Для произвольного количества газа массой m
Р·V = m·R·Т
Уравнение Клапейрона-Менделеева
Р·υ = Rμ·Т/μ
μ – молярная (молекулярная) масса газа, (кг/кмоль)
Rμ = 8314,20 Дж/кмоль·К – универсальная газовая постоянная
Термодинамика
Газовая постоянная вещества: R = R /μ
22.
22ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Теплота и работа
Теплота – энергия, передаваемая самопроизвольно от более
нагретого тела к менее нагретому телу
Количество теплоты: Q,
[Дж]
Удельное количество теплоты: q,
[Дж/кг]
Работа – количество энергии, передаваемой при условии
перемещения всего тела (его части) в пространстве под
действием сил (L,
[Дж])
Работа совершенная над телом – количество энергии,
полученное телом в форме работы
Затраченная телом работа – количество энергии, отданное
телом в форме работы
Термодинамика
23.
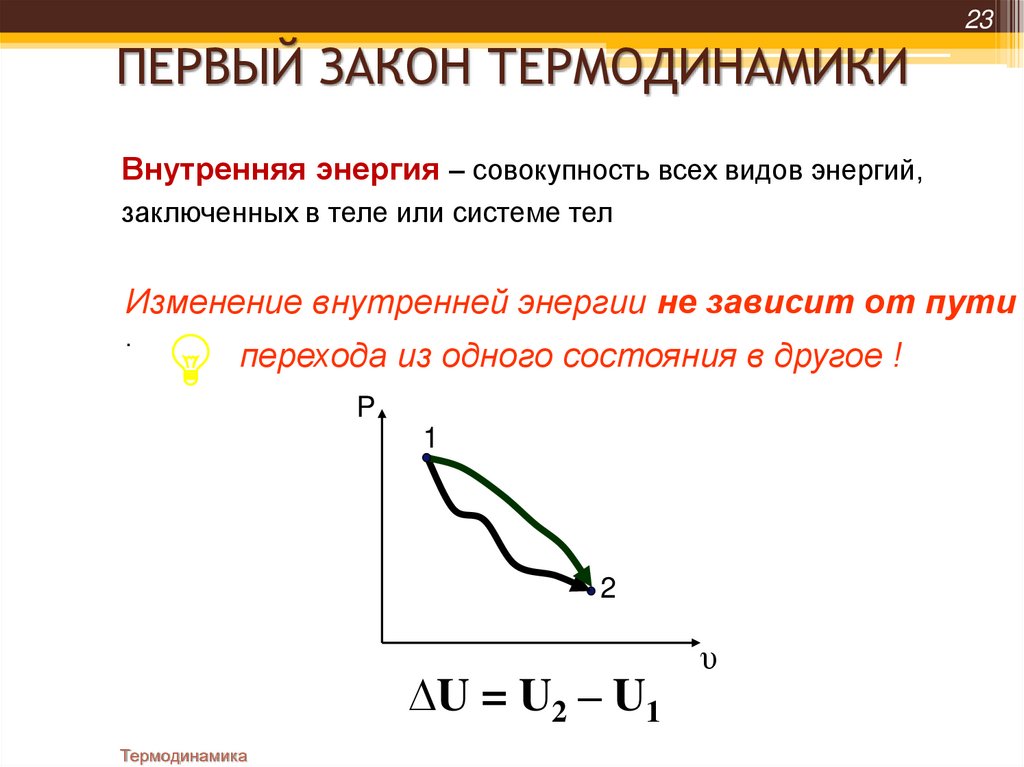
23ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Внутренняя энергия – совокупность всех видов энергий,
заключенных в теле или системе тел
Изменение внутренней энергии не зависит от пути
.
перехода из одного состояния в другое !
P
1
2
∆U = U2 – U1
Термодинамика
υ
24.
24ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
I закон термодинамики – закон сохранения и превращения энергии
«Энергия не исчезает и не возникает вновь, она лишь
переходит из одного вида в другой в различных
физических процессах»
Для термодинамических процессов закон устанавливает
связь между теплотой, работой и внутренней энергией
«Теплота, подведенная к системе, расходуется на
изменение энергии системы и совершение работы»
Термодинамика
25.
25ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Уравнение I закона термодинамики
Q = (U2 – U1) + L
Q – количество теплоты подведенной (отведенной) к системе
L – работа, совершенная системой (над системой)
(U2 – U1) – изменение внутренней энергии в данном процессе
Если
Q > 0 – теплота подводится к системе
Q < 0 – теплота отводится от системы
L > 0 –работа совершается системой
L < 0 – работа совершается над системой
Термодинамика
26.
ТЕПЛОЕМКОСТЬ26
Теплоемкость – количество теплоты, требуемое для изменения
температуры тела на один градус
С = dQ / dT , [Дж /К]
Удельные теплоемкости
массовая – с = С / m , [Дж/кг∙К]
молярная – сμ = С / ν , [Дж/моль∙К]
объемная - с′ = С / V = с·ρ , [Дж/м3 ∙К]
с = с′ · υ = сμ / μ
Термодинамика
27.
27ТЕПЛОЕМКОСТЬ
Теплоемкость
при постоянном давлении
при постоянном объеме
(изобарная) cp
(изохорная) cv
Уравнение Майера
ср – сv = R
Средняя теплоемкость в интервале температур от t1 до t2
t2
t2
t
t1
0
0
с| = (с| · t2 – с| 1· t1) / (t2 - t1)
Термодинамика
28.
28ЭНТАЛЬПИЯ, ЭНТРОПИЯ
Энтальпия
h = u + P·υ,
[Дж/кг]
u = Cv·T
Энтропия – параметр состояния, характеризующий
меру ценности теплоты,
её работоспособности
Удельная энтропия:
Термодинамика
меру потери работы
из-за необратимости
реальных процессов
меру беспорядка
системы
ds = dq / T, [Дж/(кг·К)]
29.
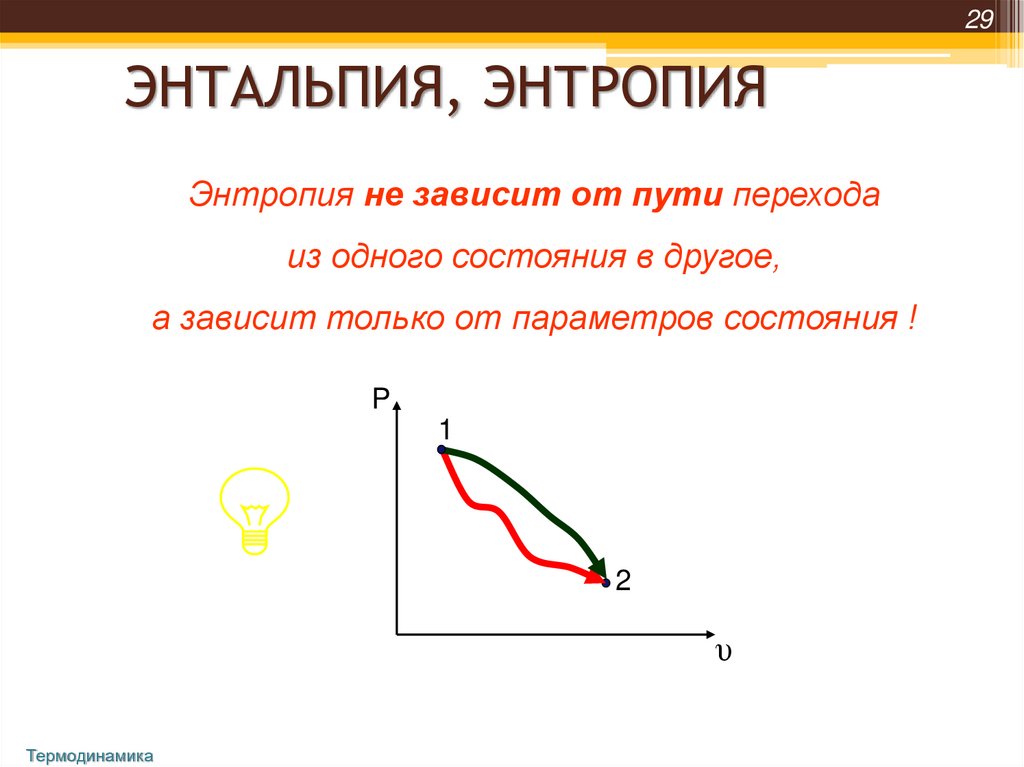
29ЭНТАЛЬПИЯ, ЭНТРОПИЯ
Энтропия не зависит от пути перехода
из одного состояния в другое,
а зависит только от параметров состояния !
P
1
2
υ
Термодинамика
30.
30Второй закон термодинамики
Устанавливает
возможен или невозможен тот или иной процесс
в каком направлении протекает процесс
когда достигается термодинамическое равновесие
при каких условиях можно получить максимальную работу
«Теплота не может самопроизвольно переходить
от более холодного тела к более нагретому»
«Там где есть разница температур,
возможно совершение работы»
Термодинамика
31.
31Смесь газов
Газовая смесь – смесь отдельных газов, не вступающих между
собой в химические реакции
Закон Дальтона
Р = Р1 + Р2 + Р3 + . . . Рn = ∑ Рi
Р1 , Р2 , Р3 . . . Рn – парциальные давления
Парциальное давление – давление, которое имел бы каждый
газ, входящий в состав смеси, если бы этот газ находился один в
том же количестве, в том же объеме и при той же температуре,
что и в смеси
Термодинамика
32.
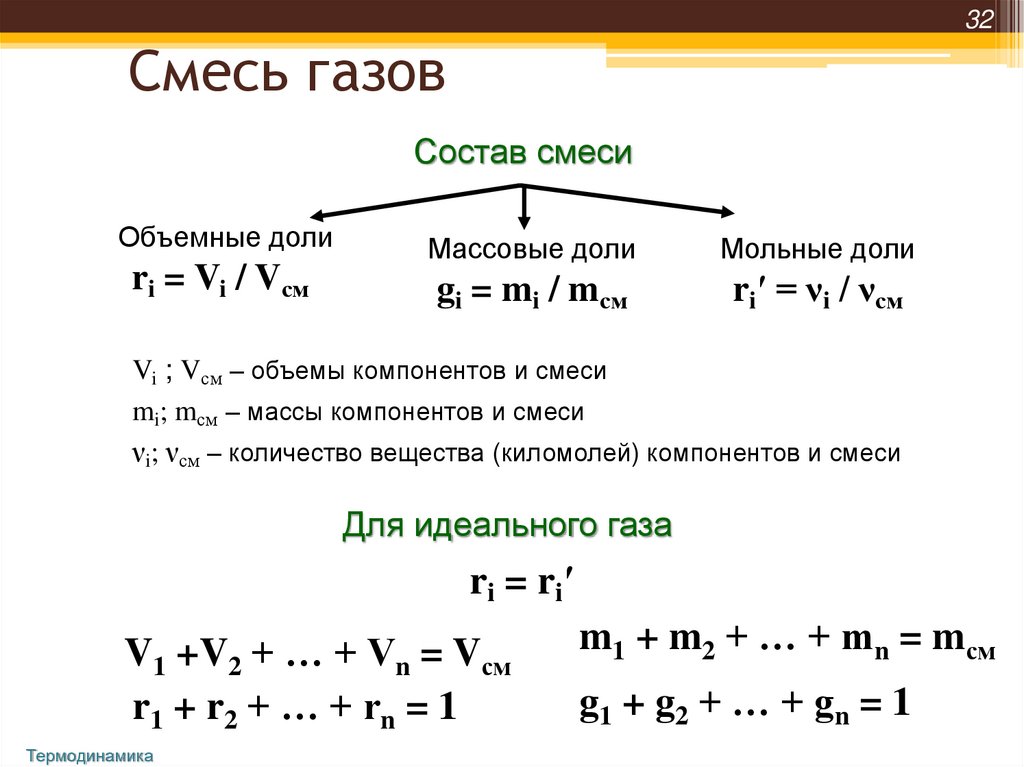
32Смесь газов
Состав смеси
Объемные доли
ri = Vi / Vсм
Массовые доли
Мольные доли
gi = mi / mсм
ri′ = νi / νсм
Vi ; Vсм – объемы компонентов и смеси
mi; mсм – массы компонентов и смеси
νi; νсм – количество вещества (киломолей) компонентов и смеси
Для идеального газа
ri = ri′
V1 +V2 + … + Vn = Vсм
r1 + r2 + … + rn = 1
Термодинамика
m1 + m2 + … + mn = mсм
g1 + g 2 + … + g n = 1
33.
33Смесь газов
Связь между объемными и массовыми долями
gi = ri∙μi/μсм
μi, μсм – молекулярные массы компонентов и смеси
Молекулярная масса смеси
n
μсм = Σ(μi · ri)
i=1
Газовая постоянная смеси
n
n
n
i=1
i=1
i=1
Rсм = Σ (gi · Ri) = Rμ Σ (gi/μi) = 1 / Σ(ri/Ri)
Термодинамика
34.
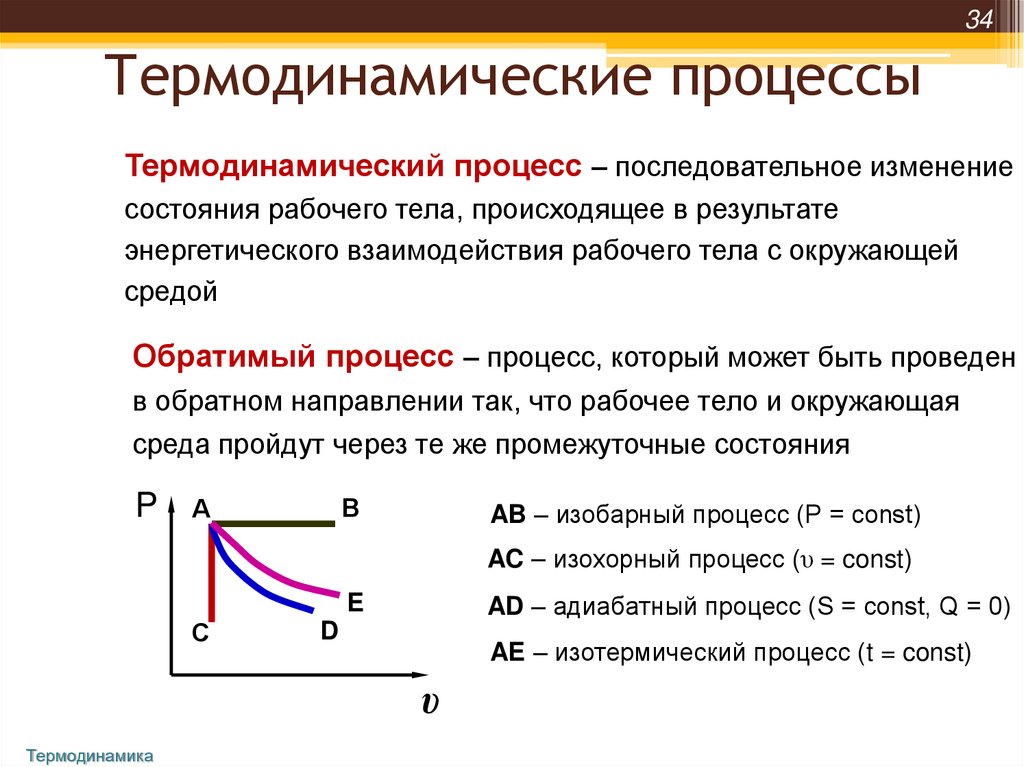
34Термодинамические процессы
Термодинамический процесс – последовательное изменение
состояния рабочего тела, происходящее в результате
энергетического взаимодействия рабочего тела с окружающей
средой
Обратимый процесс – процесс, который может быть проведен
в обратном направлении так, что рабочее тело и окружающая
среда пройдут через те же промежуточные состояния
P
В
А
AB – изобарный процесс (Р = const)
AC – изохорный процесс (υ = const)
AD – адиабатный процесс (S = const, Q = 0)
E
С
D
AE – изотермический процесс (t = const)
υ
Термодинамика
35.
35Термодинамические процессы
Рисунок
2
охлаждение
Изохорный
P
(v=const)
v1=v2
нагревание
Процесс
I закон т/д
P2/P1=T2/T1
l=0
q = Δu =
сv·(t2 - t1)
1
υ
Термодинамика
Уравнение
ИГ
Энтропия
Δs =
cv·ln(T2/T1)
36.
36Термодинамические процессы
Процесс
Изобарный
(P=сonst)
P2 = P 1
Рисунок
P
Уравнение
ИГ
cp·ln(T2/T1)
2
охлаждение
q = Du + l =
ср·(t2 - t1)
υ
Термодинамика
Энтропия
υ 2/υ 1=T2/T1 l = P·(υ2 - υ1) Ds =
нагревание
1
I закон т/д
37.
37Термодинамические процессы
Процесс
Изотермоческий
(T=сonst)
T2 = T1
Рисунок
Уравнение ИГ
I закон т/д
P
υ 2/υ 1=P1/P2
Du = 0
q=l=
1
2
l=q
υ
Термодинамика
=R·T·ln(υ2/υ 1)
38.
38Термодинамические процессы
Процесс
Рисунок
Уравнение I закон т/д
ИГ
Pυ k =const
Адиабатный
P
(s=сonst)
s2 = s1
1
2
l
υ
Термодинамика
R T1 1 υ1 υ2
Энтро
пия
k 1
Δs=0
k = cp/cv – l
k 1
показатель
адиабаты l Du c t t
v
2
1
R T1 T2
k 1
39.
39Термодинамические процессы
Процесс
Политропный
(cn=const)
Рисунок
при
n = ± , υ=сonst
n = 0, P=сonst
n = 1, T=сonst
n= k, P·υk=сonst
Уравнение
ИГ
P·υn=сonst
n - показатель
политропы
I закон т/д
Теплота процесса
q = cn ·(T2 – T1)
Δs =
cv·ln(T2/T1)
массовая теплоемкость
политропного процесса
cn=cv·(n – k)/(n – 1)
l
Термодинамика
Энтропия
R T1 - T2
n -1
RT1 1- υ1 υ2
n -1
n -1
+cp·ln(υ2/υ1)



































 Физика
Физика








