Похожие презентации:
Химическая связь
1.
Химическая связь2.
• Атомыобъединяются
в
молекулы
при
возникновении между ними химических связей.
• Образование химического соединения (молекулы,
сложного иона и др.) происходит потому, что оно
более энергетически устойчиво, чем состояние
отдельных атомов.
• Природа
химической
связи
объясняется
взаимодействием электрических полей, электронов
и ядер атомов, участвующих в образовании
химического соединения.
3.
• В зависимости от характера распределенияэлектронной
плотности
между
взаимодействующими атомами различают три
основных типа химической связи:
ковалентную,
ионную,
металлическую
4.
Ковалентная связь• Ковалентная связь – связь, образованная общими
электронными парами атомов.
• Для описания химических связей в любых
молекулах в настоящее время наибольшее
распространение получили полуэмпирические
методы:
• метод валентных связей (ВС)
• метод молекулярных орбиталей (МО).
• В основе этих методов лежат представления
квантовой механики.
5.
Метод валентных связей (ВС)• В 1916 г. американский ученый Льюис высказал
предположение о том, что химическая связь
образуется за счет обобществления двух
электронов. При этом электронная оболочка атома
стремится приобрести электронную конфигурацию
благородного газа.
• Эти предположения послужили основой для
развития метода валентных связей. В 1927 г.
Гайтлером
и
Лондоном
был
выполнен
теоретический расчет энергии двух атомов
водорода в зависимости от расстояния между ними.
6.
Результаты расчета зависят от того, одинаковы илипротивоположны по знаку спины взаимодействующих
электронов.
При совпадающем направлении спинов сближение
атомов приводит к непрерывному возрастанию энергии
системы.
При противоположно направленных спинах на
энергетической кривой имеется минимум, т. е.
образуется устойчивая система – молекула водорода
Н2.
7.
Зависимость энергии от расстояния между атомамиводорода при одинаково и противоположно
направленных спинах:
r0 соответствует минимуму
межъядерного расстояния и
называется длиной связи, а
энергия связи равна глубине
потенциальной ямы E0–E1,
где Е0 – энергия двух
невзаимодействующих
атомов, находящихся на
бесконечном
расстоянии
друг от друга.
8.
• Образование химической связи между атомамиводорода
является
результатом
взаимопроникновения
(перекрывания)
электронных облаков. Вследствие этого
перекрывания плотность отрицательного заряда
в межъядерном пространстве возрастает, и
положительно заряженные ядра притягиваются
к этой области. Такая химическая связь
называется ковалентной.
9.
Основные положения метода ВС• 1. Ковалентная связь образуется между двумя
атомами за счет взаимодействия электронных
орбиталей с антипараллельными спинами
электронов.
• 2. Связь располагается в направлении,
обеспечивающем
наибольшую
степень
перекрывания электронных орбиталей.
• 3. Ковалентная связь тем прочнее, чем более
полно перекрываются электронные орбитали.
10.
• Различают следующие механизмы образованияковалентной связи:
• обменный (спин-валентный);
• донорно-акцепторный;
• дативный.
11.
Обменный (спин-валентный)механизм
• механизм, по которому каждый из связываемых
атомов предоставляет для ее образования по
одному неспаренному электрону. Его можно
выразить следующей схемой:
+
=
12.
13.
Примеры образования связей пообменному механизму
NH3
2s
HF
2s
2p
2p
F
N
1s 1s 1s
1s
H H H
H
14.
• у атома углерода только два неспаренныхэлектрона, и он может образовать только две
ковалентные связи по обменному механизму.
Если атом углерода возбудить, т. е. сообщить
ему некоторую дополнительную энергию, то
один из 2s-электронов может перейти на
свободную 2р-орбиталь:
15.
2sC
2p
2s
возбуждение
2p
C*
• В этом состоянии углерод может образовать
четыре ковалентные связи, например, с
атомами водорода или кислорода.
16.
CH42s
C
CO2
2p
O
*
C*
1s 1s 1s 1s
H H H H
O
2s
2p
17.
Донорно-акцепторный механизм• Химическая связь образуется за счет
предоставления одним атомом в общее
пользование пары электронов, а другим –
свободной орбитали.
• Атом, предоставляющий электронную пару,
называется донором, а атом, имеющий
свободную орбиталь, – акцептором.
18.
• Схема образования связи в этом случаевыглядит так:
+
=
19.
• Например, молекула аммиака за счетэлектронной пары азота может образовать
четвертую связь с элементом, имеющим
вакантную орбиталь: NH3 + H+ = NН4+
2s
2p
N
H+
1s
H 1s H 1s H 1s
20.
• В случае дативной связи оба атома либо обечастицы одновременно выступают в роли и
донора, и акцептора электронов.
3s
3d
3p
Cl
Cl
3d
3p
3s
21.
• Электронные облака атомов имеют различнуюформу, их взаимное перекрывание может
осуществляться разными способами.
• В зависимости от способа перекрывания и
симметрии образующегося облака различают
- (сигма) и - (пи) связи.
22.
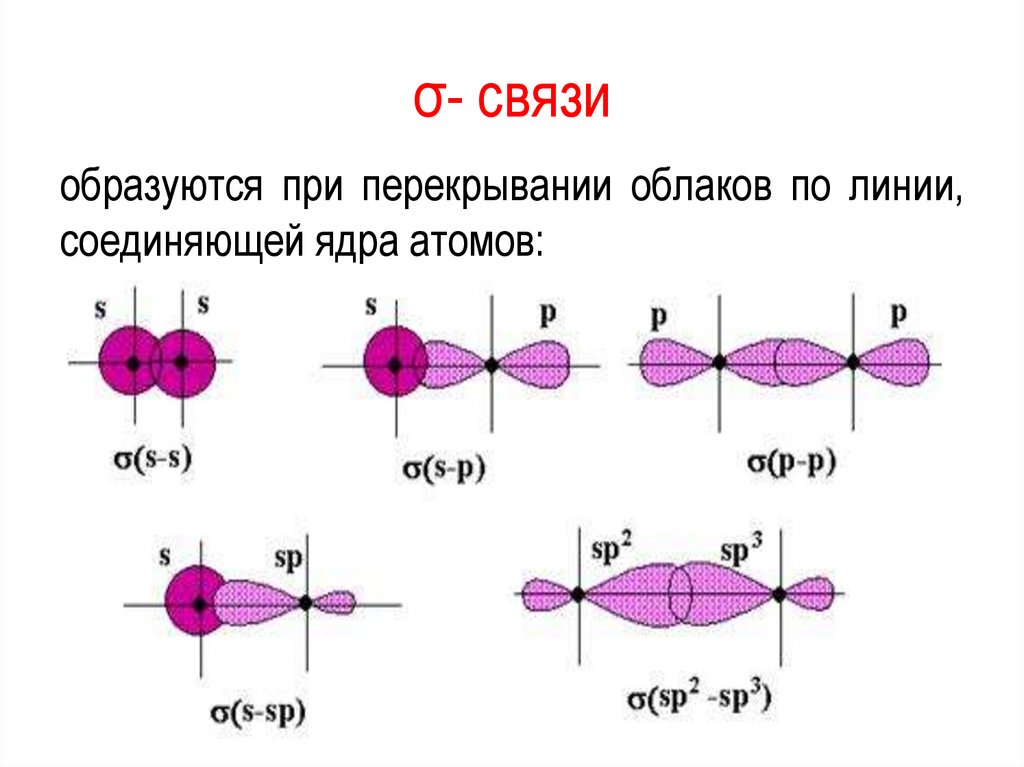
σ- связиобразуются при перекрывании облаков по линии,
соединяющей ядра атомов:
23.
π- связиобразуются при перекрывании электронных
облаков по обе стороны от линии, соединяющей
ядра атомов:
24.
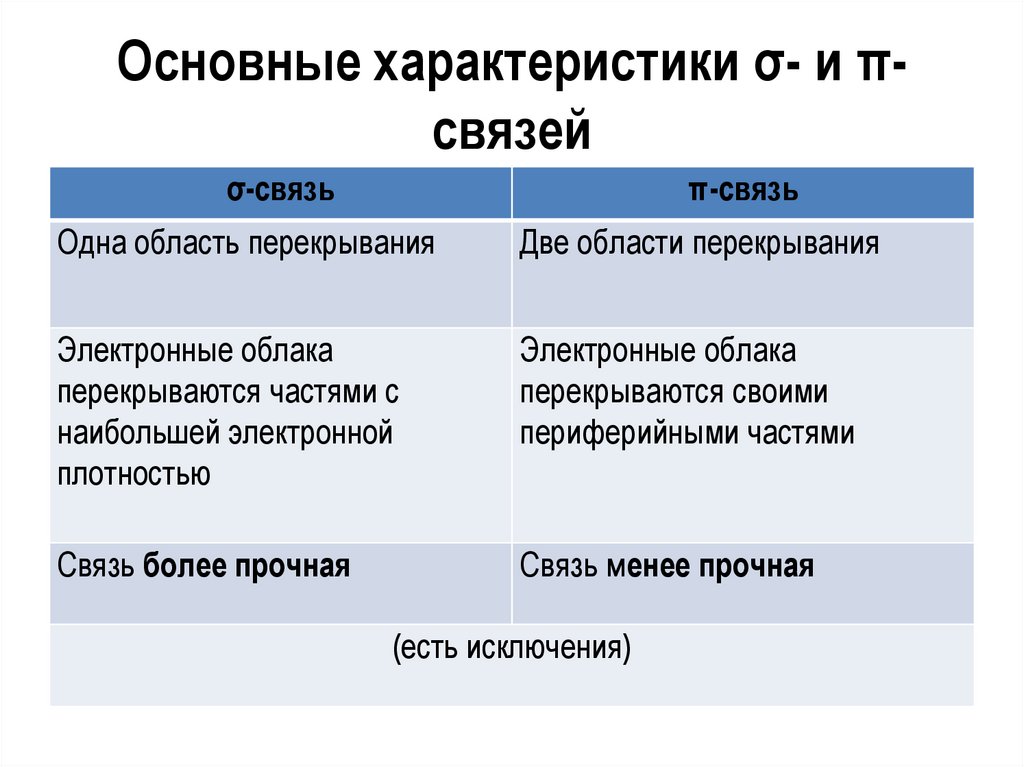
Основные характеристики σ- и πсвязейσ-связь
π-связь
Одна область перекрывания
Две области перекрывания
Электронные облака
перекрываются частями с
наибольшей электронной
плотностью
Электронные облака
перекрываются своими
периферийными частями
Связь более прочная
Связь менее прочная
(есть исключения)
25.
• Химическая связь характеризуется следующимипараметрами:
1) длиной связи – межъядерным расстоянием между
двумя химически связанными атомами;
2) валентным углом – углом между воображаемыми
линиями, проходящими через центры химически
связанных атомов;
3) энергией связи – количеством энергии, затрачиваемой
на ее разрыв в газообразном состоянии;
4) кратностью связи
– числом электронных пар,
посредством которых осуществляется химическая связь
между атомами.
26.
• π-связь возможна только в случае образованиякратных связей (двойных и тройных).
• Кратные связи короче и прочнее одинарных.
27.
Схема связей в молекуле N228.
С 2Н229.
Свойства ковалентной связи• Ковалентная связь обладает:
• насыщаемостью,
• направленностью,
• поляризуемостью.
30.
Поляризуемость• Если электронная пара, связывающая в
молекуле два одинаковых атома, в равной мере
принадлежит обоим атомам, в молекуле нет
разделения центров тяжести положительного и
отрицательного
зарядов.
Такая
связь
называется ковалентной неполярной.
31.
• Для наглядного изображения ковалентной связив химических формулах используются точки
(точка соответствует электрону, две точки между
элементами – электронной паре), а также
черточки
(чертой
обозначают
общую
электронную пару).
• Например, молекула хлора :
..
..
..
.. ..
Cl
Cl
.. ..
или Сl – Cl
32.
Ковалентная неполярная связь существует вмолекулах одноэлементных газов: H2, O2, N2, Cl2 …
33.
• Если электронная пара связывает два атома сразличной электроотрицательностью, то она
смещается
в
сторону
более
электроотрицательного атома.
• Элементы с большей электроотрицательностью
будут оттягивать общие электроны от элементов с
меньшей электроотрицательностью. Центры
тяжести положительного и отрицательного
зарядов разделяются, связь становится полярной
и называется ковалентной полярной связью
(к.п.с.).
34.
• К.п.с. существует в молекулах HCl, H2O, NF3,CO2 и др.
• За счет смещения электронов от водорода к
хлору в молекуле HCl атом хлора заряжается
частично отрицательно (δ ), водорода
частично положительно (δ+):
..
..
H. +.Cl
..
. .. .
H
.
. Cl
..
35.
• Мерой полярности связи является электрическиймомент диполя (ЭМД) μ, представляющий собой
произведение длины диполя l на абсолютный
эффективный заряд :
μ= ∙l
ЭМД обычно выражают в Кл · м. Это векторная
величина, направленная от положительного полюса
диполя к отрицательному. В многоатомных молекулах
суммарный ЭМД равен векторной сумме ЭМД
отдельных связей и зависит от строения молекулы.
36.
Электрический момент диполя в Кл · м имеетзначения порядка 10−29, поскольку длина диполя
имеет значение порядка диаметра атома (∼10−10
м), а заряд электрона 1,6 · 10−19 Кл.
В качестве единицы измерения используют также
внесистемную единицу измерения дебай (D),
1 D = 3,3 · 10−30 Кл · м. В справочной литературе
дипольные моменты молекул приводят в дебаях.
Большинство полярных молекул имеют дипольный
момент порядка 1 дебая.
37.
ЭМД химической связи в молекулахСвязь
Разность ЭО
μ, D
H–F
H–Cl
H–Br
H–I
1,78
0,96
0,76
0,46
1,83
1,11
0,83
0,45
38.
• Химическая связь в большинстве соединенийсочетает свойства ковалентной и ионной связи.
Степень
ионности
характеризуется
эффективным зарядом атомов, определяемым
экспериментально.
• В молекуле HCl эффективный заряд на атоме
водорода составляет +0,18, а на атоме хлора
–0,18 абсолютного заряда электрона. Связь в
молекуле HCl имеет на 18% ионный характер и
на 82% – ковалентный.
39.
Насыщаемость• Насыщаемость ковалентной связи обусловлена
ограниченными валентными возможностями
атомов, т. е. их способностью к образованию
строго определенного числа связей. Общее
число валентных орбиталей в атоме
определяет
максимально
возможную
валентность элемента.
• Число использованных для этого орбиталей
определяет валентность элемента в данном
соединении.
40.
41.
• Например, в соединении PCl3 фосфортрехвалентен, в соединении SiF4 кремний имеет
валентность четыре:
3p
3p
3s
3s
Si
P
Cl
Cl Cl
• В HNO3 валентность азота = 4
F
F
F
F
42.
Направленность• Направленность
ковалентной
связи
обусловливается тем, что электронные облака
атомов имеют определенное конфигурацию –
расположение в пространстве. Часто в
образовании связи участвуют орбитали разных
конфигураций. Для объяснения того, как
неравноценные по исходному состоянию
орбитали образуют равноценные химические
связи
используются
представления
о
гибридизации валентных орбиталей.
43.
• Гибридизация сопровождается изменением формыи энергии электронных облаков, которое
происходит
при
поглощении
энергии
и
сопровождается образованием одинаковых по
форме и энергии гибридных облаков (орбиталей).
Незначительные затраты энергии при таких
изменениях
окупаются
при
образовании
равноценных связей.
• Гибридные орбитали изображают в виде
неправильной сильно смещенной в одну сторону
гантели
.
44.
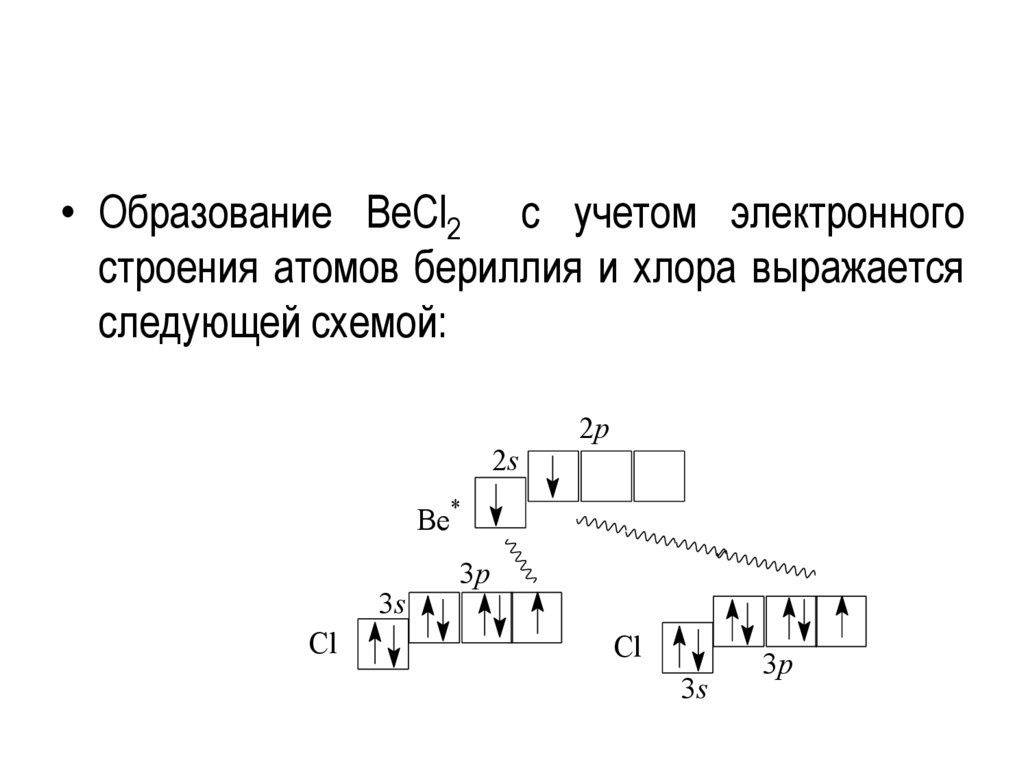
• Образование BeCl2 с учетом электронногостроения атомов бериллия и хлора выражается
следующей схемой:
2s
2p
Be*
3s
Cl
3p
Cl
3s
3p
45.
• Для объяснения равноценности связей Be Cl,используют концепцию о sp-гибридизации
валентных атомных орбиталей бериллия. При
гибридизации одна s-орбиталь и одна pорбиталь атома бериллия как бы смешиваются и
выравниваются по форме и энергии, давая две
одинаковые sp-гибридные орбитали.
46.
sp-гибридизацияЛинейную форму имеют и все другие молекулы с spгибридизацией атомных орбиталей
47.
• sp2-гибридизация дают плоскостную геометриюмолекулы: BF3
48.
BF32p
2s
F
2s
B
2s
F
2p
*
2p
F
2s
2p
49.
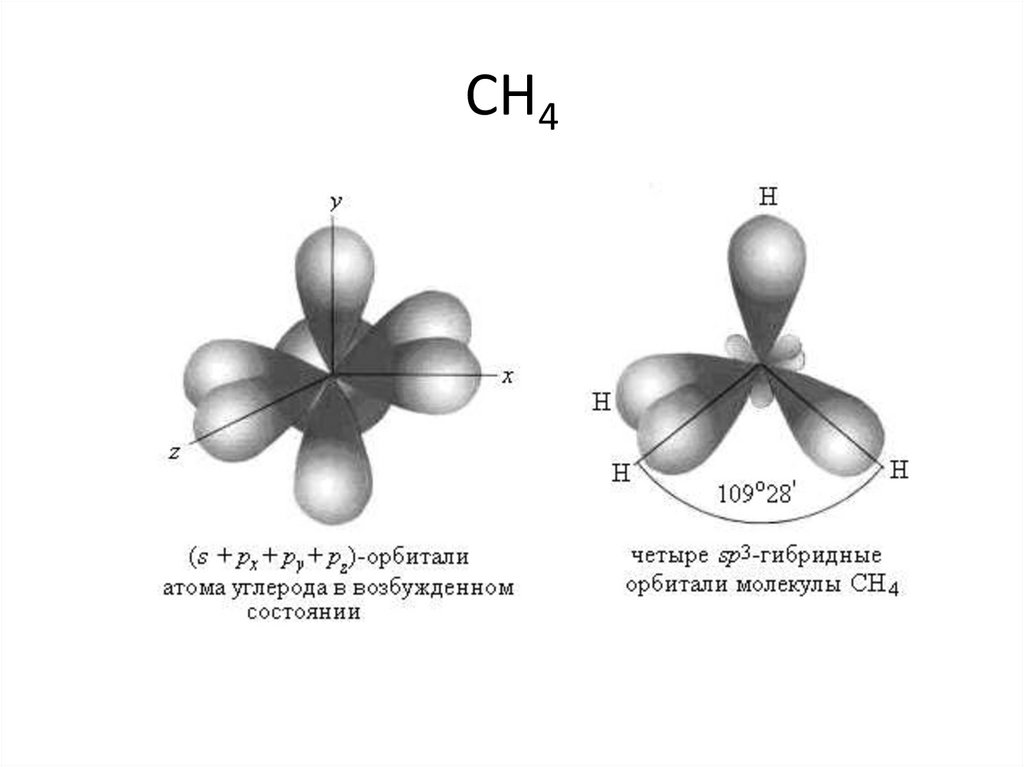
• Когда смешиваются одна s- и три p-орбитали,возникают sp3-гибридизованные орбитали,
имеющие геометрию тетраэдра (CH4):
2s
C*
H 1s
H 1s H 1s H 1s
50.
CH451.
• Гибридизации могут подвергаться как орбиталис неспаренными электронами, так и орбитали,
на
которых
находятся
неподеленные
электронные пары.
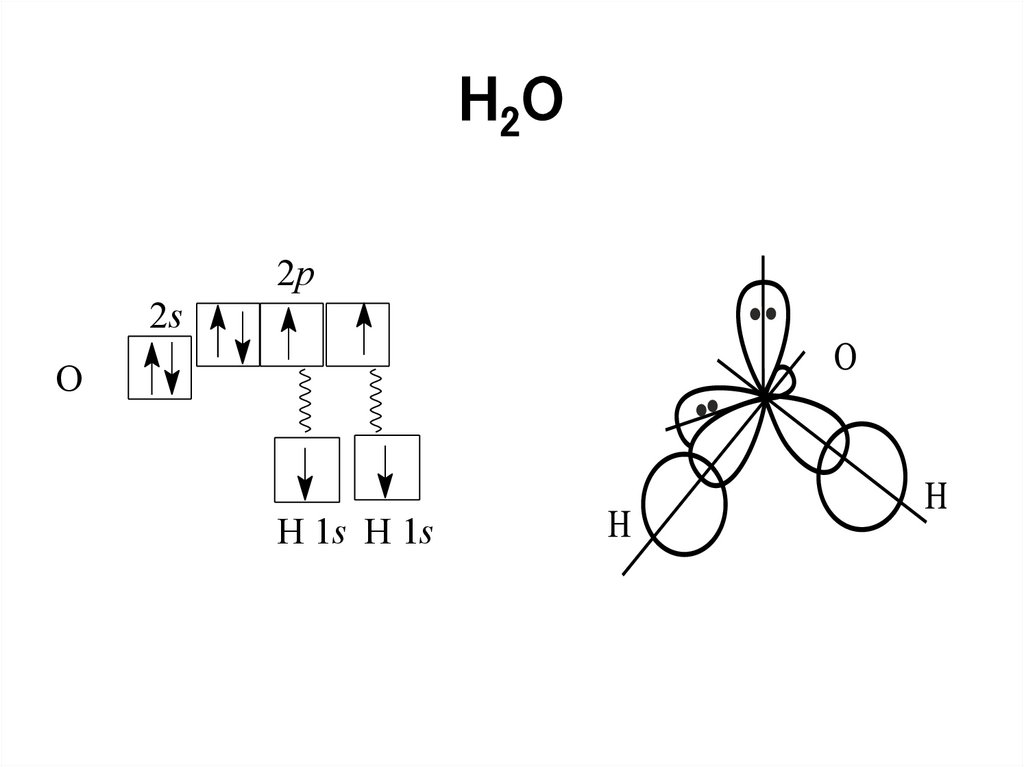
• Например, в молекуле воды H2O кислород
находится в состоянии sp3-гибридизации:
52.
H2O2p
2s
O
H 1s H 1s
53.
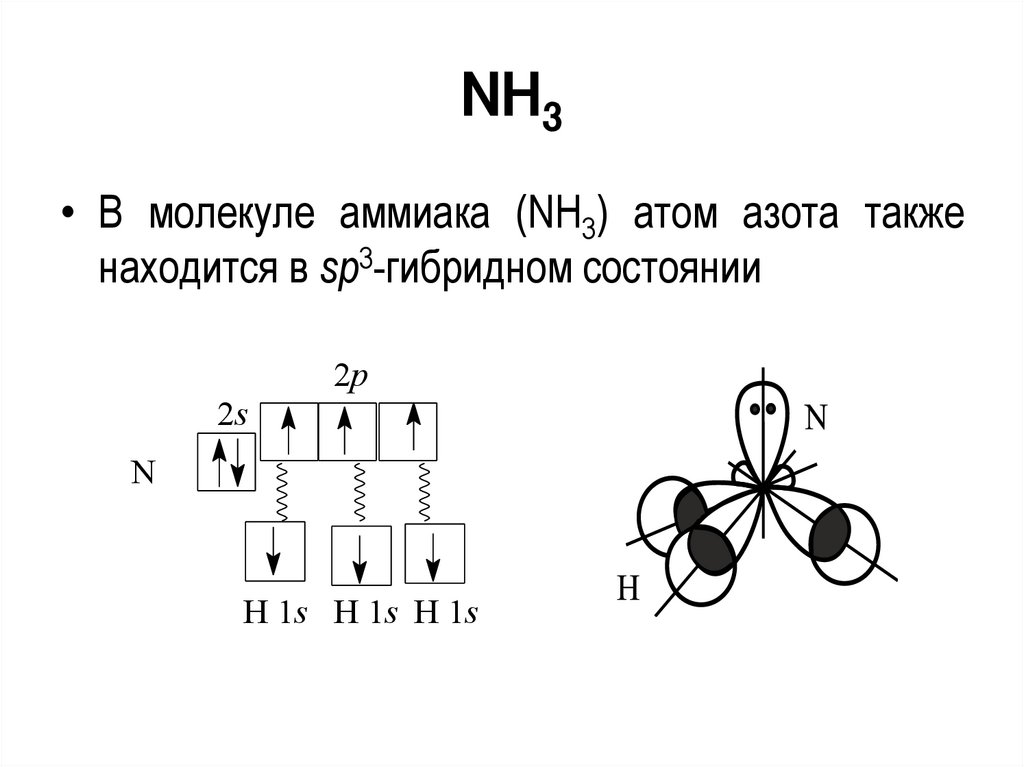
NH3• В молекуле аммиака (NH3) атом азота также
находится в sp3-гибридном состоянии
2p
2s
N
H 1s H 1s H 1s
54.
H 1sC2H2
2s
C2H4
2p
C*
H H
1s
2s 2p
1s
C*
HC
C*
2s
2p
CH
C*
2s 2p
1s
1s
H 1s
a)
H2C
б)
H H
CH2
55.
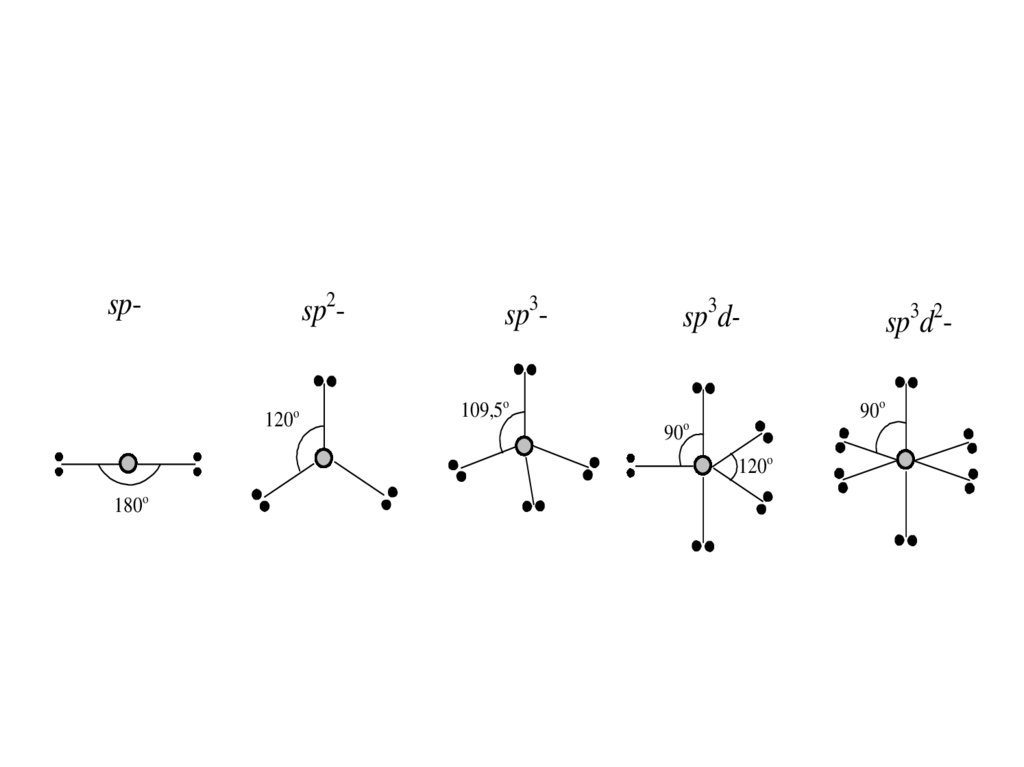
Обобщением метода ВС для предсказания геометриимолекул является метод Гиллеспи.
Основные положения метода Гиллеспи:
• 1. Все электроны, образующие химические связи
атомов, считаются равноценными независимо от их
типа (s, p, d, f).
• 2. Атомный остов, содержащий ядро и внутренние
электронные оболочки, не оказывает влияние на
расположение валентных электронов.
• 3. Электронные пары располагаются в пространстве
таким образом, чтобы отталкивание между ними было
минимальным: две электронные пары располагаются
линейно, три образуют правильный треугольник,
четыре
располагаются
тетраэдрически,
пять
направлены к вершинам тригональной бипирамиды,
шесть – к вершинам октаэдра
56.
sp2-sp-
120o
sp3109,5o
sp3d-
90o
90o
120o
180o
sp3d2-
57.
• 4. Строение молекулы определяется расположениемв пространстве связывающих электронных пар.
• 5. Орбиталь кратной связи считается единичной,
независимо от того, содержит она одну или две π связи. В то же время электронные пары двойной и
тройной связи занимают в пространстве несколько
больше места, чем электронная пара одинарной
связи.
• 6. Неподеленная электронная пара в пространстве
занимает больше места, чем связывающая
электронная пара.
58.
При рассмотрении геометрической формымолекулы методом Гиллеспи ее формула
записывается в виде AХnEm,
А – центральный атом;
X – атом, с которым центральный атом образует
химическую связь, то есть дает связывающие
электронные пары, n – число атомов Х ;
Е – неподеленная электронная пара; m – число
неподеленных электронных пар.
59.
• Число неподеленных электронных пар mопределяют следующим образом: число
валентных электронов центрального атома
минус число электронов, участвующих в
образовании связей. Полученную разность
делят на 2.
• Далее
определяется
пространственное
расположение
всех
электронных
пар
(связывающих
и
неподеленных),
затем
устанавливается геометрия молекулы.
60.
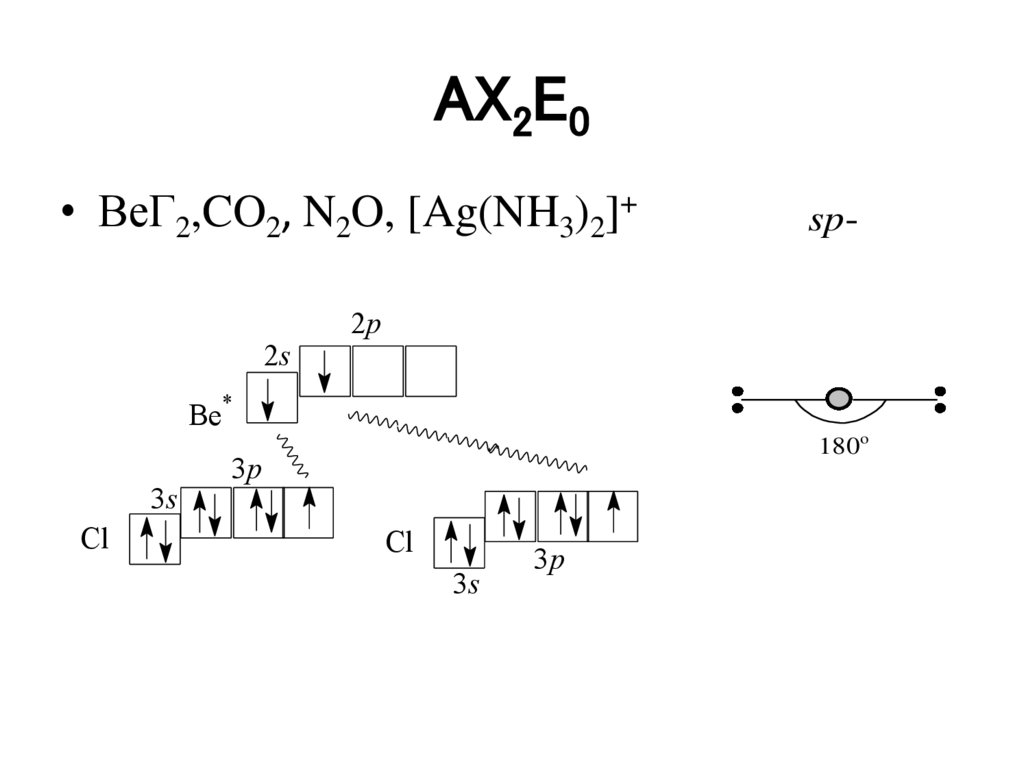
AX2E0• BeГ2,CO2, N2O, [Ag(NH3)2]+
2s
sp-
2p
Be*
3s
Cl
180o
3p
Cl
3s
3p
61.
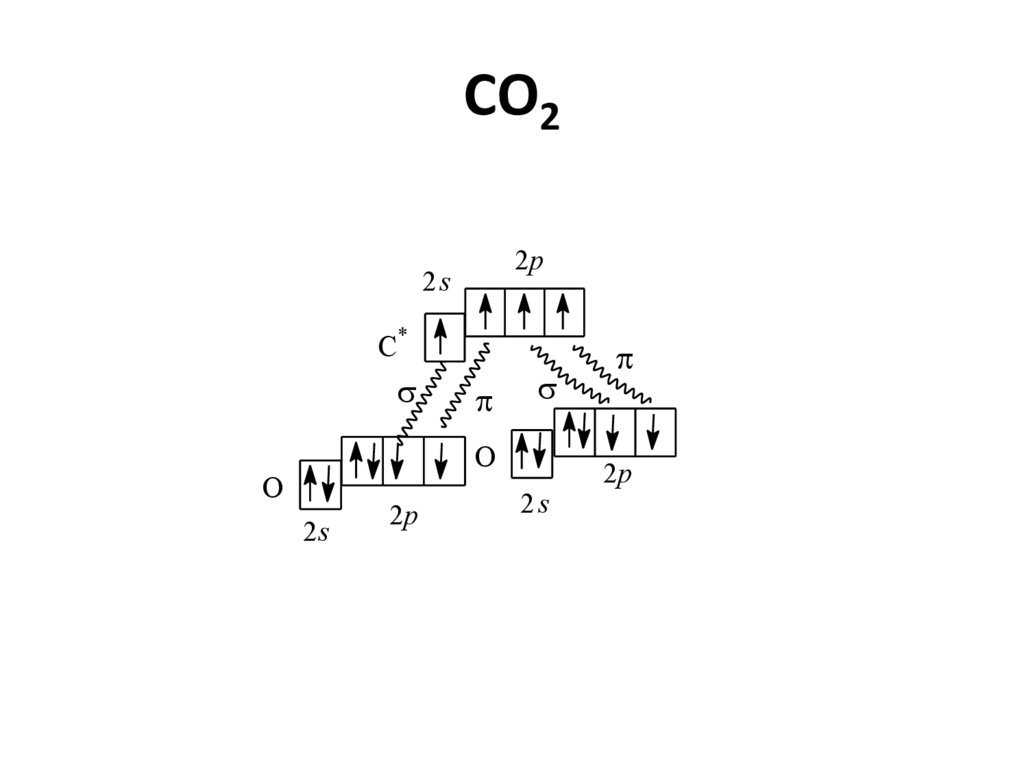
СО22p
2s
C*
O
O
2s
2p
2s
2p
62.
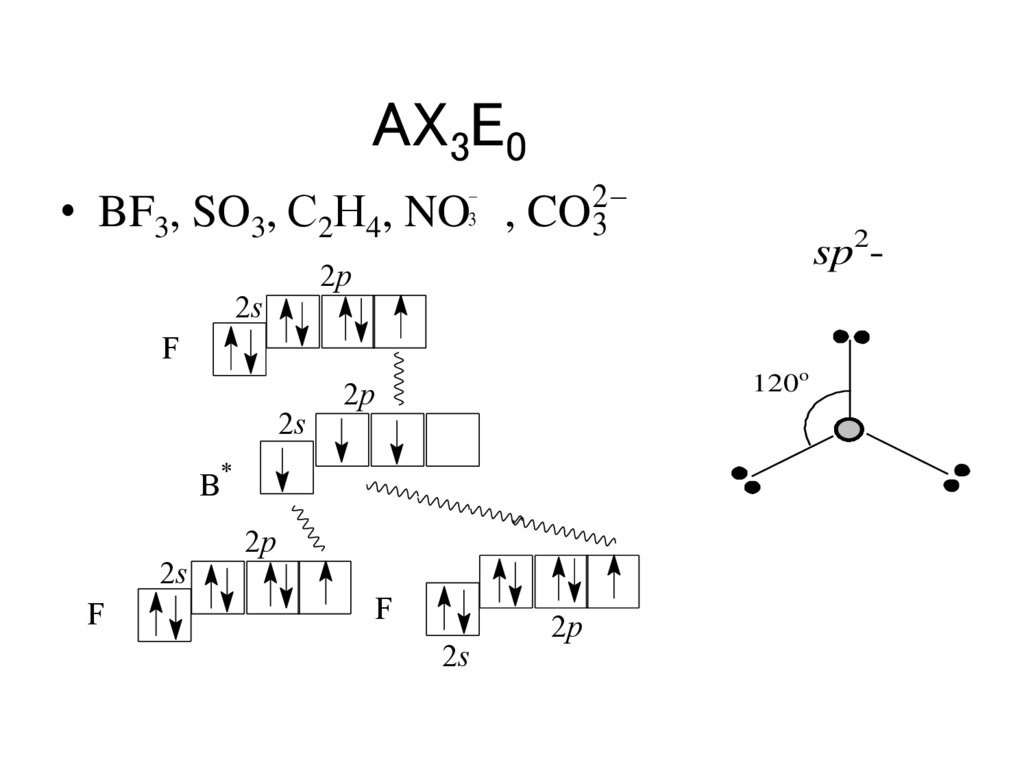
AX3E0• BF3, SO3, С2Н4, NO , CO32
3
sp2-
2p
2s
F
2s
120o
2p
B*
2s
F
2p
F
2s
2p
63.
AX2E1• SnCl2, SO2, O3
2s
O
S
O*
2p
2
sp - гибридизация
валентный угол 120o
64.
• Строение многих молекул нельзя изобразитьтолько одной схемой с локализованной связью. В таких случаях строение молекулы
может отражаться несколькими структурами с
помощью метода ВС, которые по отношению
друг к другу являются резонансными.
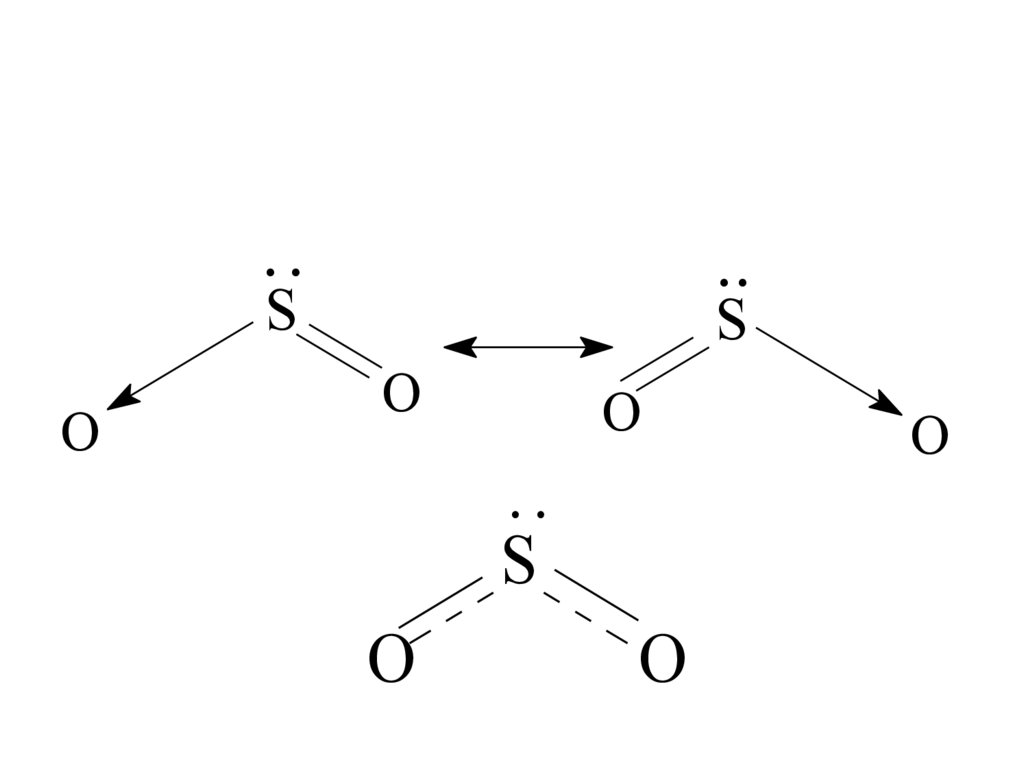
• Например, молекула SO2 может быть
изображена в виде двух резонансных структур:
65.
....
S
О
S
О
О
..
S
О
О
О
66.
AX2E2• H2O
3
sp - гибридизация
2p
валентный угол 104,5o
2s
O
H 1s H 1s
67.
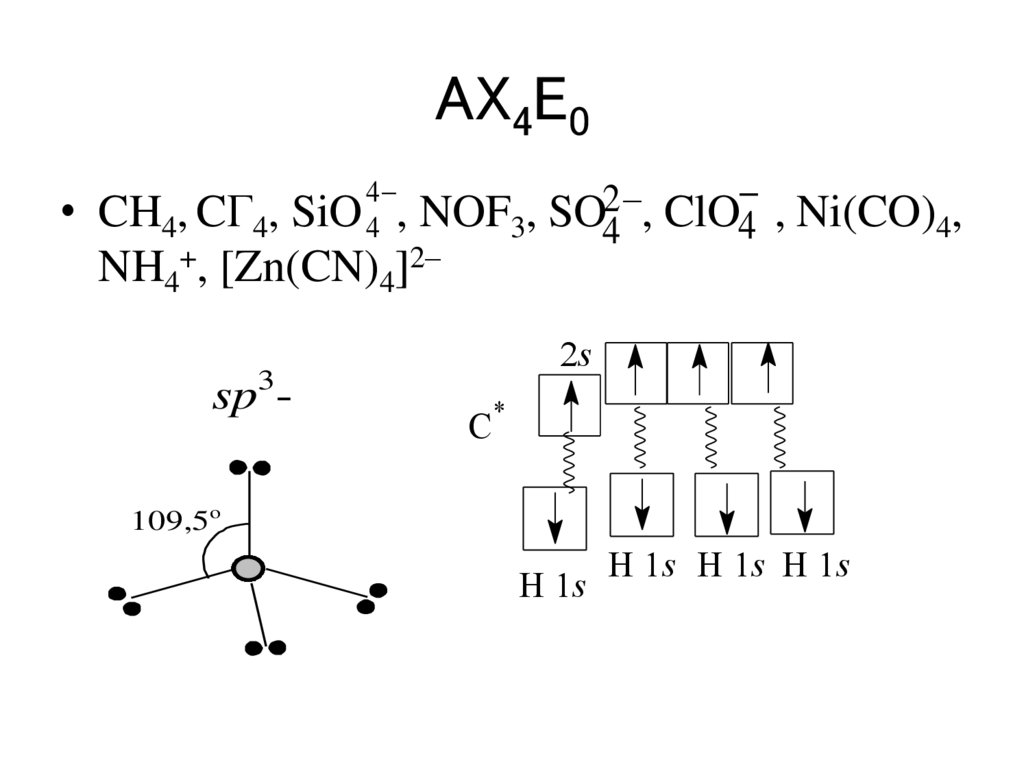
AX4E04
CH4, CГ4, SiO 4 , NOF3, SO24 , ClO4 , Ni(CO)4,
NH4+, [Zn(CN)4]2–
sp3-
2s
C
*
109,5o
H 1s
H 1s H 1s H 1s
68.
AX3E1• NH3, H3O+, SOCl2, SO 32 , IO 3 , BrO 3
2p
2s
N
sp3- гибридизация
валентный угол 107
H 1s H 1s H 1s
o
69.
AX5E0• PГ5, Fe(CO)5
3d
3p
3s
sp3d-
P*
F
90 o
120 o
F
F
F
F
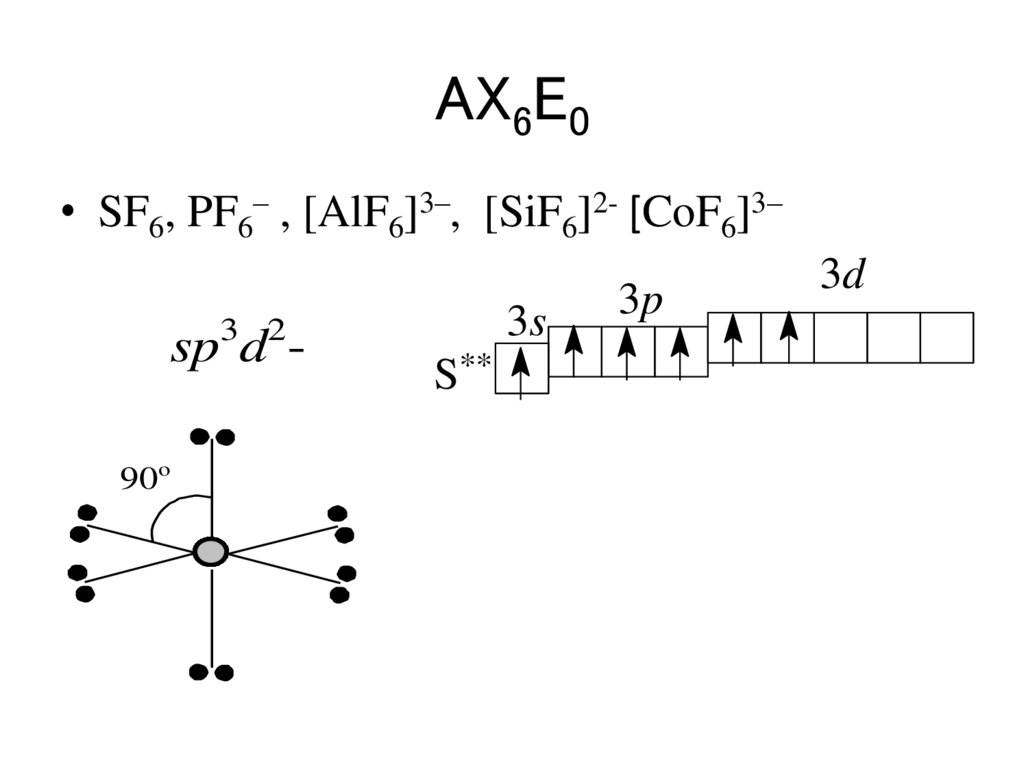
70.
AX6E0• SF6, PF6– , [AlF6]3–, [SiF6]2- [CoF6]3–
3s
3 2
sp d 90o
S**
3p
3d
71.
H 1s H 1sCH
CH
H 1s
CH2
CH 2
2p
2s
2s
C*
C*
C*
C*
2p
H 1s
H 1s H 1s
72.
• Следует различать полярность связей иполярность молекул. Связи в молекуле могут
быть
полярными,
а
сами
молекулы
неполярными в случае ее высокой симметрии.
Например, электрический момент диполя
симметрично связанных молекул СО2, SO3, СН4
равен нулю, хотя связи полярны.
• Дипольный момент молекулы характеризует ее
способность ориентироваться в электрическом
поле между положительными и отрицательными
электродами.
73.
Компенсация диполей в молекуле CO2• Электрический момент диполя молекулы СО2
(sp-гибридизация) равен нулю хотя связи С = О
полярны :
диполь связи
O
диполь связи
C
O
дипольный момент молекулы = o
74.
Неполярными являются также CCl4 (sp3-гибридизация),PF5 (sp3d-гибридизация), SF6 (sp3d2-гибридизация), хотя
связи С–Cl, P–F и S–F полярны:
75.
• Молекула воды имеет угловое строение (sp3гибридизация), является полярной :диполь связи
H
O
диполь связи
H
дипольный момент молекулы
76.
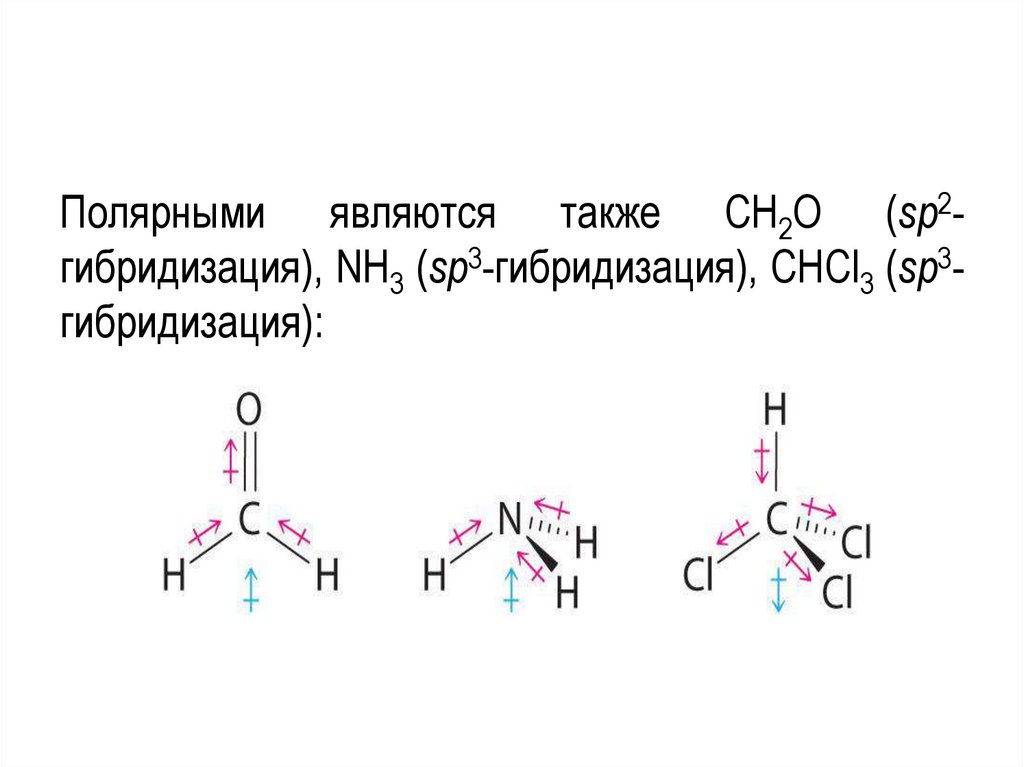
Полярными являются также CH2O (sp2гибридизация), NH3 (sp3-гибридизация), CHCl3 (sp3гибридизация):77.
• Вследствие углового строения μ (SO2) = 1,79 D.• Дипольные моменты NF3 и NH3 при одинаковой
гибридизации атома азота (sp3), примерно
одинаковой полярности связей N–F и N–H и
сходной геометрии молекул существенно
различаются, поскольку дипольный момент
неподеленной пары электронов азота при
векторном сложении ЭМД в случае NH3
увеличивает μ молекулы, а в случае NF3
уменьшает его.
78.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ• Идея метода молекулярных - все электроны
находятся на молекулярных орбиталях, единых для
всей системы ядер и электронов данной молекулы.
• Для определения волновых функций молекулярных
орбиталей используют приближение, называемое
линейной комбинацией атомных орбиталей (ЛКАО):
молекулярная волновая функция (МО) получается
простым сложением или вычитанием атомных
волновых функций (АО).
79.
Основные положения метода МО– в образовании МО могут участвовать АО, имеющие
сходную симметрию и близкую энергию;
– количество МО в молекуле равно сумме АО атомов,
входящих в ее состав;
– АО должны в достаточной степени перекрываться
при образовании МО. Поэтому орбитали внутренних
электронных слоев атомов практически не
участвуют в образовании связи и в методе МО
обычно не рассматриваются.
80.
•По аналогии с атомными s-, p-, d-, f-орбиталямимолекулярные орбитали обозначают греческими
буквами -, -, -, -.
•Заполнение молекулярных орбиталей происходит
так же, как и атомных, с соблюдением принципа
Паули, принципа наименьшей энергии и правила
Хунда; на каждой МО может находиться не более
двух электронов.
81.
• В методе МО образование молекулярныхорбиталей
рассматривается
как
результат
сложения и вычитания комбинируемых АО.
Молекулярная орбиталь, возникающая в результате
сложения АО, отвечает более низкому значению
энергии, чем сумма энергий исходных АО. Такая
МО имеет повышенную электронную плотность в
пространстве между ядрами и способствует
образованию химической связи, она называется
связывающей.
82.
• Молекулярная орбиталь, возникающая врезультате вычитания АО, отвечает более
высокому значению энергии, чем сумма энергий
исходных АО. Электронная плотность в этом
случае сконцентрирована за ядрами атомов, а
между ними равна нулю.
• Подобные МО энергетически менее устойчивы,
они приводят к ослаблению химической связи и
называются разрыхляющими (их часто
обозначают звездочками на схемах)
83.
84.
–
85.
86.
87.
• перекрывание рх-АО, (р-орбиталей, вытянутыхвдоль оси х, соединяющей ядра атомов).
Образуется
связывающая
МО
и
разрыхляющая МО
88.
• py-АО и pz-АО перекрываются с образованиемпо паре одинаковых по энергии, но взаимно
перпендикулярно
ориентированных
в
пространстве -МО
89.
• Образование молекулярных орбиталей изатомных изображают схематически в виде
энергетических диаграмм.
• Рассмотрим построение такой энергетической
диаграммы на примере молекулы водорода Н2,
ионов Н 2 , Не 2
90.
АО (H)E
МО (H2) АО (H)
E
E
+
+
+
+
МО
(H
)
МО
(He
АО
(H
)
АО (H)
АО
(He
)
2
2 ) АО (He)
1s
1s
1s
1s)
1s
1s
1s
1s
1s)
1s
1s
1s)
91.
• Устойчивая частица (молекула, ион) образуетсяв
случае,
если
сумма
электронов,
расположенных
на
связывающих
МО,
превышает сумму электронов на разрыхляющих
МО.
• Порядок связи равен половине разности числа
электронов
на
связывающих
Nсв
и
разрыхляющих Nразр МО:
Порядок связи (ПС) =
N св N разр
2
92.
• Если порядок связи = 0, то молекула не образуется.Порядок связи может принимать как целые, так и
дробные положительные значения. Чем выше
порядок связи, тем прочнее молекула.
93.
частицаH2
H2+
He2+
электронная порядок
конфигураци
связи
я молекулы
*
1,0
( 1s )2 ( 1s
)0
*
0,5
( 1s )1 ( 1s
)0
*
0,5
( 1s )2 ( 1s
)1
Есвязи,
кДж/моль
432
256
250
94.
• молекулярныеорбитали
двухатомных
гомоядерных молекул элементов II периода по
энергии располагаются следующим образом:
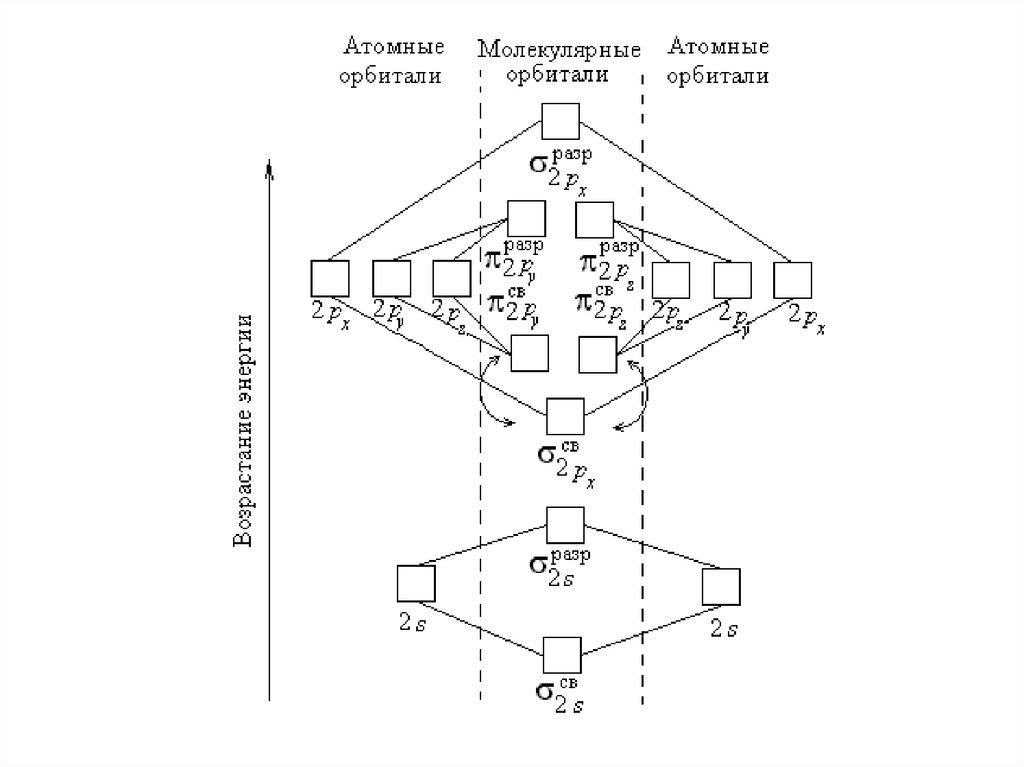
• а) для молекул Li2, Be2, B2, C2, N2 этот порядок св2s
разр
св
св
св
разр
разр
2s 2 ру = 2 рz 2 р 2 р = 2 р разр
2р
х
у
z
х
95.
EАО (N)
МО (N2)
px)
АО (N)
E
АО (O)
pz) py)
АО (O)
pz) py)
px)
2p
МО (O2)
px)
2p
pz) py)
2p
2p
pz) py)
px)
2s
2s
2s
2s
2s)
2s
2s
2s)
96.
EАО (O)
МО (O2+) АО (O+)
px)
E
АО (O)
pz) py)
2p
pz) py)
2p
px)
px)
2s
2s
2s
2s
2s)
АО (O-)
pz) py)
pz) py)
2p
МО (O2-)
px)
2p
2s
2s
2s)
97.
2Электронная конфигурация молекулярного иона O :
( 2s )2 ( *2s )2 ( 2 р )2( 2 р )2( 2 р )2 ( *2 р )0 ( *2 рz)1 ( *2 р )0
8 3
Порядок связи:
n
2,5
2
Электронная конфигурация молекулярного иона O 2:
( 2s)2 ( *2s )2 ( 2 р)2 ( 2 р )2 ( 2 р )2 ( *2 р )1 ( *2 р)z 2 ( *2 р)0
Порядок связи:
у
х
х
у
у
z
z
8 5
n
1,5
2
у
х
х
98.
Парамагнетизм кислорода99.
Энергетическая диаграмма молекулы COE
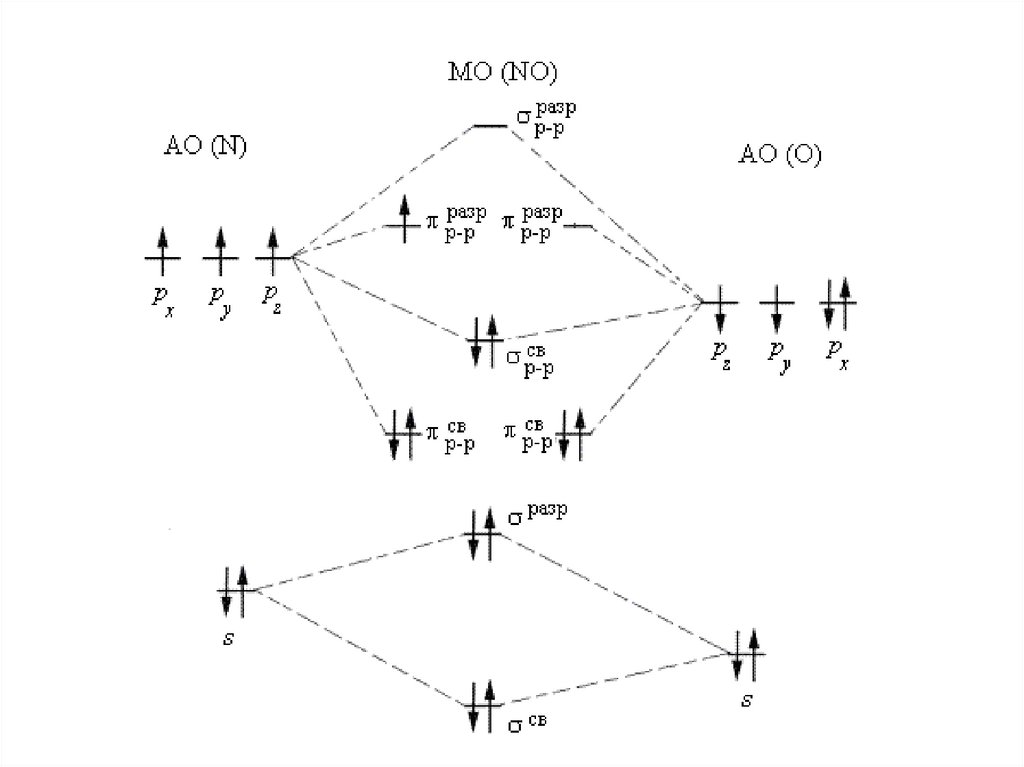
АО (C)
МО (CO) АО (O)
px)
pz) py)
px)
2p
2p
pz) py)
2s
2s
2s
2s)
100.
101.
102.
103.
104.
Типмолекулы
AX2E0
2
0
Тип
Пространственно Геометрия
молекулы
гибриди е расположение
зации электронных пар
sp
линейное
линейная
AX2E1
2
1
sp2
AX3E0
3
0
sp2
AX4E0
4
0
AX3E1
3
1
n
m
Примеры
правильный
треугольник
правильный
треугольник
угловая
BeГ2,CO2, N2O,
[Ag(NH3)2]+
SnCl2, SO2, O3,
плоскостная
BF3, SO3, С2Н4,
sp3
тетраэдр
тетраэдр
sp3
тетраэдр
треугольная
пирамида
NO 3 , CO 2
4
3
CH4, CГ4, SiO 4 ,
NOF3, SO2 , ClO ,
4
4
Ni(CO)4,
NH4+,
[Zn(CN)4]2–
NH3,
H3O+,
2
SOCl2, SO 3 , IO 3,
BrO 3
105.
AX2E22
2
sp3
тетраэдр
AX5E0
5
0
тригональная
бипирамида
AX4E1
4
1
sp3d,
dsp3
sp3d
AX3E2
3
2
sp3d
AX2E3
2
3
sp3d
AX6E0
6
0
sp3d2
тригональная
бипирамида
тригональная
бипирамида
тригональная
бипирамида
октаэдр
AX5E1
5
1
sp3d2
октаэдр
AX4E2
4
2
sp3d2
октаэдр
угловая
H2O, OF2,
SCl2
тригональная PCl5,
бипирамида Fe(CO)
5
качели
SF4
Т-образная
ClF3, BrF3
линейная
XeF2
октаэдр
SF6, PF6– ,
[AlF6]3–,
[SiF6]2[CoF6]3–
тетрагональна ICl5, IF5
я пирамида
XeF4
плоская
(квадрат)
106.
• Пример 1. Молекула BF3. Число валентныхэлектронов 3. Неподелённых электронных пар у
атома
бора
нет
(m = 0). Формула молекулы AX3E0.
n + m = 3.
Расположение электронных пар в пространстве –
правильныйй треугольник
107.
•Пример 2. Молекула SnCl2. Число валентныхэлектронов у атома олова = 4.
Число неподеленных электронных пар:
4 2 1
m= 2 =1
Формула молекулы AX2E1. Общее число электронных
пар:
n + m = 3.
Расположение электронных пар в пространстве –
плоский треугольник. Молекула имеет угловое
строение.
108.
•Пример 3. Молекула XeF4. Число валентныхэлектронов у атома ксенона = 8. Число неподелённых
электронных пар:
8 4 1
m = 2 = 2.
Формула молекулы AX4E2. Общее число электронных
пар:
n + m = 6.
Расположение электронных пар в пространстве –
октаэдр. Строение молекулы – квадрат. У атома
ксенона остаются две неподелённые пары
электронов.
109.
Пример 4. Молекула SO2. Число валентных электронову атома серы = 6. Молекула содержит две -связи.
Число неподелённых электронных пар:
6 2 2
m= 2
= 1.
Формула молекулы AX2E1.
n + m = 3.
Расположение электронных пар в пространстве –
правильный треугольник. Молекула имеет угловое
строение, у атома серы остается одна неподелённая
пара электронов.
110.
Поскольку неподеленная электронная параобразует более размытое электронное облако,
чем общая (обобществленная, связывающая),
поэтому она занимает больший объем. Это
приводит к уменьшению валентных углов по
сравнению с тетраэдрическими 109°28′.
111.
• Орбитали центрального атома, участвующие вобразовании π-связей, не подвергаются
гибридизации. Например, в ацетилене С2Н2
реализуется sp-гибридизация орбиталей атома
углерода, в этилене С2Н4 – sp2-гибридизация















































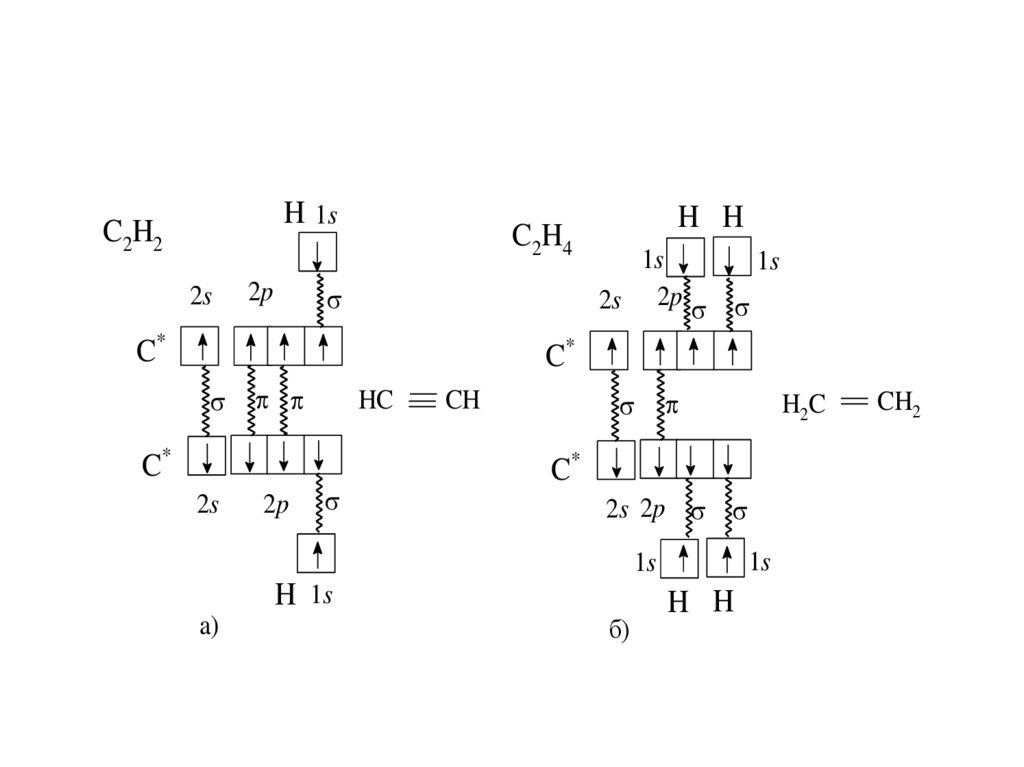















































 Химия
Химия








