Похожие презентации:
Химическая связь
1. Лекция 12
Химическаясвязь
2.
ПЛАН12.1 Химическая связь
и ее типы.
12.2 Ковалентная связь.
12.3 Водородная связь.
3.
12.1 Химическаясвязь – результат
взаимодействия двух или
более атомов, приводящий
к образованию устойчивой
многоатомной системы.
4.
Природа сил, действующихв многоатомных системах,
электрическая: притяжение
разноименно заряженных
частиц. Носителями
зарядов в веществе
являются ядра и электроны.
5.
По характерураспределения
заряженных частиц в
веществе различают
несколько типов
химической связи.
6.
Тип связи ПримерыКовалентная
Ионная
Металлическая
Н-Н
Н - Сl
+
Na Cl
Fe Fe
Al Al
Энергия
связи,
кДж/моль
200 - 800
40 - 400
7.
Силы межмолекулярноговзаимодействия
Водородная
связь
...Н О ... Н О ...
Н
Н
Ион – дипольное
взаимодействие
+
Na (H2O)n
4 - 40
Диполь –
дипольное
взаимодействие
SO2…SO2
0,4 - 4
Дисперсионные
силы
Не … Не
4 - 40
4 -40
8.
Энергия связи (Е,кДж/моль) – это
энергия, необходимая для
разрыва химической
связи в одном моль
вещества, находящегося в
газообразном состоянии.
9.
Чем большеэнергия связи,
тем прочнее
химическая
связь.
10.
Энергетический подход к описаниюхимической связи
Образование химической связи
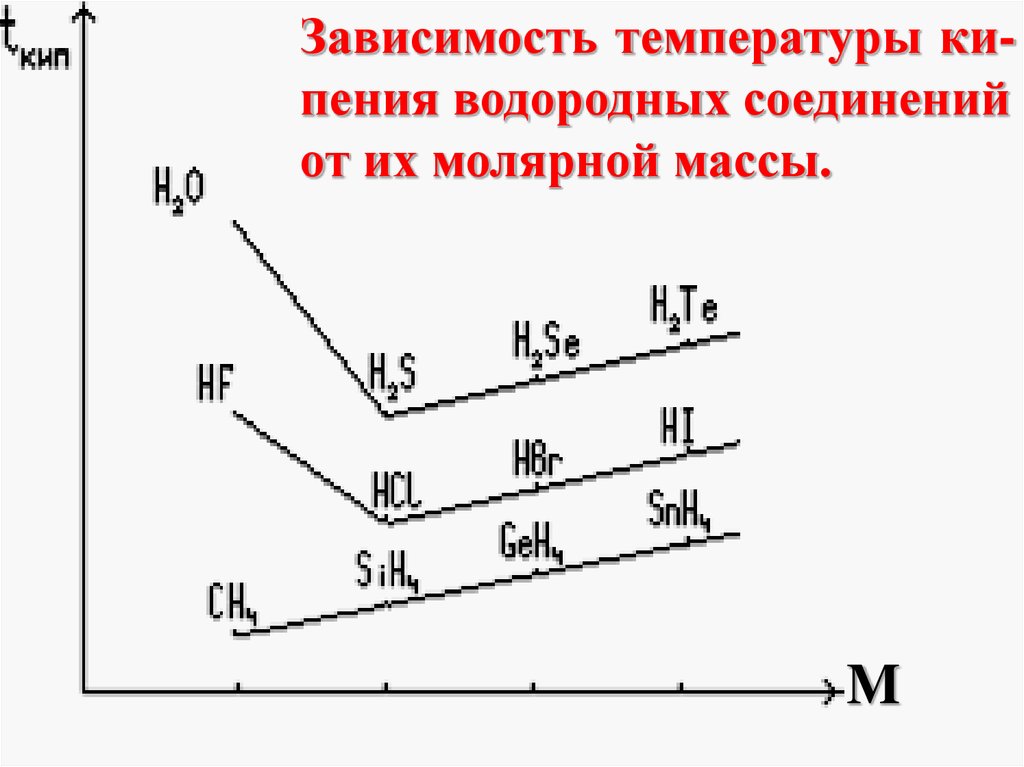
энергетически выгодно, так как
энергия связанной системы меньше,
чем суммарная энергия изолированных атомов:
А + В → АВ
Е(A) + Е(B) > Е(AB)
11.
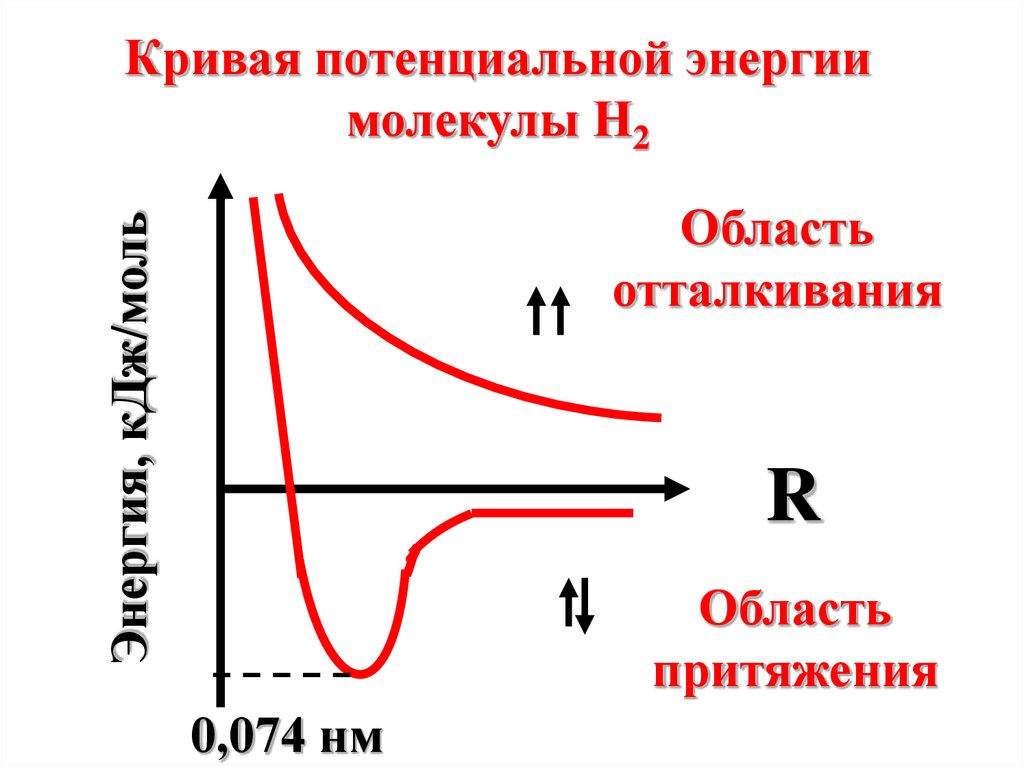
Кривая потенциальной энергиимолекулы Н2
Энергия, кДж/моль
Область
отталкивания
R
Область
притяжения
0,074 нм
12.
0,074 нм – это длинасвязи в молекуле
H2. Длина связи –
это расстояние
между атомами в
молекуле.
13.
12.2 Ковалентная связь(КС) – самый
распространенный тип
химической связи. В
органических соединениях
практически все связи
являются ковалентными.
14.
Существует дваквантово-механических
подхода к описанию
КС: метод валентных
связей (ВС) и метод
молекулярных
орбиталей (МО).
15.
12.2.1 Основныеположения метода ВС.
1. В образовании КС
участвуют только
валентные электроны.
Валентными называются
электроны, наиболее
удаленные от ядра.
16.
Валентность атомаможно предсказать по
числу неспаренных
электронов в его
стационарном и
возбужденных
состояниях.
17.
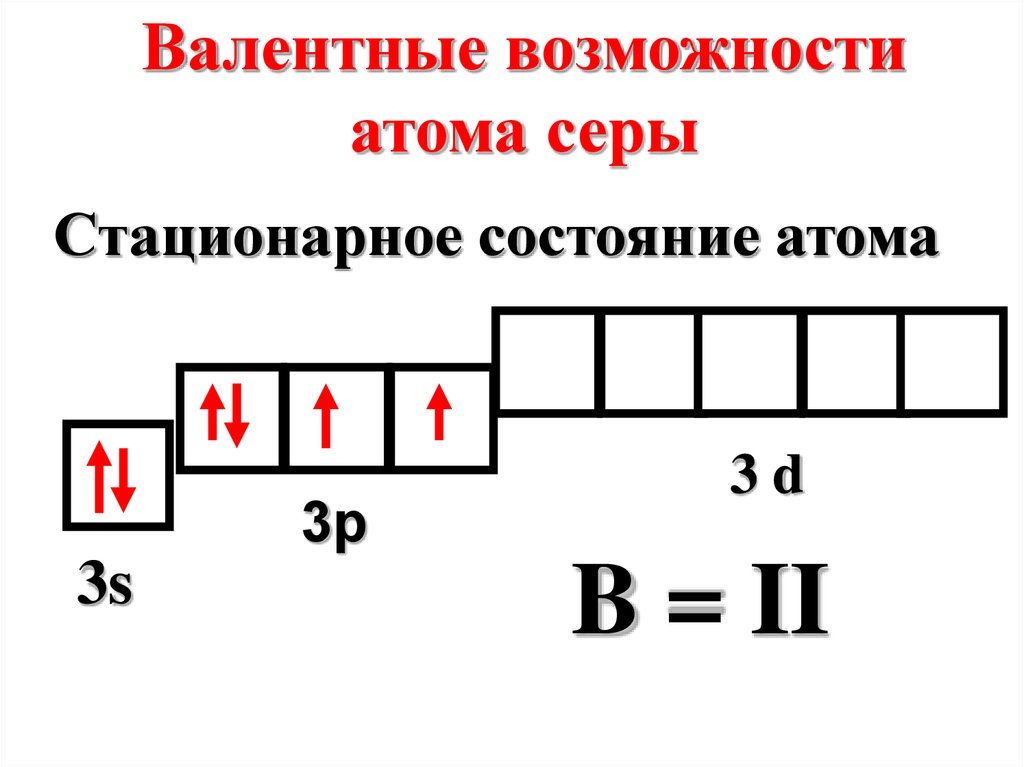
Валентные возможностиатома серы
Стационарное состояние атома
3p
3s
3d
B = II
18.
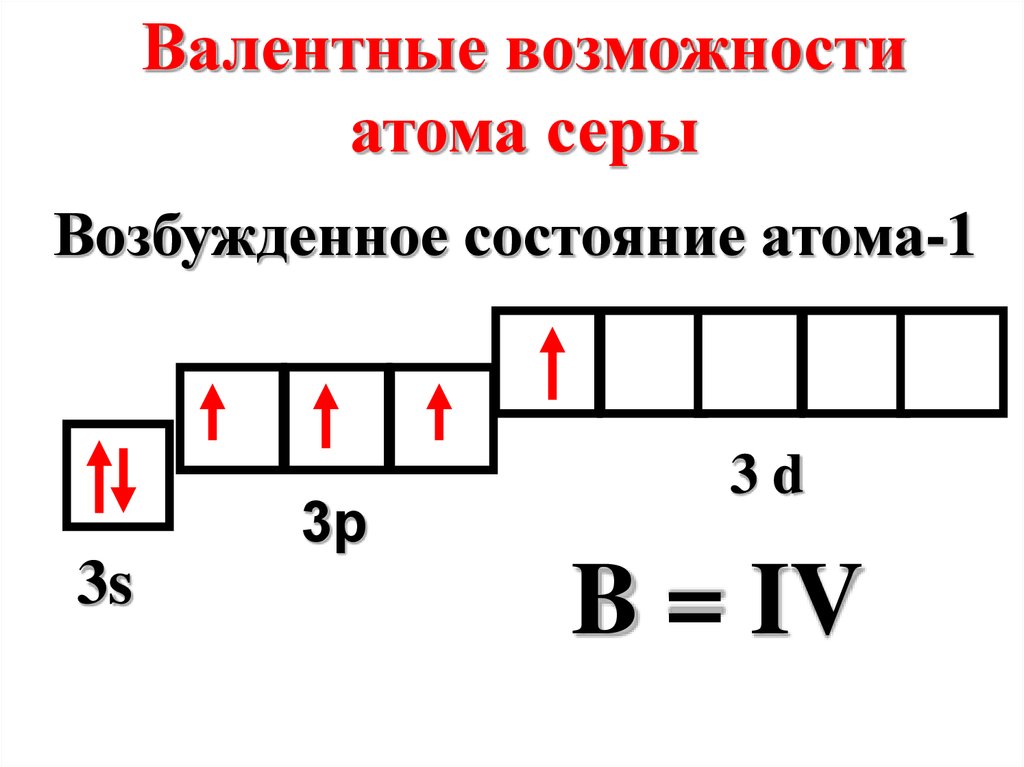
Валентные возможностиатома серы
Возбужденное состояние атома-1
3p
3s
3d
B = IV
19.
Валентные возможностиатома серы
Возбужденное состояние атома-2
3p
3s
3d
B = VI
20.
2. Единичную КСобразуют 2 электрона с
антипараллельными
спинами,
принадлежащими двум
атомам (общая
электронная пара).
21.
Ковалентная связь– это химическая
связь, образованная
при помощи общих
электронных пар,
принадлежащих двум
или более атомам.
22.
Механизмобразования КС
Обменный
Донорноакцепторный
23.
Обменный механизм –обобществление
неспаренных электронов
взаимодействующих атомов
H
H
H
H
24.
Донорно-акцепторныймеханизм –
атом-донор отдает
неподеленную
электронную пару на
вакантную орбиталь
атома-акцептора
25.
●+
H
NH3 +
H
H N H
H
+
26.
Кратность связи (n)равна числу общих
электронных пар:
Н–Н
O=O
N≡N
n = 1 Увеличение
n=2
прочносn = 3 ти связи
27.
3. С точки зрения волновыхпредставлений,
образованию общей
электронной пары
соответствует
перекрывание АО
взаимодействующих атомов.
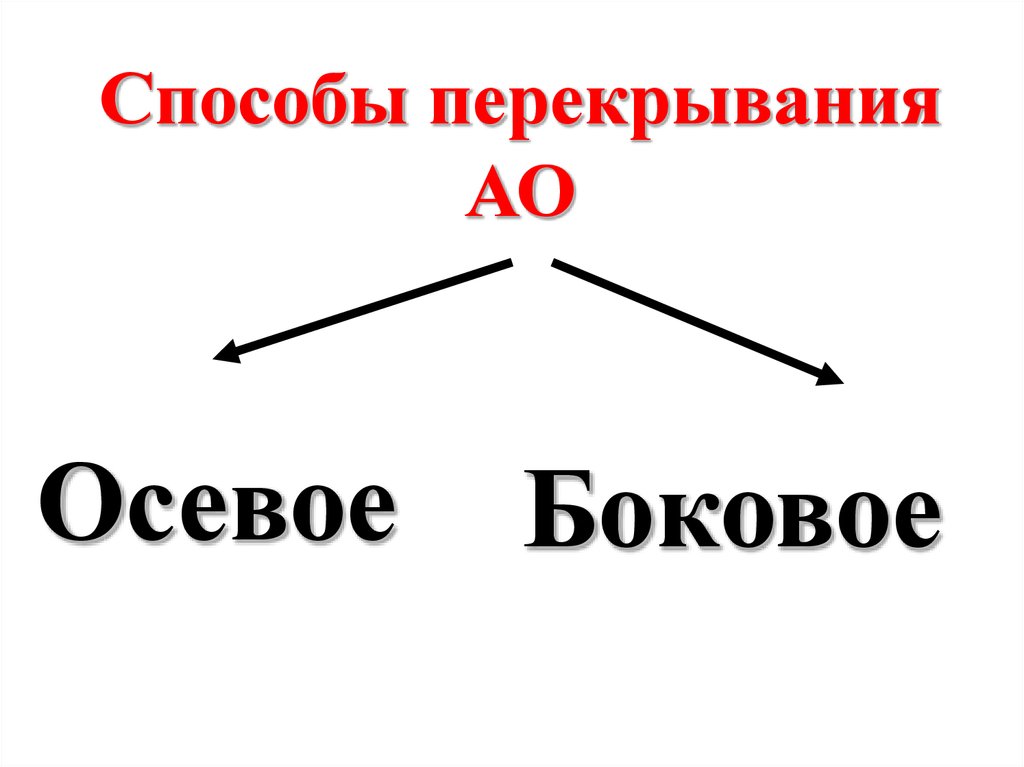
28.
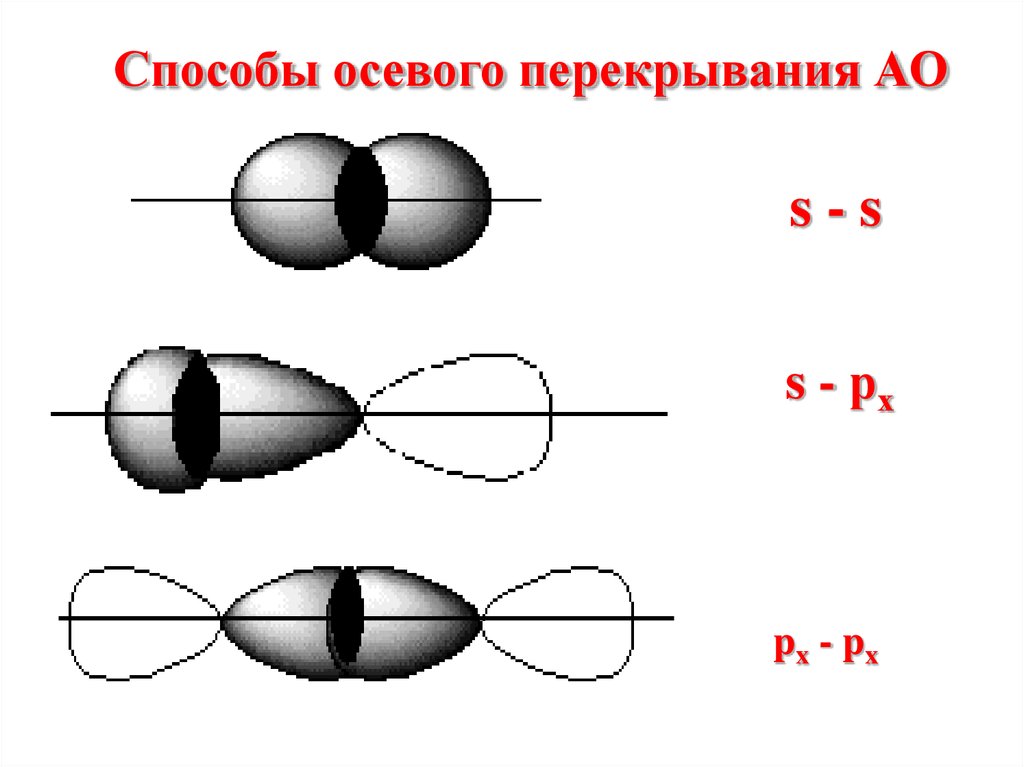
Способы перекрыванияАО
Осевое
Боковое
29.
Ось молекулы –это условная
линия,
соединяющая ядра
атомов в молекуле
30.
Способы осевого перекрывания АОs-s
s - рх
px - px
31.
При осевомперекрывании орбиталей
образуется
разновидность
ковалентной связи,
называемая σ- связью.
32.
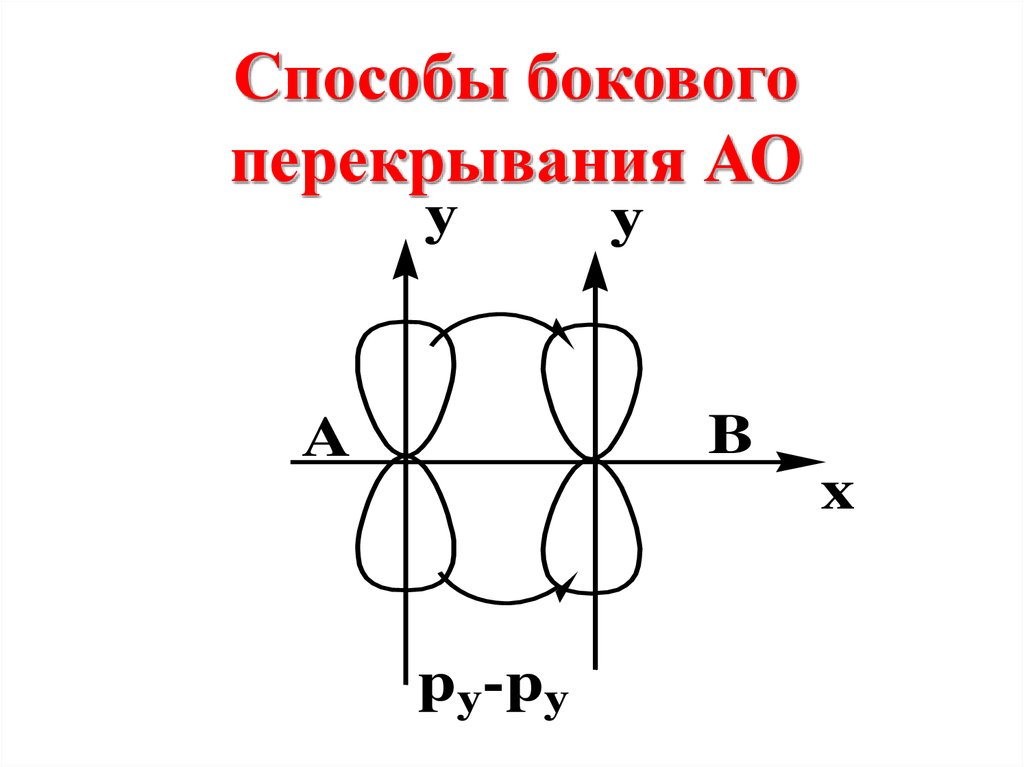
Способы боковогоперекрывания АО
y
y
B
A
x
py-py
33.
При боковомперекрывании
орбиталей образуется
разновидность
ковалентной связи,
называемая
π- связью
34.
Чем сильнееперекрываются
орбитали, тем прочнее
КС. Вот почему
σ-связи прочнее πсвязей.
35.
4. Если в молекулетри и более атомов,
то орбитали ее
центрального атома,
как правило,
гибридизованы.
36.
Гибридизация –выравнивание
орбиталей атома по
форме и энергии в
процессе
образования КС.
37.
yГибридная AO
x
z
38.
Гибридизацияэнергетическивыгодный процесс,
обеспечивающий
максимальное
перекрывание АО.
39.
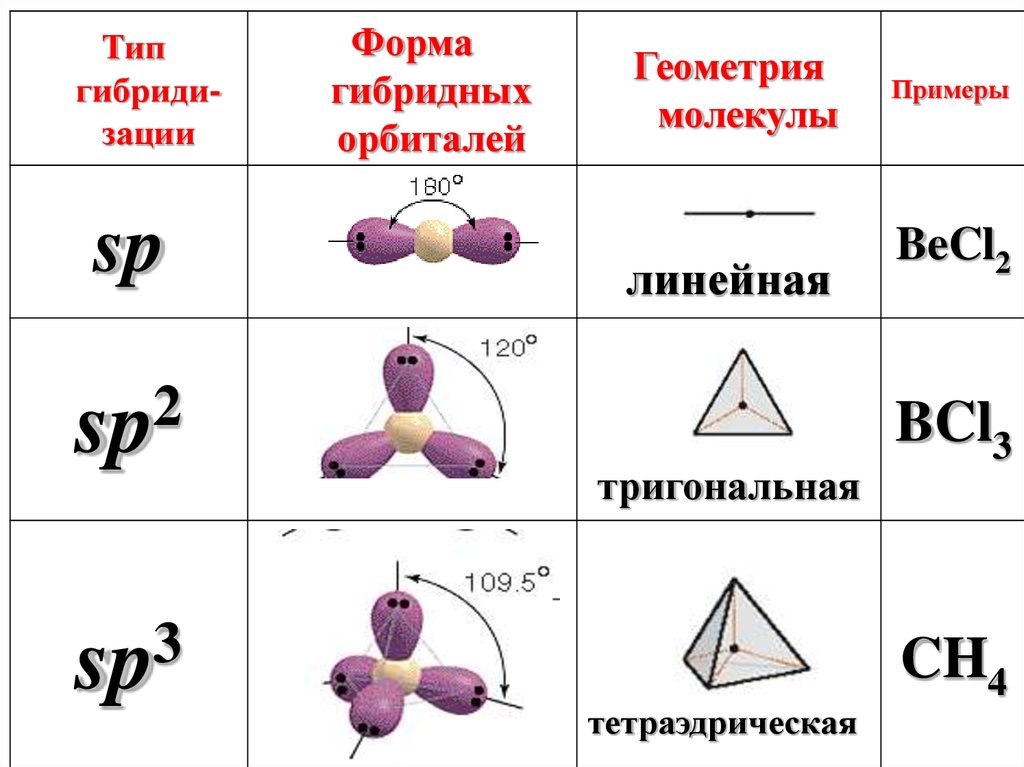
Типгибридизации
sp
2
sp
3
sp
Форма
гибридных
орбиталей
Геометрия
молекулы
линейная
тригональная
тетраэдрическая
Примеры
BeCl2
BCl3
CH4
40.
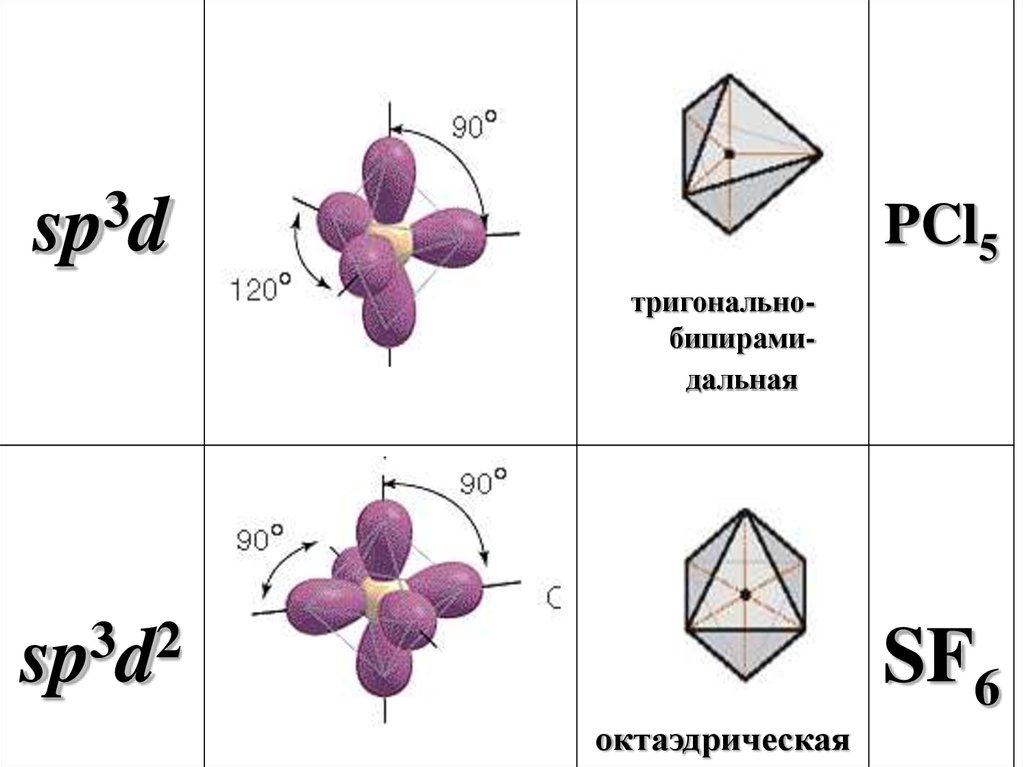
3sp d
PCl5
тригональнобипирамидальная
3
2
sp d
SF6
октаэдрическая
41.
5.Ковалентнаясвязь
Неполяр- Полярная
ная
42.
Неполярные КСсвязывают атомы
одного химического
элемента:
Н-Н, О=О, N ≡ N.
43.
Полярные КСсвязывают атомы
разных химических
элементов:
H-Cl, H-O-H, C≡O.
44.
Полярность связиобусловлена смещением
общей электронной
пары в сторону более
электроотрицательного
атома.
45.
Полярная молекула –это диполь,
характеризующийся
величиной
дипольного
момента(μ).
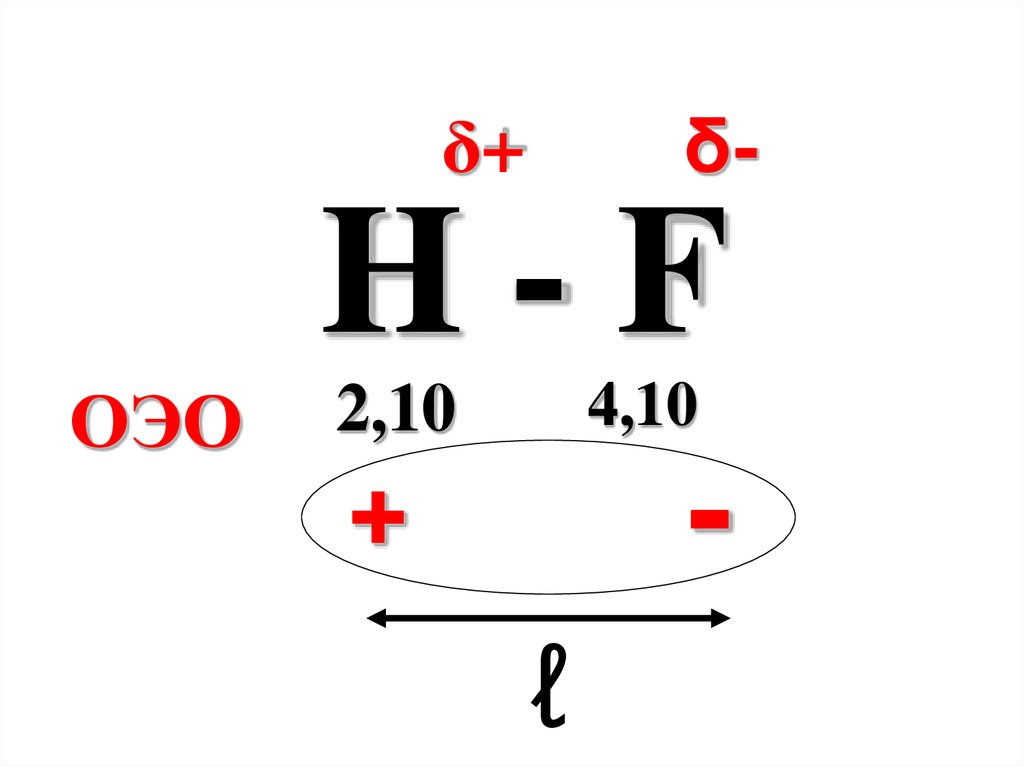
46.
μ = ℓq,ℓ – расстояние между
центрами тяжести
положительного и
отрицательного зарядов в
молекуле,
q – эффективный заряд.
47.
δ-δ+
H-F
ОЭО
4,10
2,10
-
+
ℓ
48.
Молекулаμ, Д
HF
5,82
CO
HCl
Эффектив
ный
заряд
0,77
0,11 ± 0,02
1,08 ± 0,18
±
49.
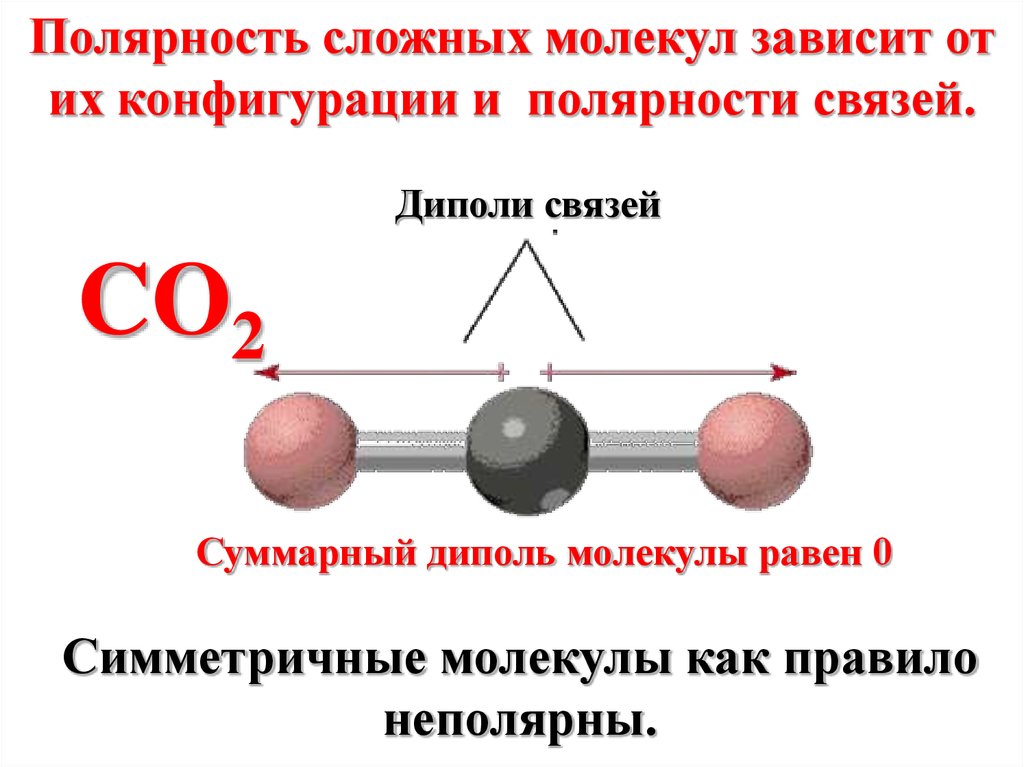
Полярность сложных молекул зависит отих конфигурации и полярности связей.
Диполи связей
CO2
Суммарный диполь молекулы равен 0
Симметричные молекулы как правило
неполярны.
50.
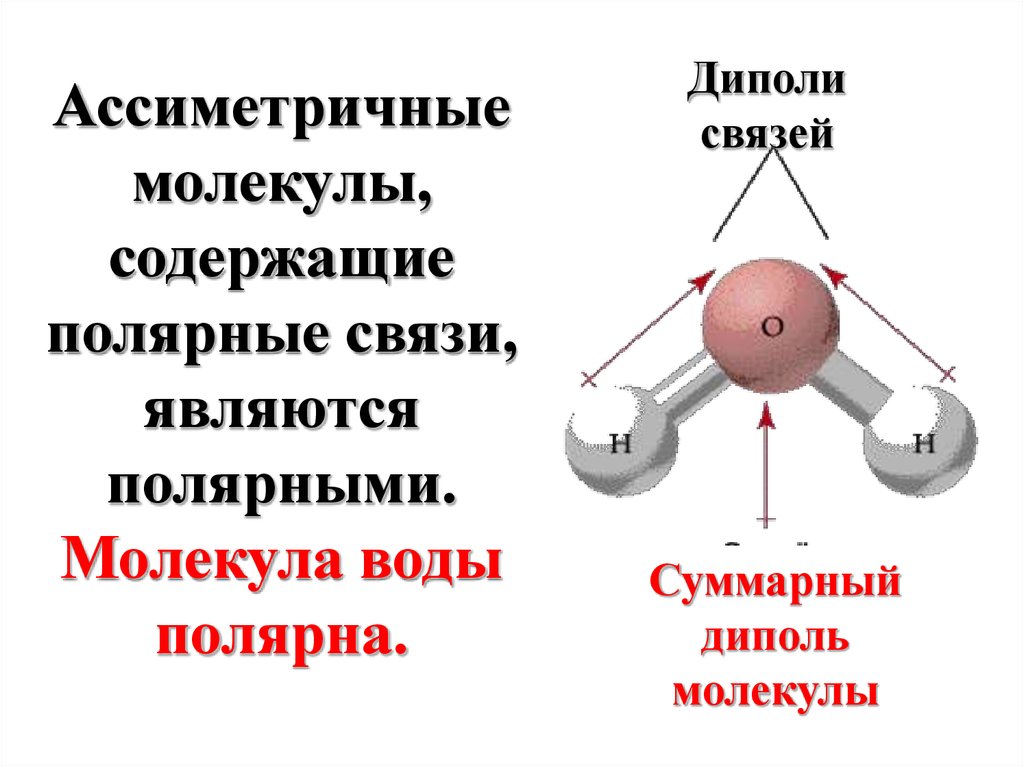
Ассиметричныемолекулы,
содержащие
полярные связи,
являются
полярными.
Молекула воды
полярна.
Диполи
связей
Суммарный
диполь
молекулы
51.
12.2.2 Основные положенияметода MO.
1.В образовании КС
участвуют все
электроны в атоме.
52.
2. Электроны вмолекулах занимают
молекулярные орбитали
(MO), подобно тому, как
в атомах они занимают
атомные орбитали (AO).
53.
3. МО заполняютсяэлектронами в
соответствии с
принципом
минимальной энергии,
принципом Паули и
правилом Гунда.
54.
МО есть результатсложения или
вычитания волновых
функций АО
взаимодействующих
атомов.
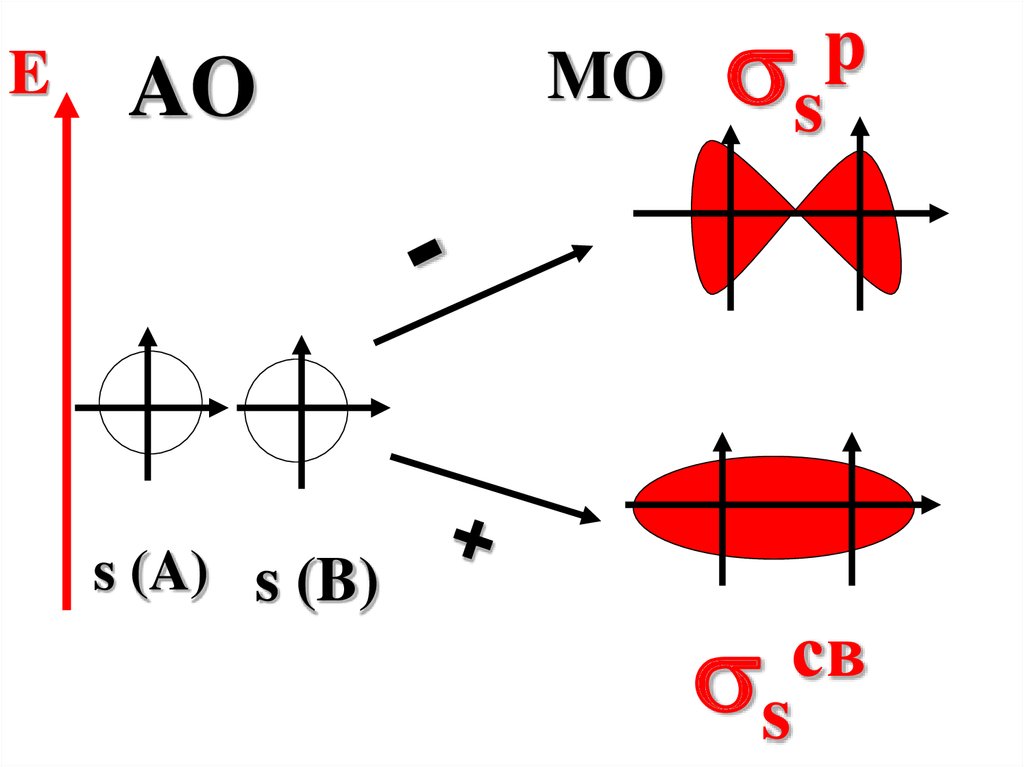
55.
При сложении АОобразуется
связывающая МО,
энергия которой меньше
энергии исходных
атомных орбиталей.
56.
При вычитании АОобразуется
разрыхляющая МО,
энергия которой больше
энергии исходных
атомных орбиталей.
57.
EAO
s (A) s (B)
MO
s
s
p
св
58.
Кратность связиN
–
N'
n=
2
59.
N – число электроновна связывающих
орбиталях,
N' – число электронов
на разрыхляющих
орбиталях.
60.
Молекула необразуется,
если n = 0
61.
Метод МОпозволяет
определить
магнитные
свойства молекул.
62.
Парамагнитныемолекулы,
генерирующие
электромагнитное поле,
содержат неспаренные
электроны на МО.
63.
Диамагнитные молекулы,не генерирующие
собственное
электромагнитное поле,
не содержат неспаренных
электронов на МО.
64.
Для описаниямолекул
используются
энергетические
диаграммы.
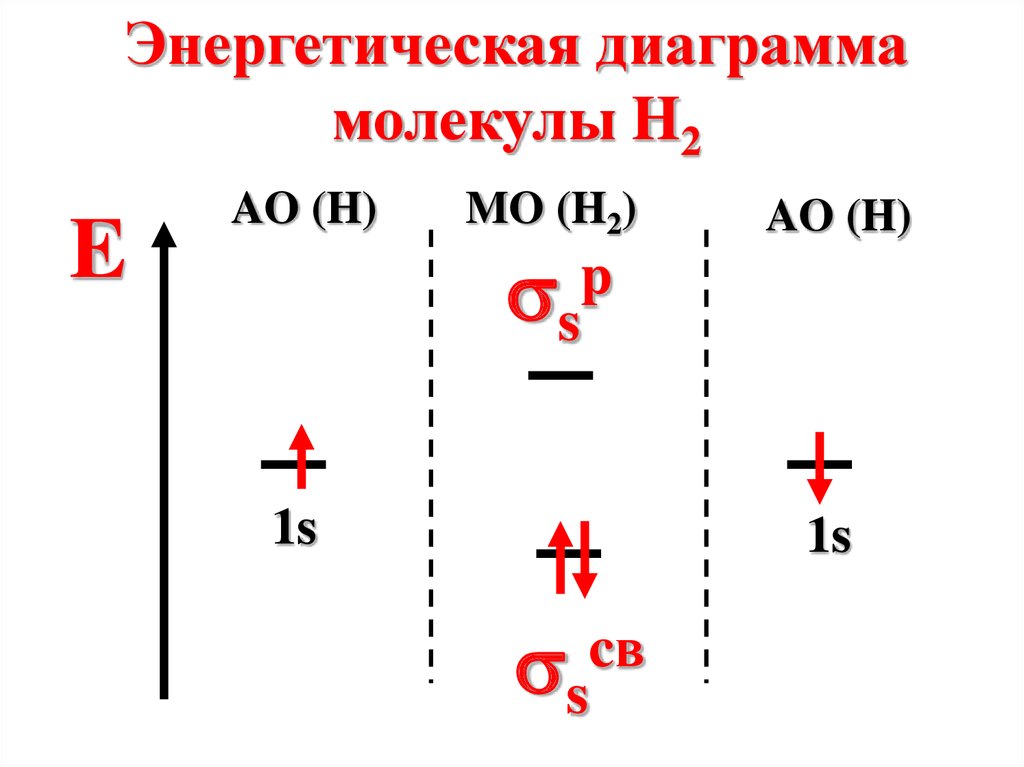
65.
Энергетическая диаграммамолекулы H2
E
AO (H)
MO (H2)
s
AO (H)
p
1s
1s
s
cв
66.
Молекула диамагнитна, таккак не содержит неспаренных
электронов на МО
n=
2-0
2
=1
67.
Энергетическая диаграмма+
+
катиона H2 (H+ H )
E
AO (H)
MO (H2)
s
AO (H+ )
p
1s
1s
s
cв
68.
Катион парамагнитен, таккак содержит неспаренный
электрон на МО
n=
1-0
2
= 1/2
69.
Энергетическая диаграммааниона H2 (H+ H )
E
AO (H)
MO (H2)
s
AO (H )
p
1s
1s
s
cв
70.
Анион парамагнитен, так каксодержит неспаренный
электрон на МО
n=
2-1
2
= 1/2
71.
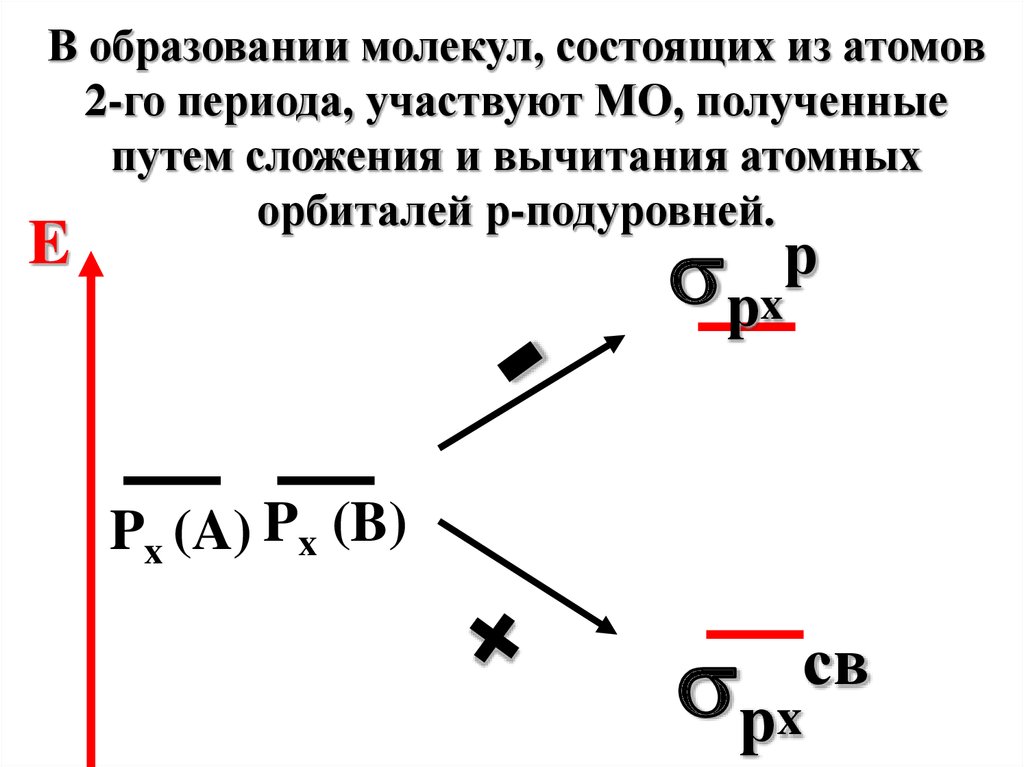
В образовании молекул, состоящих из атомов2-го периода, участвуют МО, полученные
путем сложения и вычитания атомных
орбиталей р-подуровней.
рx
E
р
Px (A) Px (B)
рx
св
72.
πрyE
р
Py (A) Py (B)
πрy
св
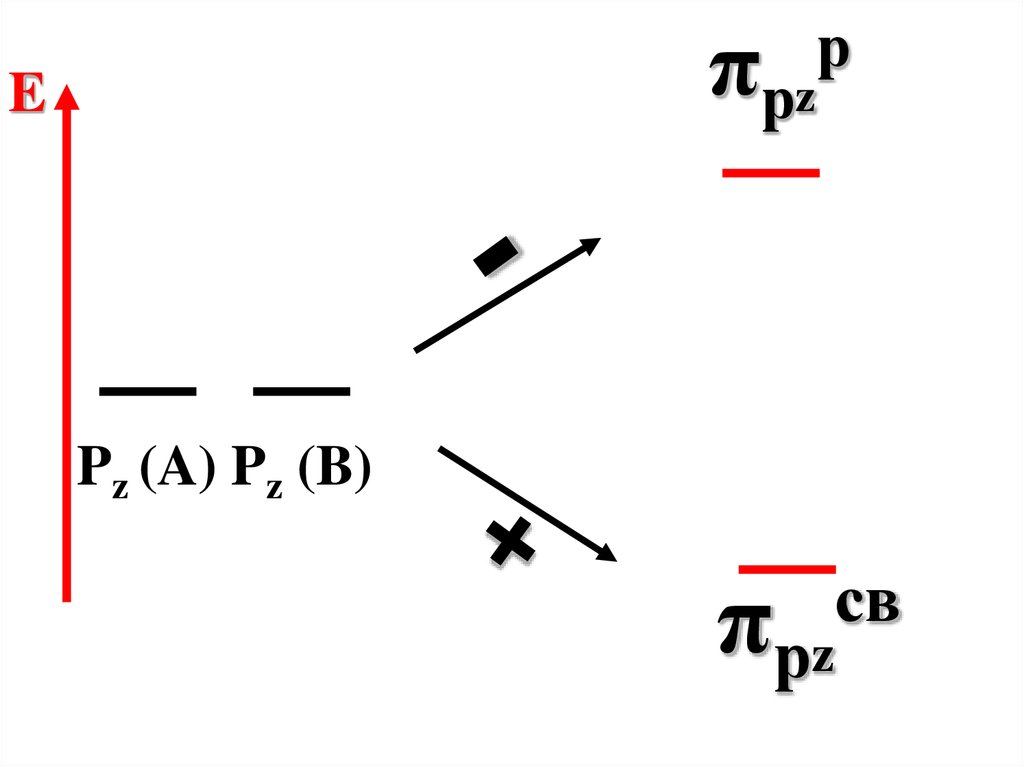
73.
πрzE
р
Pz (A) Pz (B)
св
πрz
74.
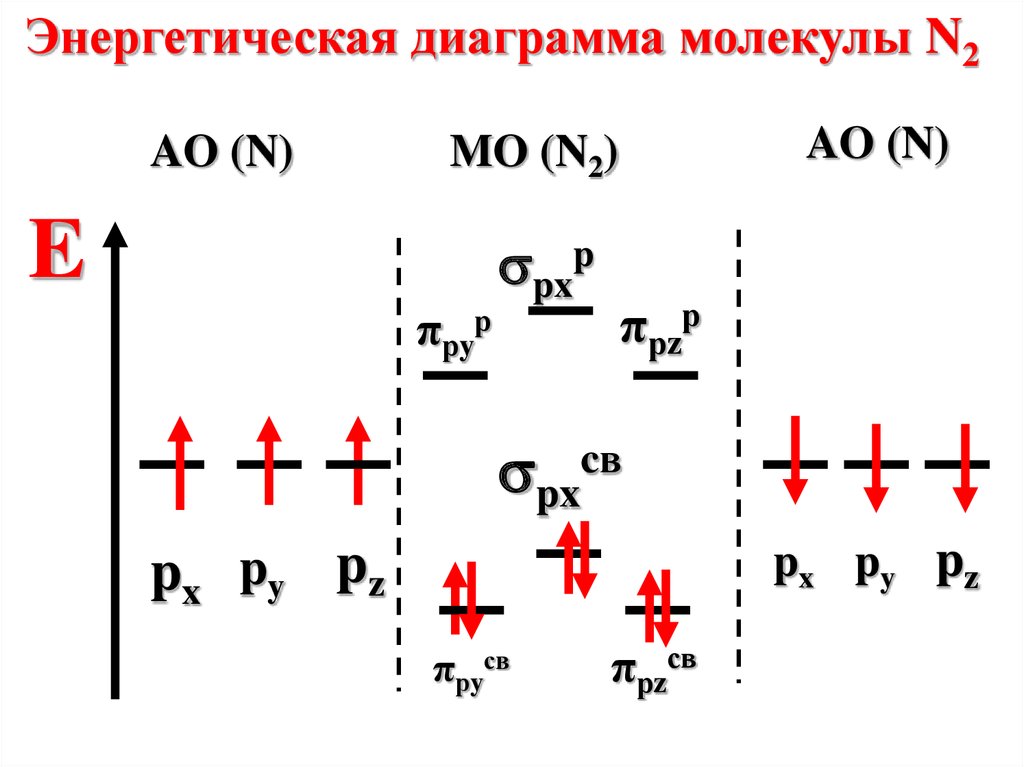
Энергетическая диаграмма молекулы N2AO (N)
AO (N)
MO (N2)
E
πрyр
pxp
πрzр
pxcв
px py pz
px py pz
πрyсв
πрzсв
75.
Молекула диамагнитна, таккак не содержит неспаренных
электронов на МО
n=
6-0
2
=3
76.
12.3 Водороднаясвязь - это особый
вид меж- и
внутримолекулярного
взаимодействия, который
описывается схемой:
R1A - H......ВR2 ,
где А и В – сильно
электроотрицательные атомы:
О, N, реже Сl и S.
F
77.
Механизм образованияводородной связи
состоит в том, что
поляризованный атом
водорода внедряется в
электронную оболочку
соседнего, ковалентно с
ним не связанного, атома.
78.
Ввиду низкойпрочности
водородной связи, ее
обозначают
пунктиром или
многоточием.
79.
Межмолекулярнаяводородная связь
приводит к ассоциации
молекул и существенно
влияет на физические
свойства веществ: tкип,
tпл, растворимость и др.
80.
Например, температуракипения родственных
соединений растет с
увеличением их молярной
массы. Однако эта зависимость
может нарушаться. Соединения
с водородной связью имеют
аномально высокие
температуры кипения.
81.
Зависимость температуры кипения водородных соединенийот их молярной массы.
M
82.
ПРИМЕРЫ СОЕДИНЕНИЙ СМЕЖМОЛЕКУЛЯРНОЙ ВОДОРОДНОЙ
СВЯЗЬЮ
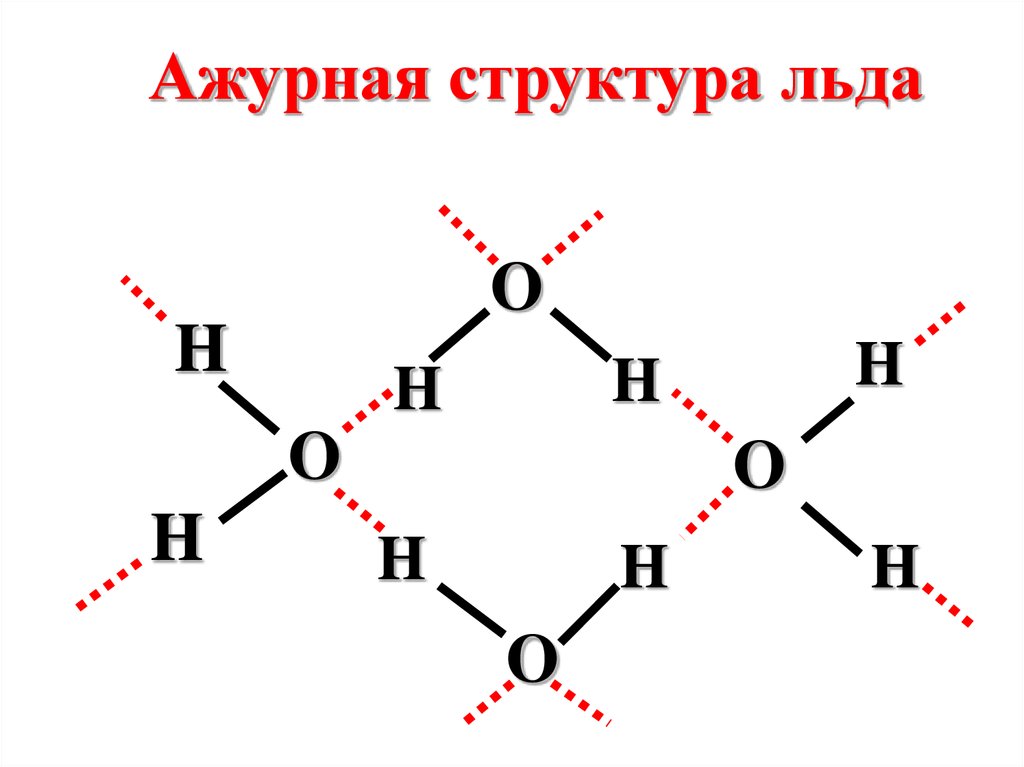
1) Вода
Во льду молекула Н2О
образует четыре водородные
связи, что формирует его
трехмерную ажурную
структуру.
83.
Ажурная структура льдаO
H
H
O
H
H
H
O
H
H
O
H
84.
При плавлении льда частьводородных связей
о
разрывается (при 20 С их
сохраняется 46%) и молекулы
воды заполняют пустоты в
структуре льда. С этим
связана аномалия плотности
воды.
85.
Плотность льдаменьше плотности
жидкой воды(0,92 и
1,0 г/мл).
Вследствие этого в зимнее время
лед закрывает поверхность
водоемов и, выполняя роль
теплоизолятора, сохраняет в них
жизнь.
86.
Ассоциацию молекул воды вжидкой фазе можно
представить схемой:
...Н О ...Н О ... Н О ...
Н
Н
Н
87.
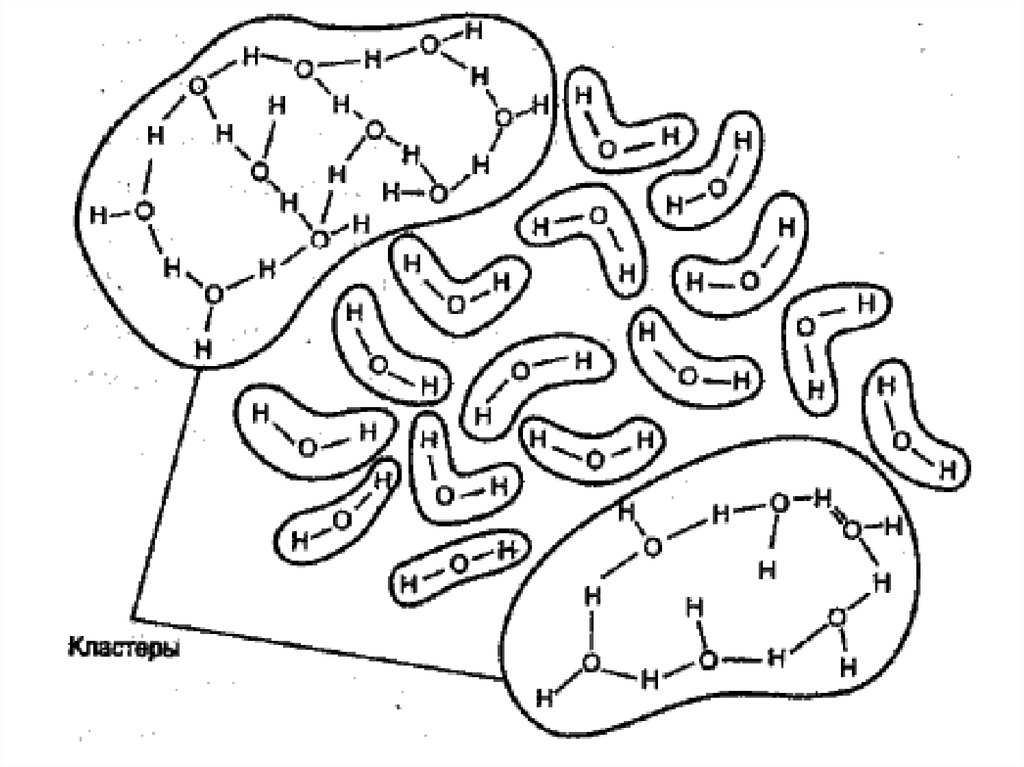
Жидкая вода содержит какассоциаты (кластеры), так
и молекулы, не связанные
водородными связями.
Кластеры называют
мерцающими, т.к. среднее
время их жизни
-10
составляет 10 с.
88.
89.
2) Фтороводородная кислота.....Н F ..... Н F ..... Н F .....
3) Спирты (R OH)
..... Н О .....Н О ..... Н О .....
R
R
R
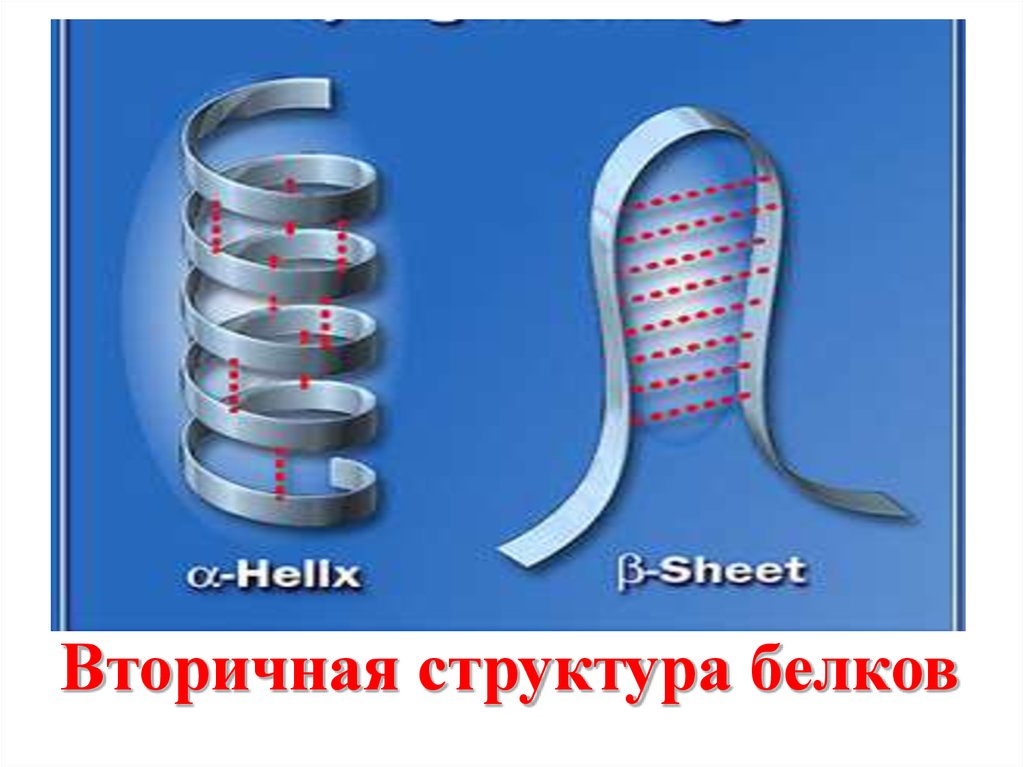
90.
Значениевнутримолекулярных
водородных связей
заключается в том, что они
участвуют в формировании
пространственных структур
биополимеров (белков,
нуклеиновых кислот,
полисахаридов).
91.
92.
Вторичная структура белков93.
Благодаримза
внимание!!!









































































 Химия
Химия








