Похожие презентации:
Организационные вопросы
1.
2.
Организационные вопросыОсновная литература
Лебедев, Ю. А. Химия : Учебник Для СПО . – 2-е изд, пер. и доп . –
Электрон. дан. – Москва : Издательство Юрайт, 2019 . – 431 . –
(Профессиональное образование) . – Режим доступа : https://www.biblioonline.ru/bcode/436520 , https://www.biblioonline.ru/book/cover/3A2CF912-6E21-43D6-8900-DC5C13C3C370 . – Internet
access . - Режим доступа: https://www.biblio-online.ru . – На рус. яз. - ISBN
978-5-9916-7723-3 : 1009.00 .
Мартынова, Татьяна Викторовна. Химия : Учебник и практикум для СПО /
Т. В. Мартынова, И. В. Артамонова, Е. Б. Годунов ; Под общ. ред. Т. В.
Мартыновой . – 2. изд., испр. и доп . – Электрон. дан. – Москва :
Издательство Юрайт, 2019 . – 368 с. – (Профессиональное образование) . –
Режим доступа : https://www.biblio-online.ru/bcode/439067 ,
https://www.biblio-online.ru/book/cover/0DC98D86-0B6A-4B5E-A82522CB82664364 . – Internet access . - Режим доступа: https://www.biblioonline.ru . – На рус. яз. - ISBN 978-5-534-11018-0 : 869.00 .
3.
Дополнительная литератураДр. издания
Учебное пособие в Инфоде
Лекции (размещены в Инфоде)
4.
Отчетность и баллыИзучение дисциплины
заканчивается
дифференцированным зачетом
Учимся, используя бальнорейтинговую систему
5.
Введение. История развития химии…………………….7Основные понятия химии…………………………………. 3
Состав веществ. Изменение веществ………………… 8
Основные законы химии......................................... 24
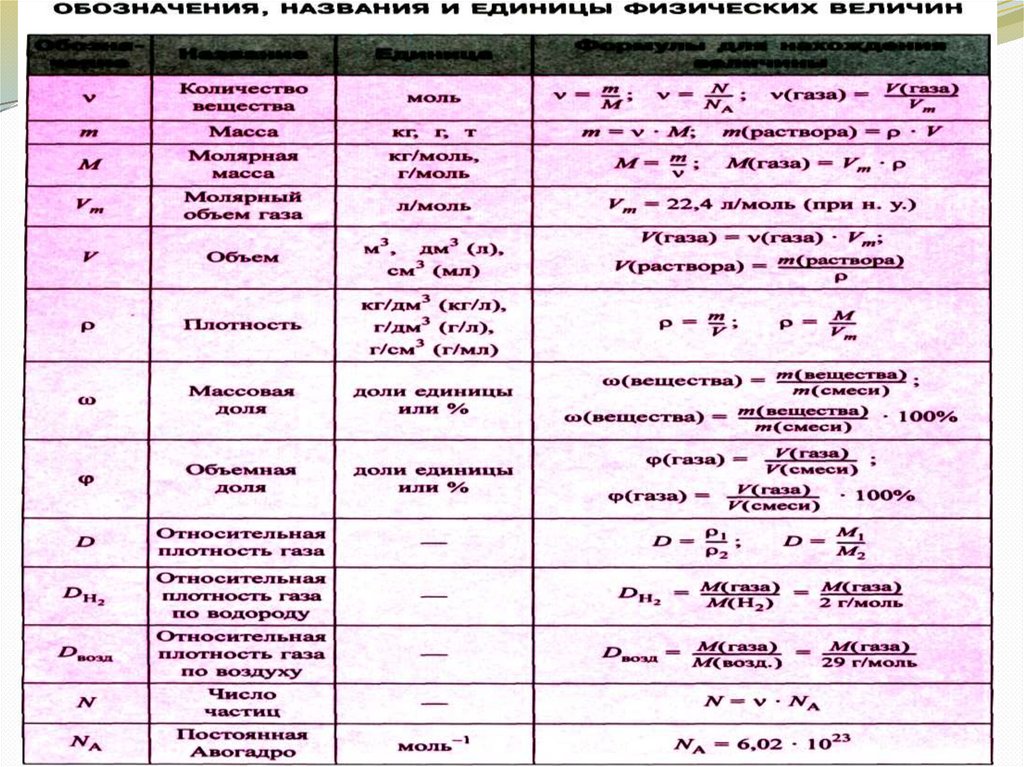
Обозначения, названия и единицы физической
величины…………………………………………………………….. 34
Задания...................................................................... 35
6.
«Широко распростирает химия рукисвои в дела человеческие. Куда не
посмотрим, куда ни оглянемся – везде
обращаются перед очами нашими
успехи ее применения»
М.В. Ломоносов
7.
а) Хеми (египетск.) – “черная” земля. Древнееназвание Египта, где зародилась наука химия.
б) Кеме (египетск.) – “черная” наука. Алхимия
как темная, дьявольская наука (сравнить с
чернокнижием – колдовством, основанным на
действии нечистой силы).
в) Хюма (древнегреч.) – “литье” металлов; того
же корня и греческое хюмос – “сок”.
г) Ким (древнекитайск.) – “золото”. Тогда химию
можно толковать как “златоделие”
8.
История развития химическойнауки. Химия в древности
Химия, как одна из
наук, изучающих
явления природы,
зародилась в Древнем
Египте еще до нашей
эры, одной из самых
развитых стран в те
времена
9.
Этапы развития химии1. Древний…
2. Алхимический…
Дописать самостоятельно
10.
Роберт БОЙЛЬ – отец химии(25.I.1627 - 30.XII.1691)
11.
Антуан-Лоран ЛАВУАЗЬЕ(26.VIII.1743 - 8.V.1794)
Французский химик АнтуанЛоран Лавуазье (1743-1794),
стал одним из
основоположников
классической химии
12.
ЛОМОНОСОВ Михаил Васильевич(19.XI.1711 - 15.IV.1765)
Основатель учения об
атомно-молекулярном
строении вещества
Открыл закон
сохранения массы
вещества.
Изучал жидкое,
газообразное и твердое
состояния тел
Разработал технологию
и рецептуру цветных
стекол
13.
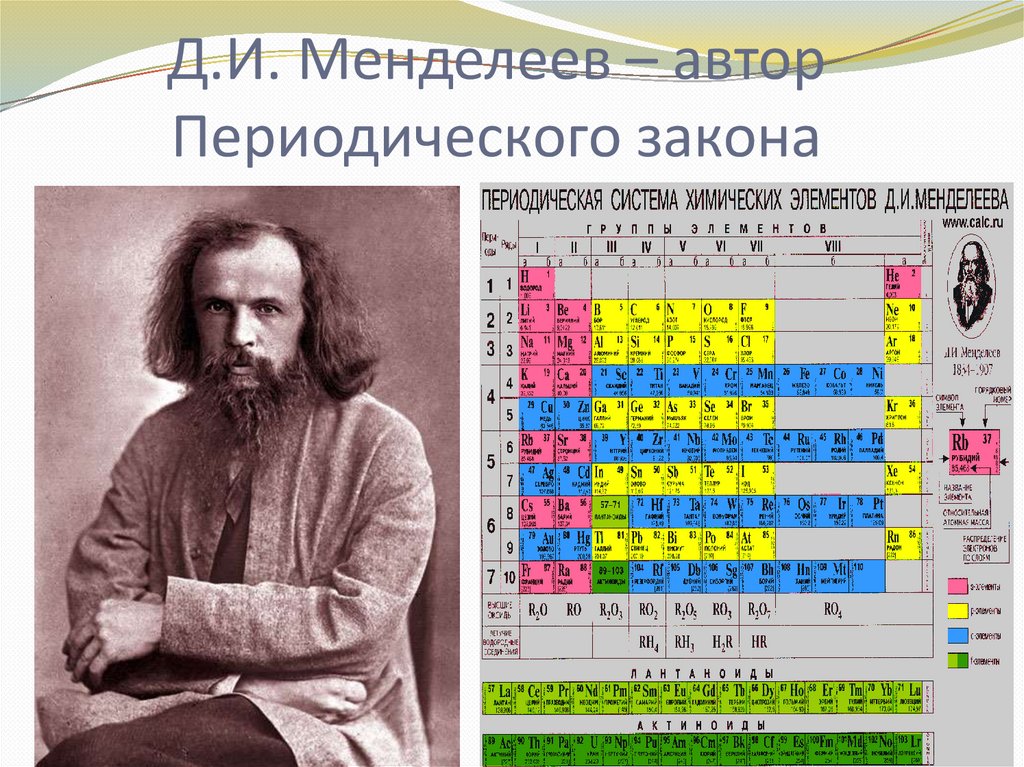
Д.И. Менделеев – авторПериодического закона
14.
15.
Вещества – это то, из чего состояттела
16.
17.
18.
Химия – индустрия чудесных превращений19.
20.
Вещество – один из видов материи, которыйхарактеризуется массой покоя. Это совокупность
атомов, ионов или молекул, состоящих из одного или
нескольких химических элементов
Вещество
Вода
Молекулы
Н2О
Атомы
2 атома
водорода
«Н» и 1 атом
кислорода
«О»
21.
Атом – это электронейтральная частица,состоящего из положительно заряженного ядра и
отрицательно заряженных электронов. Атом –
наименьшая частичка химического элемента, предел
химической делимости материи.
22.
Молекула – это отдельная электронейтральнаячастица, образующаяся при возникновении
ковалентных связей между атомами одного или
нескольких элементов, которая определяет
химические свойства вещества.
23.
Химический элемент – это совокупность атомовс одинаковым зарядом ядра.
Вещества, образованные одним химическим
элементом, называют простыми. Один и тот же
химический элемент может образовывать несколько
простых
веществ.
Это
явление
называют
аллотропией, а различные простые вещества,
образованные одним элементом, - аллотропными
видоизменениями,
или
аллотропными
модификациями.
24.
25.
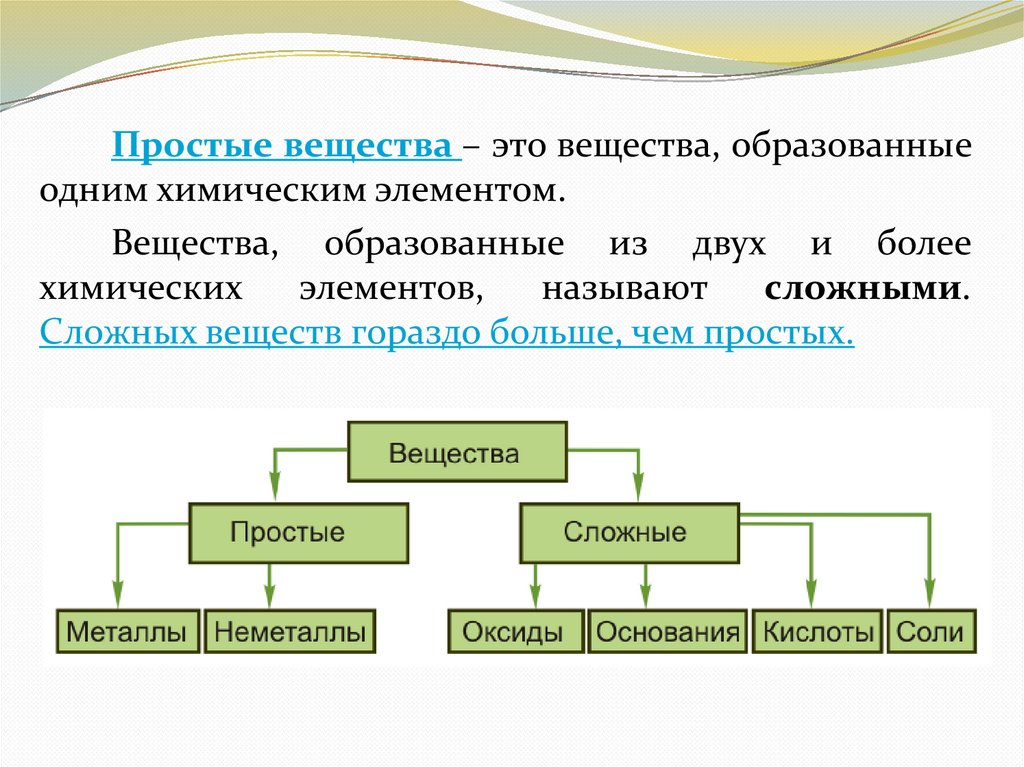
Простые вещества – это вещества, образованныеодним химическим элементом.
Вещества, образованные из двух и более
химических
элементов,
называют
сложными.
Сложных веществ гораздо больше, чем простых.
26.
Различают в качественный и количественныйсостав веществ.
Качественный состав – это совокупность
химических элементов и (или) атомных группировок,
составляющих данное химическое вещество.
Количественный состав – это показатели,
характеризующие количество или число атомов того
или иного химического элемента и (или) атомных
группировок, образующих данное химическое
вещество.
27.
Состав веществ отображают посредствомхимической символики.
По предложению Й. Я. Берцелиуса элементы
принято обозначать первой или первой и одной из
последующих букв латинских названий элементов.
28.
Химическийзнак
(символ)
–
несет
значительную информацию. Он обозначает название
элемента, один его атом, один моль атомов этого
элемента. По символу химического элемента можно
определить его атомный номер и относительную
атомную массу.
29.
Химическая формула – это способ отображенияхимического состава вещества. Она обозначает
название вещества, одну молекулу его, один моль
этого вещества. По химической формуле можно
определить качественный состав вещества, число
атомов и количество вещества каждого элемента в
одном моле вещества, его относительную
молекулярную и молярную массу.
Н
Н2О
Р2О5 Н3РО4 СН3СООН КОН О2
30.
Формулы вещества составляют на основании ещеодного важнейшего понятия в химии – валентности.
Валентность – это способность атомов одного
химического элемента соединятся со строго
определенным числом атомов другого химического
элемента.
31.
Широкоиспользуются
несколько
видов
химических формул:
1. Простейшая (эмпирическая) формула показывает
качественный состав и соотношения, в которых
находятся частицы, образующие данное вещество.
2. Молекулярная (истинная) формула показывает
качественный состав и число составляющих
вещество частиц, но не показывает порядок связей
частиц в веществе, т. е. его структуру.
3. Графическая формула отражает порядок соединения
атомов, т. е. связи между ними.
Посмотреть видеоролик получения
формулы по названию
32.
AОтносительная
атомная
масса
( r)
химического
элемента
–
это
величина,
показывающая отношение средней массы атома
природной изотопной смеси элемента к 1/12 массы
атома углерода12С :
Единая углеродная атомная единица массы (а. е.
м.) равна:
1 а. е. м. = 1
12
m( C ) 1,66057 *10
12
27
кг.
33.
Относительная атомная масса – одна изосновных характеристик химического элемента.
Относительная молекулярная масса (M r ) равна
сумме относительных атомных масс всех атомов,
образующих молекулу вещества.
34.
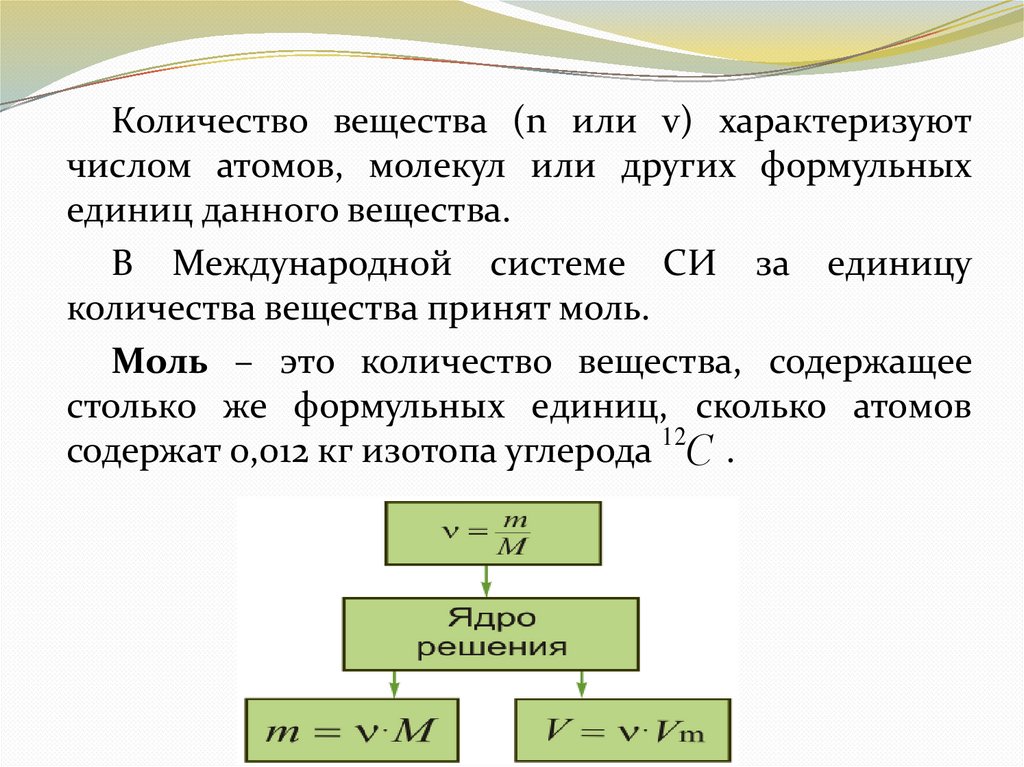
Количество вещества (n или v) характеризуютчислом атомов, молекул или других формульных
единиц данного вещества.
В Международной системе СИ за единицу
количества вещества принят моль.
Моль – это количество вещества, содержащее
столько же формульных единиц, сколько атомов
содержат 0,012 кг изотопа углерода 12С .
35.
36.
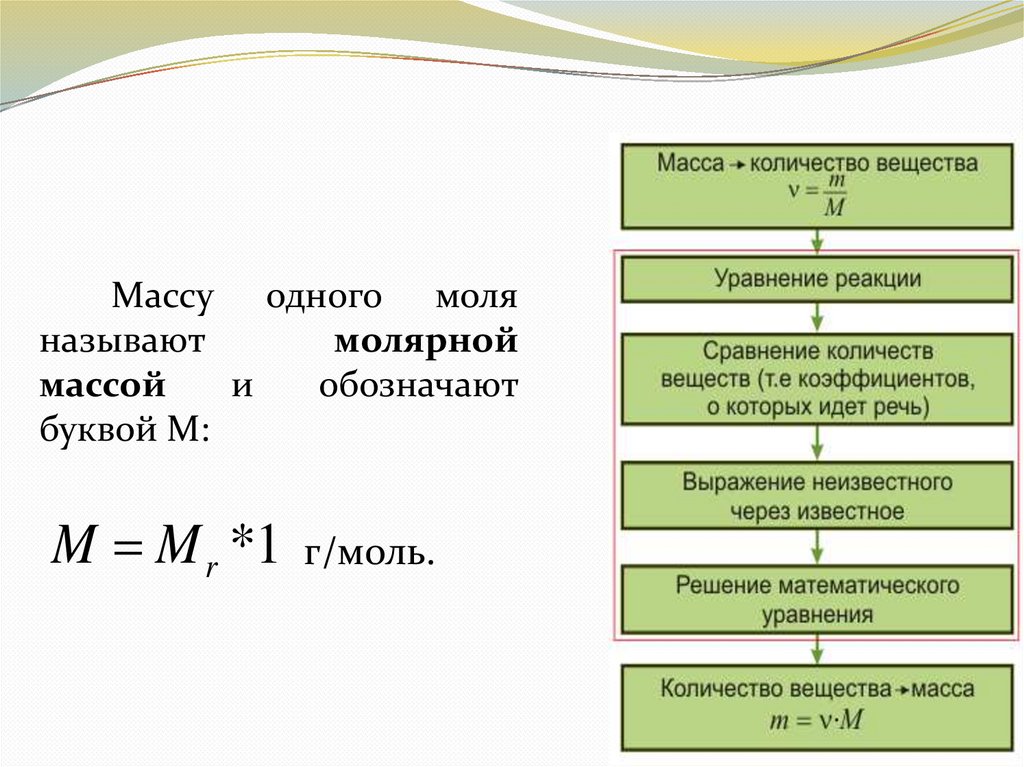
Массу одного моляназывают
молярной
массой
и
обозначают
буквой М:
M M r *1 г/моль.
37.
38.
Молярная масса может быть выражена черезчисло молекул (или атомов) в одном моле вещества
(m0) и массу ( N A ) отдельной молекулы (или атома):
Массу молекулы (атома) в килограммах можно
рассчитать по уравнению
m0 M r *1а.е.м. M r *1,66 *10
27
кг ,
следовательно
3
M *10 (кг/моль) = N M *1,66 *10 27 (кг/моль)
A
r
39.
Из этого выражения можно определить числомолекул или атомов, содержащихся в одном месте
любого вещества, которое называют постоянной
Авогадро.
Постоянная Авогадро ( N A ) – число атомов или
молекул
(или
других
формульных
единиц),
содержащихся в одном моле вещества; она всегда
равна
N A 6,022 *10 моль
23
1
40.
41.
I.Закон сохранения массы.
Был открыт М. В. Ломоносовым и сформулирован
А. Лавуазье:
Масса веществ, вступивших в реакцию, равна массе
веществ, образовавшихся в результате реакции.
Этот закон является одним
стехиометрических законов химии.
из
основных
Посмотреть видеоролик.
42.
Стехиометрия – раздел химии, в которомрассматриваются массовые и объемные соотношения
между реагирующими веществами, вывод химических
формул и составление уравнений химических
реакций.
43.
II. Закон постоянства состава вещества.Сформулирован Ж.-Л. Прустом в 1799 г.:
Всякое чистое вещество независимо от способа его
получения всегда имеет постоянный качественный и
количественный состав.
Однако уже в начале XIX в. К. Бертолле показал,
что элементы могут соединятся друг с другом в
разных соотношениях в зависимости от массы
реагирующих веществ.
44.
Современная формулировка закона постоянствасостава вещества таков:
Состав соединений молекулярной структуры
является постоянным независимо от способа их
получения. Состав соединений немолекулярной
структуры (с атомной, ионной или металлической
кристаллической
решеткой)
не
является
постоянным и зависит от способа их получения.
45.
Веществапостоянного
состава
называют
дальтонидами в честь английского физика и химика
Дж. Дальтона, а вещества переменного состава –
бертоллидами в честь французского химика К.
Бертолле.
Посмотреть видеоролик.
46.
III. Закон Авогадро.Сформулирован
А.
Авогадро
в
результате
проведения многочисленных экспериментов:
В равных объемах различных газов при одинаковых
условиях содержится одинаковое число молекул.
47.
1.Из закона Авогадро вытекают 2 следствия:
Один моль любого газа при одинаковых условиях
занимает один и тот же объем. Этот объем,
называемый молярным ( Vm ), при нормальных
условиях (давление p0 = 101325 Па и абсолютной
температуре T0 = 273,15 К) равен 22,4 л:
Vm 22,4 л / моль
48.
2. Массы двух разных газов, занимающих одинаковыйобъем при одинаковых условиях, относятся между
собой как их молярные массы
Отношение масс двух газов, занимающих равный
объем при одинаковых условиях, называют
относительной плотностью одного газа по
другому и обозначают буквой D.
49.
Уравнение состояния идеального газа (уравнениеМенделеева-Клапейрона):
m
pV
RT
M
или
pV nRT ,
где p – давление;
V – объем газа; m – масса газа;
М – молярная масса газа;
Т – температура;
n – количество вещества газа, моль;
R – универсальная газовая постоянная, значение
которой зависит от единиц, в которых измеряют
давление и объем.
50.
Основные законы химии51.
1.Найдите относительные молекулярные массы
веществ, состав которых описывается формулами:
O3
H 2 SO4 Ca3 (PO4 ) 2
Cu(OH )2
2. Рассчитайте относительные молекулярные массы
медного купороса CuSO4 * 5H 2O и
кристаллической соды Na2CO3 *10 H 2O
52.
3. Сколько молекул содержится в 32 г сернистого газаSO3 ?
4. Какова масса 1,2 *1023 молекул аммиака NH 3 ?
5. Какова масса 5,6 (н. у.) углекислого газа? Сколько
молекул содержится в этом объеме газа?
6. Каков объем 128 г сернистого газа при нормальных
условиях? Сколько молекул содержится в 128 г этого
газа?
7. Найдите массу кислорода, содержащегося в баллоне
объемом 50 л при температуре 25 С и давлении 790
кПа.















































 Химия
Химия








