Похожие презентации:
Предмет биохимии. Понятия о сН и рН. Буферные системы. Лекция №1
1.
Казахский национальный аграрныйуниверситет
Кафедра физиологии, морфологии и
биохимии
Дисциплина-Биохимия
ЛЕКЦИЯ № 1
Тема лекции: Предмет биохимии. Понятия о
сН и рН. Буферные системы .
.
2.
Тема лекции. Предмет биохимии и ее значение вподготовке высококвалифицированных специалистов.
Основы физической и коллоидной химии. cH и pH.
Буферные системы крови.
Цель лекции: показать студентам значение биохимии
как
фундаментальную
основу
подготовки
специалистов,
соответствующих
современным
требования науки и практики, а также ознакомить
студентов с основами физической и коллоидной
химии.
План лекции.
* Значение современной биохимии в подготовке
специалистов.
* Диссоциация воды.
* Понятие о cH и pH.
* Буферные растворы.
3.
Биологическая химия – наука окачественном составе, количественном
содержании и химических процессах
происходящих в живой материи. Современная
биологическая химия охватывает большую
область человеческих знаний.
4.
В зависимости от подхода к изучениюживой материи биохимию делят на
статическую, динамическую и
функциональную.
Статическая биохимия исследует
химический состав организмов. В
понятие химический состав включают
как качественный состав соединений,
так и количественное содержание их в
тех или иных биологических объектах.
5.
Динамическая биохимия исследуетпревращения химических соединений и
взаимосвязанных с ними превращений
энергии в процессе жизнедеятельности
живых организмов.
Функциональная биохимия исследует
связи между строением химических
соединений и процессами их
видоизменения в процессе их
функционирования.
6.
Практически в ходе биохимическихисследований все три раздела
переплетаются друг с другом, так как в
живом организме состав и строение
веществ неотделимы от их
преобразований, равно как и от
функций тех структур, органов и
тканей, в которых эти вещества
находятся.
7.
Биохимия является одной из фундаментальныхдисциплин в подготовке высоко
квалифицированных специалистов-биологов,
медицинских и ветеринарных врачей,
зоотехников, биотехнологов. Она вооружает
их знаниями, необходимыми для решения
кардинальных вопросов медицины,
ветеринарии, животноводства, агрономии,
пищевой промышленности, а также в решении
проблем надежного обеспечения населения
продуктами питания, а также
промышленности сырьем.
8.
Современная биохимия приобретает всебольшее основополагающее влияние в
биологии, так как проникновение в самую
глубокую сущность жизненных явлений,
управление жизнедеятельностью организма
человека, животных, растений и
микроорганизмов будет достигнуто только
тогда, когда биохимическая наука расшифрует
в достаточной мере набор, строение и
свойства химических соединений, из которых
слагается все живое, и выяснит
закономерности их превращений в процессе
существования живой материи.
9.
Биохимия и ее современныеметоды исследования являются
фундаментами для решения
самых сложных вопросов
биологии, медицины, ветеринарии,
растениеводства, промышленности
микробиологического синтеза,
пищевой промышленности и т.д.
10.
Изучение роста, развития идифференцировки растительных и
животных форм жизни невозможны без
биохимических знаний. Биохимия в
медицине и ветеринарии определяет
стратегию создания и применения новых
лекарственных форм, является
источником новых методов для
диагностики заболеваний и основой для
больших открытий, касающихся причин
тех или иных патологических процессов
в организме.
11.
Установлено, что многие болезни,передающихся по наследству, возникают в
результате нарушения отдельных звеньев
обмена белков, углеводов, липидов,
нуклеиновых кислот, витаминов, гормонов
и минеральных веществ, что послужило
причиной для выделения в отдельную
область медицины и ветеринарии учения о
молекулярных основах патологии, в
частности об энзимопатиях, т.е
нарушениях функций ферментов,
приводящих к развитию заболевания.
12.
Разработка и применение многочисленных иразнообразных химических препаратов в
животноводстве и ветеринарии, базирующиеся на
данных биохимии, способствует повышению
продуктивности животных и сохранению их
поголовья.
Изучение биохимии микроорганизмов и
открывающиеся при этом широкие перспективы
их практического использования привели к
созданию промышленности
микробиологического синтеза кормового белка,
аминокислот, антибиотиков, витаминов и
ферментов. Можно привести еще много
примеров, иллюстрирующих огромное значение
биохимической науки в области теории и
практики.
13.
Программа курса биологическойхимии с клинико-биохимическими
методами исследования составлена
так, что наряду с ознакомлением с
основами биологической химии
студенты получают представления о
патологической химии, что
подготавливает их к изучению
клинических дисциплин.
14.
При дальнейшем прохождении клиническихдисциплин биохимия выступает не только
как фундаментальная наука, но и как
теоретическая основа прикладных
исследований современной ветеринарии. На
основе биохимии разрабатываются многие
современные методы диагностики
заболеваний с.х. животных. Биохимия
открывает пути не только для познания
механизма возникновения патологии, но и
для изыскания средств активного
вмешательства в процессы
жизнедеятельности организма с целью
ликвидации патологического процесса.
15.
Русские, советские и казахстанскиеученые внесли большой вклад в
развитие биохимии. что
предопределило выход биохимии на
передовые рубежи мировой
биохимической науки.
16.
Диссоциация воды. Понятие о cH и pH.Вода как слабый электролит в
незначительной степени диссоцирует
на ионы H+и OH-, которые находятся в
равновесии с недиссоциированными
молекулами:
H2 О
H+ + OH-
17.
Этот факт имеет исключительно важноезначение, т.к. вода является средой, в
которой протекают самые разнообразные
химические процессы. Она обладает
хорошей растворяющей способностью и
вызывает электролитическую
диссоциацию многих растворенных в ней
веществ. Опытным путем установлено, что
в 1 л воды при комнатной температуре
(22оС), диссоциации подвергаются лишь
10 моль воды и при этом образуется 10-7
моль/л ионов H+ и 10-7 моль/л ионов OH-.
18.
Произведение концентраций ионовводорода и гидроксид-ионов в воде
называется ионным произведением воды
(обозначается Кв). При определенной
температуре Кв. – величина постоянная.
Например, если в водном растворе (H+)
=10-7 моль/л, то (OH-) определяется так:
Для чистой воды и для разбавленных
водных растворов при неизменной
температуре произведение концентрации
ионов водорода и гидроксид-ионов есть
величина постоянная.
В чистой воде при 250С [Н+]*[ОН-] =
[H2O] =1•10-14 моль/л
19.
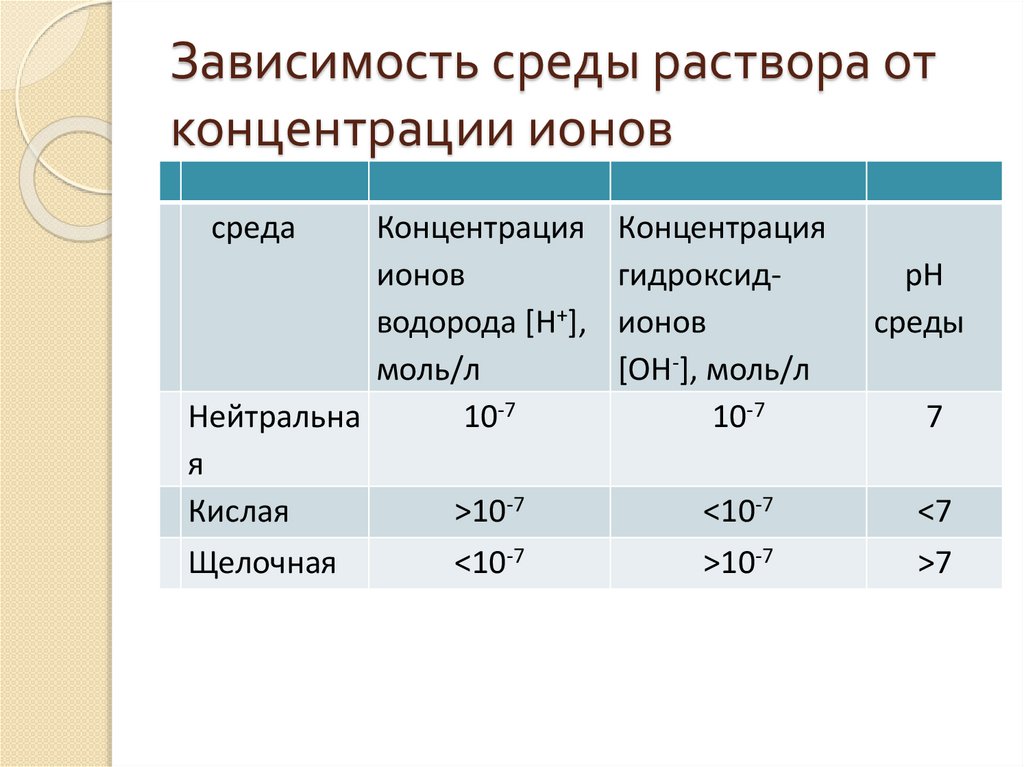
Зависимость среды раствора отконцентрации ионов
20.
Зависимость среды раствора отконцентрации ионов
среда
Концентрация
ионов
водорода [Н+],
моль/л
Нейтральна
10-7
я
Кислая
>10-7
Щелочная
<10-7
Концентрация
гидроксидионов
[ОН-], моль/л
10-7
рН
среды
7
<10-7
<7
>10-7
>7
21.
22.
Таким образом, кислотность и щелочность раствора можновыражать через концентрацию либо ионов H+, либо ионов
OH-.На практике пользуются первым способом, который
называется cH+, что обозначает концентрацию ионов
водорода. Тогда для нейтрального раствора cH+=10-7, для
кислого cH+ > 10-7 и для щелочного
cH+ < 107моль/л.
Чтобы избежать неудобств, связанных с применением
чисел с отрицательными показателями степени,
концентрацию водородных ионов принято выражать через
водородный показатель и обозначать символом pH
(читается «пэ» - «аш»). Водородным показателем – pH
называется обратный отрицательный десятичный логарифм
cH+или концентрации водородных ионов.
pH = - Ig [H+] или cH+.
23.
Методы определения pH. Они делятся на две группы:1.Колориметрические или непрямые методы;
2.Электрометрические и прямые методы.
Из этих методов наиболее простыми и распространёнными
являются колориметрические методы определения pH,
основанные на применении индикаторов. Индикаторами
называются вещества, изменяющие свою окраску в зависимости
от pH раствора, в котором они находятся. По химической
природе индикаторы обычно представляют собой слабые
кислоты, анионы которых имеют одну, а недиссоциированные
молекулы другую окраску. Индикаторы бывают:
А) одноцветные, когда окрашены или анион или
недиссоциированная молекула;
Б) двухцветные, окрашены и анион и недиссоциированная
молекула.
Диссоциация индикатора кислоты происходит по уравнению:
1п
H + In
24.
Если к индикатору прибавить кислоту, т.е. повыситьконцентрацию водородных ионов, то положение равновесия
сдвинется в сторону образования молекул индикатора и
раствор принимает ее окраску. Если наоборот, прибавить
щелочь, то раствор принимает окраску аниона, т.к. реакция
сдвинется в правую сторону. Примером двухцветного
индикатора является метиловый красный, который в кислой
среде имеет оранжевую, а в щелочной – желтую окраску.
Примером одноцветного индикатора является фенолфталеин,
который в кислой среде – бесцветен, а в щелочной имеет
малиновую окраску. pHсреды, при котором индикатор
диссоциирован наполовину называется точкой перехода
индикатора. В точке перехода индикатор имеет промежуточную
окраску. Область между двумя значениями pH, при которой
происходит заметное на глаз изменение окраски индикатора,
называется зоной перехода индикатора.
25.
Колориметрический метод определения pHвыполняется в двух вариантах:
А) буферный
Б) безбуферный.
Буферный метод определения pH выполняется
с помощью заранее приготовленных буферных
растворов с использованием универсального
индикатора (смесь индикаторов), а в
безбуферном методе применяется
одноцветный индикатор и используется так
называемый прибор Михаэлиса. Однако эти
методы с каждым годом уступают
электрометрическому методу определения pH.
Электрометрический метод определения pH
производится с помощью специального
прибора –pH-метра. Это самый точный и
удобный метод определения pH.
26.
СВОЙСТВА БУФЕРНЫХ СИСТЕМ.1.Буферные растворы способны поддерживать
постоянство значения pH при разведении и
добавлении небольшего количества сильной
кислоты или щелочи. Это свойство
объясняется тем, что при разбавлении
концентрация кислоты и соли уменьшается в
одно и то же число раз, благодаря чему
отношение кислота-соль сохраняет свою
постоянную величину.
2.При добавлении небольшого количества
сильной кислоты или щелочи pH раствора
практически также не меняется. Для примера
рассмотрим механизм действия карбонатного
буфера.
H2CO3
NaHCO3
27.
Допустим, в этот буферный раствордобавляли небольшое количество сильной
кислоты – HCI. Она сильная кислота,
поэтому полностью распадается на ионы
H+и CI-, согласно уравнению
HCI
H+ + CIТаким образом, в результате добавления
сильной кислоты резко увеличивается
количество ионов водорода, однако
изменение pH в кислую сторону не
происходит, т.к. HCI взаимодействует c
солью, образуя нейтральную соль и
слабую кислоту согласно уравнению:
NaHCO3+HCI
NaCI+H2CO3
28.
Полученная угольная кислота очень слабая иплохо диссоциирует на ионы, и мало
образуются ионов водорода, поэтому pH
раствора практически не изменяется.
Если в буферный раствор добавить немного
щелочи, NaOH как сильное основание
реагирует с кислотой, в результате которой
образуются нейтральная соль и вода, которая
плохо диссоциирует на ионы и поэтому pH не
изменяется.
H2CO3 + NaOH
NaHCO3 + H2O
29.
Различные буферные растворы обладаютразличной буферной емкостью. Буферной
емкостью называется количество миллиграмм
– эквивалентов сильной кислоты или сильного
основания, которое необходимо добавить к
литру буферного раствора, чтобы изменить его
pH на единицу. Чем больше буферная емкость,
тем буферный раствор является более ценным.
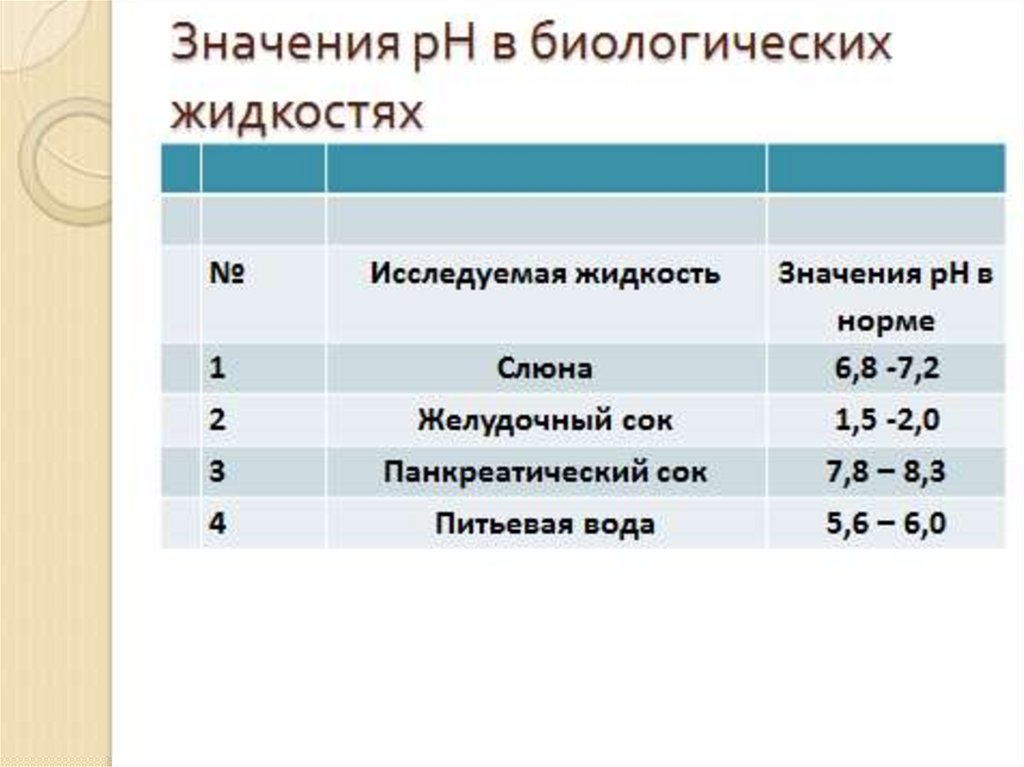
РОЛЬ БУФЕРНЫХ СИСТЕМ КРОВИ.
Организм человека и животных может
существовать только при постоянном значении
pH (7,36). В кровь от кишечника и тканей
могут поступать кислые и основные вещества,
которые могли бы изменять реакцию среды.
30.
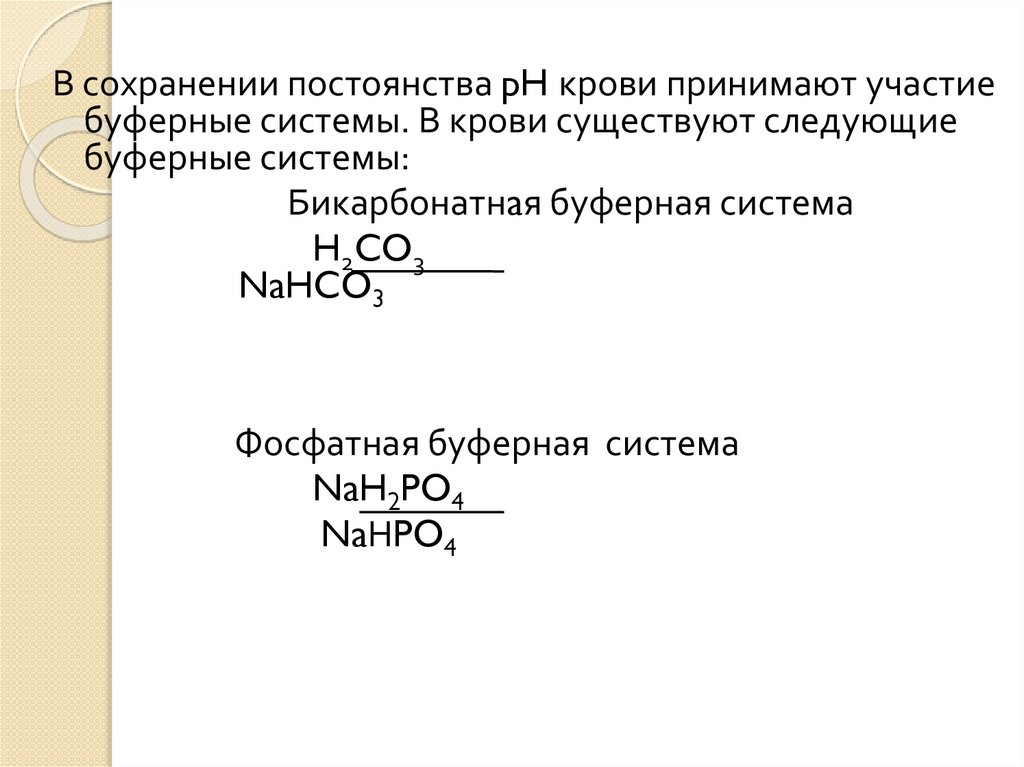
В сохранении постоянства pH крови принимают участиебуферные системы. В крови существуют следующие
буферные системы:
Бикарбонатнaя буферная система
H2CO3
NaHCO3
Фосфатная буферная система
NaH2PO4
NaНPO4
31.
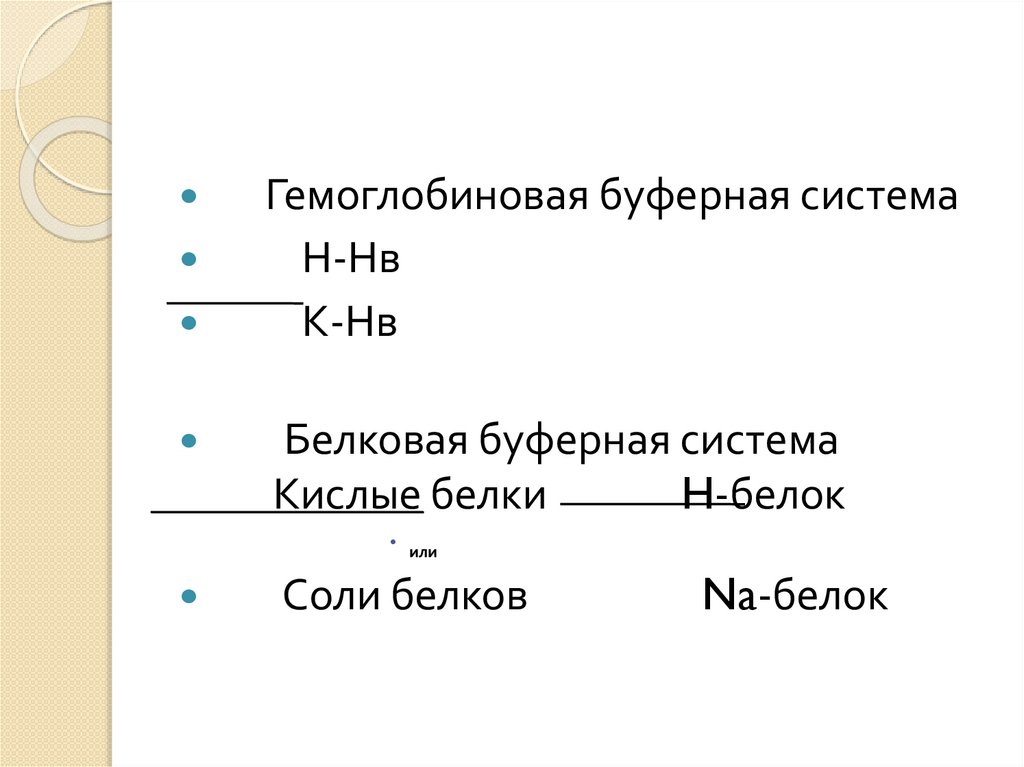
Гемоглобиновая буферная системаН-Нв
К-Нв
Белковая буферная система
Кислые белки
H-белок
или
Соли белков
Na-белок
32.
Главным буфером плазмы крови являетсябикарбонатный, а основное значение в
эритроцитах имеет гемоглобиновый буфер.
Роль буферных систем в сохранении
постоянного значения pH крови заключается в
том, что сильные кислоты и сильные
основания переводят в слабые кислоты,
нейтральные соли и воду, защищая организм
от ацидоза (повышенная кислотность) и
алкалоза (повышенная щелочность
организма).
33.
КОНТРОЛЬНЫЕ ВОПРОСЫДайте определение буферных растворов.
Зачем нужны буферные растворы?
На каком принципе составляются буферные
растворы?
В чем суть бикарбонатной буферной системы?
В чем смысл фосфатной буферной системы?
Каким образом образуется гемоглобиновая
буферная система?
Почему не меняется значение pH буферного
раствора при добавлении небольшого
количества кислоты или щелочи?
34.
ЛИТЕРАТУРАЧечеткин А.В. и др. Биохимия
животных. – М.: 1982.
Малахов А.Г., Вишняков С.И. Биохимия
с.х. животных. М.: 1984.
Сеитов З.С. Биохимия. Алматы.
КазНАУ. 2001.






























 Биология
Биология Химия
Химия








