Похожие презентации:
Электрохимия
1.
ЭЛЕКТРОХИМИЯ2.
Предмет электрохимии.Растворы электролитов
Электрохимия
– раздел физической химии, который рассматривает законы
взаимного превращения химической и электрической форм
энергии и системы, в которых такие превращения возможны.
– раздел физической химии, в котором изучают физикохимические свойства ионных систем, а также процессы и
явления на границах раздела фаз с участием заряженных
частиц – электронов или ионов.
Электрохимические реакции
- реакции, которые протекают за счет подведенной извне
электрической энергии.
- самопроизвольные реакции, которые сами являются
источником электрической энергии
3.
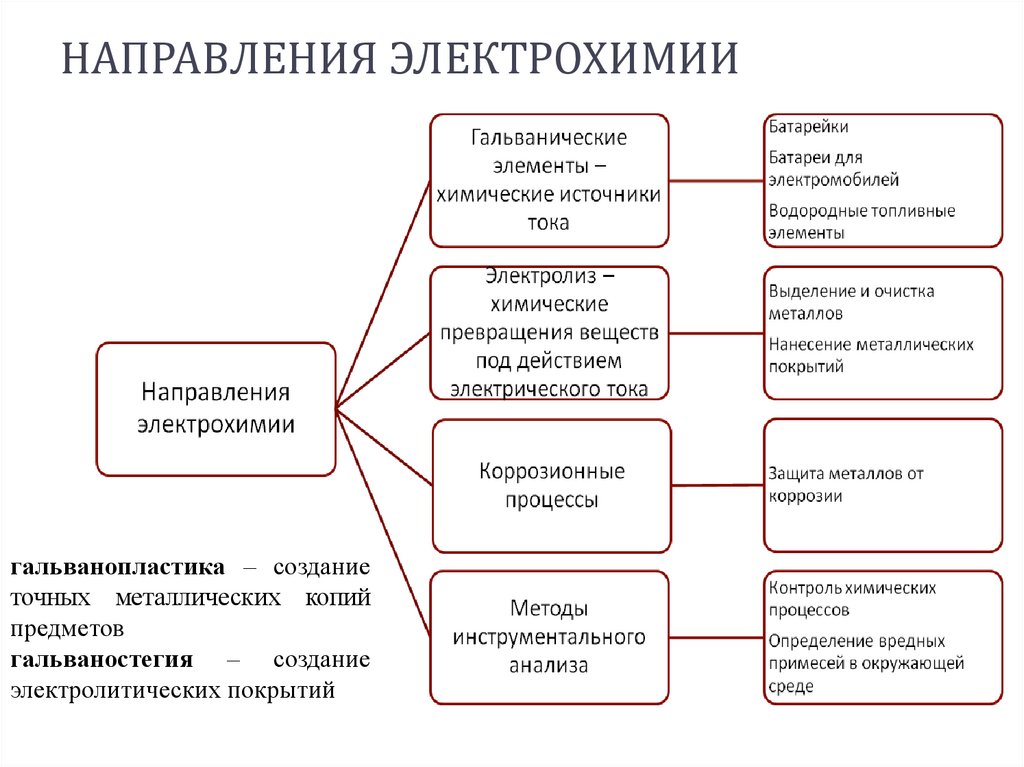
НАПРАВЛЕНИЯ ЭЛЕКТРОХИМИИгальванопластика – создание
точных металлических копий
предметов
гальваностегия – создание
электролитических покрытий
4.
Электрохимические системыЭлектрохимические системы (электрохимические
цепи)
–
системы,
в
которых
протекают
электрохимические реакции.
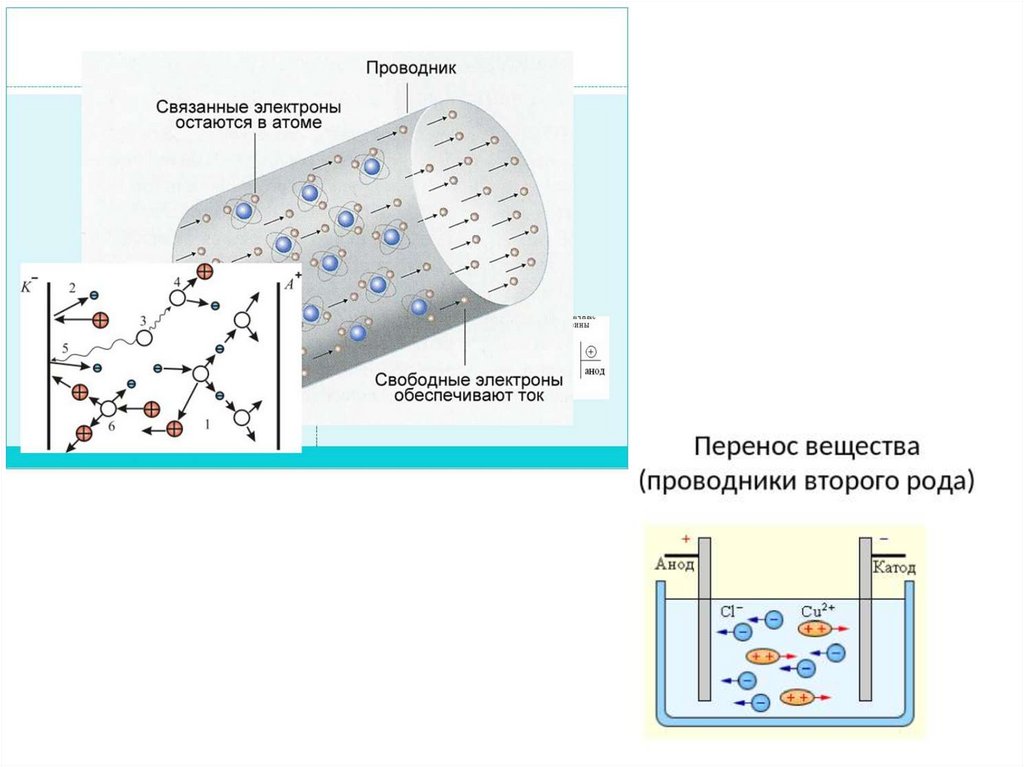
Электрический ток – упорядоченное, направленное
движение заряженных частиц (электронов и ионов).
Протекание тока обеспечивается присутствием в
электрохимических системах проводников, в которых
содержатся частицы, имеющие заряд и возможность
свободно перемещаться внутри проводника.
5.
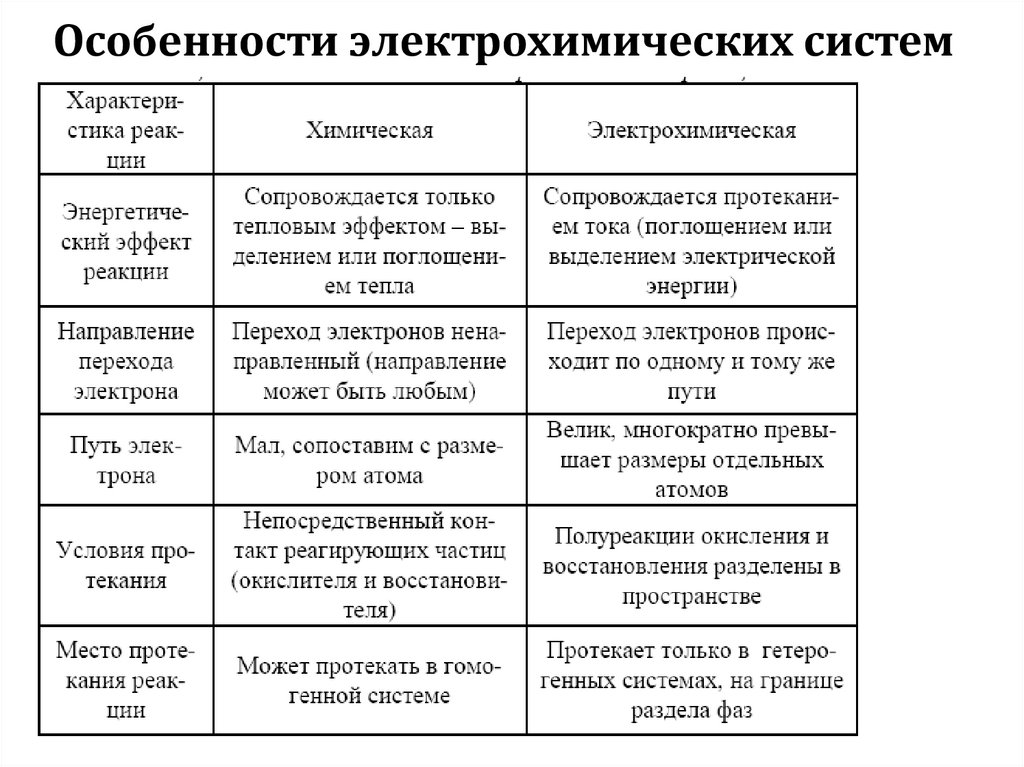
Особенности электрохимических систем6.
7.
8.
9.
10.
Особенности электрохимических систем11.
Электролитывещества
или
системы,
содержащие в заметных количествах ионы и
обладающие ионной проводимостью
Электролиты - вещества, молекулы которых
способны в растворе или расплаве распадаться на
ионы в результате процесса электролитической
диссоциации и проводить электрический ток
Различают
твёрдые электролиты
расплавы и растворы электролитов
12.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ при растворении в воде практически полностьюдиссоциируют на ионы.
К сильным электролитам относятся:
- Растворимые соли;
- Многие неорганические кислоты: HNO3, H2SO4, HClO3, HClO4, HMnO4, HCl,
HBr, HI;
- Основания щелочных (LiOH, NaOH, KOH) и щелочноземельных (Ca(OH)2,
Sr(OH)2, Ba(OH)2) металлов.
СЛАБЫЕ ЭЛЕКТРОЛИТЫ в водных растворах лишь частично (обратимо)
диссоциируют на ионы.
К слабым электролитам относятся:
- Почти все органические кислоты и вода (Н2О);
- Некоторые неорганические
кислоты: H2S, H3PO4,HClO4, H2CO3, HNO2, H2SiO3 ;
·
Нерастворимые гидроксиды металлов (Mg(OH)2,Fe(OH)2, Zn(OH)2).
На степень электролитической диссоциации влияет ряд факторов:
•природа растворителя и электролита;
•температура: поскольку диссоциация — процесс эндотермический,
повышение температуры повышает значение α;
•концентрация: при разбавлении раствора степень диссоциации возрастает, а с
увеличением концентрации — уменьшается;
13.
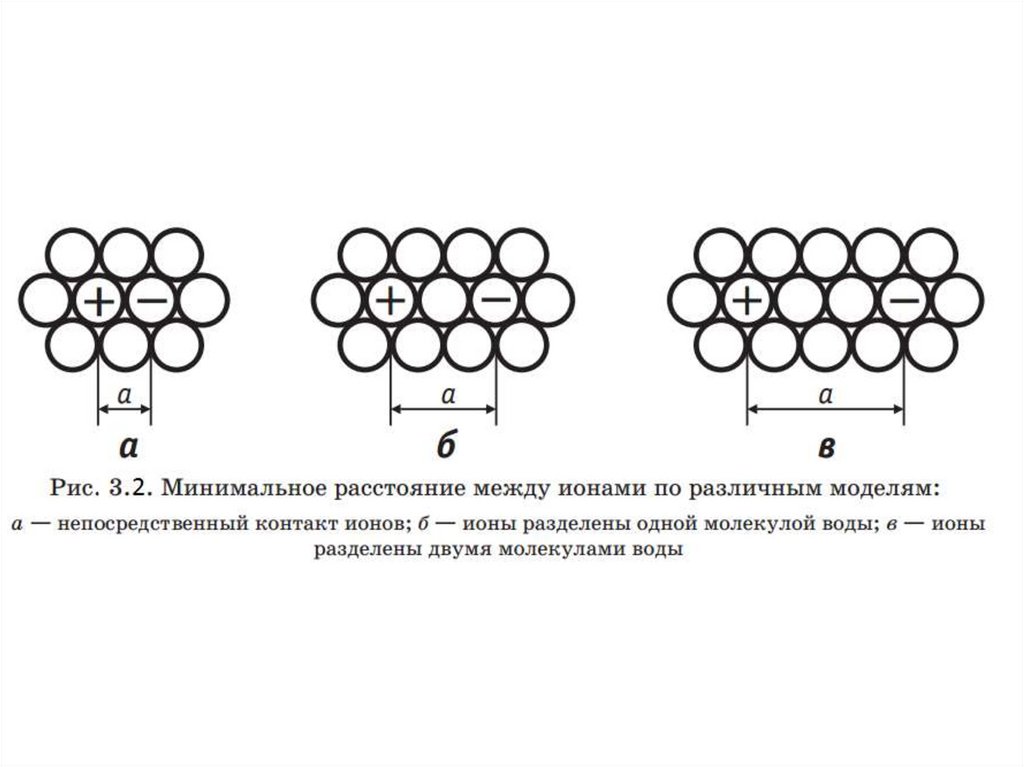
Электролитическая диссоциация.Влияние характеристик растворителя.
Диссоциация возможна, если молекулы растворителя полярны,
т.е. обладают электрическим дипольным моментом. Для полярных
растворителей по сравнению с неполярными характерны более
высокие температуры плавления и кипения, а также более высокая
диэлектрическая проницаемость ε.
Диэлектрическая проницаемость – это величина,
характеризующая реакцию растворителя на электрическое поле.
Она показывает, во сколько раз сила взаимодействия двух
электрических зарядов в данной среде меньше, чем в вакууме.





































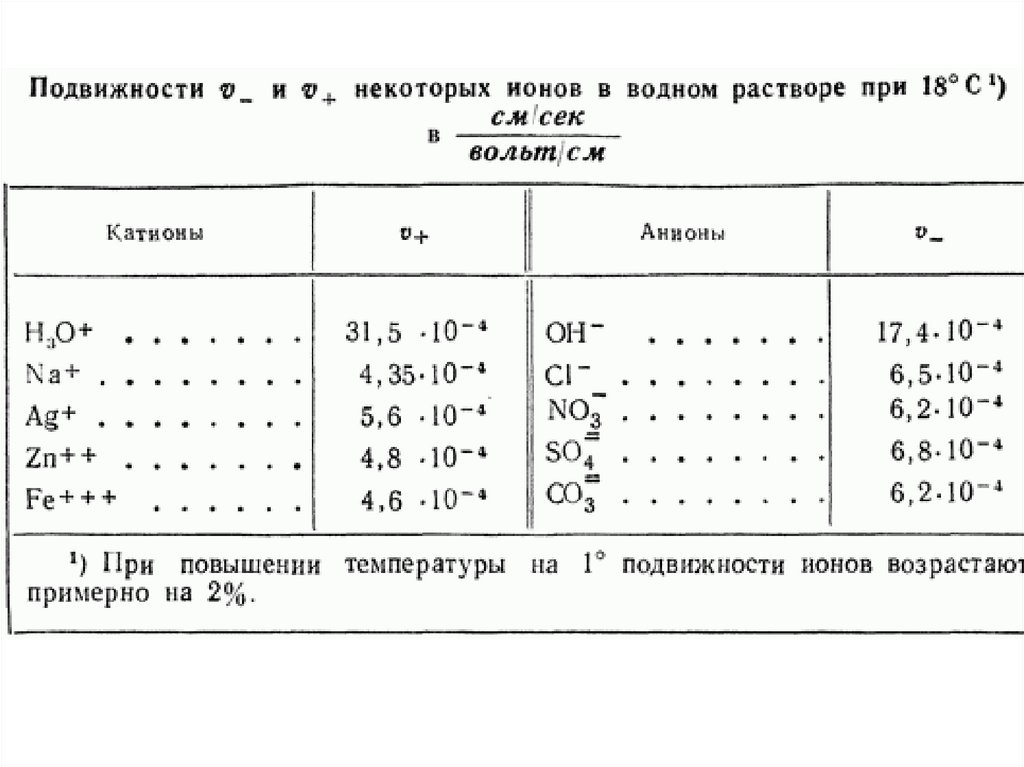
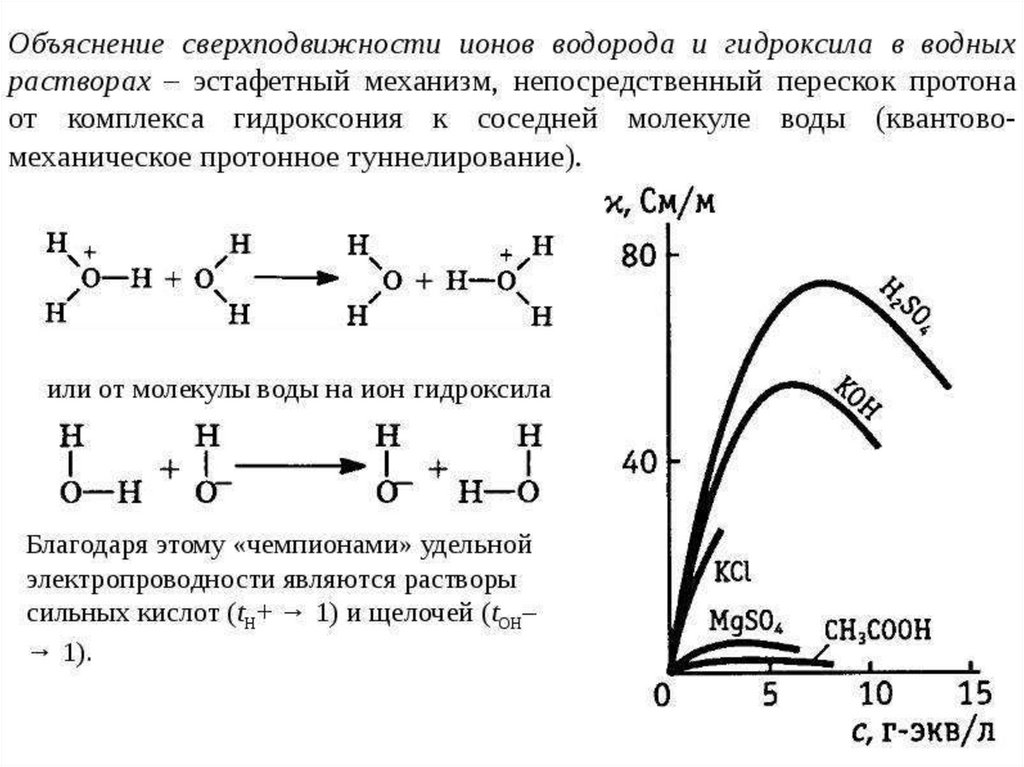
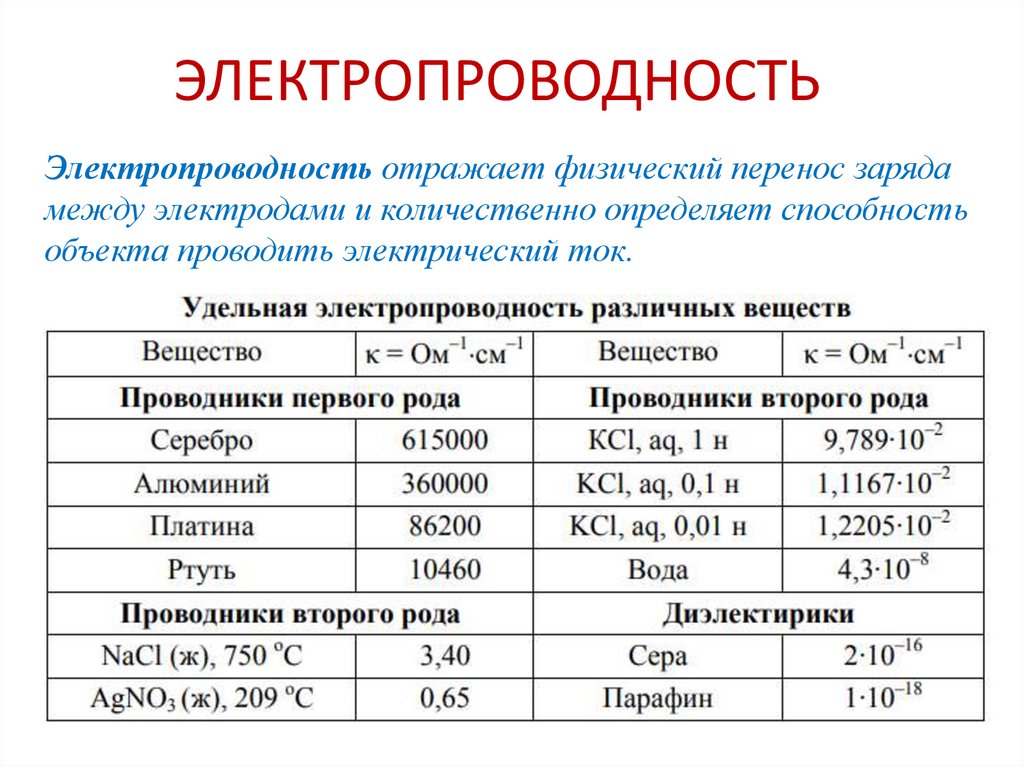



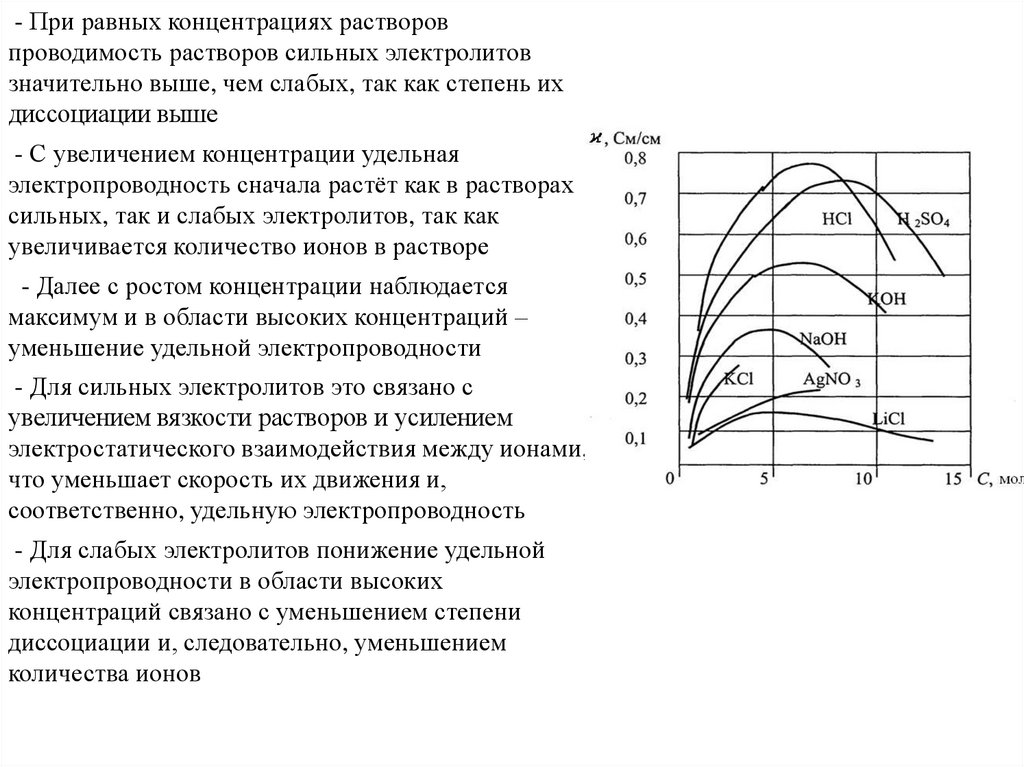



























 Химия
Химия








