Похожие презентации:
Химические реакции. Классификация
1.
2.
3.
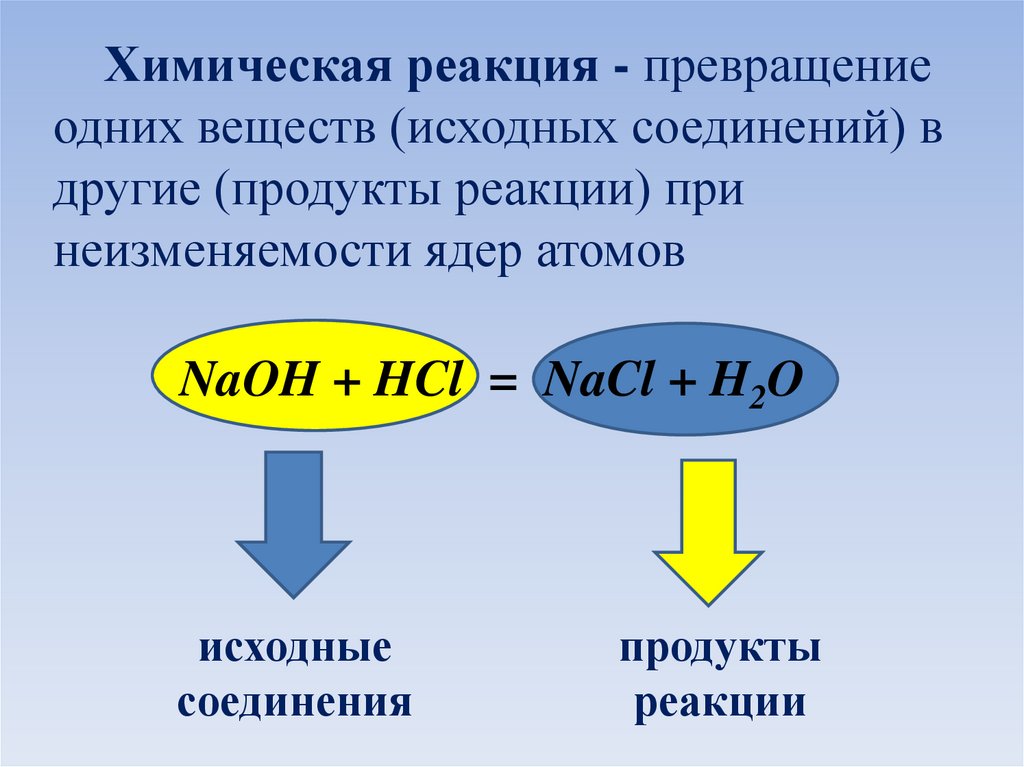
Химическая реакция - превращениеодних веществ (исходных соединений) в
другие (продукты реакции) при
неизменяемости ядер атомов
NaOH + HCl = NaCl + H2O
исходные
соединения
продукты
реакции
4.
5.
Признаки химических реакций:1. Появление, исчезновение или изменение цвета:
FeCl3 + 6KSCN = K3[Fe(SCN)6] + 3KCl
жёлтый р-р бесцв. р-р р-р кроваво-красного цвета
2. Появление, исчезновение или изменение запаха:
FeS + 2HCl = FeCl2 + H2S↑
запах тухлых яиц
3. Выпадение или растворение осадка:
AgNO3 + NaCl = AgCl↓ + NaNO3
белый осадок
4. Выделение газа:
NaHCO3 + СH3COOH = CH3COONa + H2O + CO2↑
5. Выделение света или тепла, поглощение теплоты:
4P + 5O2 = 2P2O5 + Q
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
Реакция нейтрализации –сильная кислота + сильное основание:
18.
19.
20.
Тепловой эффект реакции (Q, ΔH) - количество теплоты, которое выделяется(+Q или -ΔH) или поглощается (-Q или +ΔH) в результате химической реакции.
Тепловые эффекты химических реакций изучает специальный раздел химии термохимия.
Термохимическое уравнение - уравнение химической реакции, в котором
указываются тепловой эффект химической реакции и агрегатные состояния
исходных веществ и продуктов реакции:
C(тв) + O2(г) = CO2↑ + 402,24 кДж
В термохимических уравнениях тепловой эффект реакции относится к мольным
количествам веществ.
n(C) = 1 моль, n(O2) = 1 моль, n(CO2) = 1 моль
















 Химия
Химия








