Похожие презентации:
Строение вещества
1.
СТРОЕНИЕВЕЩЕСТВА
2.
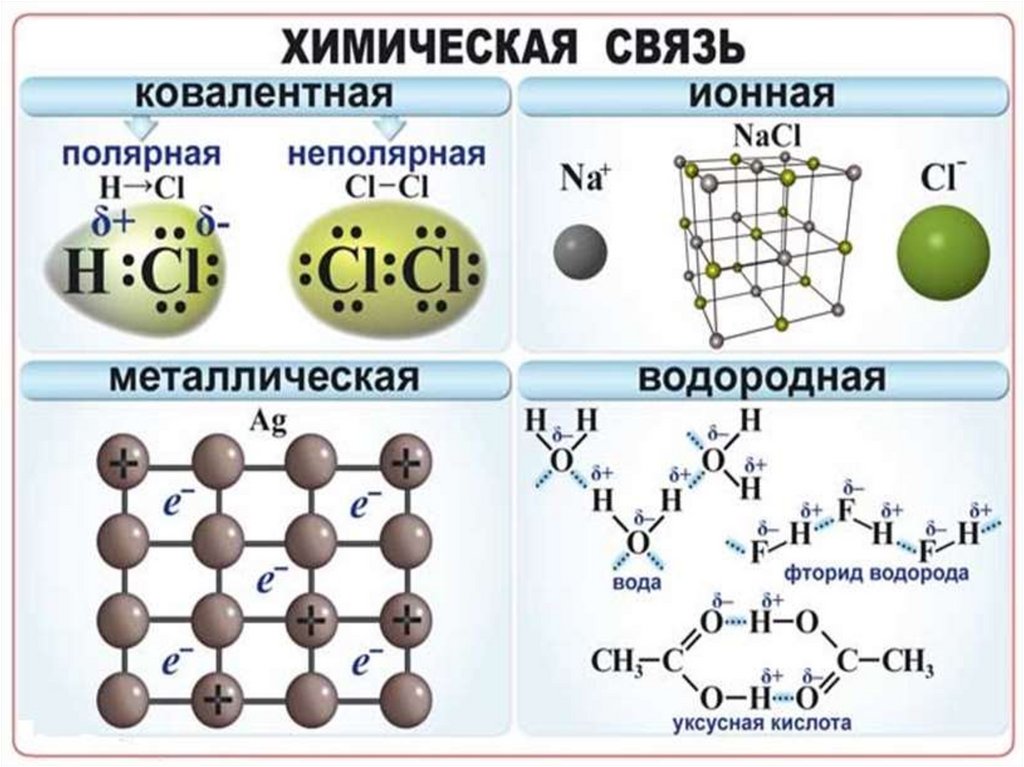
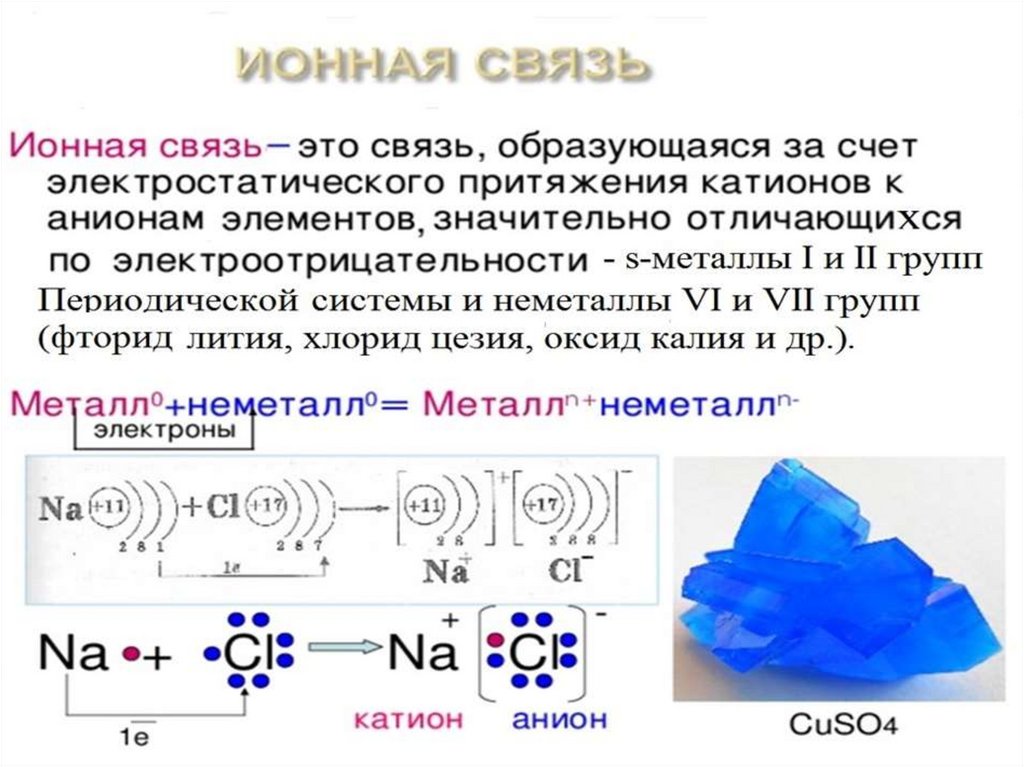
Химическая связь взаимодействие атомов,связывающее их в единую
устойчивую систему
(молекулу, ион, кристалл и
др.)
3.
4.
5.
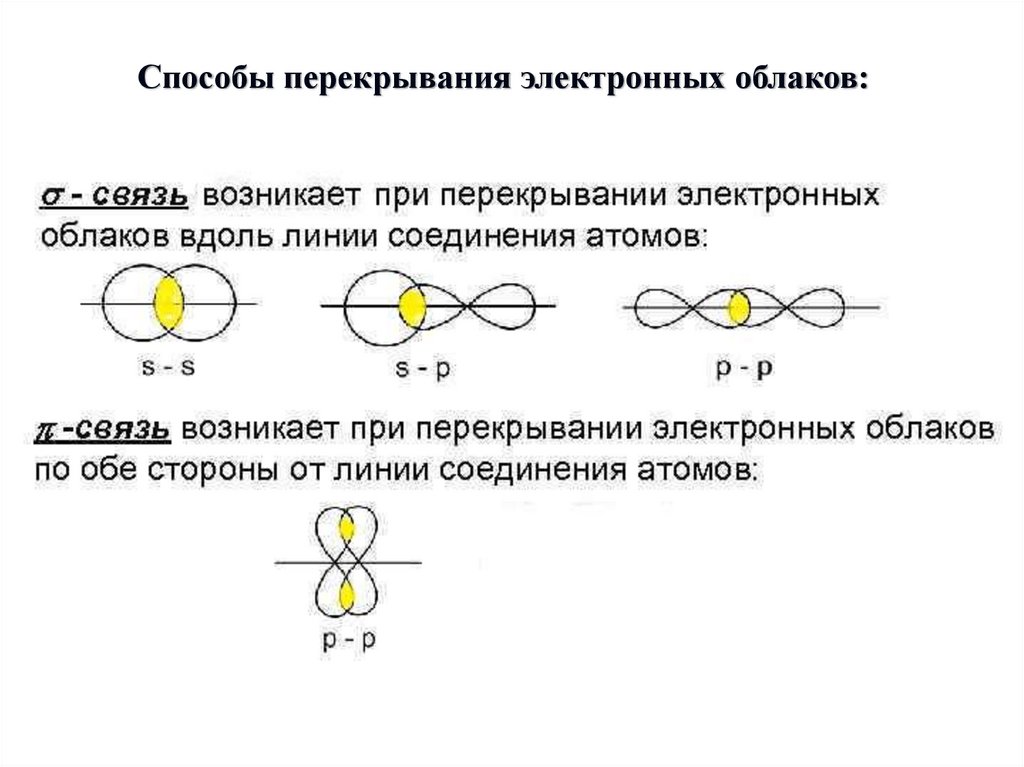
Способы перекрывания электронных облаков:6.
Характеристики ковалентной связи:Энергия связи – энергия, которую необходимо затратить
для разрыва данной связи. Измеряется в кДж/моль. Зависит
от радиуса перекрывающихся облаков.
Кратность связи – число химических связей между
двумя атомами. Её можно показать сплошной линией между
атомами либо точками. Чем больше кратность связи, тем
прочнее связь.
Длина связи – расстояние между ядрами атомов в
молекуле. Измеряется в нм.
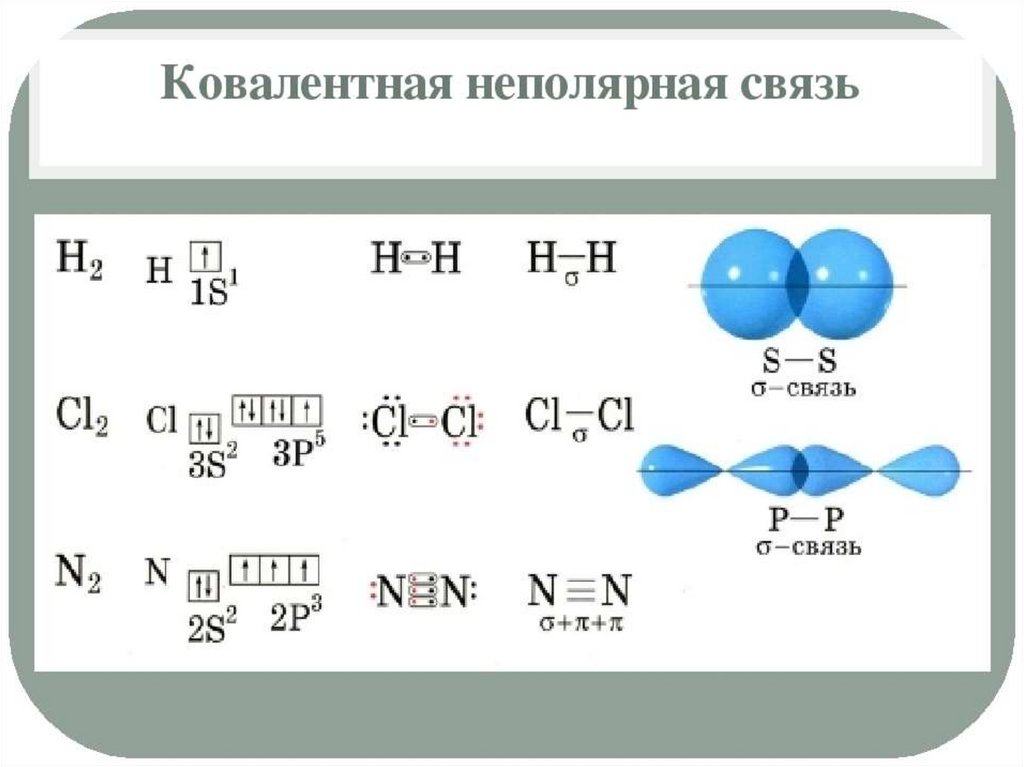
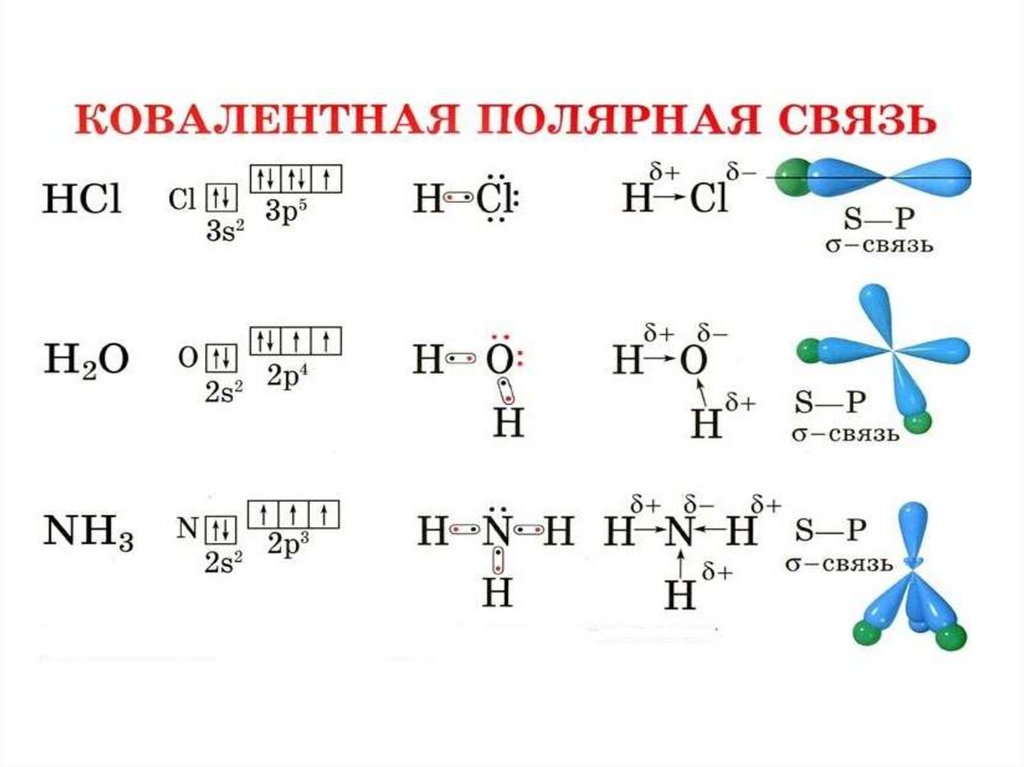
Полярность связи – смещение общей электронной
плотности к более электроотрицательному атому. В
зависимости от этого ковалентная связь делится на
полярную и неполярную
7.
8.
9.
10.
11.
12.
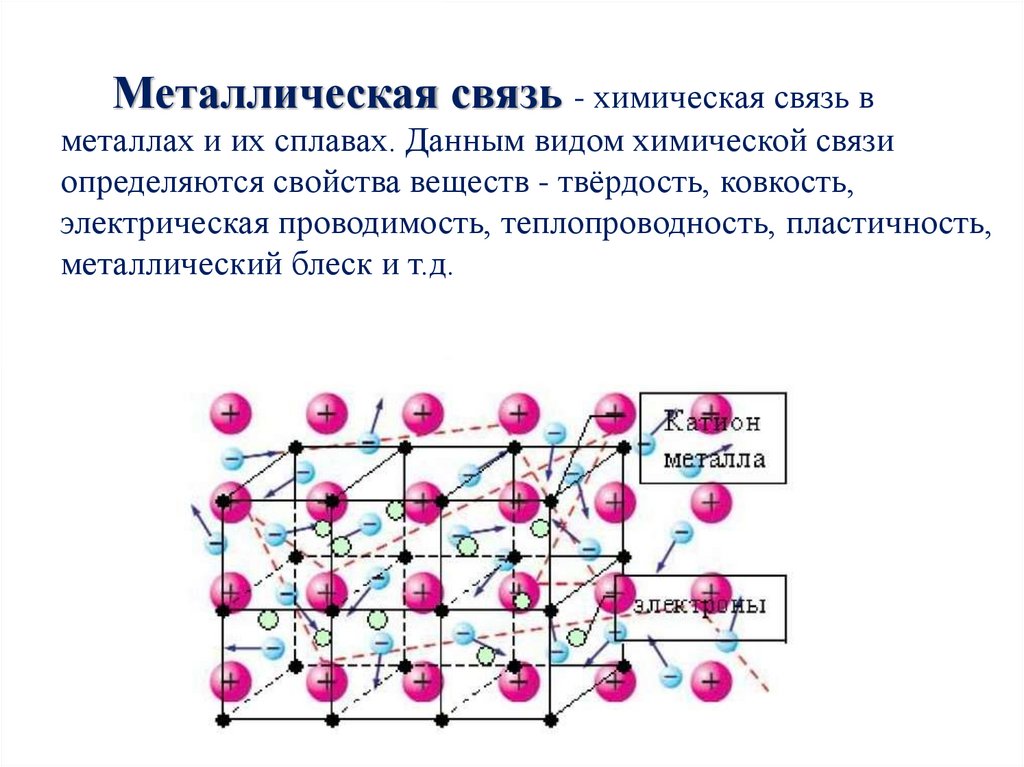
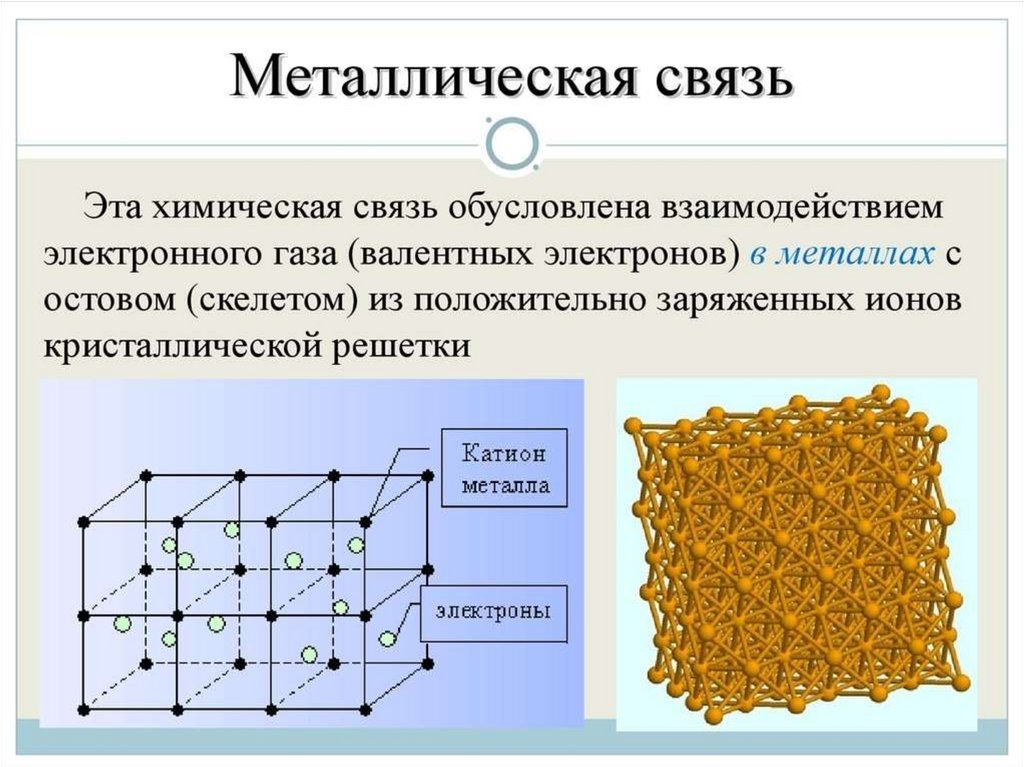
Металлическая связь - химическая связь вметаллах и их сплавах. Данным видом химической связи
определяются свойства веществ - твёрдость, ковкость,
электрическая проводимость, теплопроводность, пластичность,
металлический блеск и т.д.
13.
14.
15.
16.
17.
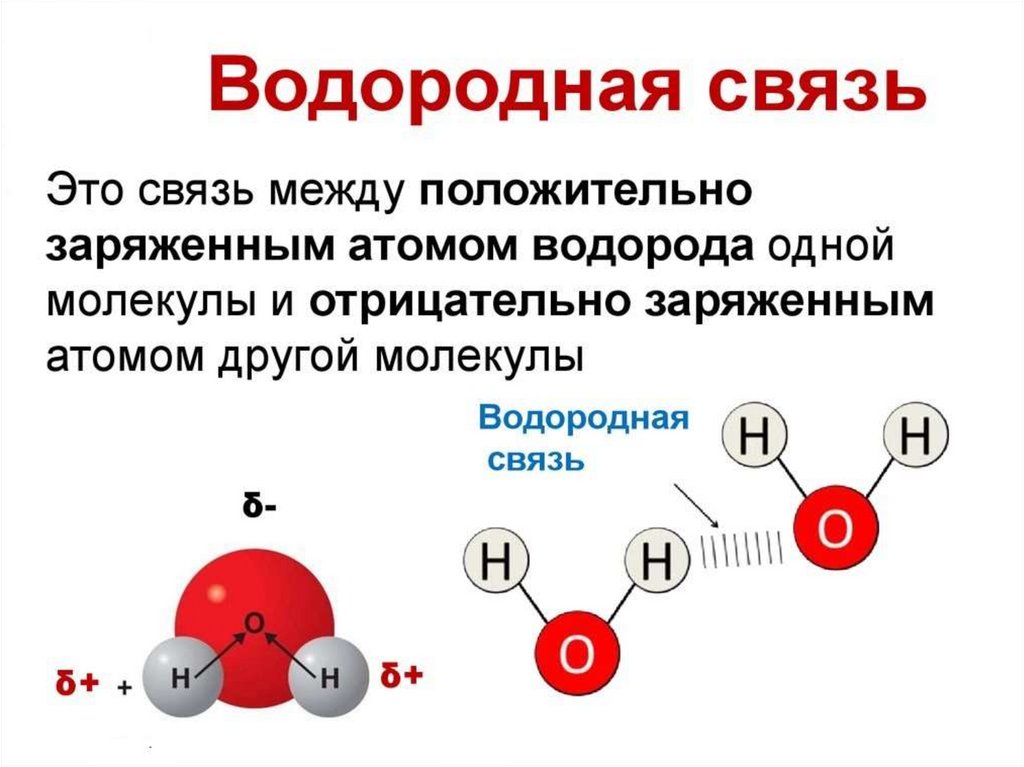
Наличие водородной связи обуславливаетфизические и химические свойства
вещества - высокие температуры плавления
и кипения, хорошую растворимость,
высокую испаряемость. Связь слабая и
легко рвётся, но множество таких связей
способно породить силу, на которой, в
буквальном смысле, держится всё живое.
Соединения с водородной связью - спирты,
карбоновые кислоты, амины,
аминокислоты, белки, вода, аммиак,
фтороводород
18.
19.
20.
21.
22.
23.
24.
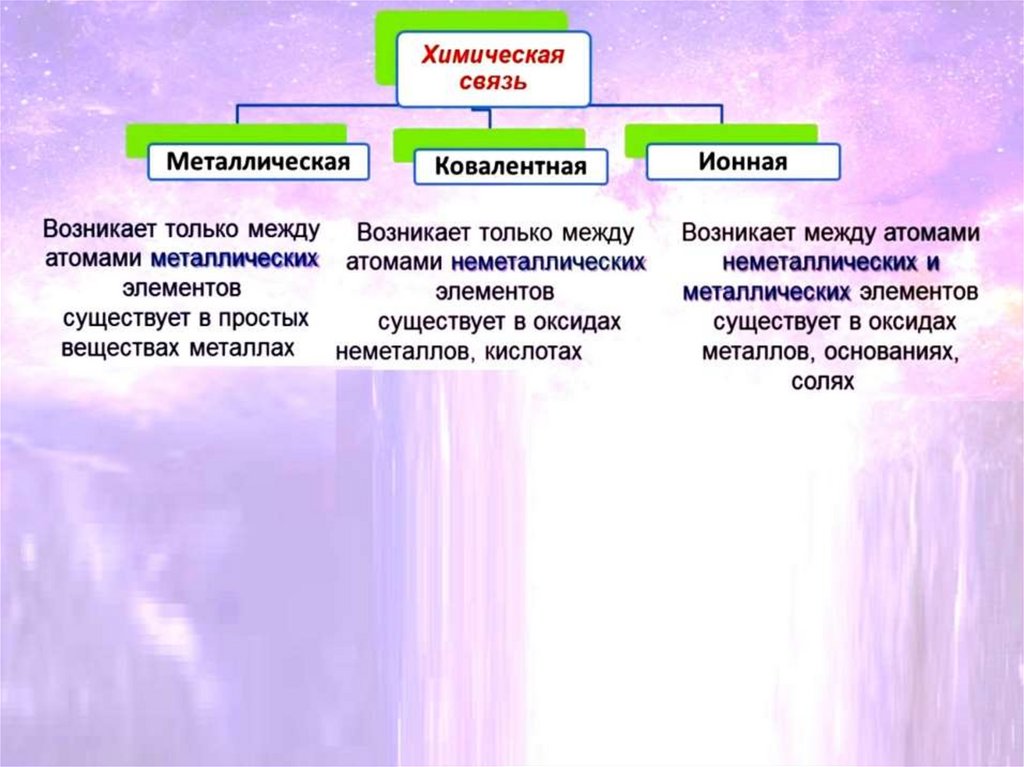
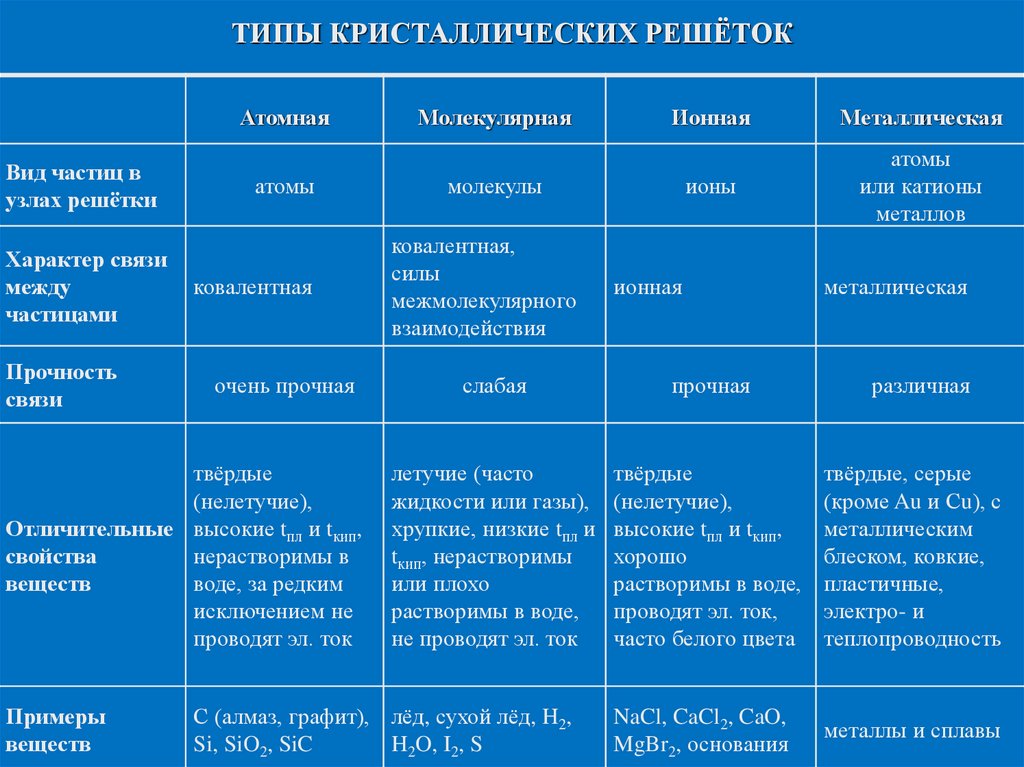
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОКАтомная
Вид частиц в
узлах решётки
Характер связи
между
частицами
Прочность
связи
атомы
ковалентная
очень прочная
твёрдые
(нелетучие),
Отличительные высокие tпл и tкип,
свойства
нерастворимы в
веществ
воде, за редким
исключением не
проводят эл. ток
Примеры
веществ
Молекулярная
Ионная
Металлическая
ионы
атомы
или катионы
металлов
молекулы
ковалентная,
силы
межмолекулярного
взаимодействия
ионная
металлическая
слабая
прочная
различная
летучие (часто
жидкости или газы),
хрупкие, низкие tпл и
tкип, нерастворимы
или плохо
растворимы в воде,
не проводят эл. ток
твёрдые
(нелетучие),
высокие tпл и tкип,
хорошо
растворимы в воде,
проводят эл. ток,
часто белого цвета
твёрдые, серые
(кроме Au и Сu), с
металлическим
блеском, ковкие,
пластичные,
электро- и
теплопроводность
NaCl, CaCl2, CaO,
MgBr2, основания
металлы и сплавы
С (алмаз, графит), лёд, сухой лёд, H2,
Si, SiO2, SiC
H2O, I2, S
25.
Вопросы для самоконтроля:1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Что такое химическая связь?
Виды химической связи?
Что такое ковалентная связь? Способы перекрывания электронных
облаков при образовании ковалентной связи?
Характеристики ковалентной связи?
Виды ковалентной связи?
Механизмы образования ковалентной связи?
Что такое ионная связь?
Что такое металлическая связь? Чем она обусловлена? Какие свойства
имеют вещества с данным типом связи? Что такое электронный газ?
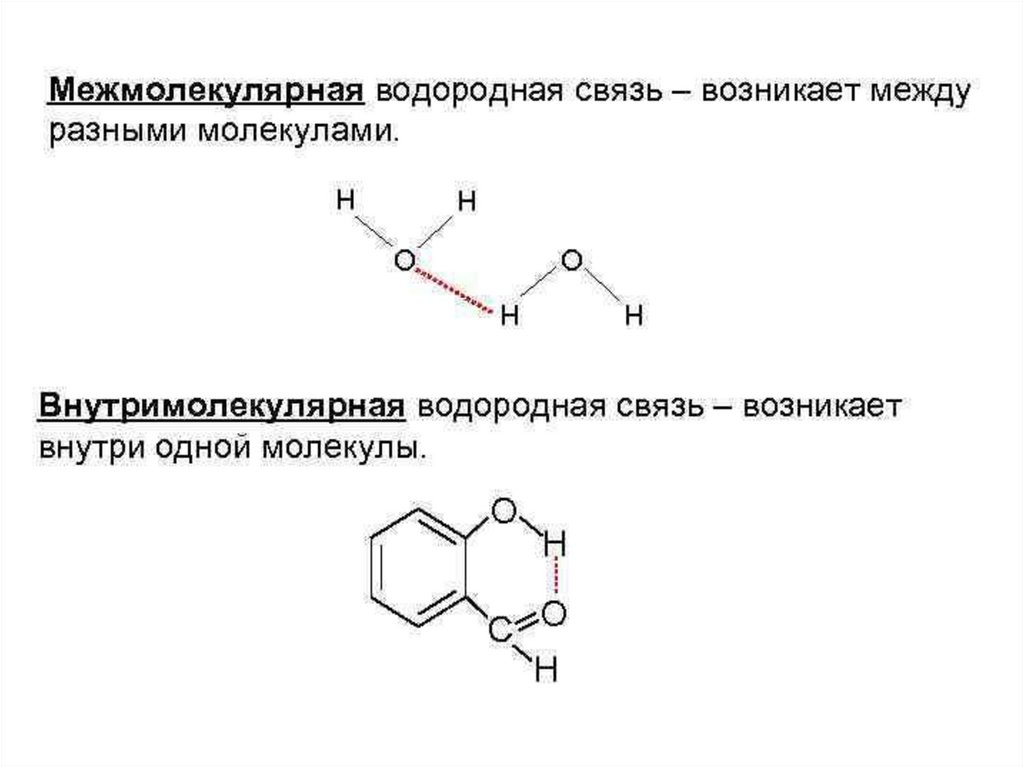
Что такое водородная связь? Виды водородной связи? Значение
водородных связей в молекуле? Примеры веществ с водородной
связью? Свойства веществ с водородной связью?
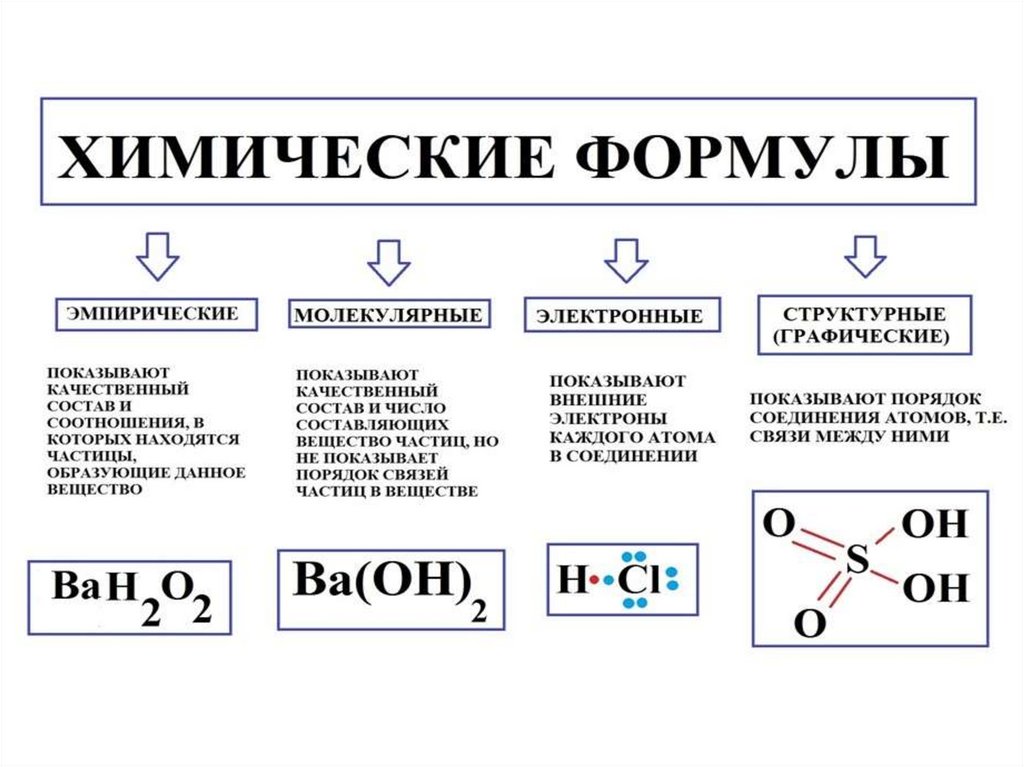
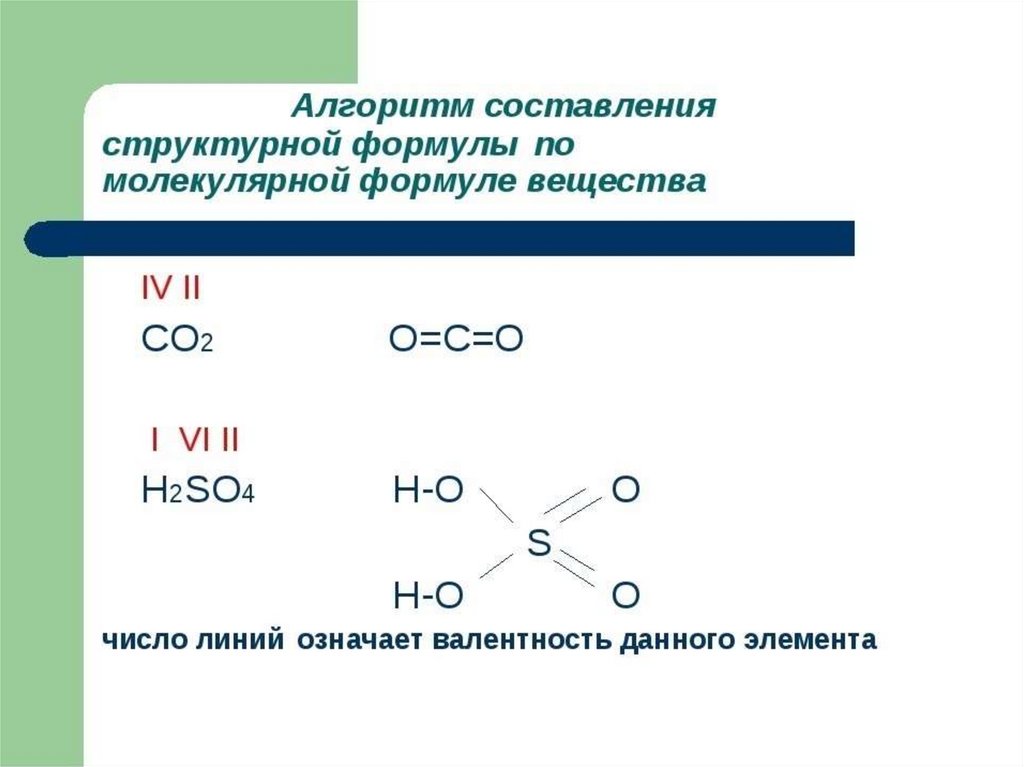
Виды химических формул? Что такое структурная формула?
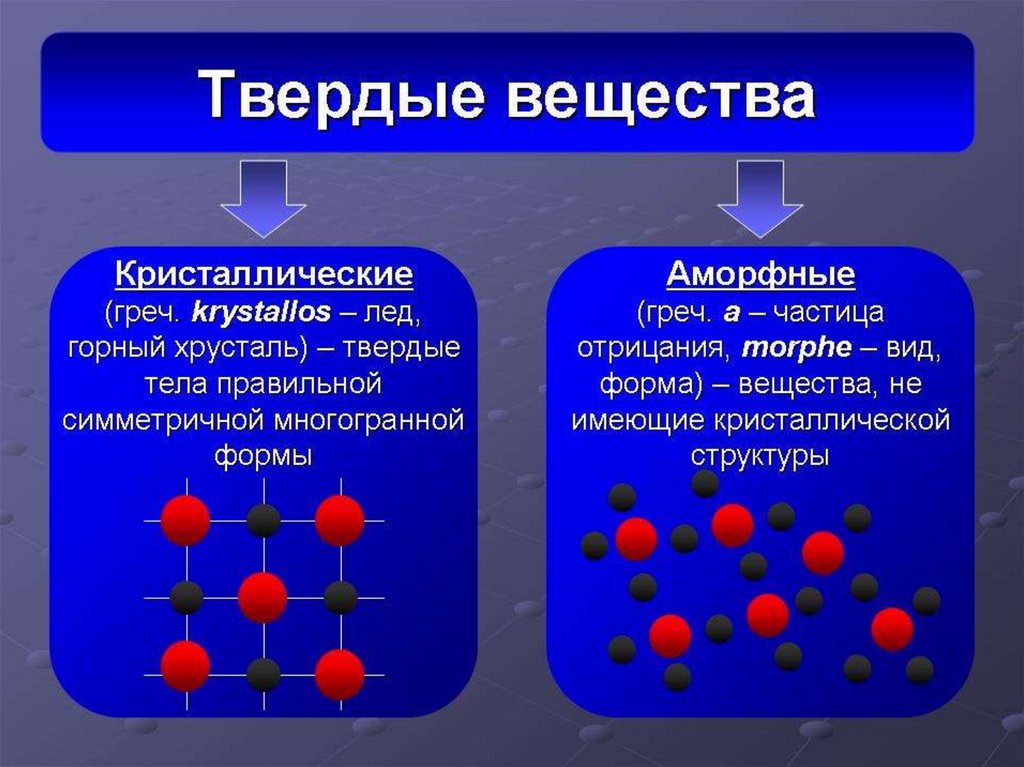
Классификация твёрдых веществ? Что такое кристаллические
вещества? Что такое аморфные вещества?
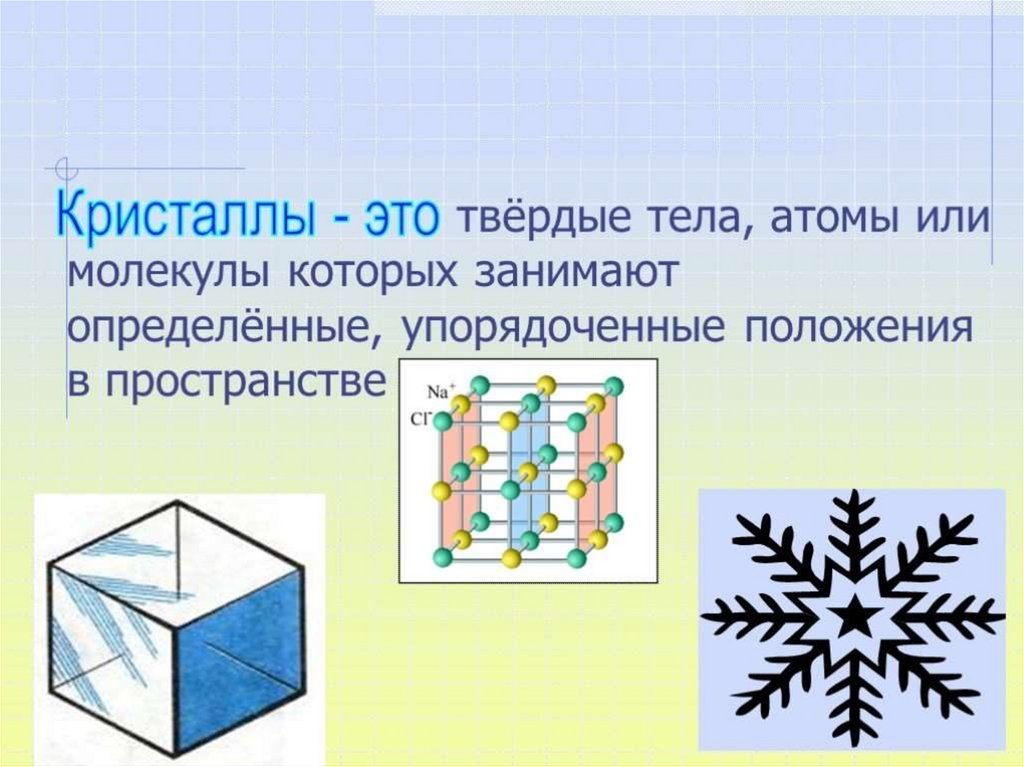
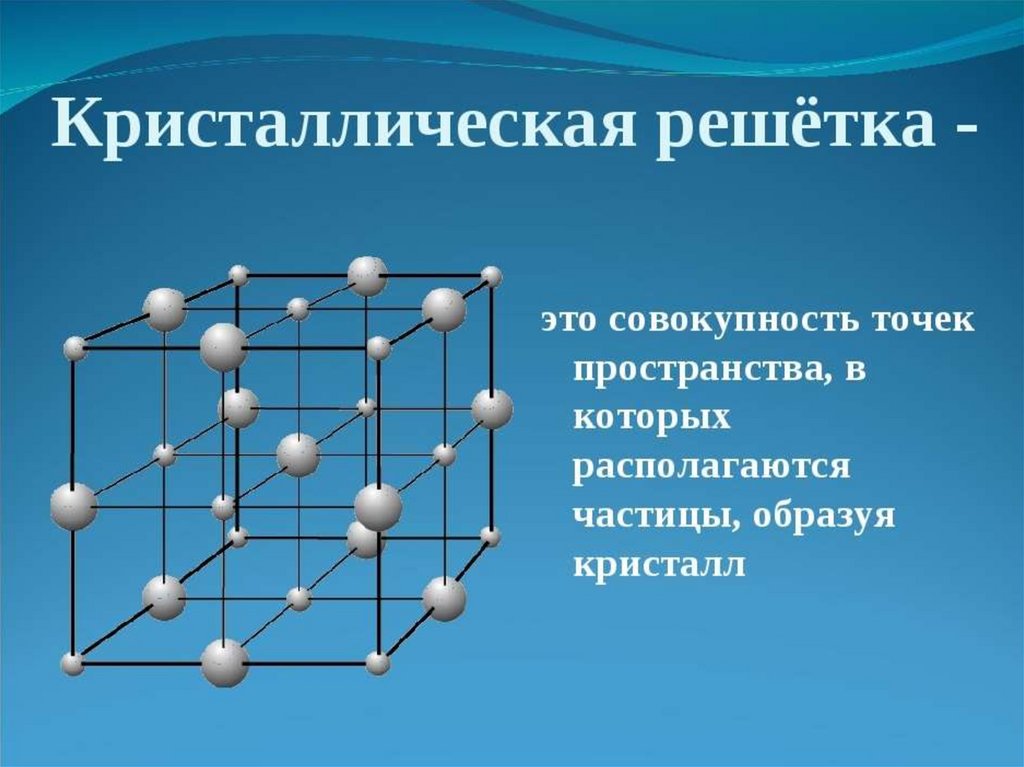
Что такое кристаллы? Что такое кристаллическая рещётка?
Типы кристаллических решёток и свойства веществ с ними?









 Химия
Химия








