Похожие презентации:
Металлы: общая характеристика
1.
2.
Химические элементы – металлы.Из 114 известных элементов –
92 относятся к металлам.
Металлы – это химические
элементы, атомы которых
отдают электроны внешнего
( предвнешнего) электронного
слоя, превращаясь в
положительные ионы (катионы).
3.
Роль металлов в истории развитиячеловечества
Семь металлов создал свет
По числу семи планет:
Медь, железо, серебро…
Дал на Космос на добро.
Злато, олово, свинец…
Сын мой, сера – их отец.
А еще ты должен знать:
Всем им ртуть – родная мать.
Самородок золота
Железный метеорит
Самородная медь
Самородок серебра
4.
Главные особенности элементовметаллов.
Малое число валентных электронов ( [1-3] ).
Сравнительно большие радиусы атомов.
Небольшие значения электроотрицательности (от 0,7 до 1,9).
Исключительно восстановительные свойства ( - свои электроны).
Некоторые химические элементы металлы обладают
двойственными свойствами (амфотерность).
5.
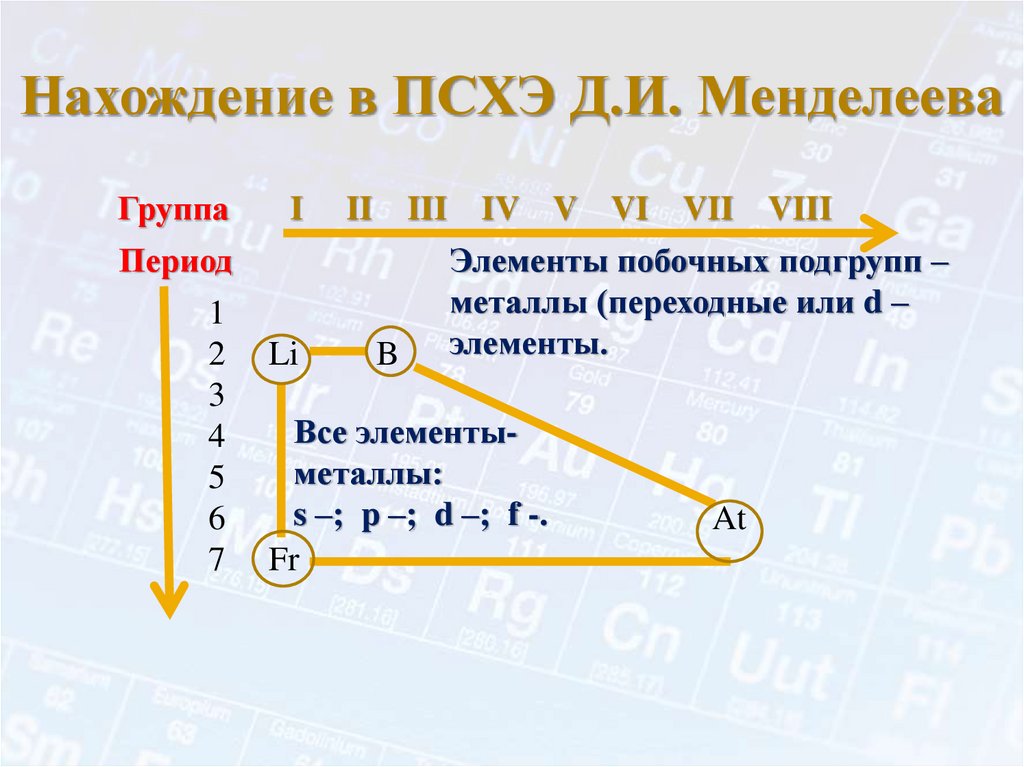
Нахождение в ПСХЭ Д.И. МенделееваГруппа
I
II
III
Период
1
2
3
4
5
6
7
Li
B
IV V VI VII VIII
Элементы побочных подгрупп –
металлы (переходные или d –
элементы.
Все элементыметаллы:
s –; p –; d –; f -.
Fr
At
6.
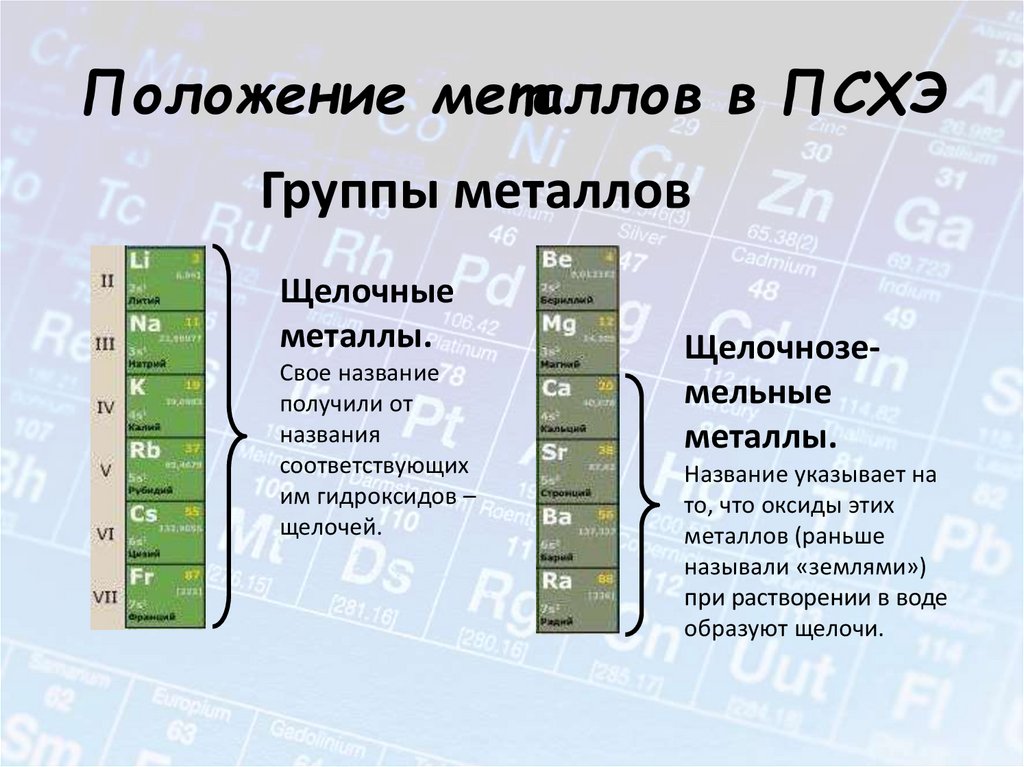
Положение металлов в ПСХЭ7.
Изменение свойств в ПСХЭ Д.И.Менделеева
В главной подгруппе
Число электронов на внешнем слое не изменяется
Радиус атома увеличивается
Электроотрицательность уменьшается
Восстановительные свойства усиливаются
Металлические свойства усиливаются
8.
Изменение свойств в ПСХЭ Д.И.Менделеева
В периоде:
Заряды ядер увеличиваются
Радиусы атомов уменьшаются
Число электронов на внешнем слое увеличивается
Электроотрицательность увеличивается
Восстановительные свойства уменьшаются
Металлические свойства ослабевают
9.
Положение металлов в ПСХЭГруппы металлов
Щелочные
металлы.
Свое название
получили от
названия
соответствующих
им гидроксидов –
щелочей.
Щелочноземельные
металлы.
Название указывает на
то, что оксиды этих
металлов (раньше
называли «землями»)
при растворении в воде
образуют щелочи.
10.
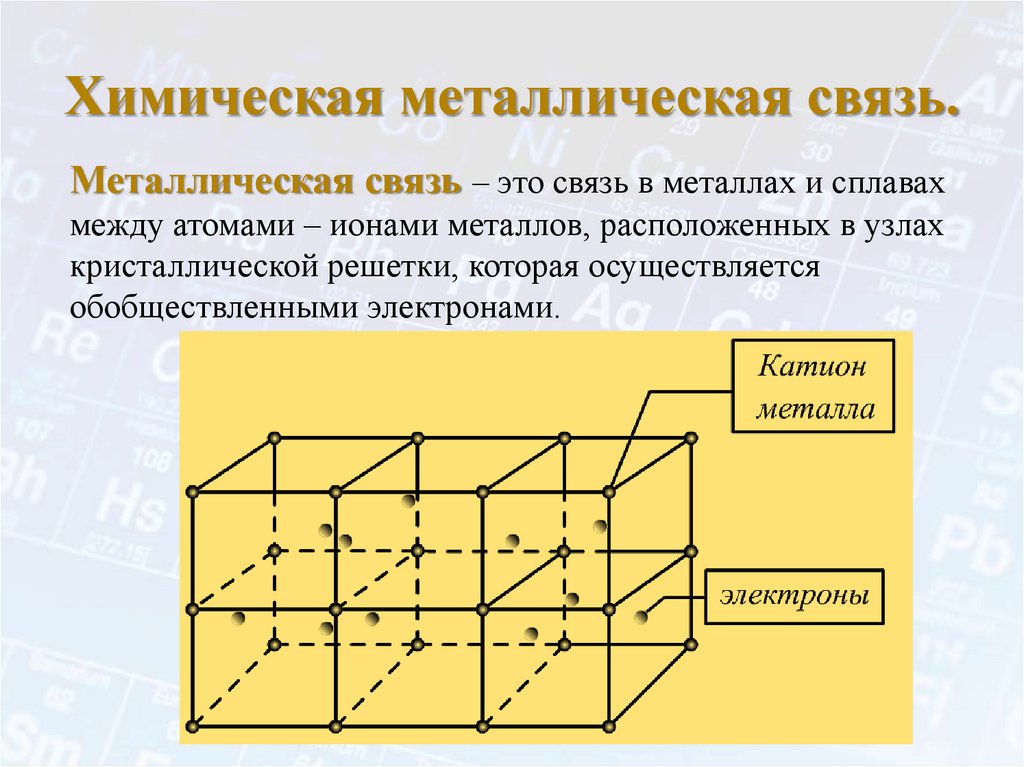
Химическая металлическая связь.Металлическая связь – это связь в металлах и сплавах
между атомами – ионами металлов, расположенных в узлах
кристаллической решетки, которая осуществляется
обобществленными электронами.
11.
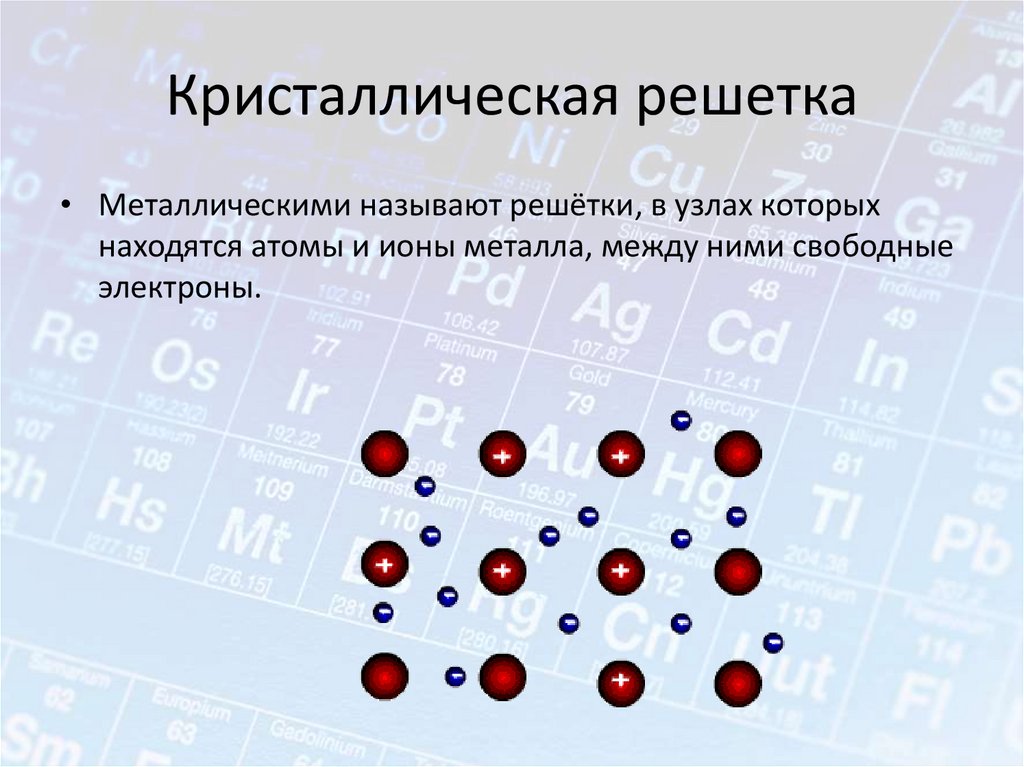
Кристаллическая решетка• Металлическими называют решётки, в узлах которых
находятся атомы и ионы металла, между ними свободные
электроны.
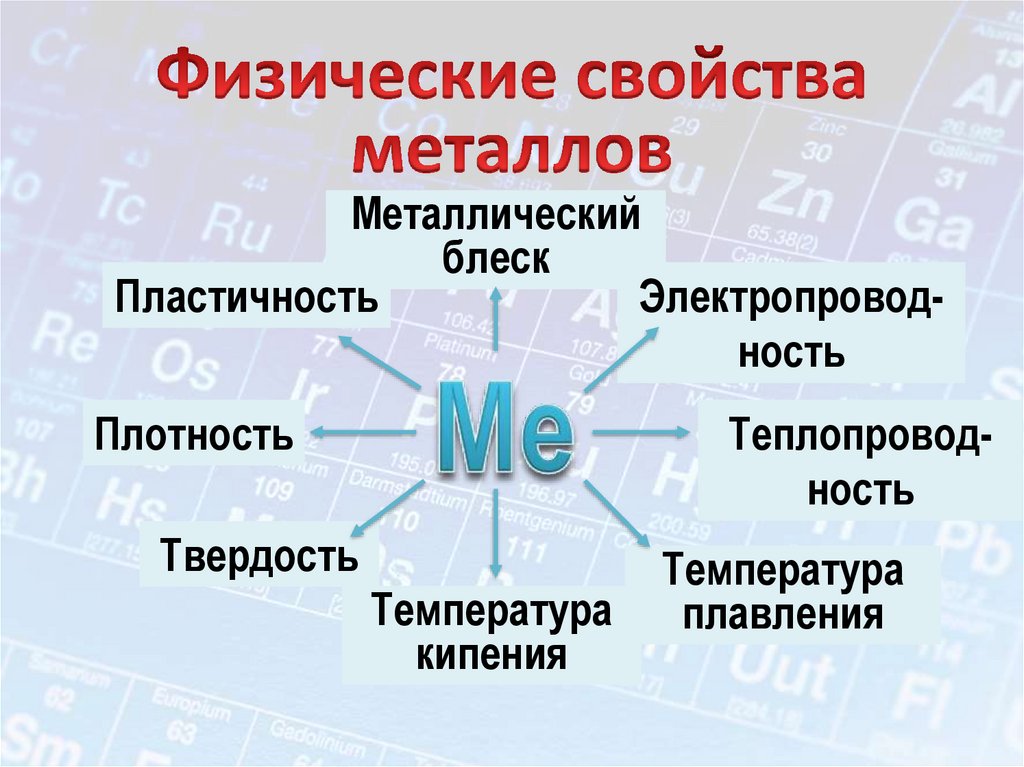
12.
Металлическийблеск
Пластичность
Электропроводность
Плотность
Теплопроводность
Твердость
Температура
кипения
Температура
плавления
13.
Металлычерные
цветные
14.
Металлылегкие
( плотность не более 5 г/см3 )
тяжелые
( плотность больше 5 г/см3 )
15.
Металлымягкие
твердые
16.
Металлылегкоплавкие
тугоплавкие
( t пл < 1539 0С )
( t пл > 1539 0С )
17.
Основные физические свойства→
+
е
→
е
Электропроводность
связана с направленным
движением электронов при
помещении
металла
в
электрическое поле.
18.
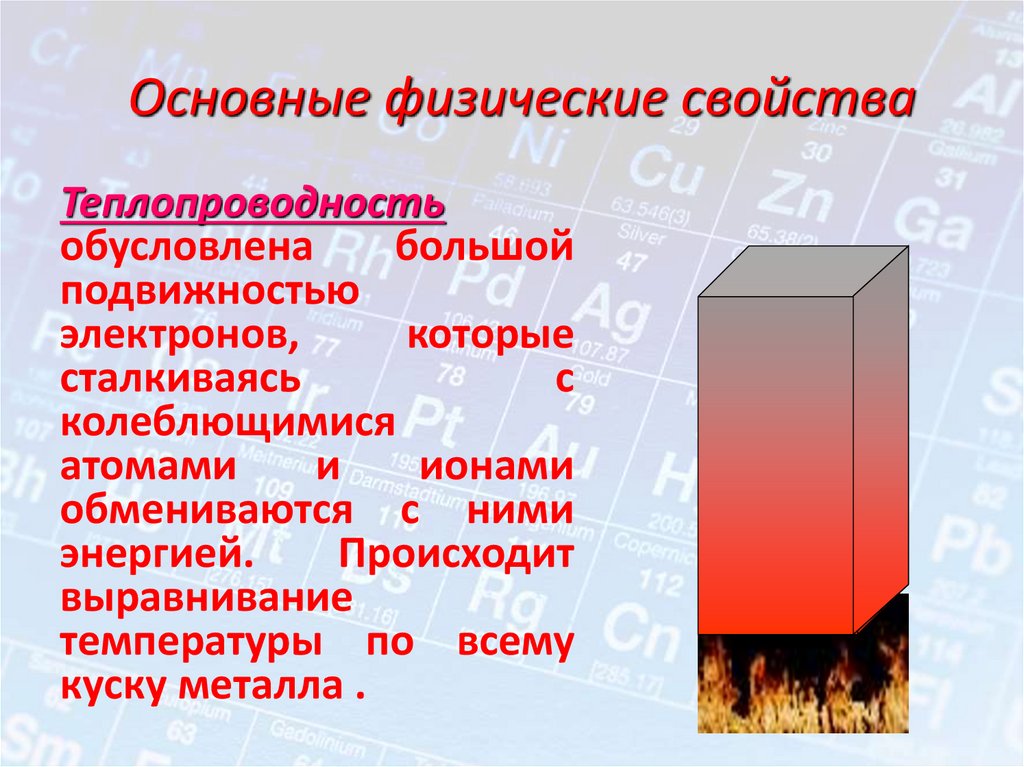
Основные физические свойстваТеплопроводность
обусловлена
большой
подвижностью
электронов,
которые
сталкиваясь
с
колеблющимися
атомами
и
ионами
обмениваются с ними
энергией.
Происходит
выравнивание
температуры по всему
куску металла .
19.
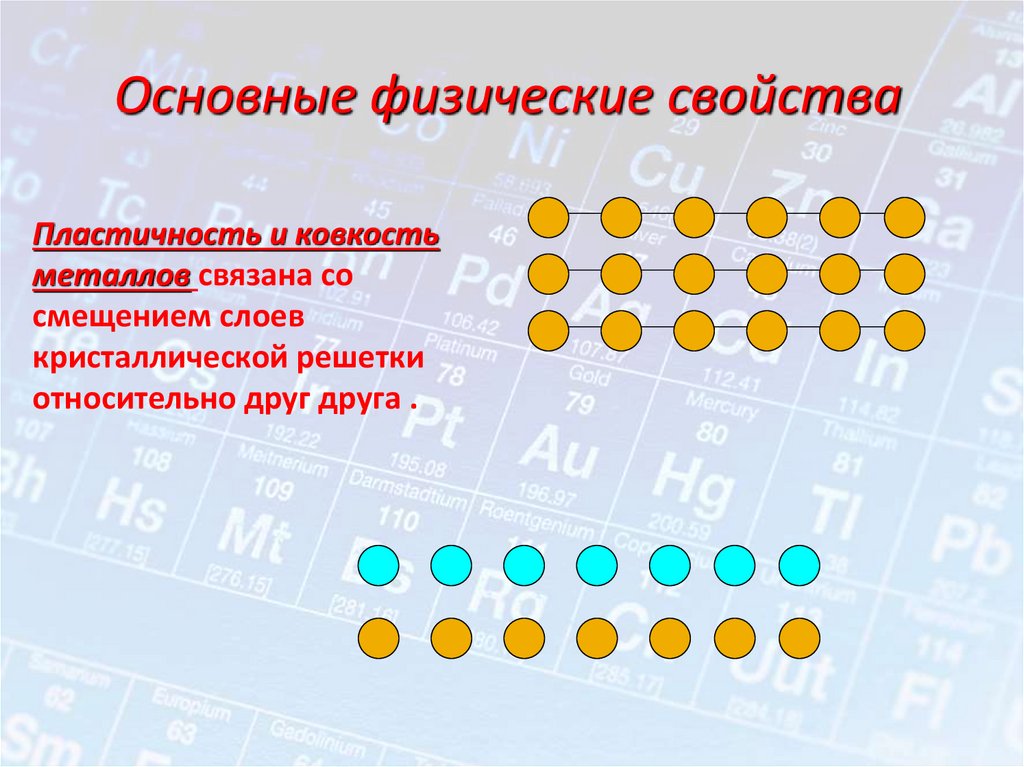
Основные физические свойстваПластичность и ковкость
металлов связана со
смещением слоев
кристаллической решетки
относительно друг друга .
20.
21.
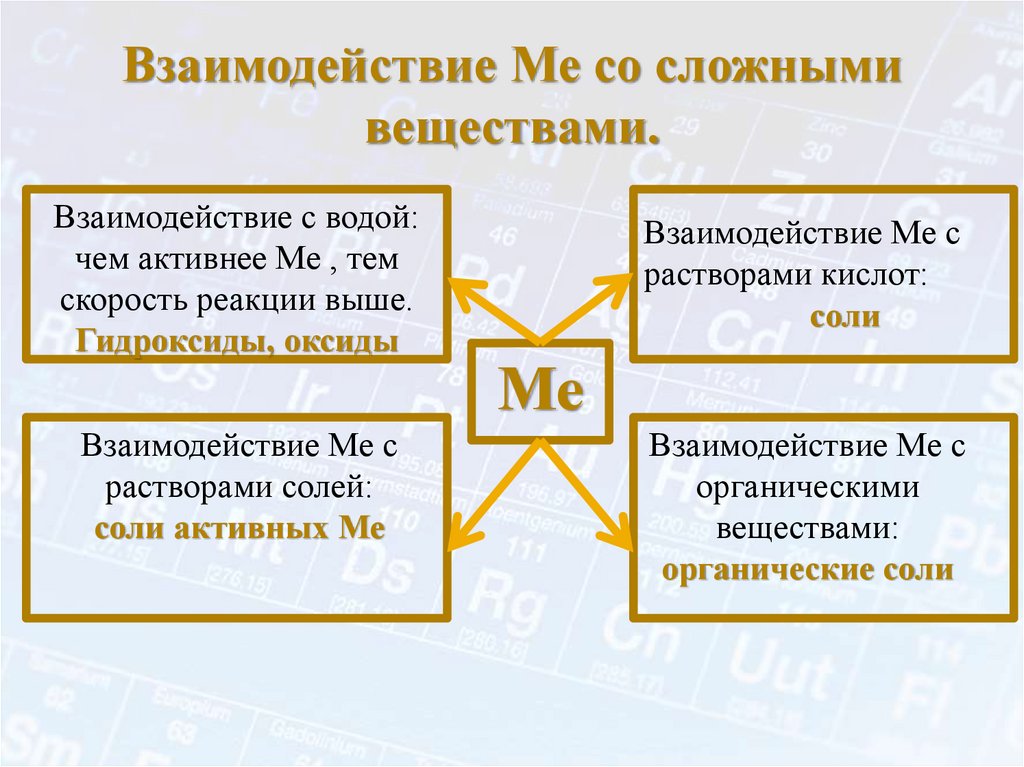
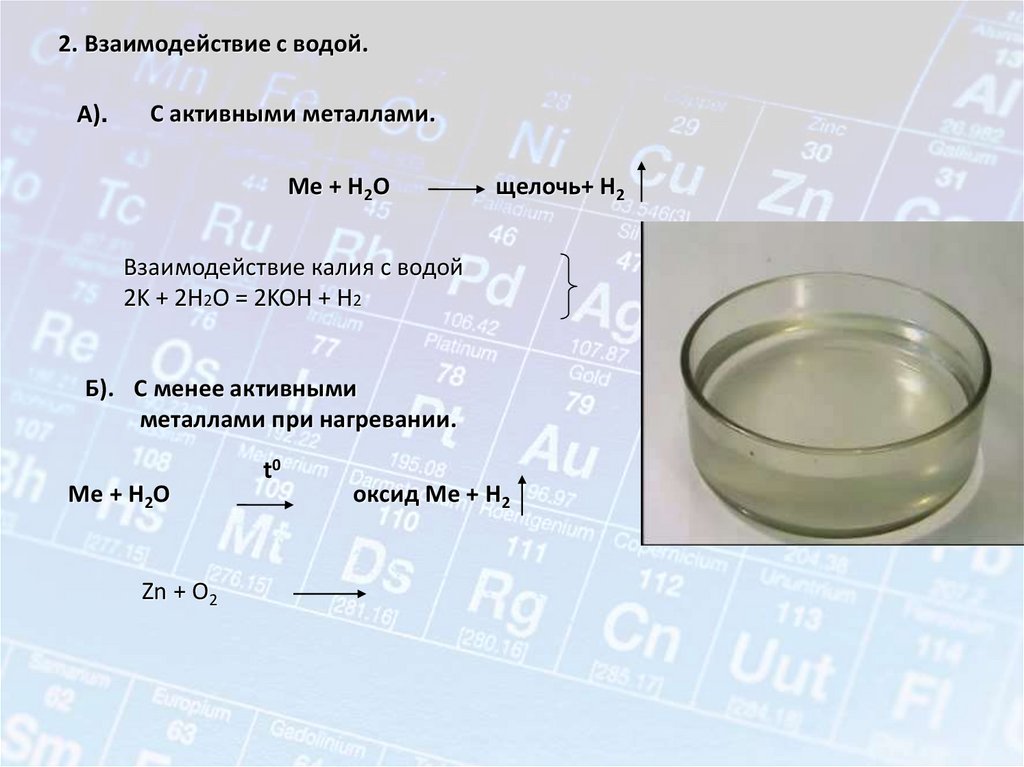
Химические свойства металлов• Основным химическим свойством металлов является
способность их атомов легко отдавать свои валентные
электроны и переходить в положительно заряженные
ионы. Типичные металлы никогда не присоединяют
электронов; их ионы всегда заряжены положительно.
22.
Металлы – простые вещества.В атомах металлов на внешнем энергетическом уровне:
1. Малое количество электронов.
2. Очень большой атомный радиус.
Способствует быстрой отдаче электронов атомом
металла в результате их взаимодействия с другими
атомами
Me° - nē
окисление
Me


































 Химия
Химия








