Похожие презентации:
Общая характеристика металлов
1.
Всероссийский конкурспрофессионального мастерства
«Лучшая учебная презентация»
Номинация «Профессиональное образование»
Презентация к уроку по теме
«Общая характеристика металлов»
Учебная презентация по дисциплине «Химия»
для специальности 34.02.01 «Сестринское дело»
Автор: Марина Александровна Павлова,
преподаватель ГАПОУ ВО «Вязниковский
технико-экономический колледж»»
Вязники, 2022
2.
Металлов много есть, но дело не в количестве:В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов
Пред египтянином, китайцем, древним греком
И каждым современным человеком!
2
3. ПЛАН ЗАНЯТИЯ
1. Положение металловв ПСХЭ
4. Металлическая
химическая связь
2. Строение атомов
металлов
5. Металлическая
кристаллическая
решётка
3. Закономерности
изменения
восстановительных
свойств в ПСХЭ
6. Общие физические
свойства металлов
7. Общие химические
свойства металлов
4. 1. Положение металлов в ПСХЭ Д.И. Менделеева
• Металлызанимают
главные
подгруппы
НИЖЕ
диагонали В - At
• Металлы
занимают
полностью все
побочные
подгруппы
ПСХЭ
• Металлов в
ПСХЭ
насчитывается
96 (из 118
химических
элементов).
4
5. 2. Строение атомов металлов
• Атомы металлов имеютсравнительно большие
атомные радиусы и
небольшое количество
электронов на внешних
энергетических уровнях
(чаще всего от 1 до 3).
• Следовательно, внешние
электроны атомов металлов
слабо связаны с ядром,
металлы их легко отдают,
проявляя в химических
реакциях
восстановительные
свойства
5
6. 3. Закономерности изменения восстановительных свойств в ПСХЭ
В группах сверхувниз:
- число электронов
на внешнем э/у не
изменяется;
- количество э/у
увеличивается,
значит
увеличивается
атомный радиус;
- связь внешних
электронов с ядром
ослабевает;
В периодах слева направо:
- число электронов на внешнем э/у увеличивается;
- количество э/у не изменяется, атомный радиус сжимается;
- связь внешних электронов с ядром усиливается;
- следовательно, восстановительные свойства
ОСЛАБЕВАЮТ
- следовательно
восстановительные
свойства
ВОЗРАСТАЮТ
7.
4. Металлическаяхимическая связь
Ме0 – ne- → Men+
• Металлическая связь - это тип связи в металлах и их сплавах между атомами
или ионами металлов и относительно свободными электронами (электронным
газом) в кристаллической решетке.
• Сущность образования металлической связи состоит в следующем: атомы
металлов отдают наружные электроны, и некоторые из них превращаются
в
положительно
заряженные
ионы.
Оторвавшиеся
от
атомов
электроны
относительно
свободно
перемещаются
между
возникшими положительными ионами металлов. Между этими частицами
возникает металлическая связь, т. е. электроны как бы цементируют
положительные ионы в металлической решетке
7
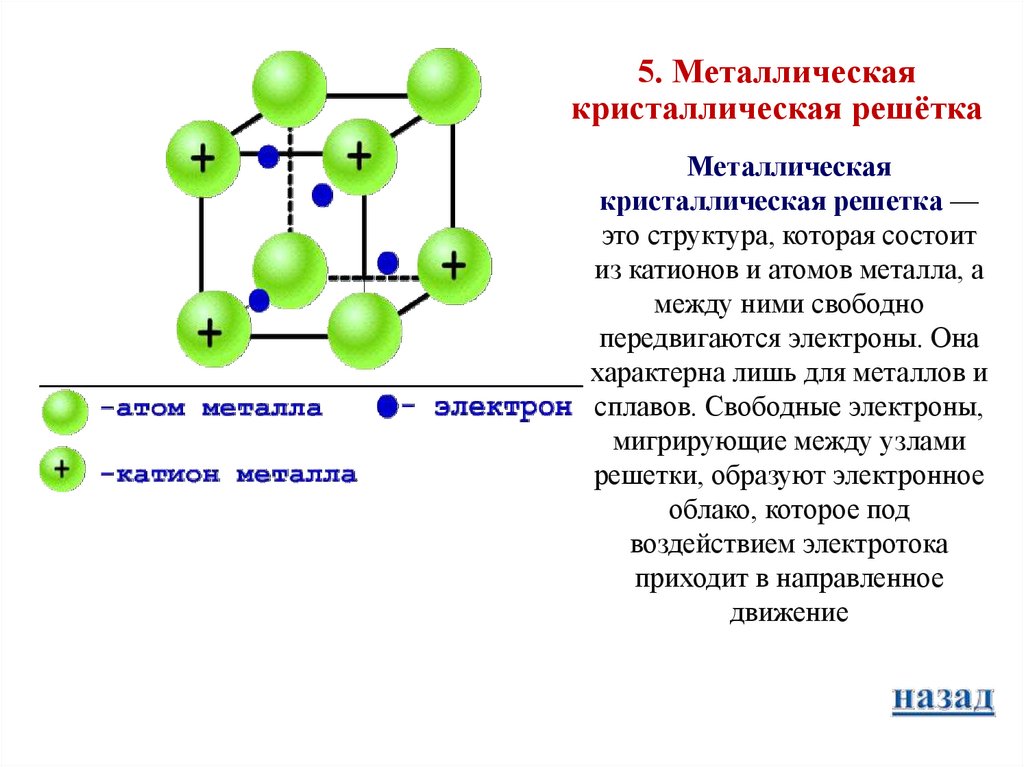
8.
5. Металлическаякристаллическая решётка
Металлическая
кристаллическая решетка —
это структура, которая состоит
из катионов и атомов металла, а
между ними свободно
передвигаются электроны. Она
характерна лишь для металлов и
сплавов. Свободные электроны,
мигрирующие между узлами
решетки, образуют электронное
облако, которое под
воздействием электротока
приходит в направленное
движение
9.
6. Общие физические свойства металловТеплопроводность
Металлический
блеск
Электропроводность
Пластичность
МЕТАЛЛЫ
Твёрдость
9
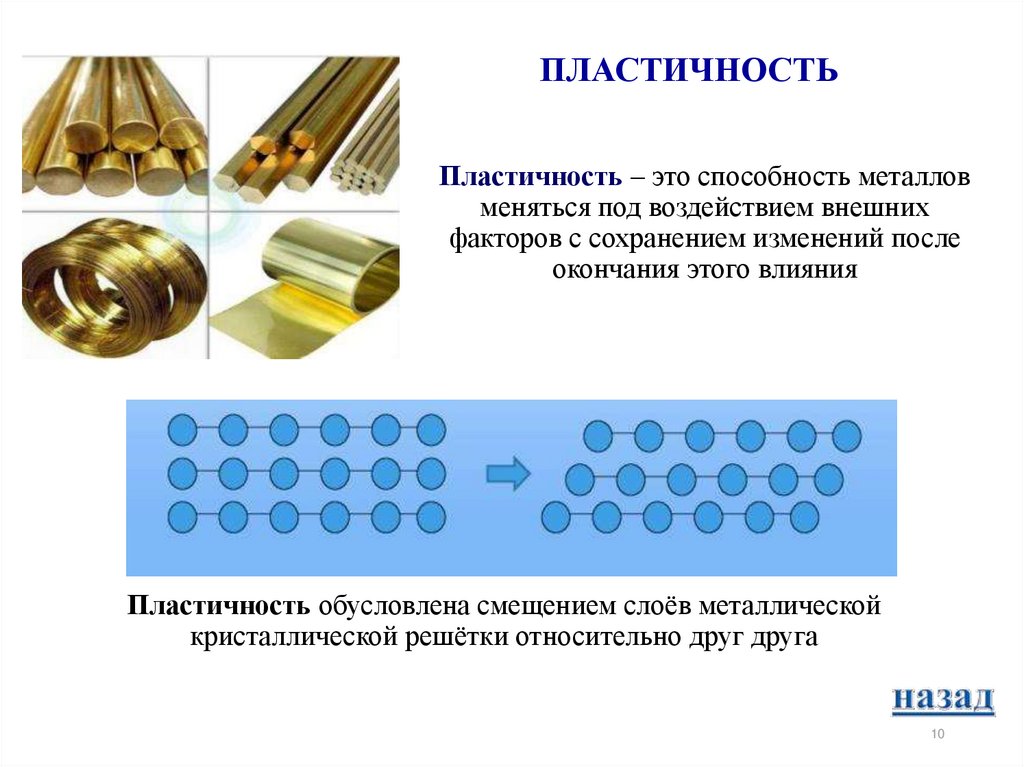
10. Пластичность – это способность металлов меняться под воздействием внешних факторов с сохранением изменений после окончания
ПЛАСТИЧНОСТЬПластичность – это способность металлов
меняться под воздействием внешних
факторов с сохранением изменений после
окончания этого влияния
Пластичность обусловлена смещением слоёв металлической
кристаллической решётки относительно друг друга
10
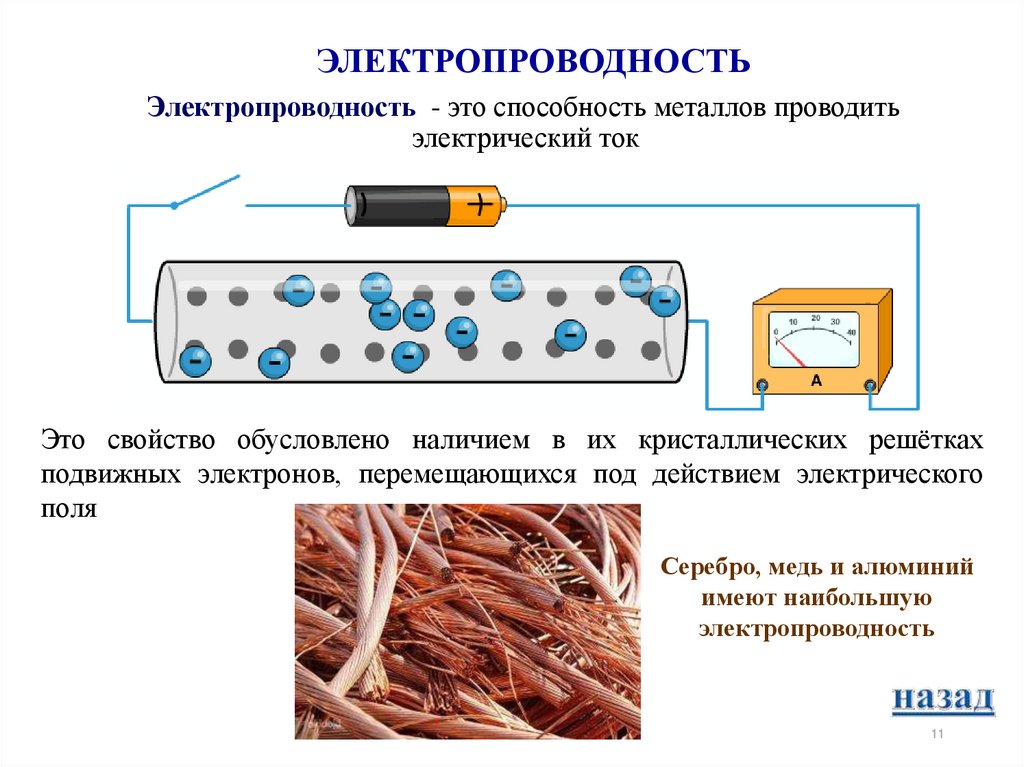
11. ЭЛЕКТРОПРОВОДНОСТЬ
Электропроводность - это способность металлов проводитьэлектрический ток
Это свойство обусловлено наличием в их кристаллических решётках
подвижных электронов, перемещающихся под действием электрического
поля
Серебро, медь и алюминий
имеют наибольшую
электропроводность
11
12. ТЕПЛОПРОВОДНОСТЬ
Под теплопроводностью металлови сплавов понимают их
способность передавать тепловую
энергию от одной точки к другой,
если между ними возникает
разница температур
Теплопроводность металлов
обусловлена в основном свободными
электронами. В результате
постоянных соударений свободных
электронов с атомами происходит
перенос избыточной энергии из
более нагретых частей твердого тела
в менее нагретые
13.
МЕТАЛЛИЧЕСКИЙБЛЕСК
Металлический блеск — это
способность металлов отражать
световые лучи
Блеск металлов
обусловлен тем, что
электроны, заполняющие
межатомное пространство
отражают световые лучи,
как зеркала, а не
пропускают как стекло
14.
ТВЁРДОСТЬВсе металлы, кроме ртути при нормальных условиях находятся в твёрдом
состоянии, однако обладают различной твёрдостью
Самые мягкие металлы –
щелочные: Cs, Rb, K, Na, Li и
пр. (режутся ножом)
Самые твёрдые металлы –
металлы VI В группы: Cr
(царапает стекло), W, Mo и пр.
Хром
15.
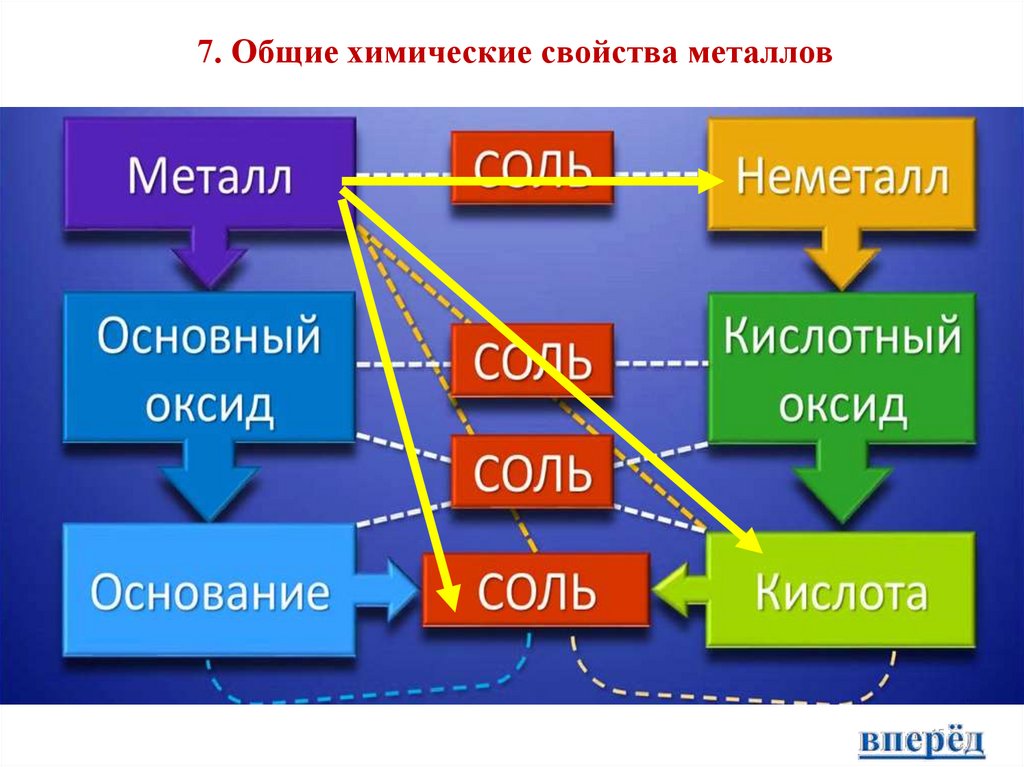
7. Общие химические свойства металлов15
16.
Посмотри видео (нажми в центр слайда)Источник: https://www.youtube.com/watch?v=qwLFyRqGC3Q&t=277s
17.
ПРОВЕРЬ СЕБЯ1. Верны ли следующие суждения о металлах: А) В периоде с увеличением заряда ядра
металлические свойства ослабевают; Б) Все металлы при комнатной температуре являются
твердыми.
а) верно только А б) верно только Б в) верны оба суждения г) оба суждения не верны.
2. Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
а) изменяется периодически б) не изменяется в) увеличивается г) уменьшается.
3. Ряд наименее активных металлов:
а) Rb, Ba, Ag
б) Li, Cs, Fe
в) Сu, Hg, Ag
г) Na, K, Cs
4. Для металлов характерен вид связи:
а) атомная; б) ионная; в) металлическая
5. Наиболее твёрдый металл:
а) алюминий; б) медь; в) хром; г) олово
6. Выберите только верные утверждения:
A. Радиус атомов у металлов меньше, чем у неметаллов
B. Активность металлов возрастает с ростом радиуса атома
C. Активность металлов в периоде возрастает слева направо
D. Калий активнее, чем натрий
E. Атомы металлов способны как отдавать наружные электроны, так и принимать чужие
F. В группах активность металлов возрастает снизу вверх
G. Самый активный восстановитель – это литий
H. Все металлы теплопроводны и электропроводны
7. Расставьте металлы в порядке увеличения их металлических и восстановительных свойств:
Na, Rb, Li, Cs, Fr, K
17
18.
ПРОВЕРЬ СЕБЯ1. Верны ли следующие суждения о металлах: А) В периоде с увеличением заряда ядра
металлические свойства ослабевают; Б) Все металлы при комнатной температуре являются
твердыми.
а) верно только А б) верно только Б в) верны оба суждения г) оба суждения не верны.
2. Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
а) изменяется периодически б) не изменяется в) увеличивается г) уменьшается.
3. Ряд наименее активных металлов:
а) Rb, Ba, Ag
б) Li, Cs, Fe
в) Сu, Hg, Ag
г) Na, K, Cs
4. Для металлов характерен вид связи:
а) атомная; б) ионная; в) металлическая
5. Наиболее твёрдый металл:
а) алюминий; б) медь; в) хром; г) олово
6. Выберите только верные утверждения:
A. Радиус атомов у металлов меньше, чем у неметаллов
B. Активность металлов возрастает с ростом радиуса атома
C. Активность металлов в периоде возрастает слева направо
D. Калий активнее, чем натрий
E. Атомы металлов способны как отдавать наружные электроны, так и принимать чужие
F. В группах активность металлов возрастает снизу вверх
G. Самый активный восстановитель – это литий
H. Все металлы теплопроводны и электропроводны
7. Расставьте металлы в порядке увеличения их металлических и восстановительных свойств:
Na, Rb, Li, Cs, Fr, K (Li, Na, K, Rb, Cs, Fr)
18
19.
ОЦЕНИ СВОЁ НАСТРОЕНИЕ ПО ОКОНЧАНИЮРАБОТЫ
19















 Химия
Химия








