Похожие презентации:
Аналитическая химия. Тема 1. Идентификация ионов элементов в растворах
1.
Аналитическая химияЛекции 1-2
1. Идентификация ионов
элементов в растворах
2. Применение химического
равновесия в аналитической
химии
Ст. преп. каф. аналит. химии ФГБОУ ВО РХТУ им. Д.И. Менделеева
Шалимова Елизавета Георгиевна
2.
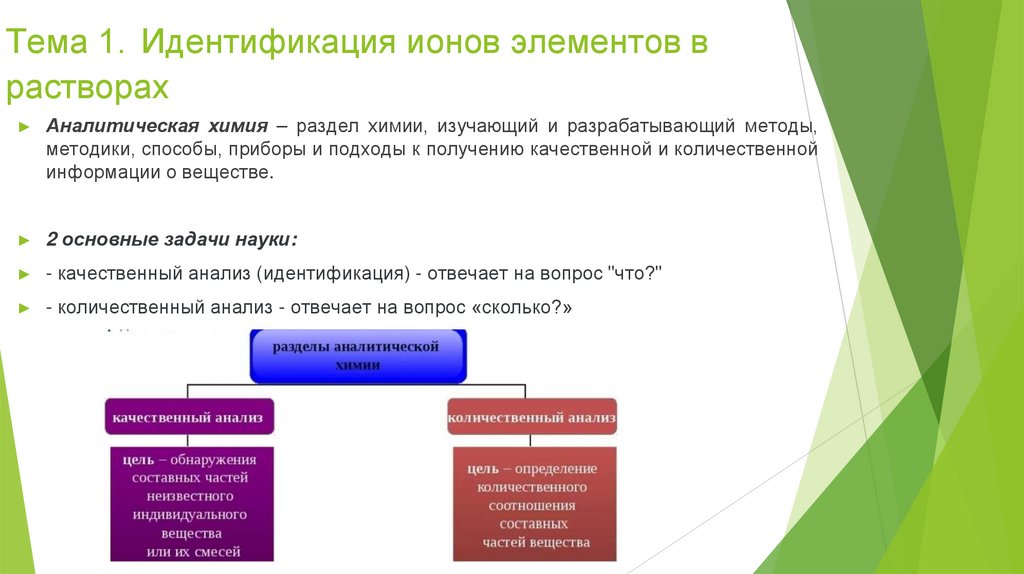
Тема 1. Идентификация ионов элементов врастворах
Аналитическая химия – раздел химии, изучающий и разрабатывающий методы,
методики, способы, приборы и подходы к получению качественной и количественной
информации о веществе.
2 основные задачи науки:
- качественный анализ (идентификация) - отвечает на вопрос "что?"
- количественный анализ - отвечает на вопрос «сколько?»
3.
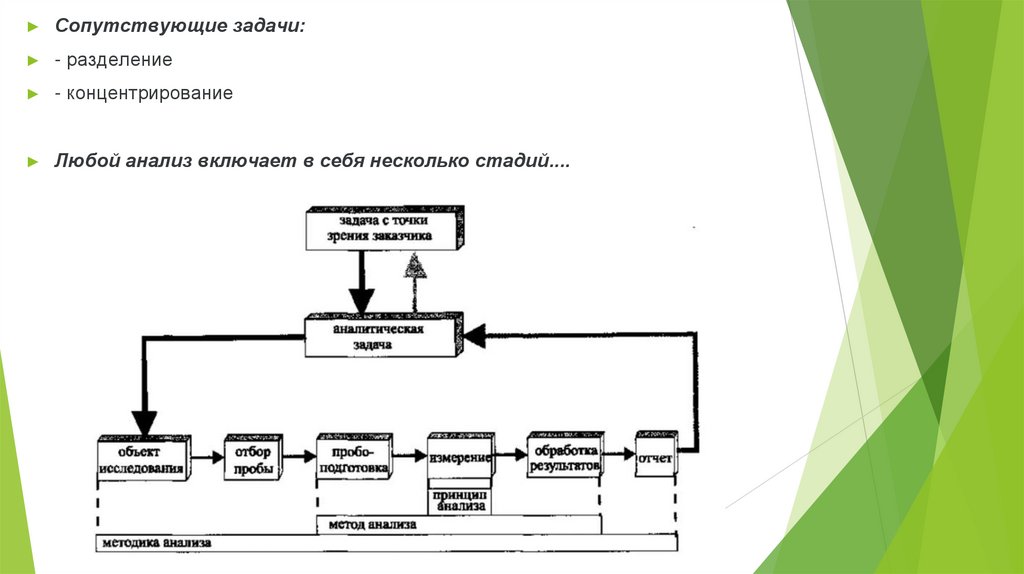
Сопутствующие задачи:
- разделение
- концентрирование
Любой анализ включает в себя несколько стадий....
4.
Различия методов и методик. Слова похожие, а значения??????
Метод - совокупность принципов, положенных в основу анализа, безотносительно
объекта исследования
Методика - подробное описание всех операций и условий проведения анализа для
конкретного объекта конкретным методом
Классификация методов анализа
Методы бывают:
1 Соответствующие целям исследования
- качественный
- количественный
2 Соответствующие разделам области науки:
- химические
- физические
- физико-химические
- биологические
- биохимические
5.
3. По природе исследуемых частиц
- фазовый анализ
- функциональный анализ
- изотопный анализ
- элементный
-молекулярный
4. По количеству содержащегося вещества
Вид анализа и
техника выполнения
МакроПолумикроМикроСубмикроУльтрамикро-
Масса пробы, г
Объём раствора, мл
> 0.1
10 - 103
0.01 – 0.1
0.1 - 10
< 0.01
0.01 - 1
10-4 – 10-3
< 10-2
< 10-4
< 10-3
6.
5. По воздействию на объект
-разрушающий
-неразрушающий
6. В соответствии с процедурой измерения количества объекта
- весовой
- титриметрический
7.
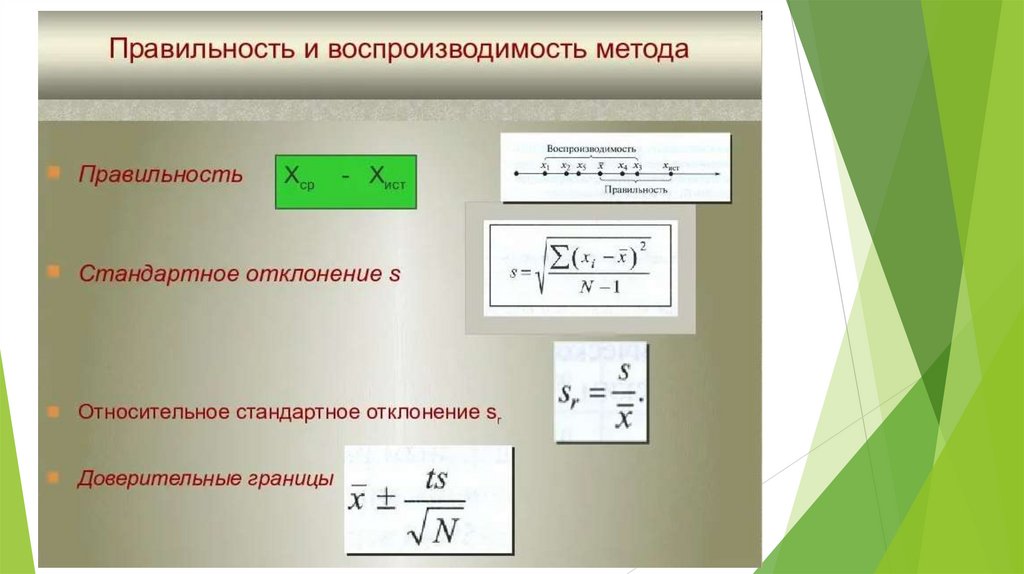
Требования к методам анализа-
- Правильность (характеризует близость эксперементальных и истинных значений
определяемой величины)
-
- Воспроизводимость (характеризует степень разброса параллельных
определений, отражает случайные ошибки измерения)
-
- Точность (гибрид правильности и воспроизводительности)
-
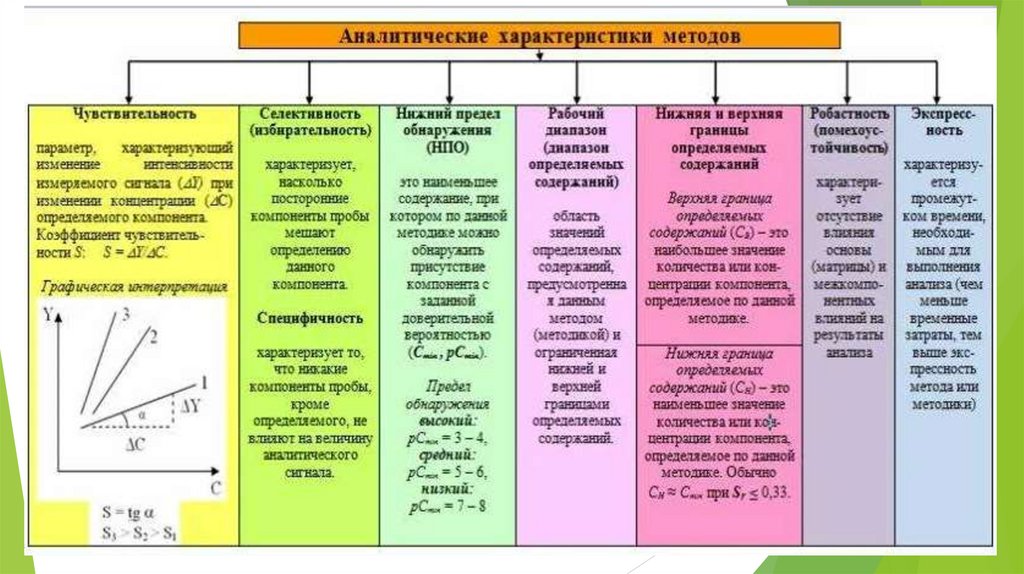
- Предел обнаружения (наименьшее содержание вещества, которое можно
обнаружить по заданной методике с заданной вероятностью)
-
- Чувствительность (возможность открывать какой-либо компонент смеси с
определенной его концентрации. Характеризуется количественными параметрами:
пределом обнаружения, открываемым минимумом, предельным разбавлением.
Реакция тем более чувствительна, чем меньшее количество вещества удается
обнаружить с ее помощью. )
-
- Селективность (избирательность) (возможность реактива взаимодействовать
лишь с несколькими ионами (1-2) раствора в сложной смеси)
8.
- экспрессность
- простота
- экономичность
- возможность автоматизации
► Большинство методик как качественного, так и
количественного анализа используют понятие
«химическая аналитическая реакция» и
«качественная химическая реакция»
Химическая аналитическая реакция - реакция, сопровождающаяся каким-либо
аналитическим эффектом, который заметен визуально или инструментально, как
для качественного, так и для количественного анализа, при этом аналитической
реакцией считается реакция, в которой открываемый минимум m ≤ 50 мкг
Качественная химическая реакция -реакция, обладающая каким-либо
аналитическим эффектом, использующаяся для качественного анализа
9.
10.
11.
12.
► Аналитический сигнал и его синонимыАналитический сигнал – физико-химическая величина, функционально связанная
с концентрацией.
Аналитический эффект - визуально или инструментально заметный эффект
протекания химической аналитической реакции
Аналитическая форма – продукт реакции, имеющий определенные свойства,
заметные визуально или инструментально
Примеры аналитических эффектов:
1) выпадение или растворение осадка
Al3+ + 3 OH- → Al(OH)3↓
Al(OH)3↓ + OH- → [Al(OH)4]-
2)выделение газа со специфическими свойствами
S2- + 2 H+ → H2S↑
3) изменение цвета раствора
Fe3+ + n SCN- → [Fe(SCN)n]3-n
13.
4) образование кристаллов соответствующих вида, формы и цвета и изучение их
морфологии под микроскопом (микрокристаллоскопическая реакция)
5) окраска пламени в характерный цвет в присутствии того или иного элемента
6) Образование окрашенных перлов с тетраборатом натрия (например Co(BO2)2)
7) Специфические инструментальные методы
14.
Предел обнаружения, чувствительность и ихсинонимы
Предельное разбавление (объем раствора с предельной концентрацией, в котором
содержится 1 г определяемого вещества, измеряется в мл/г, минимальный
возможный объем - 1 капля раствора)
Сmin= 1/Gпред
Открываемый минимум (наименьшее количество определяемого вещества,
дающее положительный результат при действии данного реактива)
Сmin= 1 : Gпред =(1: (V[мл]/m[мкг]))*106
15.
Селективность (избирательность) и еёсинонимы, пути достижения
Специфичность (вариант селективности, где возможность реагировать
проявляется лишь с 1 определяемым веществом)
► Важно запомнить!!!!! Ни селективности, ни специфичности
в чистом виде не бывает. Эти свойства проявляются лишь
в определенных условиях
Какие условия можно регулировать для достижения результата:
1) температура
Cl- + Ag+→ AgCl
2 Cl- + Pb2+ → PbCl2
2) соотношение реагентов
K+ + Na3[Co(NO2)6] → KNa2[Co(NO2)6]↓ + Na+
2 K+ + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2 Na+
16.
3) рН раствора
K+ + Na3[Co(NO2)6] → KNa2[Co(NO2)6] ↓ + Na+ (рН 3-7) СН3СООН
Na3[Co(NO2)6] + 3 Н+→ Н3[Co(NO2)6] + 3 Na+ (рН < 3)
Na3[Co(NO2)6] + 3 OН-→ CoO(OH)↓ + 6 NO2- + 3 Na+ + H2O (рН> 7)
4) присутствие мешающих ионов
NH4+ + Na3[Co(NO2)6] → NH4 Na2[Co(NO2)6] ↓ + Na+
5) присутствие окислителей и восстановителей
2 HI + 2 Na3[Co(NO2)6] → I2 + 2 Co(NO2)2 + 6 NaNO2 + 2 HNO2
Маскирование
Устранение мешающего действия ионов в сложной смеси без предварительного
разделения за счет различных термодинамических или кинетических свойств
присутствующих совместно в одном растворе ионов (образование мешающим
ионом бесцветного комплексного соединения)
Fe3+ + 3 SCN- → Fe(SCN)3 ярко-красный
Co2+ + 4 SCN- → [Co(SCN)4]- синий
Fe3+ + 6 F- → [FeF6]3- бесцветный
17.
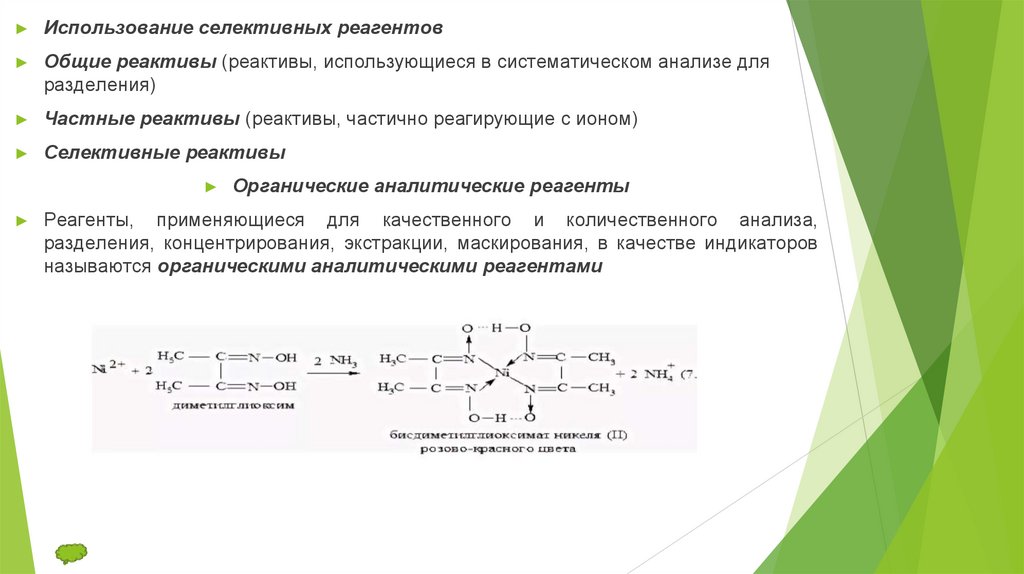
Использование селективных реагентов
Общие реактивы (реактивы, использующиеся в систематическом анализе для
разделения)
Частные реактивы (реактивы, частично реагирующие с ионом)
Селективные реактивы
Органические аналитические реагенты
Реагенты, применяющиеся для качественного и количественного анализа,
разделения, концентрирования, экстракции, маскирования, в качестве индикаторов
называются органическими аналитическими реагентами
18.
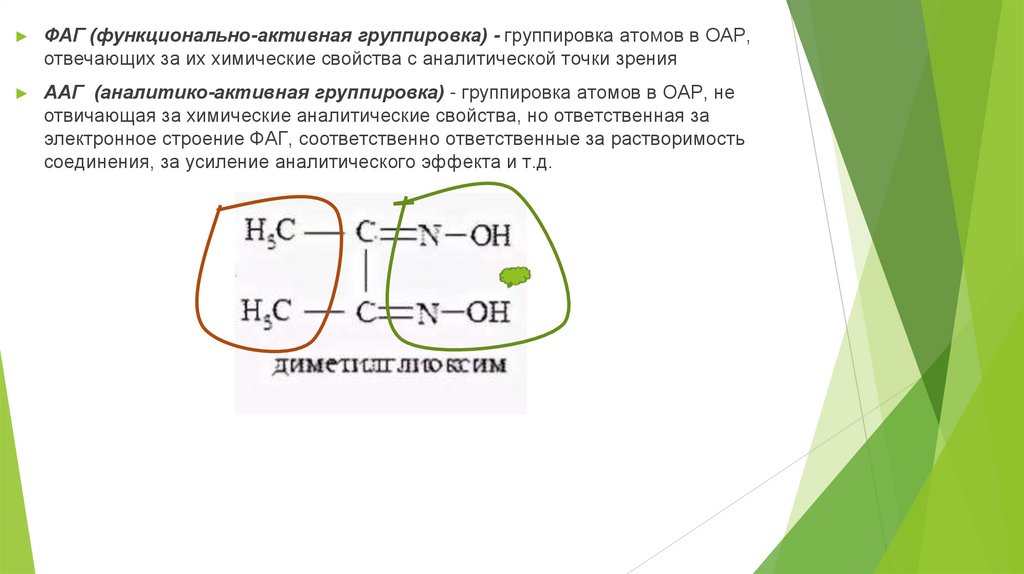
ФАГ (функционально-активная группировка) - группировка атомов в ОАР,
отвечающих за их химические свойства с аналитической точки зрения
ААГ (аналитико-активная группировка) - группировка атомов в ОАР, не
отвичающая за химические аналитические свойства, но ответственная за
электронное строение ФАГ, соответственно ответственные за растворимость
соединения, за усиление аналитического эффекта и т.д.
19.
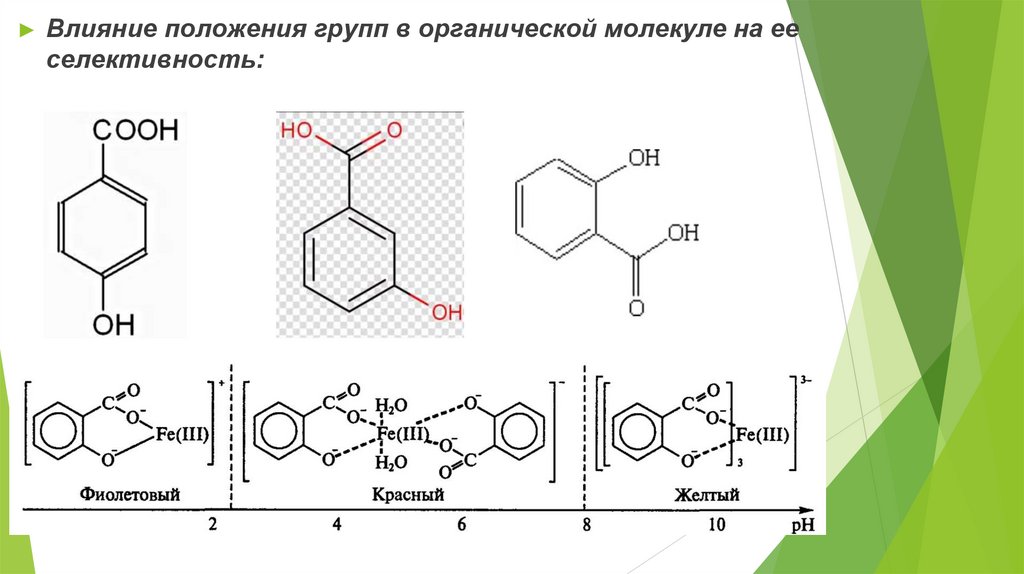
► Влияние положения групп в органической молекуле на ееселективность:
20.
► Гипотеза аналогийГипотиза В.И. Кузнецова, соотносившего свойства, реакционную способность,
условия взаимодействия между органическими аналитическими реагентами и
простейшими неорганическими.
Пример: -ОН (ОАР) соотносится с Н2О, -NH2 ( и пр. азотсодержащие ОАР)
соотносятся с NH3, -SH (ОАР) соотносится с H2S
Условия взаимодействия между органическим реагентом и ионом металла
идентичны условиям, в которых проходила реакция с подобным неорганическим
реагентом.
Исключения: условия взаимодействия упомянуты лишь относительно гидролиза и
подобных взаимодействий с органическими реагентами
21.
Систематический анализ - анализ, путем последовательного выделения
отдельных аналитических групп и последуещего открытия каждого иона в каждой
отдельной группе, порядок реакций строго определен.
Дробный анализ - анализ, путем проведения отдельных реакций в каждой
отдельно взятых порциях раствора с помощью селективных и специфических
реагентов
Cu2+, Zn2+
Cu2+ + 2 OH- → Cu(OH)2↓
Zn2+ + 4 OH- → [Zn(OH)4]2-
Cu(OH)2↓ + 2 H+ → Cu2+ + 2 H2O
2 Cu2+ + K4[Fe(CN)6] → Cu2[Fe(CN)6]↓ + 4 K+
[Zn(OH)4]2- + 4 H+ → Zn2+ + 4 H2O
3 Zn2+ + 2 K4[Fe(CN)6] →t→ K2 Zn3[Fe(CN)6]2↓ + 6 K+
22.
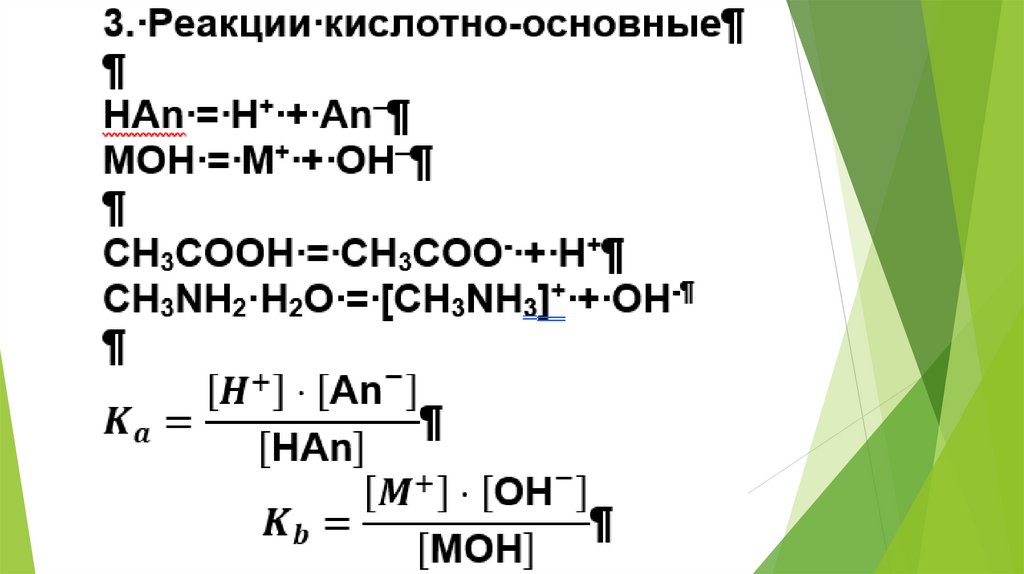
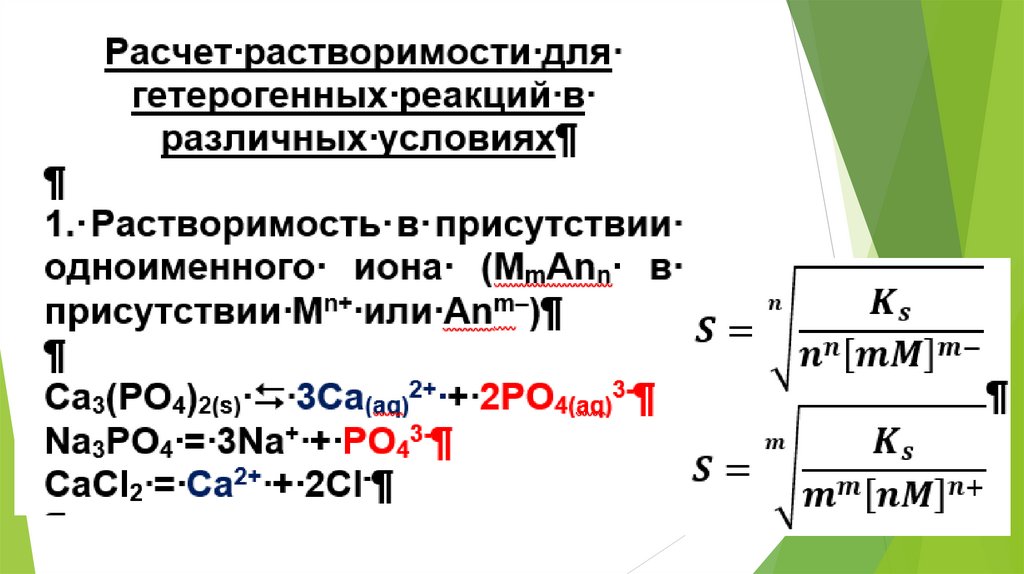
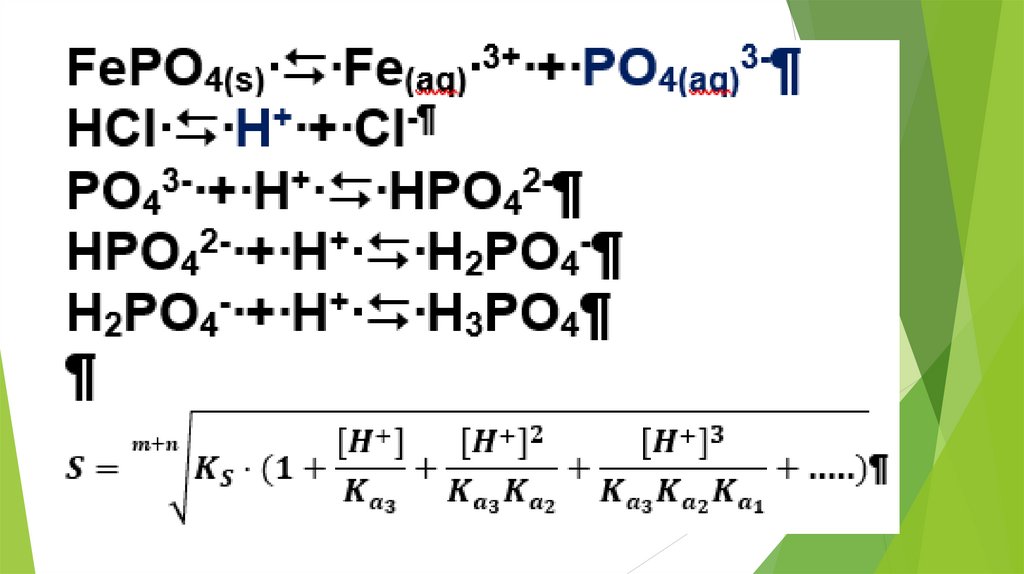
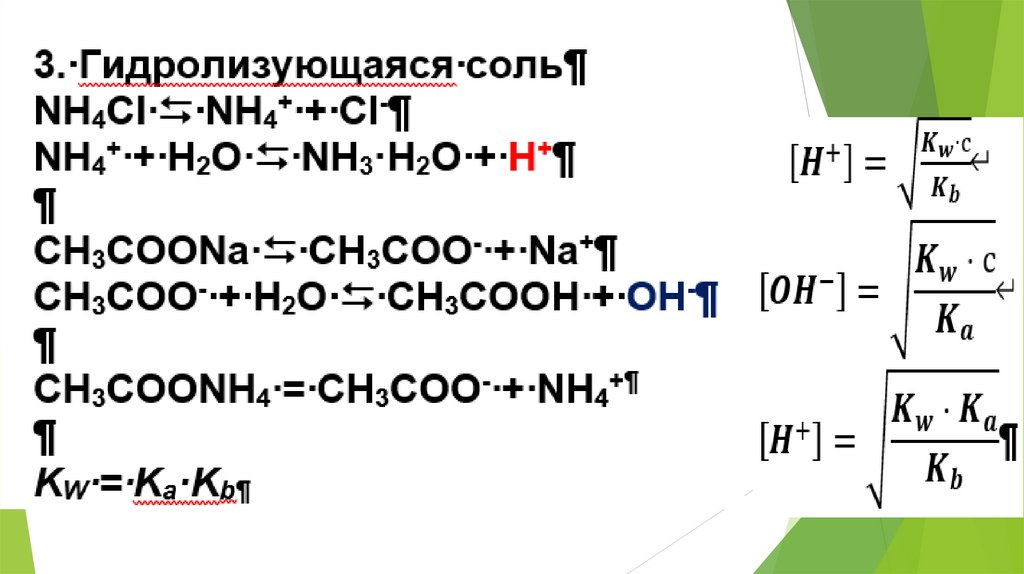
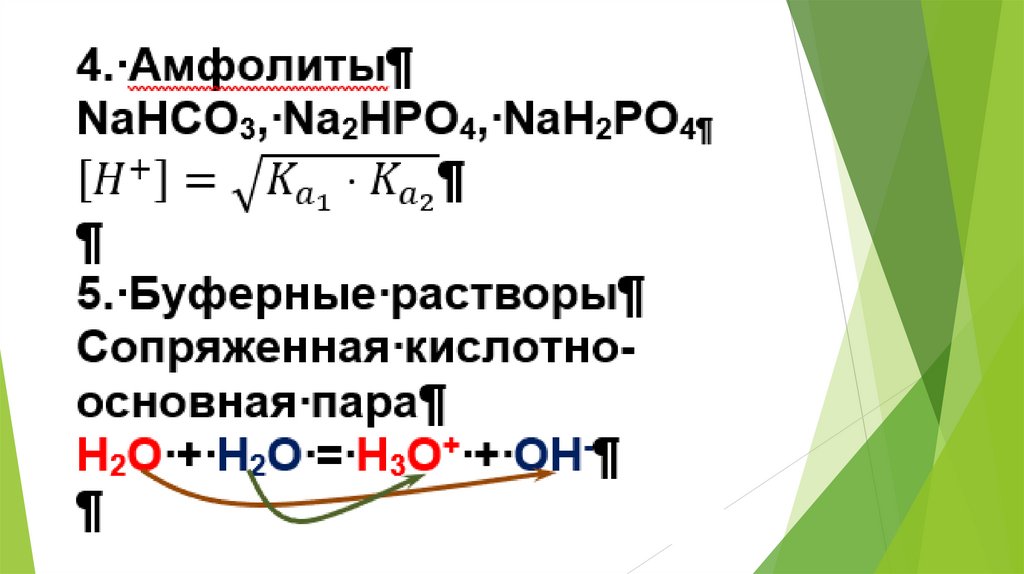
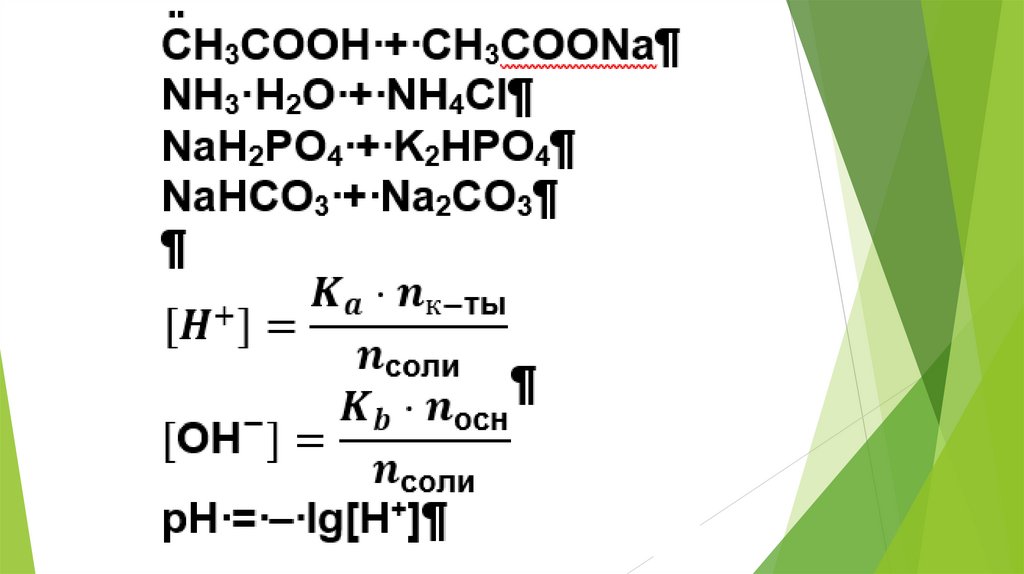
2. Использование равновесных процессовв аналитической химии
23.
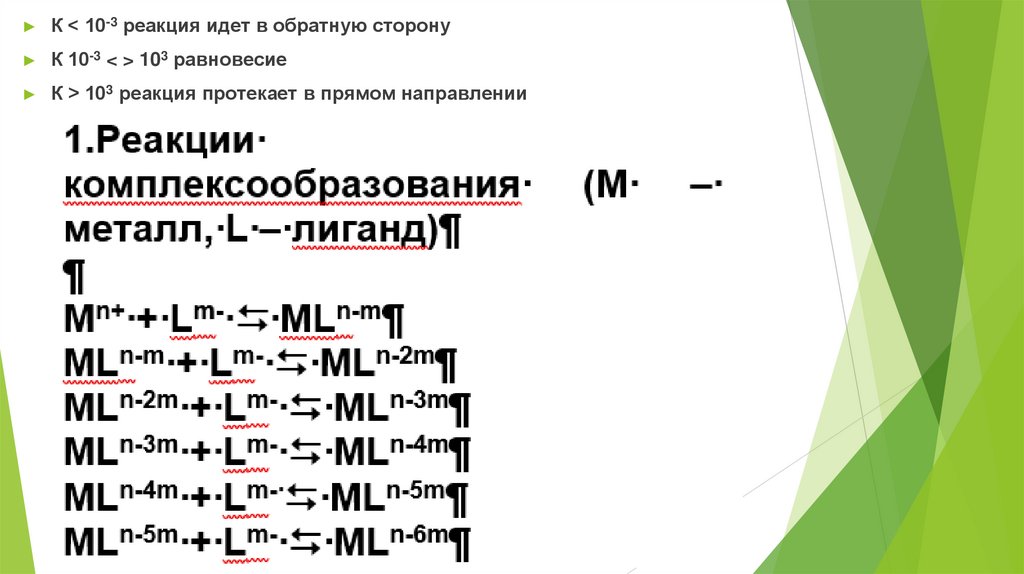
К < 10-3 реакция идет в обратную сторону
К 10-3 < > 103 равновесие
К > 103 реакция протекает в прямом направлении
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
Тестhttps://h5p.org/node/1071064




















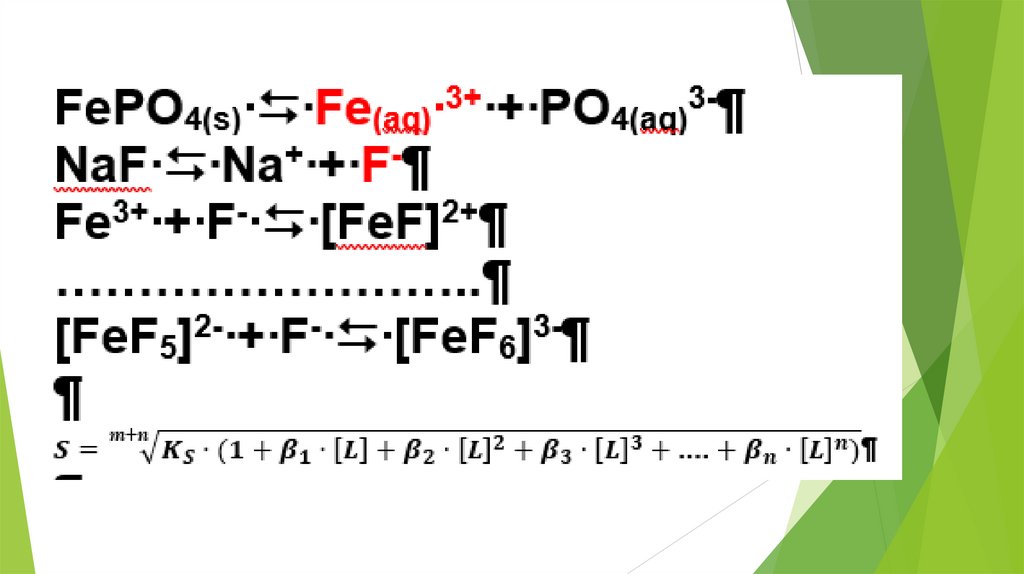





 Химия
Химия








