Похожие презентации:
Качественные реакции на ионы в растворах
1.
Качественные реакции на ионы врастворах
Выполнил: Ученик МАОУ"СОШ№31"
Лидановский Егор
Научный руководитель – Федоров Р.А.
2.
Содержание1.Введение……………………………………………………………….3
2.Цели и задачи…………………………………………………………4
3.Основная часть
Раздел 1. Явление растворения и электролитической диссоциации в растворах…………….5
Раздел 2. Условия протекания реакции в растворе…………………..6
Раздел 3.Характеристика аналитических реакций :
способы и условия их выполнения……………………………………7-8
Раздел 4. Классификация ионов…………………………………….9-11
Раздел 5. Выявление и проведение качественных реакций на
ионы…………………………………………………………………..11-19
4.Заключение…………………………………………………………...20
5.Вывод. Алгоритм анализа неизвестного в-ва………………...20-22
6.Итоговая таблица………………………………………………...23-24
7.Приложение……………………………………………………….25-33
8.Список используемой литературы и источников……………………………………………………………...34
3.
Цели и задачиЦель - расширение знаний в области химии растворов, определение ионов при помощи качественного
анализа. Определение и обозначение цветов и других особенностей продуктов качественной реакции.
Одна из целей — понять процесс хода реакций в растворах с качественным исходом с помощью
различных методов и подходов с разных точек зрения.
Но все же главной целью является создание краткого и удобного справочника для начинающих
химиков, некого пособия по качественным реакциям, чтобы знать больше, готовиться к Олимпиадам и
экзаменам.
Задачи
1. Изучение явления электролитической диссоциации.
2. Изучение условий протекания реакции растворе.
3. Выявление признаков качественной реакции, определение качественной реакции в растворе.
4. Проведение практических опытов. Доказание качественных реакций на ионы, научное обоснование.
Фиксация результатов, занесение в учетную таблицу.
5. Анализ, итоговое объяснение результатов. Вывод и заключение.
4.
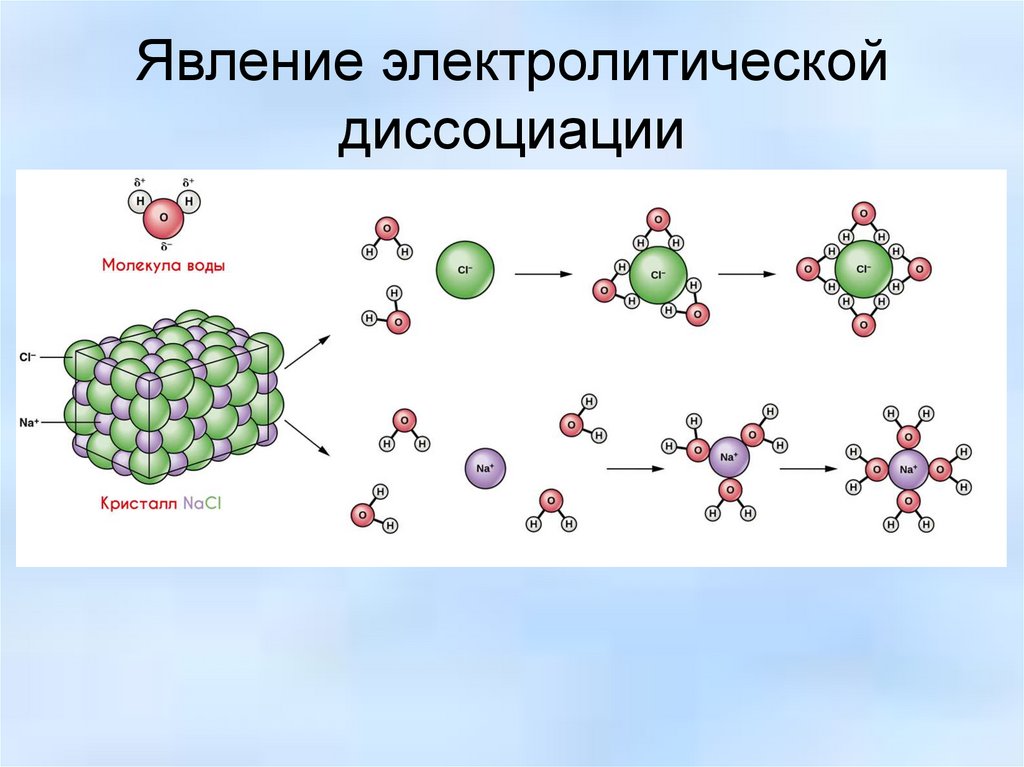
Явление электролитическойдиссоциации
Растворение — процесс образование гомогенной смеси в растворе, что происходит путем диффузии и
взамодействия молекул растворителя с растворимым веществом. Если явление диффузии — физический процесс
проникновения частиц вещества в среду частиц другого вещества, то чем является процесс реагирования частиц
вещества растворенного и растворяющего
NaCl + 8H2O = Na+(H2O)4 + Cl- (H2O)4
5.
Явление электролитическойдиссоциации
6.
Равновесие в растворах приобратимых реакциях
Так как для условия равновесия справедливо равенство υ A + B = υ C + D , а в свою очередь скорость
реакции(скорость изменения концентрации зависит от коэффицента пропорциональности (k) и
концентрации веществ[A], [В], [С], [D], (измеряется в моль/л)). Отсюда :
k A + B[A][В] = k C + D [D][С] и из этого следует вывод :
[D][С]\[A][В] = k A + B \ k C + D , где в свою очередь коэффиценты пропорциональности - константы и,
соответственно константивно и частное тоже будет константой, которая показывает зависимость
концентраций веществ для установления равновесия в системе.
7.
Произведение растворимости.Образвание осадков.
Произведение растворимости — есть произведение концентрации ионов в растворе при
данных условиях. При помощи этой величины мы можем понять концентрацию ионов того
или иного в-ва в растворе для малорастворимых веществ.
8.
Характеристика аналитическихреакций : способы и условия их
выполнения
1. Для качественной реакции важна чувствительность, быстрота протекания реакции
и простота.
2. Для протекания качественной реакции важна избирательность.
3.Создание или устранение особой pH среды раствора, маскирование некоторых ионов.
Выпадение осадка BaSO4
Образование роданида железа(III)
9.
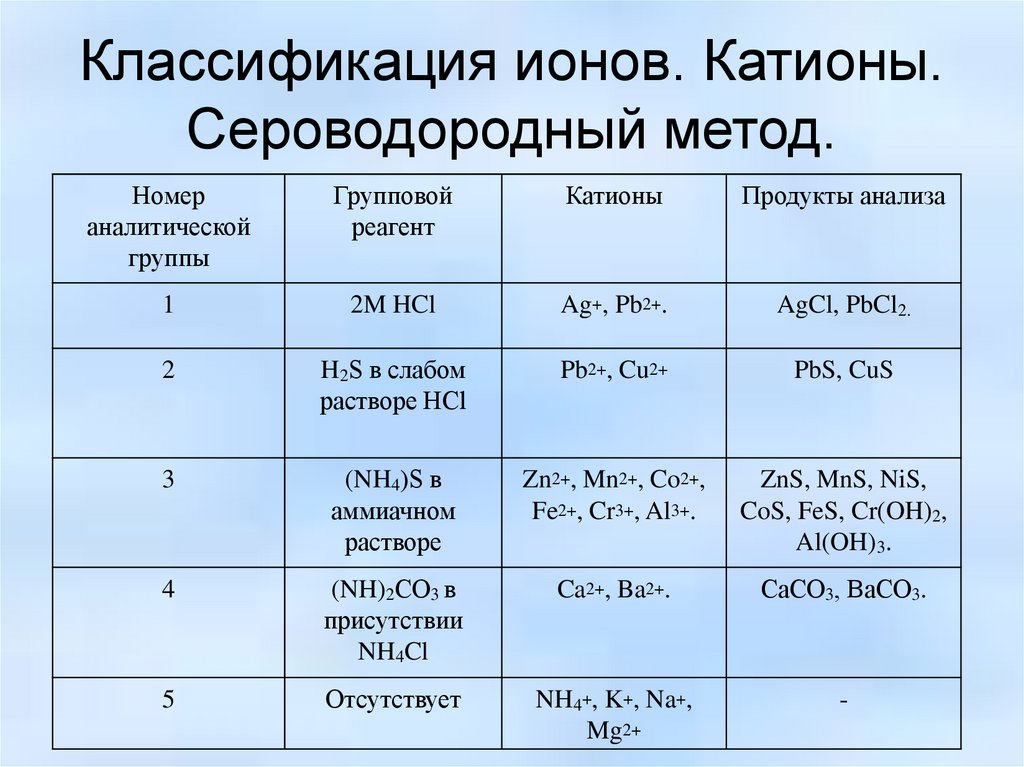
Классификация ионов. Катионы.Сероводородный метод.
Номер
аналитической
группы
Групповой
реагент
Катионы
Продукты анализа
1
2M HCl
Ag+, Pb2+.
AgCl, PbCl2.
2
H2S в слабом
растворе HCl
Pb2+, Cu2+
PbS, CuS
3
(NH4)S в
аммиачном
растворе
Zn2+, Mn2+, Co2+,
Fe2+, Cr3+, Al3+.
ZnS, MnS, NiS,
CoS, FeS, Cr(OH)2,
Al(OH)3.
4
(NH)2СO3 в
присутствии
NH4Cl
Ca2+, Ba2+.
CaСO3, BaСO3.
5
Отсутствует
NH4+, K+, Na+,
Mg2+
-
10.
Классификация ионов. Катионы.Кислотно-основный метод.
Номер
аналитической
группы
Групповой
реагент
Катионы
Продукты
анализа
1
HCl
Ag+, Pb2+
AgCl, PbCl2.
2
H2SO4
Pb2+, Ca2+, Ba2+
PbSO4, CaSO4,
BaSO4.
3
NaOH(конц.)
Al3+, Cr3+, Zn2+
AlO2-, CrO2-,
ZnO22-.
(Растворы)
4
Конц. NH3*H2O
Fe2+, Fe3+, Mg2+,
Mn2+
Fe(OH)2,
Fe(OH)3,
Mg(OH)2,
Mn(OH)2
5
Конц. NH3*H2O
Cu2+, Co2+
Cu(NH3)42+,
Co(NH3)62+
(Растворы)
11.
Классификация ионов. Анионы.Аналитическая
группа
Групповой реагент
Анионы
Результат
действия
группового
реагента
Первая
BaCl2
SO42-, SO32-,
S2O32-, CO32-,
PO43-, CrO42-, F-
BaSO4….
Вторая
AgNO3
Cl-, Br -, I-, S2-
AgCl, Ag2S….
Третья
-
NO3-, CH3COO-,
MnO4-
-
12.
Качественные реакции на ионы.Катионы.
H+
13.
Качественные реакции на ионы.Катионы.
Сu2+
Ag+
14.
Качественные реакции на ионы.Катионы.
Pb2+
Mn2+
15.
Качественные реакции на ионы.Катионы.
Сo2+
Cr3+
16.
Качественные реакции на ионы.Катионы.
Fe2+
Fe3+
17.
Качественные реакции на ионы.Катионы.
18.
Качественные реакции на ионы.Катионы.
Zn2+
Al3+
19.
Качественные реакции на ионы.Катионы.
20.
Качественные реакции на ионы.Катионы.
Ba2+
21.
Качественные реакции на ионы.Катионы.
Ca2+
Mg2+
22.
Качественные реакции на ионы.Катионы.
Li+
23.
Качественные реакции на ионы.Катионы.
K+ - гексанитрокобальтат (III) натрия калия.
K2Na[Co(NO2)6]
24.
Качественные реакции на ионы.Анионы.
СO32-
PO43-
25.
Качественные реакции на ионы.Анионы.
Cl-
Br-
I-
26.
Качественные реакции на ионы.Анионы.
NO3-
MnO4-
27.
ВыводМоим выводом стала компактная таблица, в которую я поместил ионы,
способы их определения, различения между собой. Также, отметим, что
при определении ионов надо пользоваться самыми простыми и
специфичными, избирательными и показательными реакциями. И еще я бы
хотел предложить начинающим химиком свой метод определения
неизвестного неорганического вещества в пробирке. Этот алгоритм состоит
из нескольких шагов. Все спецефические реакции были указаны в разделе
5.(Стр. 12 - 19)
28.
Алгоритм ислледования1.Определяем рН. При помощи индикаторов или рН-метров смотрим концентрацию
Н+ или OH- ионов.
2.В зависимости от полученного результата выполняем определение:
А) При большой концентрации Н+ . Высокая концентрация этих ионов говорит о том, что
в растворе — кислота. Поэтому, нужно определить анионы кислоты. Выполняем
определение при помощи солей бария и серебра. Если получаем схожие результаты, то
используем специфичные реакции.
Б) При большой концентрации OH- . Высокая концентрация гидроксид-анионов говорит о
том, что раствор — щелочь, поэтому нужно определить катион металла. Растворимых
гидроксидов не так много, поэтому остается определить между Ba2+ , Li+ , NH4+ , K+. Если
не определился не один из этих ионов, значит вещество — раствор NaOH.
Примечание. Высокая концентрация ионов Н+ и OH- также может наблюдаться в
растворах солей, подвергающихся гидролизу. Если при высокой конц. Н+ - соль образована
сильной к-той и слабым основанием(слабые основание нерастворимы, поэтому при
дальнейшем добавлении щелочи выпадает осадок). OH- - щелочная среда соотв. Соли
сильного основания и слабой к-ты, поэтому при добавлении кислоты сразу выявится
качество реакции(определится анион, т.к. большинство слабых кислот нестабильны или
имеют характерный признак). Далее остается определить анион сильного основания.
29.
Алгоритм ислледованияВ) При нормальном значении pH. Нормальное значение pH говорит о том, что
растворенное вещество — соль. Поэтому нам нужно определить и катион и анион(К слову,
для этого можно предположить наличие аниона или катиона по цвету Сu2+ - голубые
растворы, Сo2+ - синие растворы, Fe3+ - красно-бурые растворы, Сr3+ - зеленые растворы,
MnO4- - розовые растворы). Для определения первого пользуемся воздействием слабым
раствором щелочи, по цвету осадка(или запаху газа) мы определяем ион(если не произошло
реакции то это ионы Ba2+, Li+ , K+). Если выпал белый осадок, то разделяем пробу на 2
части, в одну пробу добавляем концентрированный раствор щелочи, а в другую — серную
кислоту. Если выпал осадок при добавлении кислоты, то это ионы Ca2+ или Pb2+ . При
добавлении щелочи растворятся гидроксиды алюминия, цинка, свинца. Различение
проводим по специфичным реакциям(Были описаны ранее для каждого иона).
Далее определяем анион по различной растворимости солей бария и серебра. Сначала
нужно посмотреть на взаимодействие с Ba2+(если ранее мы определили, что это соль бария,
то соответственно используем сначала соли серебра, а затем сильные кислоты и наоборот,
соответственно). При выпадении белых осадков пользуемся специфичными реакциями для
каждого аниона. (В любом случае, сначала нужно определить аналитическую группу). И,
наконец, если не случилось никакой качественной реакции, то используем взаимодействие
сильной кислотой. Воздействие кислотой нам подскажет по запаху ионы CH3COO- , а если
запах не источается, то тогда следует добавить медь. При этой реакции будет выделяется
бурый газ и раствор обретет голубой окрас.
30.
ЗаключениеПроделав довольно большую работу, изучив большое количество теоретического материала,
прибавив к этому свои знания, я смог достичь поставленных целей. Все задачи, что были
задуманы мною в начале изучения были попунктно выполнены. Я узнал много различных
мелочей и нюансов в химическом анализе, что крайне важны, что помогают выполнять
изучение более точно, правильно и аккуратно.
Я смог изучить явление электролитической диссоциации, выяснил, от чего зависит качество
реакции, скорость. Также, в ходе исследования я сам провел множество наглядных опытов,
что является лучшей практикой при работе с лабораторным оборудованием. Главное — что
я смог познакомиться с правилами и основами химического исследования раствора, что
является важным для моей будущей профессии и научной деятельности.
Я смог совместить свою старые знания, полученные знания, практическую деятельность и
сделать окончательный вывод и подвести итог моей работы, тем самым выполнив главную
цель.
31.
Спасибо за внимание!!!Бахнет?
Не должно!!!





























 Химия
Химия








