Похожие презентации:
Карбоновые кислоты
1.
Карбоновыекислоты
2.
Карбоновыми кислотами называютсякислородсодержащие органические вещества,
молекулы которых содержат
О
//
карбоксильную группу – C или – СООН,
\
OH
связанную с углеводородным радикалом или
атомом водорода.
3.
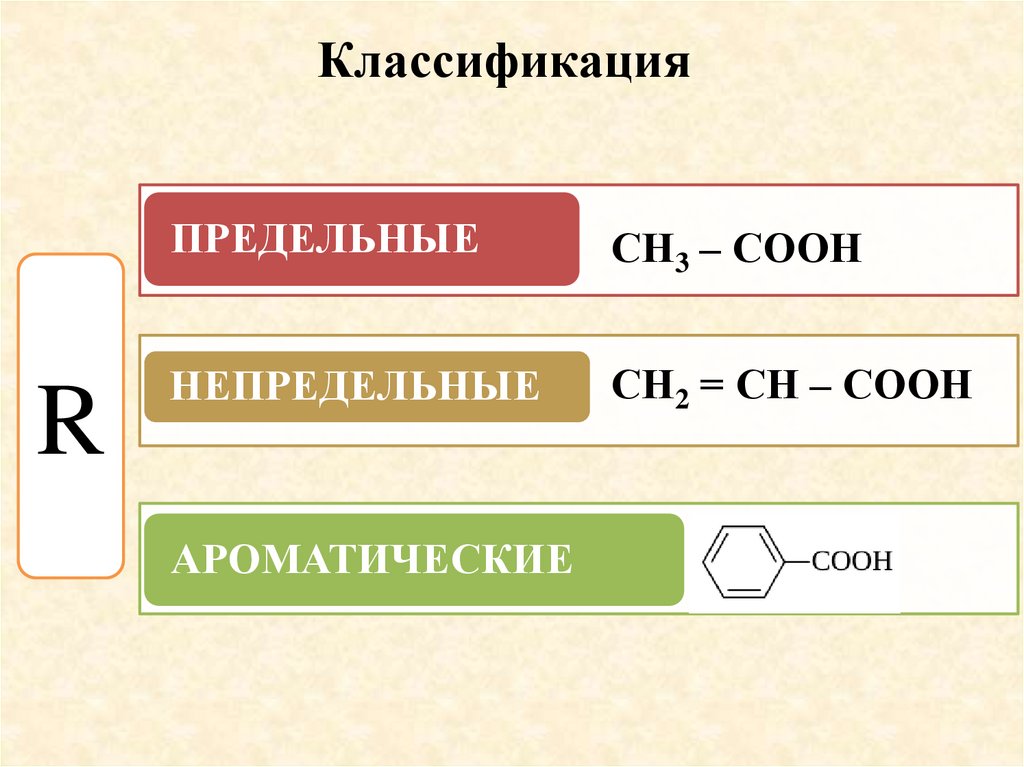
КлассификацияR
ПРЕДЕЛЬНЫЕ
СН3 – СООН
НЕПРЕДЕЛЬНЫЕ
СН2 = СН – СООН
АРОМАТИЧЕСКИЕ
4.
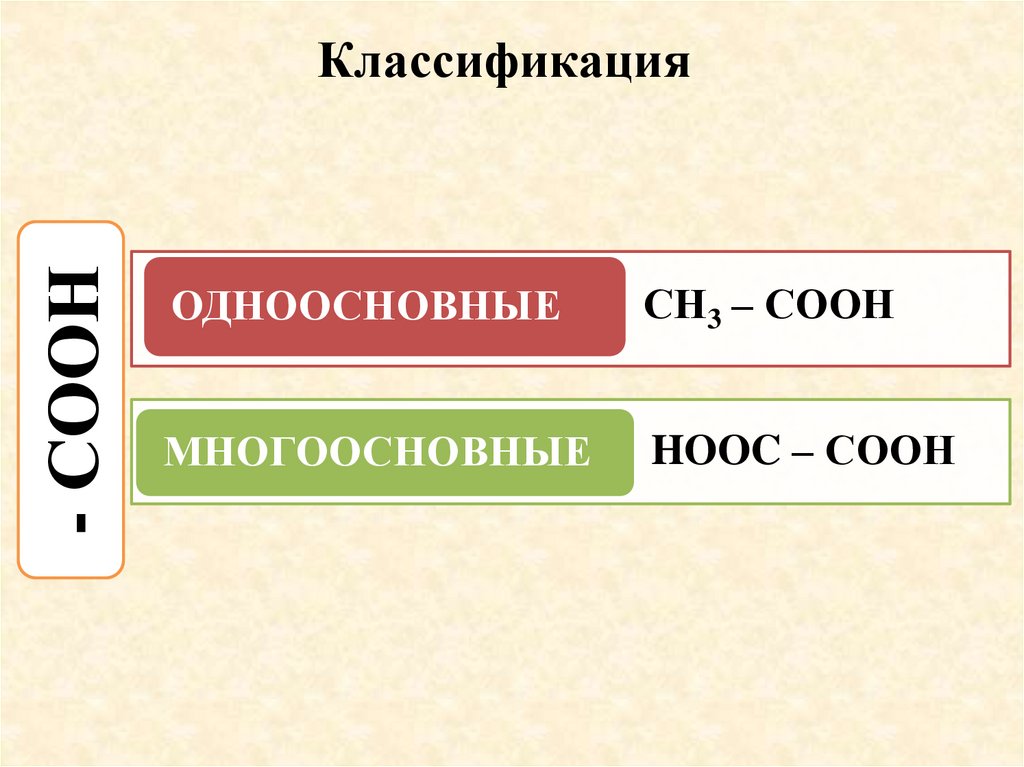
- СООНКлассификация
ОДНООСНОВНЫЕ
СН3 – СООН
МНОГООСНОВНЫЕ
HOOC – СООН
5.
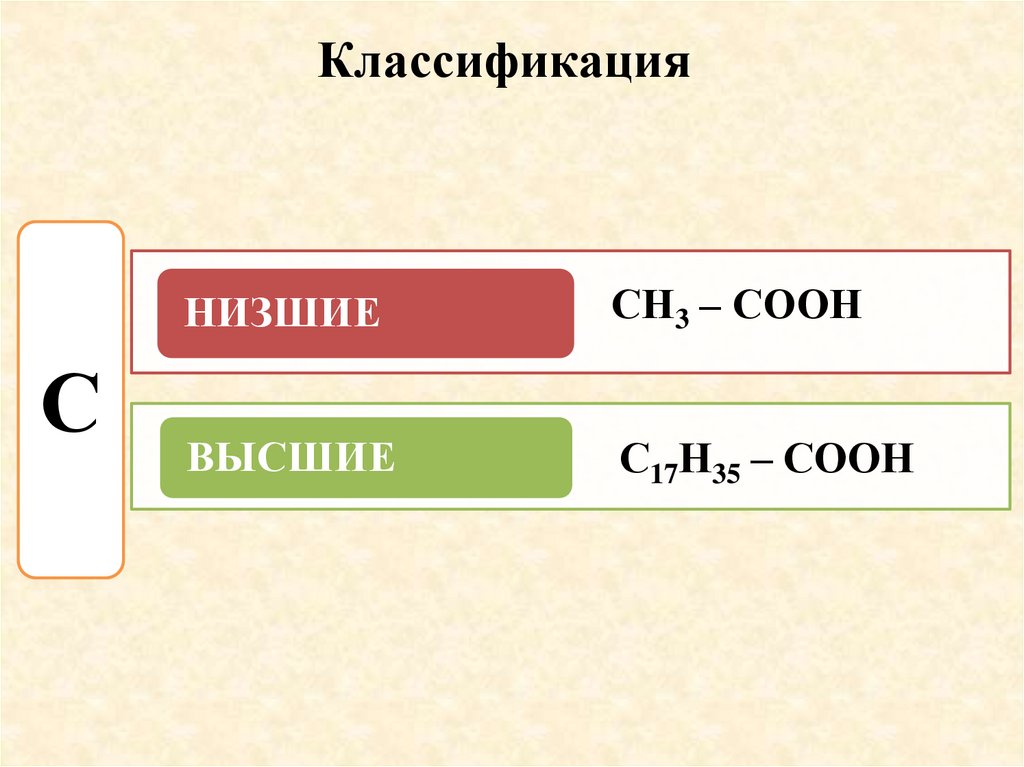
КлассификацияС
НИЗШИЕ
СН3 – СООН
ВЫСШИЕ
С17Н35 – СООН
6.
Предельныеодноосновные
карбоновые кислоты
7.
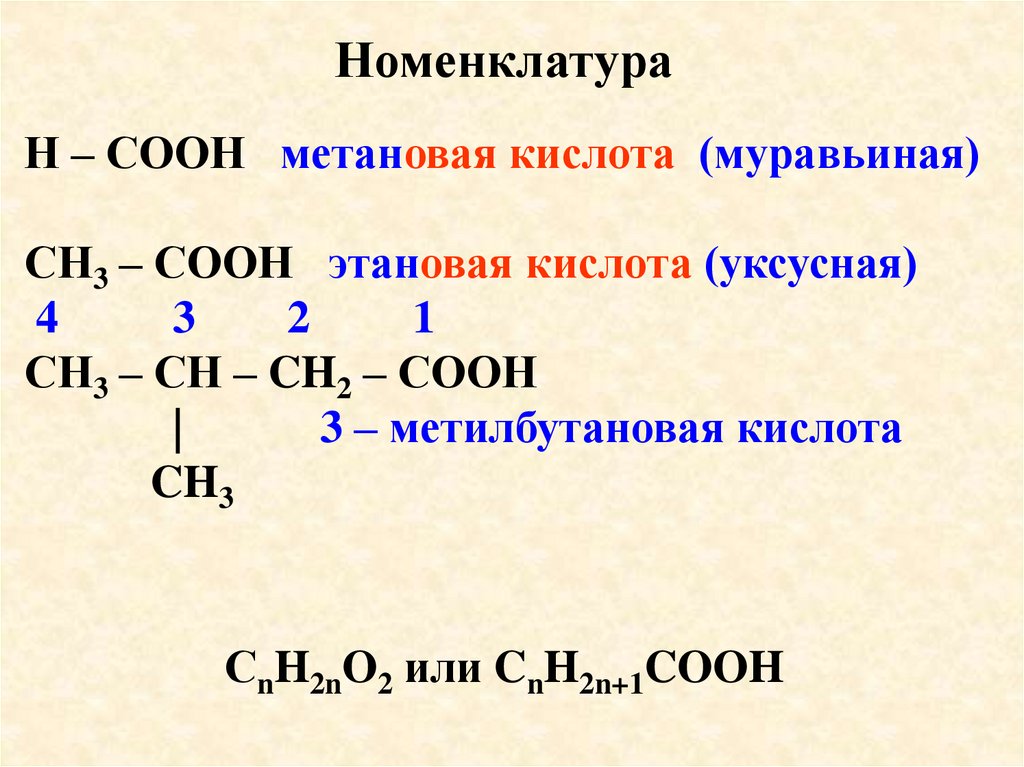
НоменклатураН – СООН метановая кислота (муравьиная)
СН3 – СООН этановая кислота (уксусная)
4
3
2
1
СН3 – СН – CH2 – СООН
|
3 – метилбутановая кислота
CH3
СnH2nO2 или CnH2n+1COOH
8.
Изомерия1. Изомерия углеродного скелета (c C4)
Задание: Составьте формулы трех изомерных
карбоновых кислот общего состава С5Н10О2
и дайте им названия по систематической
номенклатуре
9.
2. Межклассовая изомерия (c C2)Карбоновые кислоты – сложные эфиры
СН3 – СООН уксусная кислота
Н – СООСН3 метиловый эфир муравьиной кислоты,
метилформиат
10.
Физические свойстваСреди карбоновых кислот нет газообразных
веществ. Причина – наличие водородных связей в
молекуле, что приводит к образованию димеров. Низшие
кислоты - жидкости с острым запахом, хорошо
растворимые в воде. С увеличением числа атомов
углерода растворимость кислот падает, а температура
кипения повышается. С С11 кислоты - твердые вещества
без запаха, не растворимые в воде.
11.
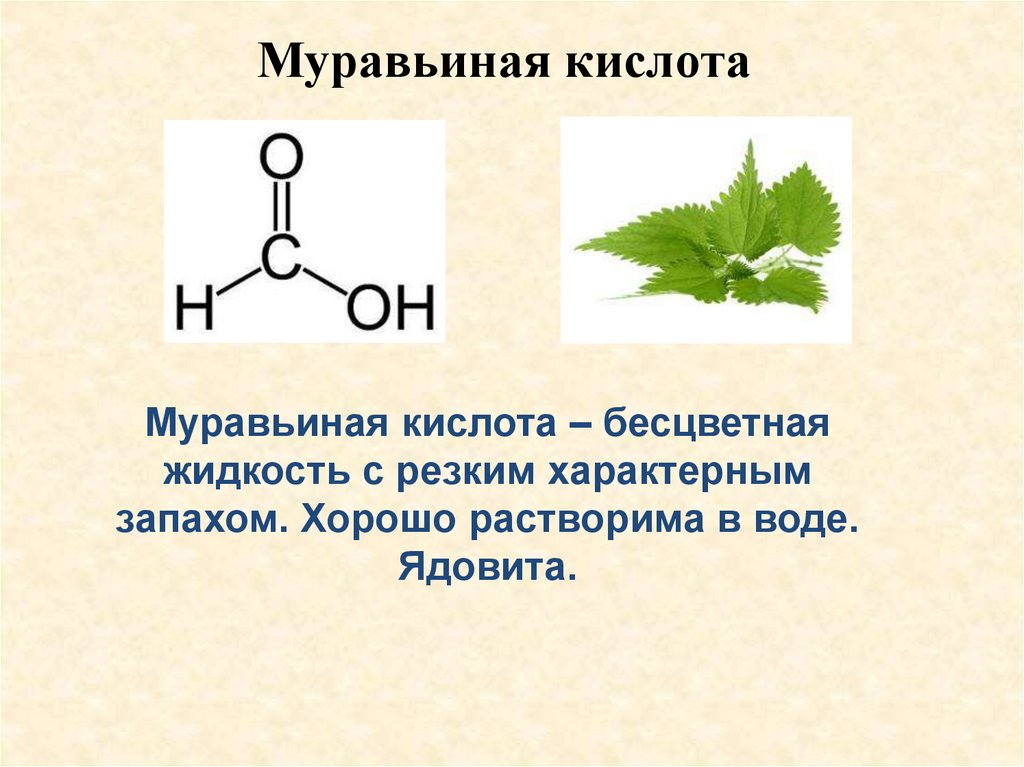
Муравьиная кислотаМуравьиная кислота – бесцветная
жидкость с резким характерным
запахом. Хорошо растворима в воде.
Ядовита.
12.
Уксусная кислотаУксусная кислота – бесцветная жидкость с
характерным резким запахом. Гигроскопична.
Хорошо растворима в воде. Безводная
уксусная кислота называется ледяной, так как
при замерзании образует кристаллы похожие
на лед.
13.
Пальмитиновая и стеариноваякислоты
Твердые, жирные на ощупь вещества, почти
нерастворимые в воде.
14.
Химические свойства1. Каков состав неорганических кислот?
2. Почему неорганические кислоты обладают
общими химическими свойствами?
3. Как называются производные кислот?
4. Из чего они состоят?
5. Как составляется формула соли?
6. С чем могут реагировать неорганические
кислоты?
15.
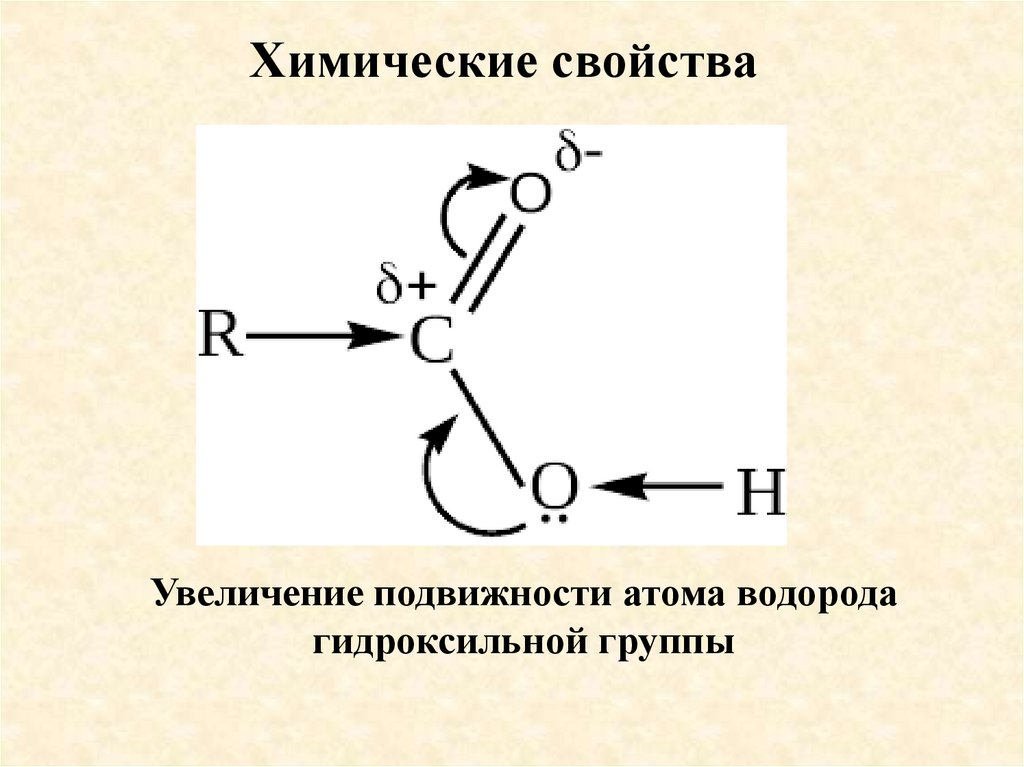
Химические свойстваУвеличение подвижности атома водорода
гидроксильной группы
16.
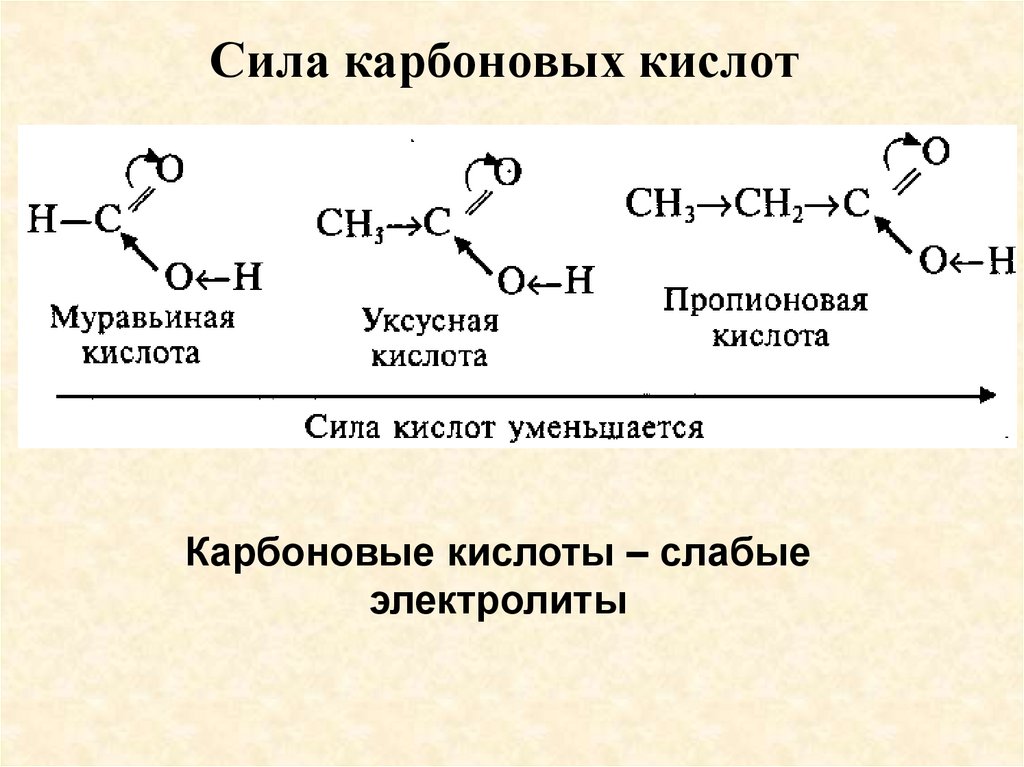
Сила карбоновых кислотКарбоновые кислоты – слабые
электролиты
17.
Химические свойства1. Действие на индикаторы (слабые электролиты)
Составьте уравнения диссоциации муравьиной
и уксусной кислот
2. Взаимодействие с металлами, стоящими левее
водорода в электрохимическом ряду напряжений
Составьте уравнение взаимодействия цинка с
уксусной кислотой. Дайте название полученной
соли.
18.
Химические свойства3. Взаимодействие с основными оксидами
Составьте уравнение взаимодействия оксида
магния с уксусной кислотой. Дайте название
полученной соли.
4. Взаимодействие с основаниями
Составьте уравнение взаимодействия гидроксида
натрия с муравьиной кислотой. Дайте название
полученной соли.
19.
Химические свойства5. Взаимодействие с солями более слабых кислот
Составьте уравнение взаимодействия силиката
натрия с уксусной кислотой. Дайте название
полученной соли.
6. Взаимодействие со спиртами (реакция
этерификации)
Составьте уравнение взаимодействия метанола с
уксусной кислотой. Дайте название полученному
эфиру.
20.
1) Н – СООН ⇄ Н – СОО– + Н+СН3 – СООН ⇄ СН3 – СОО– + Н+
2) 2СН3 – СООН + Zn → (CH3 – COO)2Zn + H2
ацетат цинка
3) 2СН3 – СООН + MgO → (CH3 – COO)2Mg + H2O
ацетат магния
4) H – СООН + NaOH → H – COONa + H2O
формиат натрия
21.
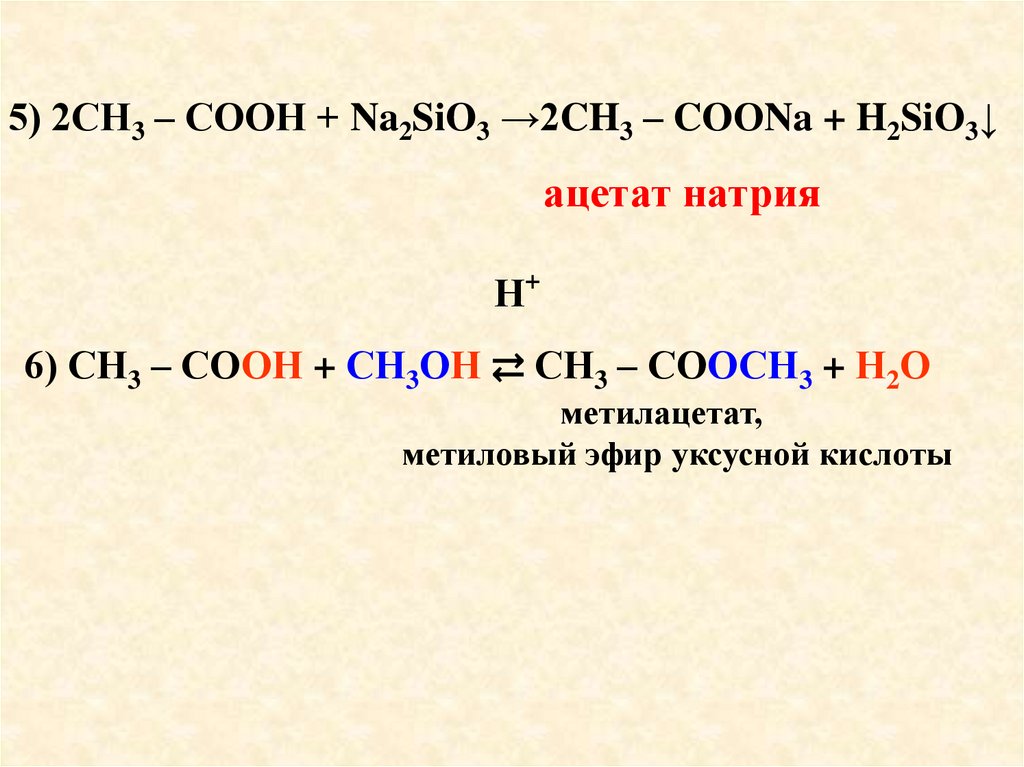
5) 2СН3 – СООН + Na2SiO3 →2CH3 – COОNa + H2SiO3↓ацетат натрия
+
Н
6) СН3 – СООН + СН3ОН ⇄ СН3 – СООСН3 + Н2О
метилацетат,
метиловый эфир уксусной кислоты
22.
Химические свойства7. Реакция замещения в радикал в α-положение с
галогенами
P(красный)
CH3 – СН2 – COОН + Cl2 → CH3 – СHCl – COОН + HCl
Введение атома галогена усиливает кислотность образованной
кислоты, а именно
1) чем сильнее галоген (F>Cl>Br>I)
2) чем больше его атомов (СF3COOH>CH2FCOOH)
3) чем он ближе к карбоксильной группе
(СF3COOH>СF3СН2COOH)
23.
Химические свойства8. Реакция с аммиаком
СН3 – COОН + NH3 → CH3 – COОNH4
ацетат аммония
24.
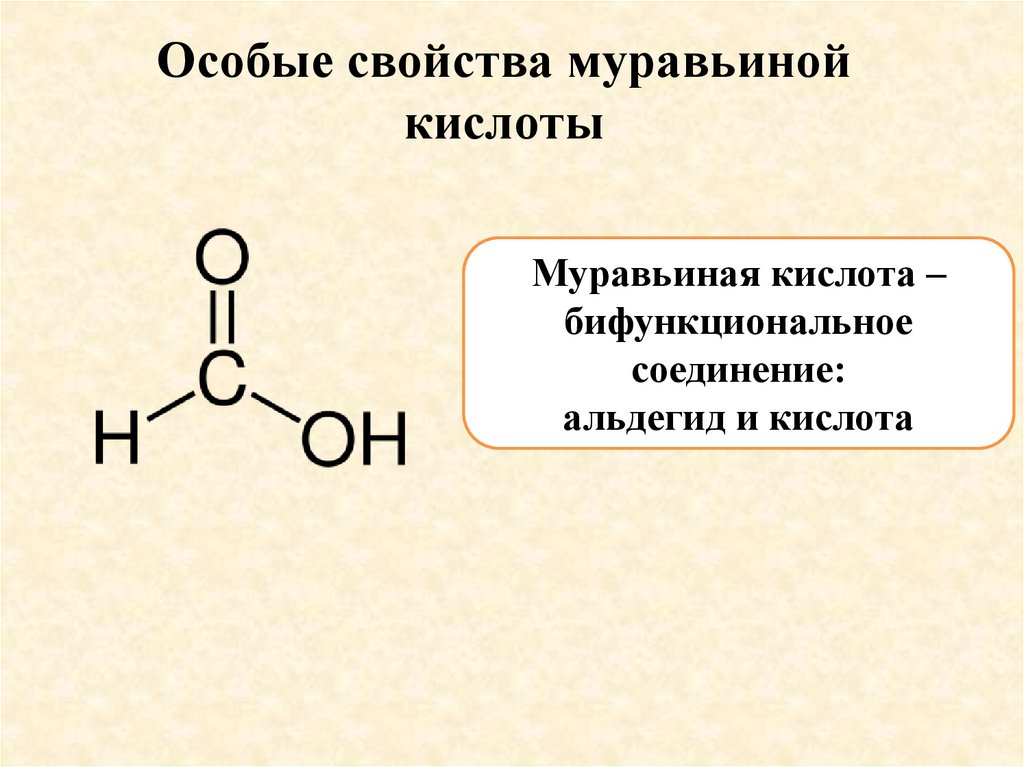
Особые свойства муравьинойкислоты
Муравьиная кислота –
бифункциональное
соединение:
альдегид и кислота
25.
Особые свойства муравьинойкислоты
1. Реакция «серебряного зеркала» (при нагревании).
НСООН + 2[Аg(NН3)2]ОН →2Аg↓ + (NН4)2СО3 + 2NН3↑ + Н2О
2. С гидроксидом меди (II) (при нагрев.)
НСООН + 2Сu(ОН)2 → Сu2О↓ + СО2↑ + 3Н2О
3. Разлагается при нагревании в присутствии
концентрированной Н2SО4
НСООН → СО↑ + Н2О
26.
Получение1. Окисление алканов, спиртов, альдегидов в
присутствии катализаторов:
2СН3 – СН2 – СН2 – СН3 + 5О2 → 4СН3 – СООН + 2Н2О
СН3 – СН2 – ОН + О2 → СН3 – СООН + Н2О
2СН3 – СНО + О2 → 2СН3 – СООН
27.
Получение2. Гидролиз геминальных тригалогенидов:
H2 O
СН3 – СCl3 + 4KOH → СН3 – СООK + 3KCl + 2Н2О
СН3 – СООK + HCl → СН3 – СООH + KCl
3. Взаимодействие реактива Гриньяра с
углекислым газом.
H2O, Н+
СН3MgBr + CO2 → СН3 – СООMgBr →
СН3 – СООН
−MgOHBr
28.
Получение4. Получение муравьиной кислоты:
t, р
СО+ NaOH → HCOONa
2НСООNa + H2SO4 → 2HCOOH + Na2SO4
5. Гидролиз сложных эфиров
Н+
СН3 – СООСН3 + Н2О ⇄ СН3 – СООН + СН3ОН
29.
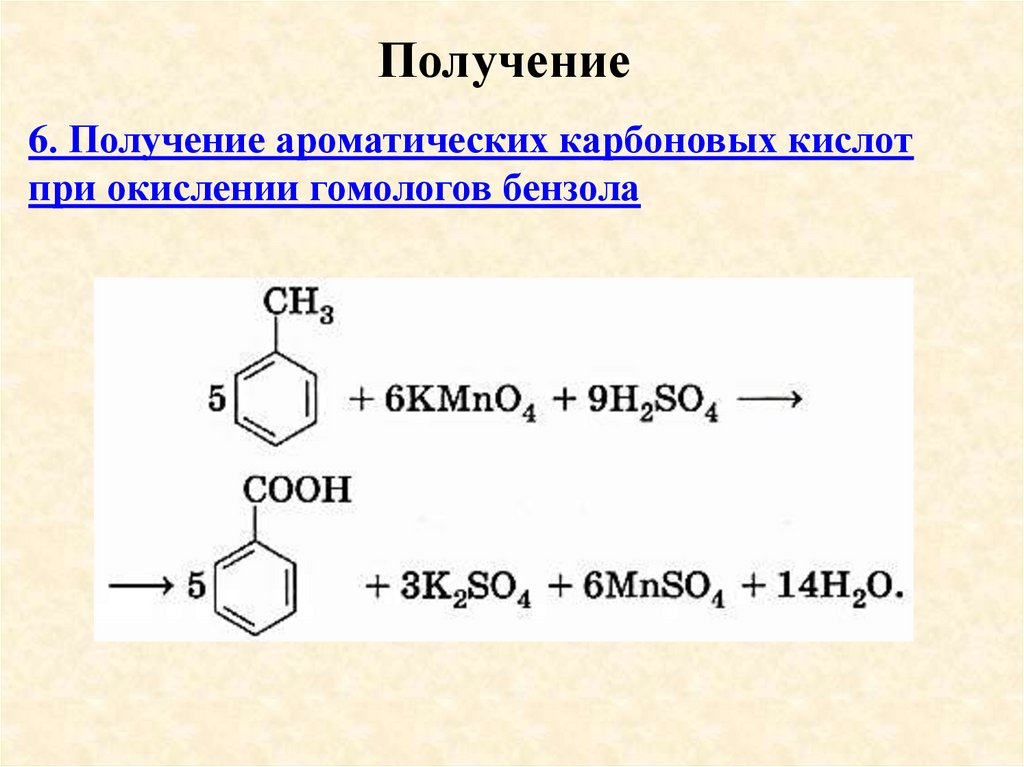
Получение6. Получение ароматических карбоновых кислот
при окислении гомологов бензола
30.
ПрименениеМуравьиная кислота НСООН
В пищевой промышленности муравьиная кислота (Е236) в
используется в качестве добавки при изготовлении
консервированных овощей. Она замедляет развитие
патогенной среды и плесеней в консервированных и квашеных
овощах. Также ее используют в производстве безалкогольных
напитков, в составе рыбных маринадов и других кислых
рыбопродуктов. Кроме того, ее часто применяют для
дезинфекции бочек для вина и пива.
В медицине муравьиную кислоту применяют как
антисептическое, очищающее и болеутоляющее средство, а в
некоторых случаях – как бактерицидное и
противовоспалительное.
31.
ПрименениеУксусная кислота СН3СООН
Применяется в химической промышленности для
производства искусственного шёлка, пластмасс,
красителей (индиго), лекарственных препаратов,
например, аспирина, является отличным консервантом
Уксусную кислоту применяют для получения душистых
веществ, используют как растворитель. Применяется при
крашении тканей и бумаги.
32.
ПрименениеСтеариновая кислота С17Н35СООН
Широко используется в косметической
промышленности: стеарат натрия является одним из
основных компонентов мыла, сама стеариновая кислота
входит в состав многих косметических средств.
Применяется в производстве свечей и как мягчитель в
производстве резины.
Стеараты натрия, кальция, свинца используются как
компоненты пластичных смазок.
33.
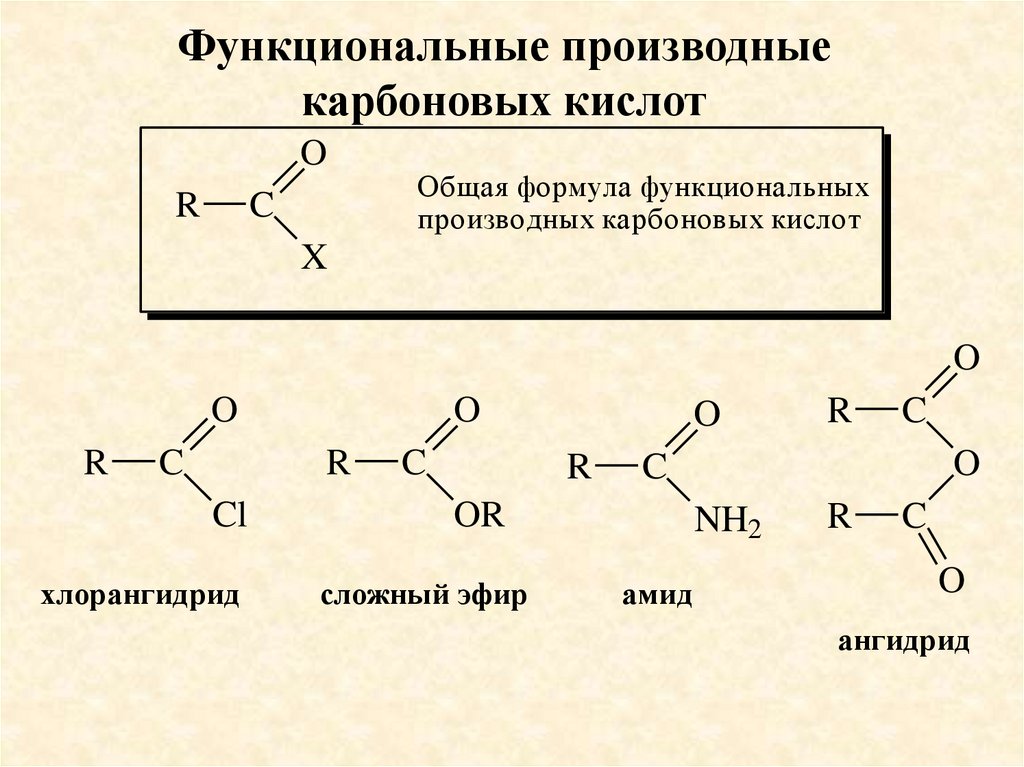
Функциональные производныекарбоновых кислот
O
R
C
Общая формула функциональных
производных карбоновых кислот
X
O
O
R
C
O
R
Cl
хлорангидрид
C
O
R
C
O
C
OR
сложный эфир
R
NH2
амид
R
C
O
ангидрид
34.
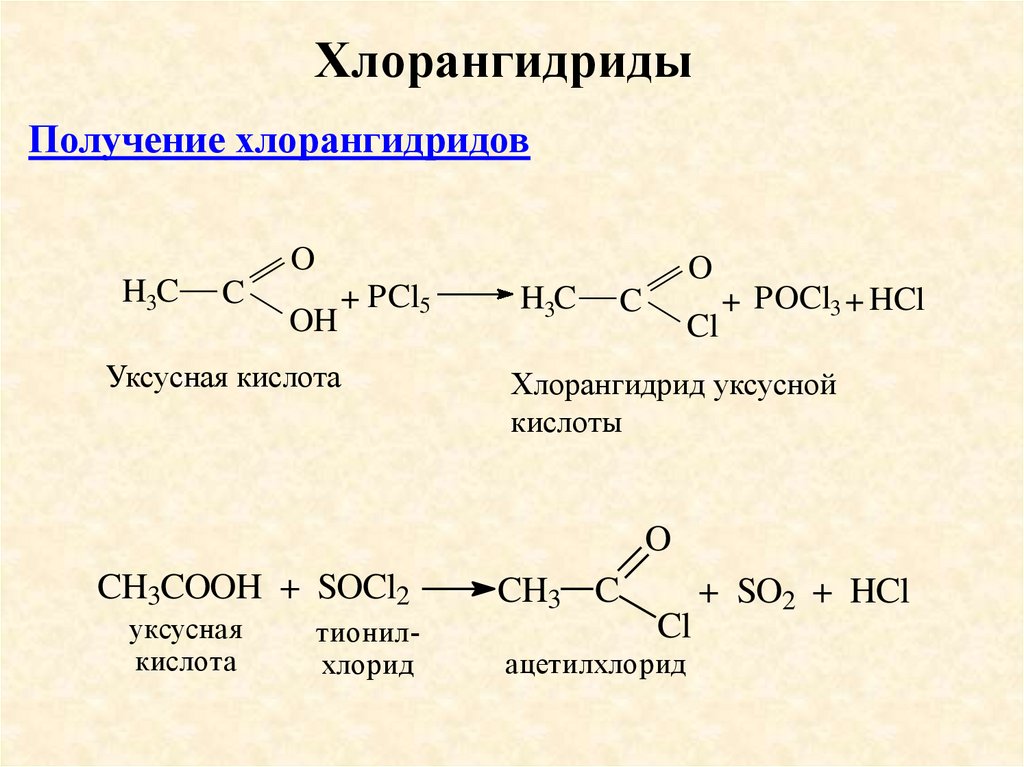
ХлорангидридыПолучение хлорангидридов
O
H3C
C
OH
+ PCl5
Уксусная кислота
O
H3C
C
Cl
+ POCl3 + HCl
Хлорангидрид уксусной
кислоты
O
CH3COOH + SOCl2
уксусная
кислота
тионилхлорид
CH3 C
Cl
ацетилхлорид
+ SO2 + HCl
35.
ХлорангидридыФизические свойства
Хлорангидриды по большей части жидкости, кипят
при значительно более низких температурах чем
соответствующая кислота из-за отсутствия
межмолекулярных водородных связей.
Благодаря высокой реакционной способности
хлорангидриды широко применяются в органическом
синтезе в качестве ацилирующего агента для введения в
синтезируемую молекулу остатка карбоновой кислоты.
36.
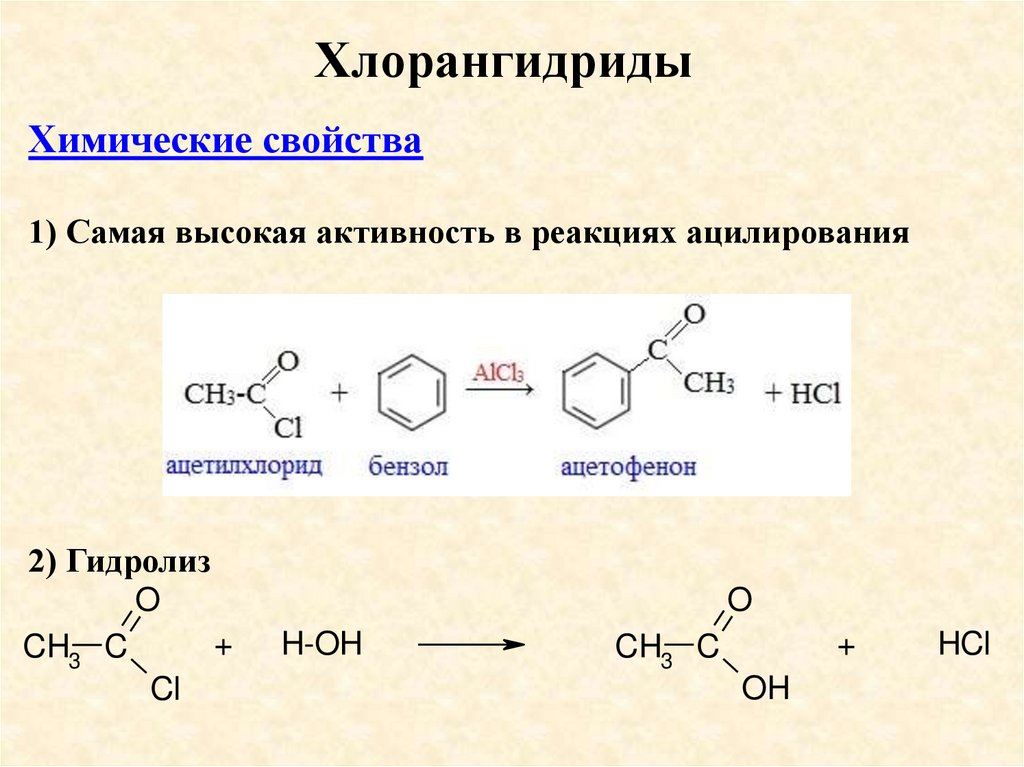
ХлорангидридыХимические свойства
1) Самая высокая активность в реакциях ацилирования
2) Гидролиз
O
O
+
CH3 C
Cl
H-OH
+
CH3 C
OH
HCl
37.
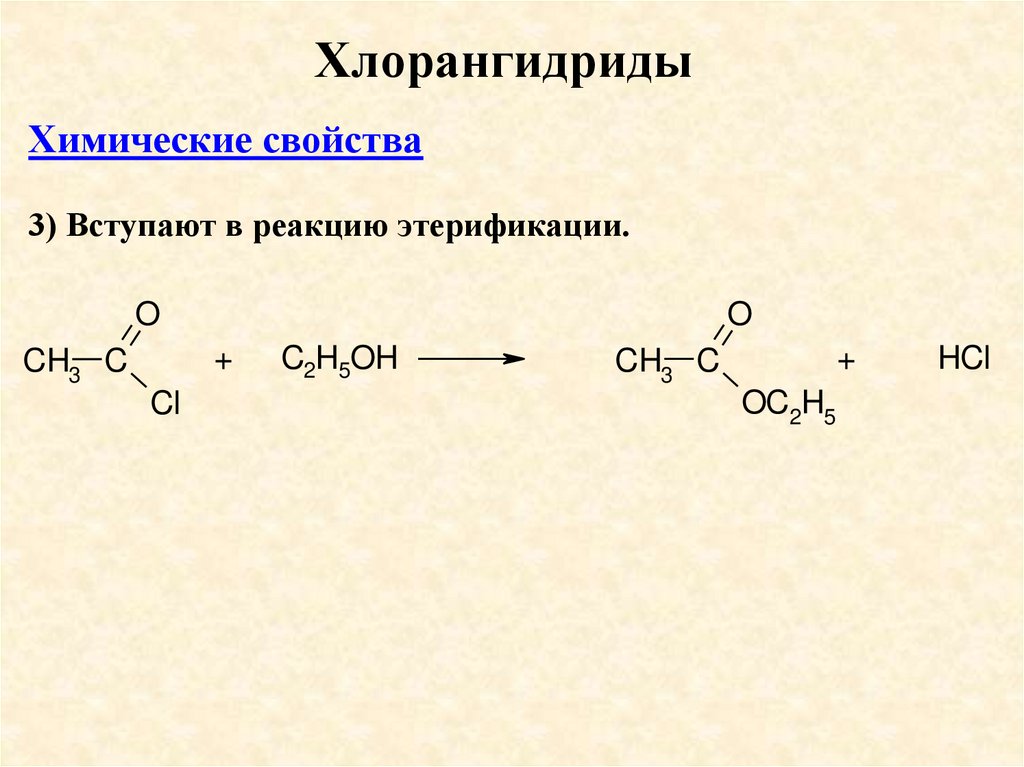
ХлорангидридыХимические свойства
3) Вступают в реакцию этерификации.
O
O
+
CH3 C
Cl
C2H5OH
+
CH3 C
OC2H5
HCl
38.
Ангидриды карбоновых кислотАнгидриды – это соединения, образующиеся при
отщеплении воды от кислот.
Физические свойства
Ангидриды карбоновых кислот представляют собой
бесцветные жидкости или кристаллические вещества.
Низшие представители гомологического ряда обладают
раздражающим запахом. Ангидриды карбоновых кислот
малорастворимы в воде и медленно с ней реагируют.
Уксусный ангидрид применяется в качестве
ацилирующего реагента в производстве пластмасс,
лекарственных средств (ацетилсалициловой кислоты и
др.).
39.
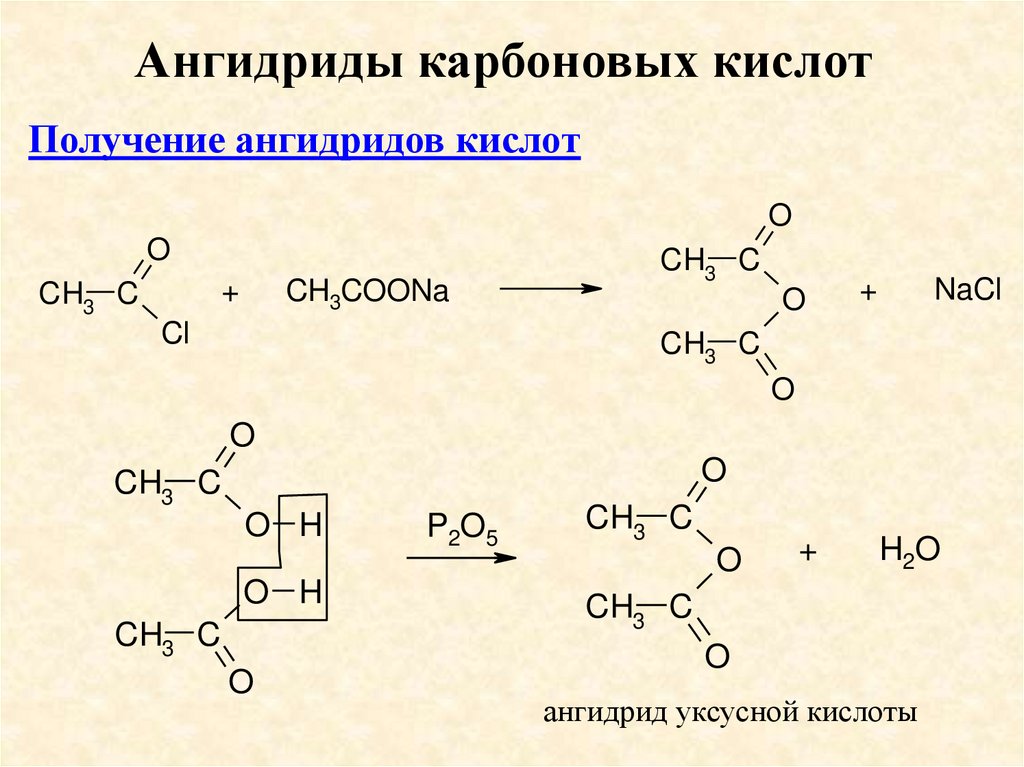
Ангидриды карбоновых кислотПолучение ангидридов кислот
O
O
+
CH3 C
CH3COONa
Cl
CH3 C
O
+
NaCl
CH3 C
O
O
O
CH3 C
O H
O H
CH3 C
O
P2O5
CH3 C
O
+
H2O
CH3 C
O
ангидрид уксусной кислоты
40.
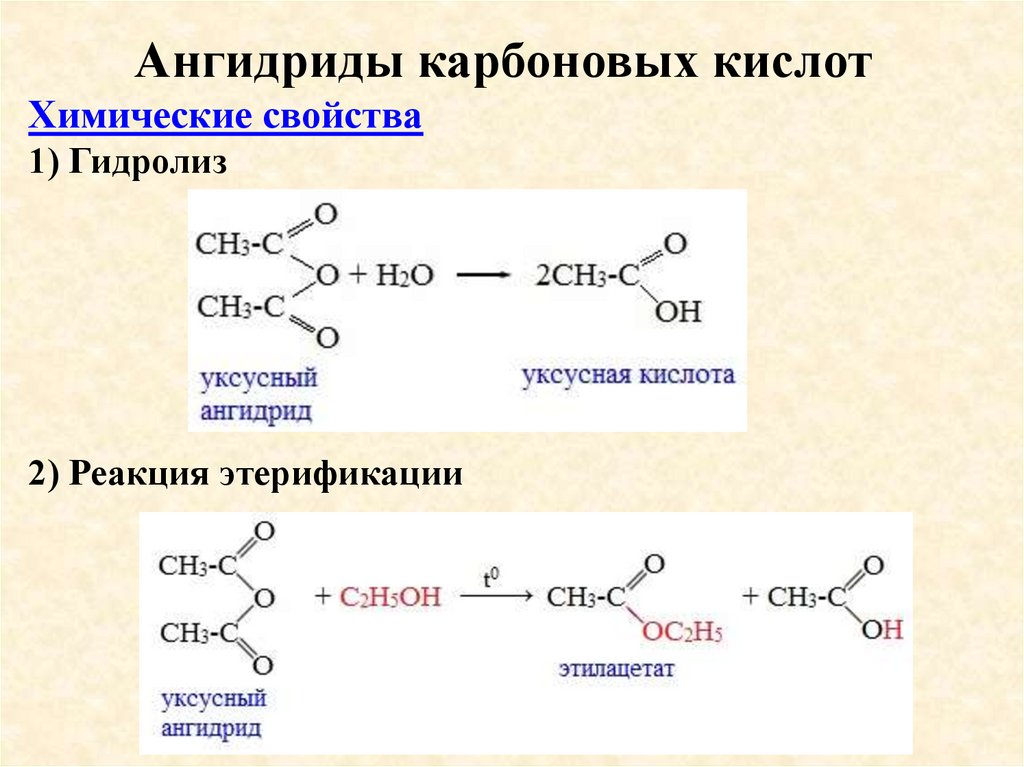
Ангидриды карбоновых кислотХимические свойства
1) Гидролиз
2) Реакция этерификации
41.
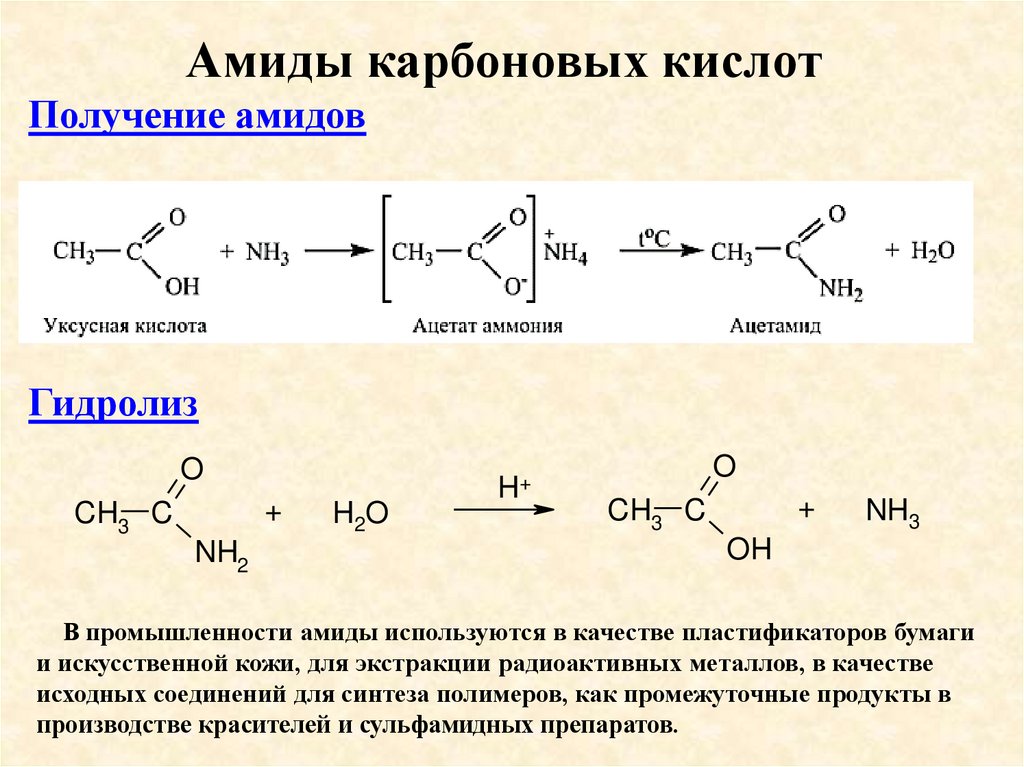
Амиды карбоновых кислотПолучение амидов
Гидролиз
O
+
CH3 C
NH2
H2O
H+
O
+
CH3 C
NH3
OH
В промышленности амиды используются в качестве пластификаторов бумаги
и искусственной кожи, для экстракции радиоактивных металлов, в качестве
исходных соединений для синтеза полимеров, как промежуточные продукты в
производстве красителей и сульфамидных препаратов.
42.
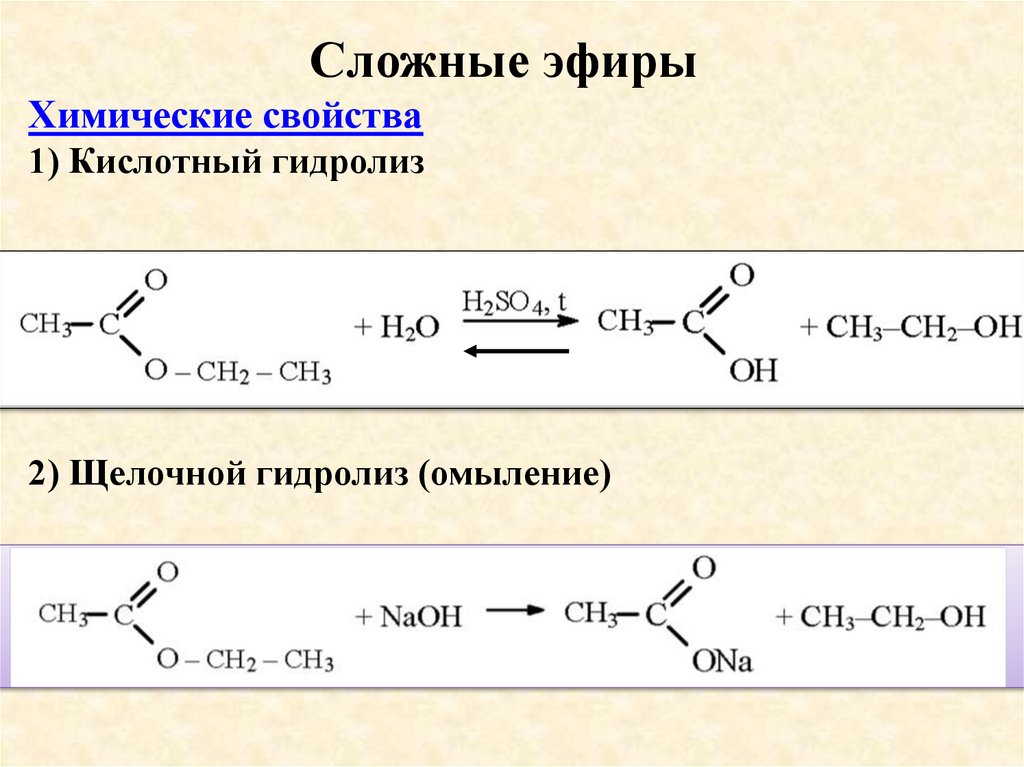
Сложные эфирыПолучение: реакция этерификации
H2SO4
O
CH3 C
O H +
O
CH3 C
H O C2H5
O C2H5 +
H O H
Физические свойства
Сложные эфиры простейших кислот и спиртов – бесцветные летучие
жидкости, практически нерастворимые в воде, многие обладают
приятным запахом. Сложные эфиры высших кислот и высших
одноатомных спиртов – воскообразные вещества, входят в состав,
например, пчелиного воска.
Применятся в качестве ароматизаторов в пищевой промышленности и
парфюмерии. Некоторый эфиры применяются в медицине, в
производстве пластмасс и в качестве растворителей.
43.
Сложные эфирыХимические свойства
1) Кислотный гидролиз
2) Щелочной гидролиз (омыление)

























 Химия
Химия








