Похожие презентации:
Карбоновые кислоты. Классификация карбоновых кислот
1.
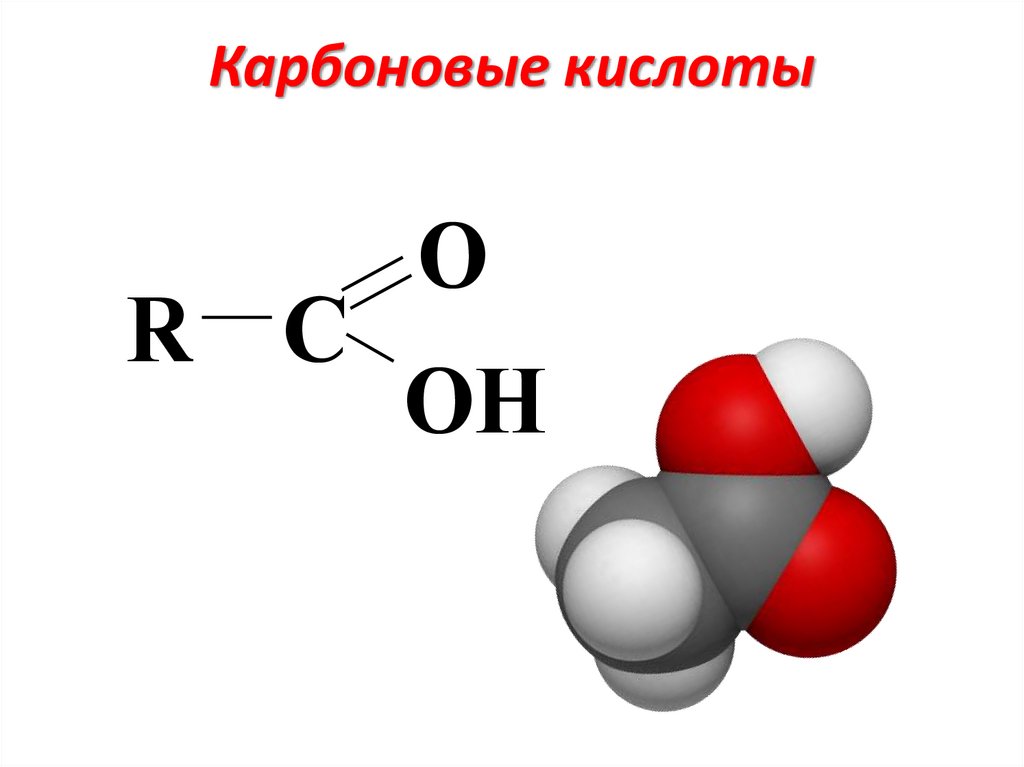
Карбоновые кислотыR C
O
OH
2.
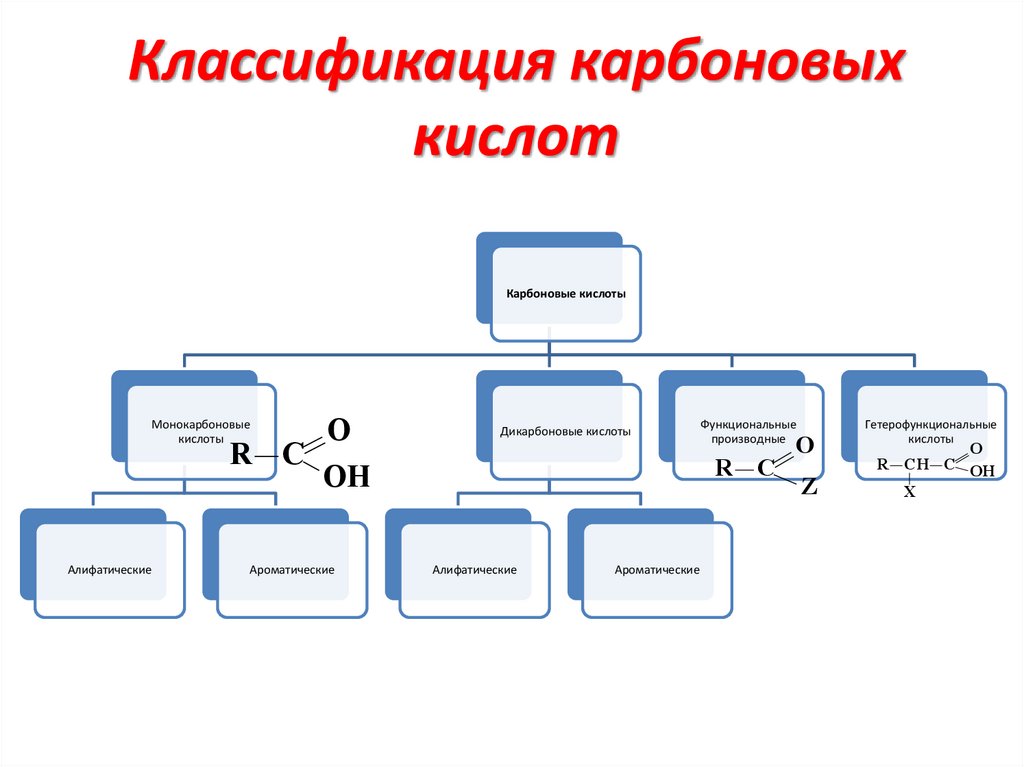
Классификация карбоновыхкислот
Карбоновые кислоты
Монокарбоновые
кислоты
R C
Алифатические
O
Дикарбоновые кислоты
R C
OH
Ароматические
Функциональные
производные
Алифатические
Ароматические
O
Z
Гетерофункциональные
кислоты
O
R CH C OH
X
3.
Классификация карбоновых кислот• 1. Монокарбоновые
• 1.1. Алифатические, насыщенные CnH2n+1 COOH
HCOOH метановая кислота, муравьиная кислота
(формиат)
CH3COOH этановая, уксусная кислота (ацетат)
1
4
3
2
CH3CHCH2COOH 3-метилбутановая кислота
изовалерьяновая кислота (изовалерат)
CH3
CH3CH2CH2CH2CH2COOH гексановая кислота
капроновая кислота (капрат)
4.
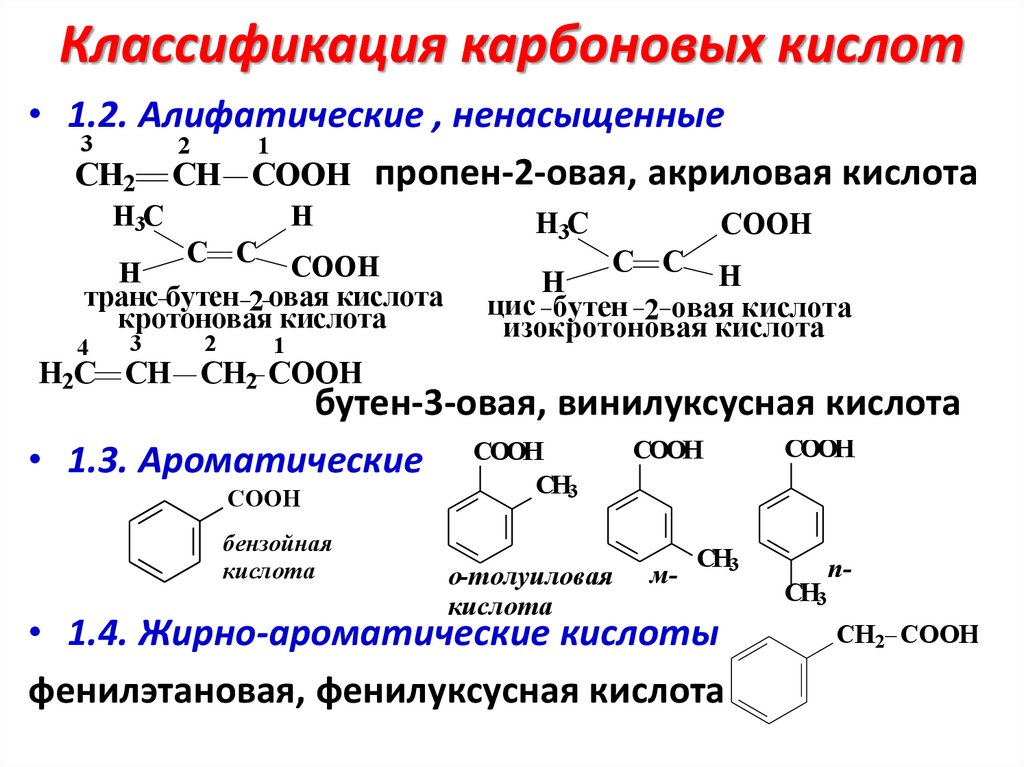
Классификация карбоновых кислот• 1.2. Алифатические , ненасыщенные
3
2
1
CH2 CH COOH пропен-2-овая, акриловая кислота
H3C
H
C C COOH
H
транс бутен 2 овая кислота
кротоновая кислота
4
3
2
1
H3C
СOOH
C C H
H
цис бутен 2 овая кислота
изокротоновая кислота
H2C CH СH2 COOH
бутен-3-овая, винилуксусная кислота
СООН
СООН
• 1.3. Ароматические СООН
СООН
бензойная
кислота
СН3
о-толуиловая
кислота
м-
СН3
• 1.4. Жирно-ароматические кислоты
фенилэтановая, фенилуксусная кислота
СН3
nCH2 COOH
5.
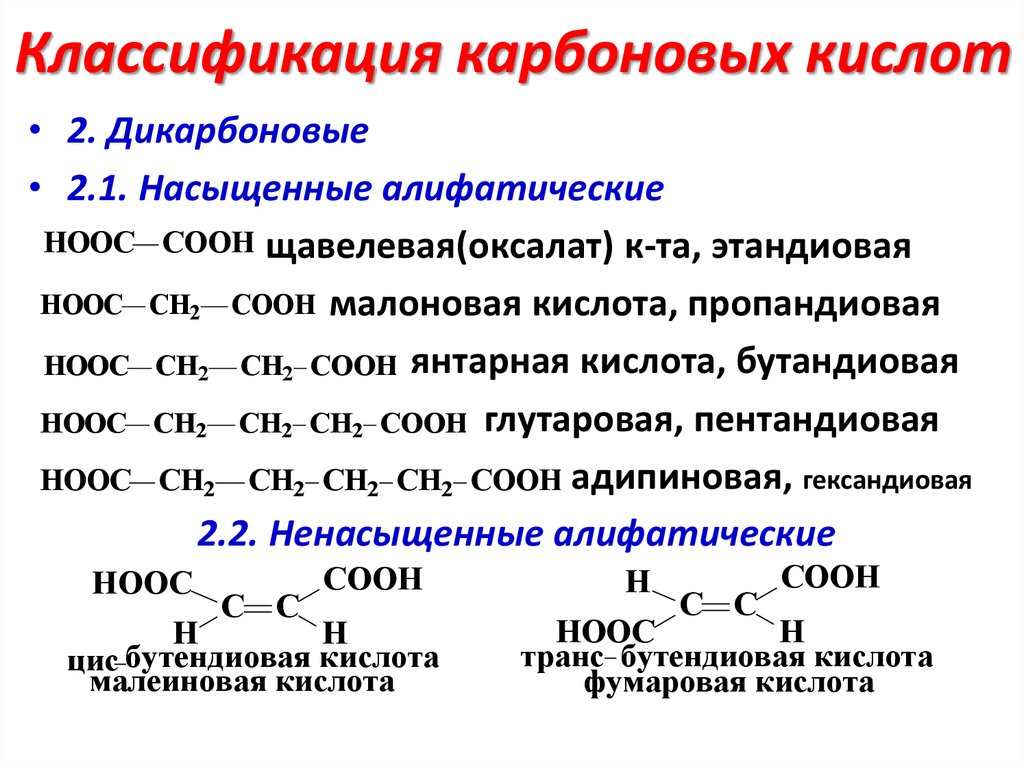
Классификация карбоновых кислот• 2. Дикарбоновые
• 2.1. Насыщенные алифатические
HOOC COOH щавелевая(оксалат) к-та, этандиовая
HOOC CH2 COOH малоновая кислота, пропандиовая
HOOC CH2 CH2 COOH янтарная кислота, бутандиовая
HOOC CH2 CH2 CH2 COOH глутаровая, пентандиовая
HOOC CH2 CH2 CH2 CH2 COOH адипиновая, гександиовая
2.2. Ненасыщенные алифатические
HOOC
C C
COOH
H
H
цис бутендиовая кислота
малеиновая кислота
H
C C
COOH
HOOC
H
транс бутендиовая кислота
фумаровая кислота
6.
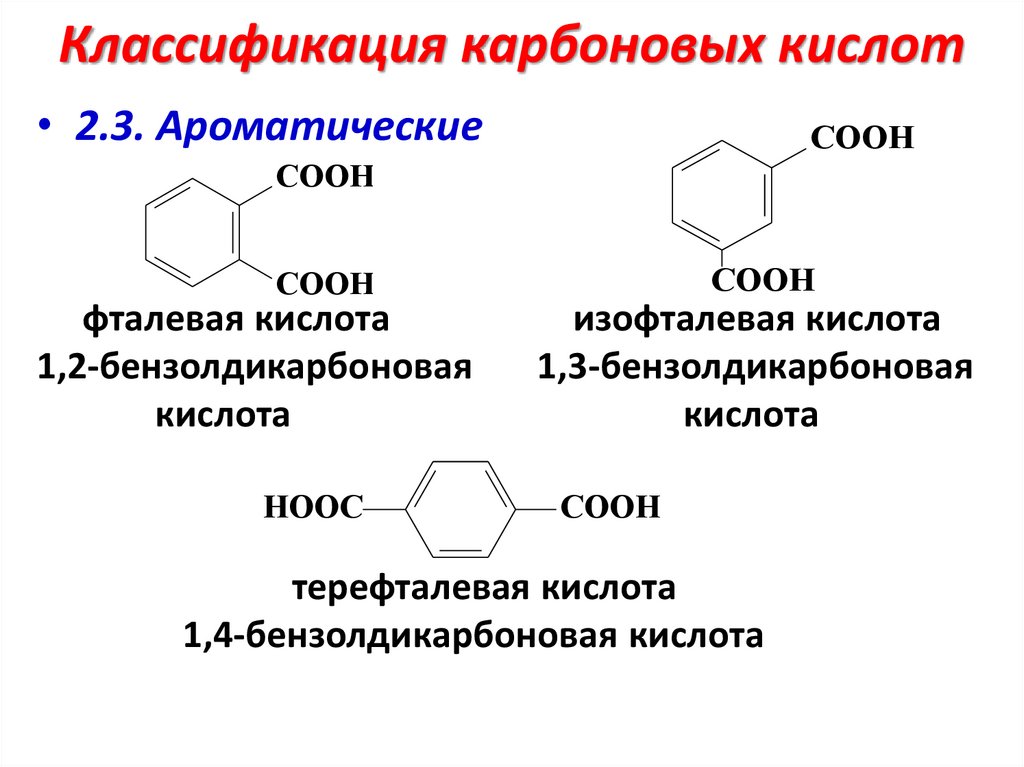
Классификация карбоновых кислот• 2.3. Ароматические
COOH
COOH
COOH
фталевая кислота
1,2-бензолдикарбоновая
кислота
HOOC
COOH
изофталевая кислота
1,3-бензолдикарбоновая
кислота
COOH
терефталевая кислота
1,4-бензолдикарбоновая кислота
7.
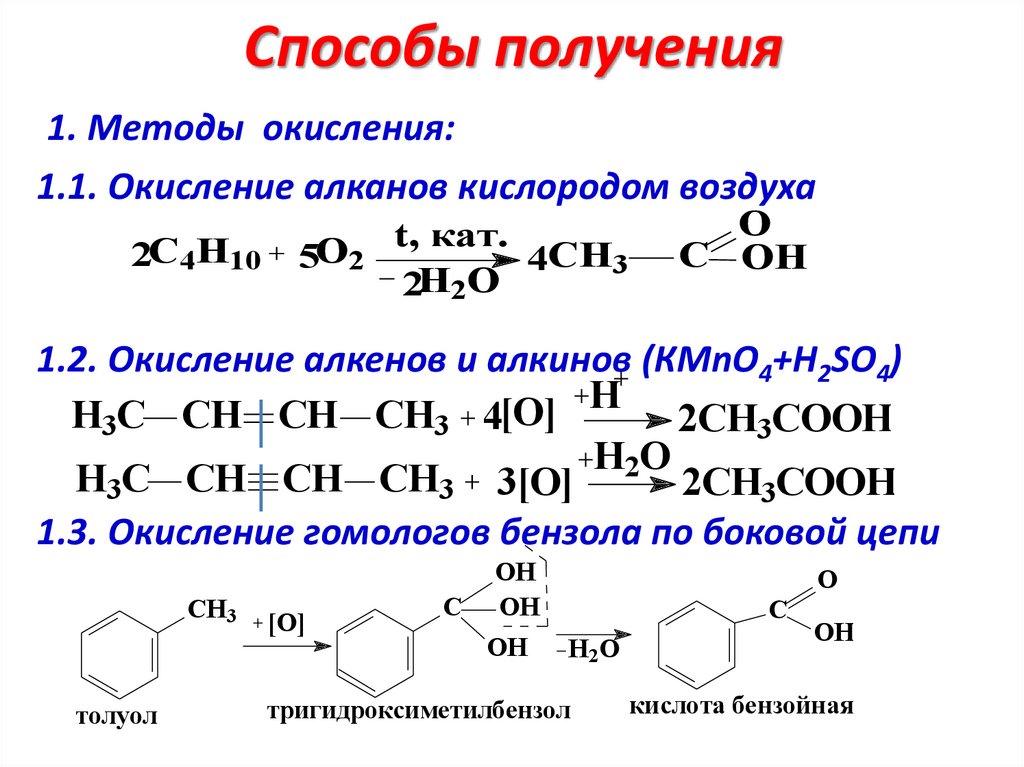
Способы получения1. Методы окисления:
1.1. Окисление алканов кислородом воздуха
2С4H10 5O2
t, кат.
4CH3
2H2O
O
C OH
1.2. Окисление алкенов и алкинов (КMnO4+H2SO4)
H
[O]
H3C CH CH CH3 4
2CH3COOH
H2O
H3C CH CH CH3 3[O]
2CH3COOH
1.3. Окисление гомологов бензола по боковой цепи
CH3
толуол
[O]
C
OH
OH
OH
O
C
H2O
тригидроксиметилбензол
OH
кислота бензойная
8.
Способы полученияCOOH
СH3
СH3
[O]
[O]
CH3
n ксилол
CH3
COOH
CH3
о ксилол
COOH
терефталевая кислота
SR
CHCl2
2 Cl2, hv
2HCl
SN 1
O H
C
CH
OH
2 NaOH вод.
_ NaCl
2
COOH
фталевая кислота
O
H
C
O
OH
[O]
_H O
2
1.4. Окисление спиртов и альдегидов
H3C CH2
OH
[O],kat.
CH3
H2O
O
C
H
[O],kat.
CH3COOH
1.5. Окисление кетонов в жестких условиях
H3C C CH2
O
CH2
CH3
[O]
HCOOH CH3CH2CH2COOH
CH3COOH CH3CH2COOH
9.
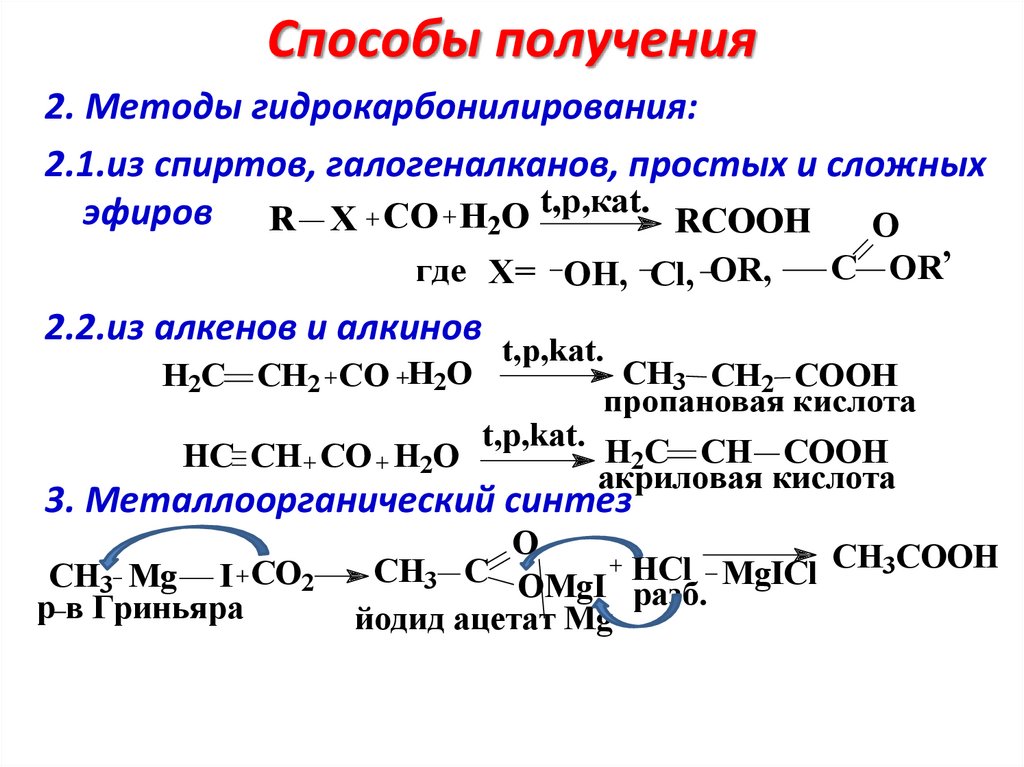
Способы получения2. Методы гидрокарбонилирования:
2.1.из спиртов, галогеналканов, простых и сложных
эфиров R X CO H2O t,p,каt. RCOOH O
где X= OH, Cl, OR,
2.2.из алкенов и алкинов
H2C CH2 CO H2O
HC CH CO H2O
,
C OR
t,p,kat.
t,p,kat.
CH3 CH2 COOH
пропановая кислота
H2C CH COOH
акриловая кислота
3. Металлоорганический синтез
CH3 Mg I CO2
р в Гриньяра
O
CH3 C OMgI HCl MgICl CH3COOH
разб.
йодид ацетат Mg
10.
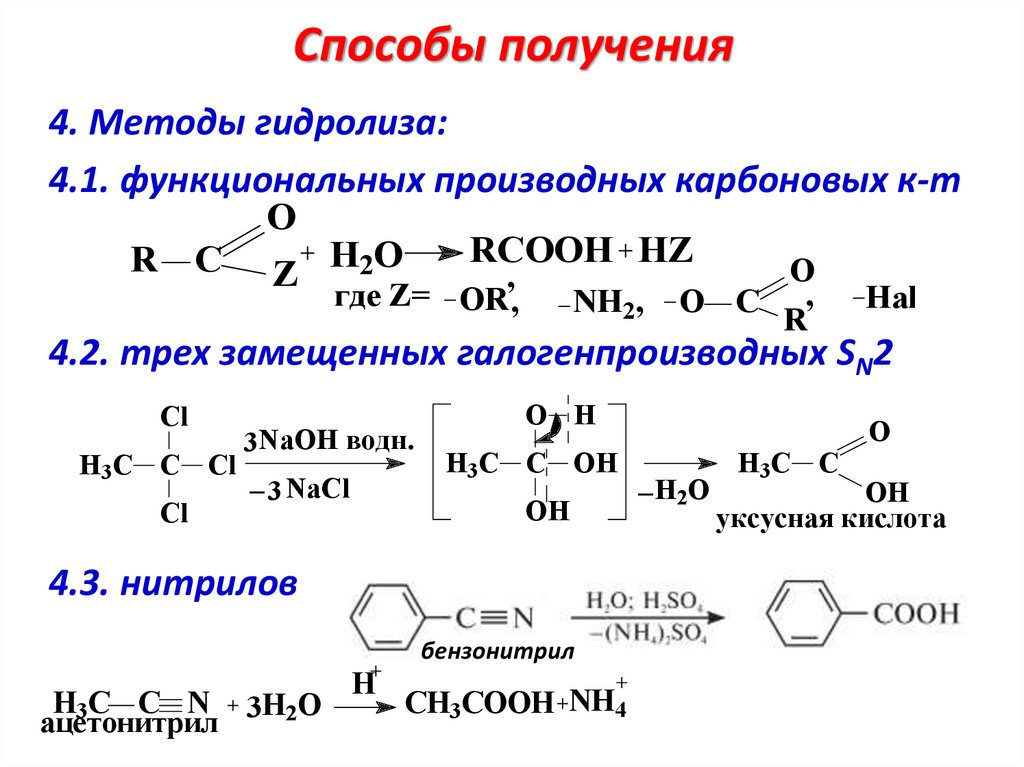
Способы получения4. Методы гидролиза:
4.1. функциональных производных карбоновых к-т
O
RCOOH HZ
R C Z H2O
O
,
где Z= OR ,
NH2,
O C
,
R
Hal
4.2. трех замещенных галогенпроизводных SN2
Cl
3NaOH водн.
H3C C Cl _
3 NaCl
Cl
O H
H3C C OH
OH
4.3. нитрилов
бензонитрил
H3C C N 3H2O
ацетонитрил
H
CH3COOH NH4
_H O
2
H3C C
O
OH
уксусная кислота
11.
Физические свойства• Начиная с муравьиной кислоты все кислоты
жидкости с высокой температурой кипения.
Дикарбоновые кислоты – твёрдые вещества.
• Это объясняется наличием водородной связи
R
C
O
O
H
H
O
O
C
R
• образуются циклические димеры
• Первые представители хорошо растворимы в воде,
высшие – нет
12.
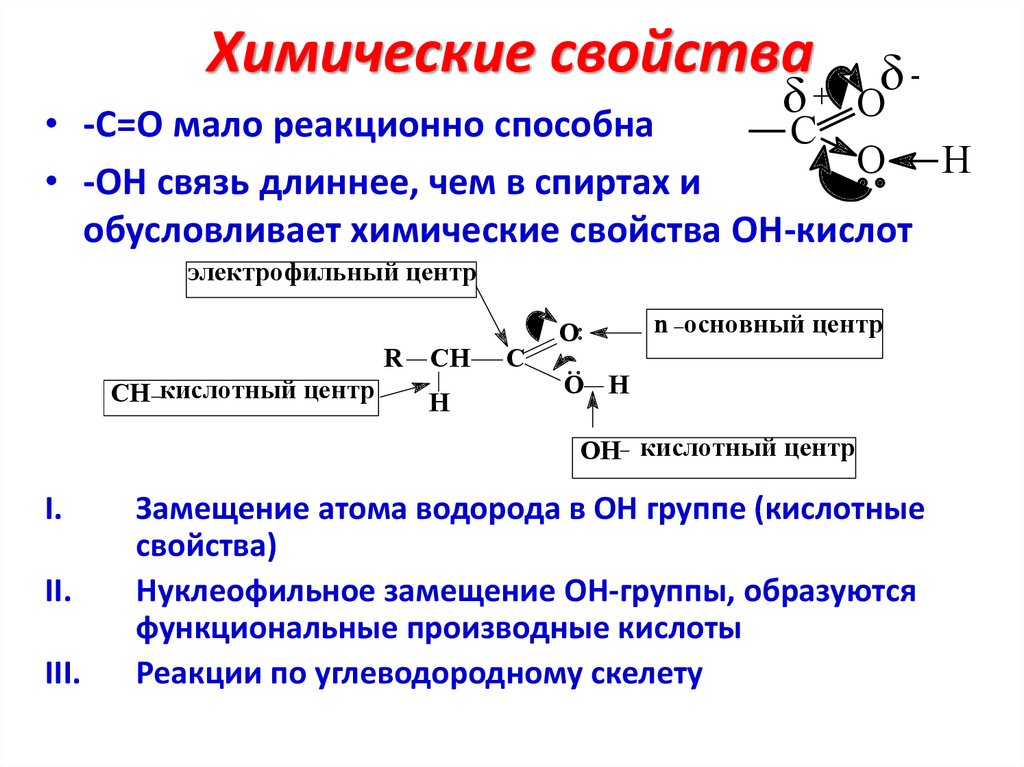
Химические свойства-
+ O
• -С=О мало реакционно способна
C
O H
• -ОН связь длиннее, чем в спиртах и
обусловливает химические свойства ОН-кислот
электрофильный центр
R CH
CH кислотный центр
H
C
O
n основный центр
O H
OH кислотный центр
I.
II.
III.
Замещение атома водорода в OH группе (кислотные
свойства)
Нуклеофильное замещение OH-группы, образуются
функциональные производные кислоты
Реакции по углеводородному скелету
13.
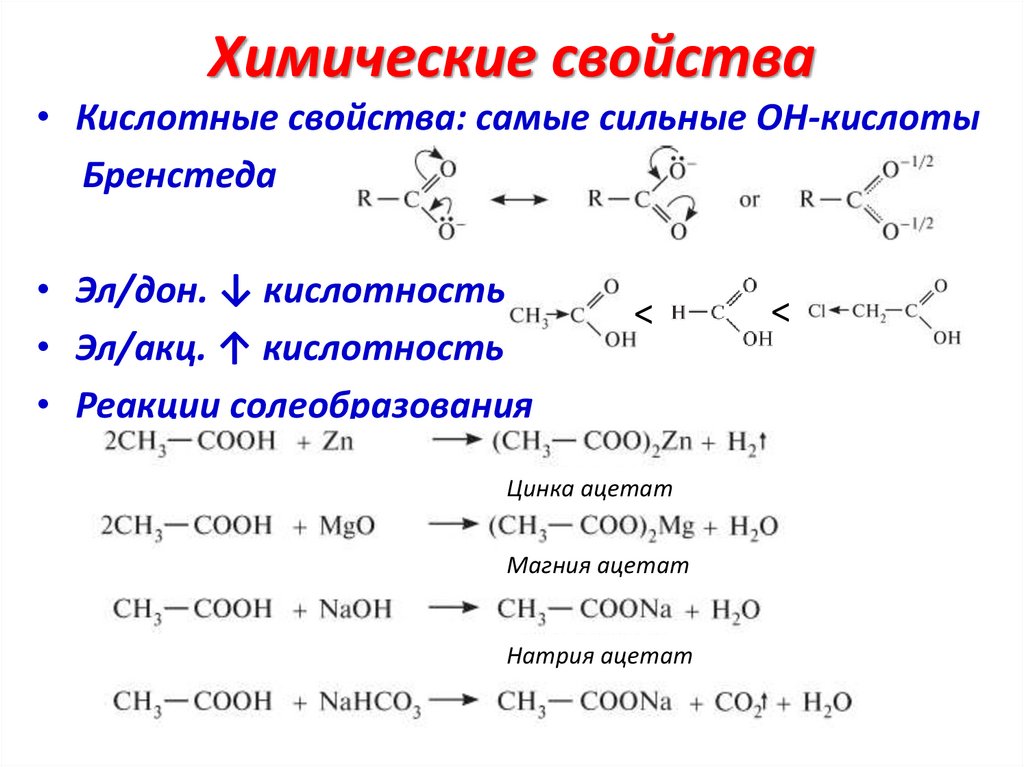
Химические свойства• Кислотные свойства: самые сильные ОН-кислоты
Бренстеда
• Эл/дон. ↓ кислотность
• Эл/акц. ↑ кислотность
• Реакции солеобразования
<
Цинка ацетат
Магния ацетат
Натрия ацетат
<
14.
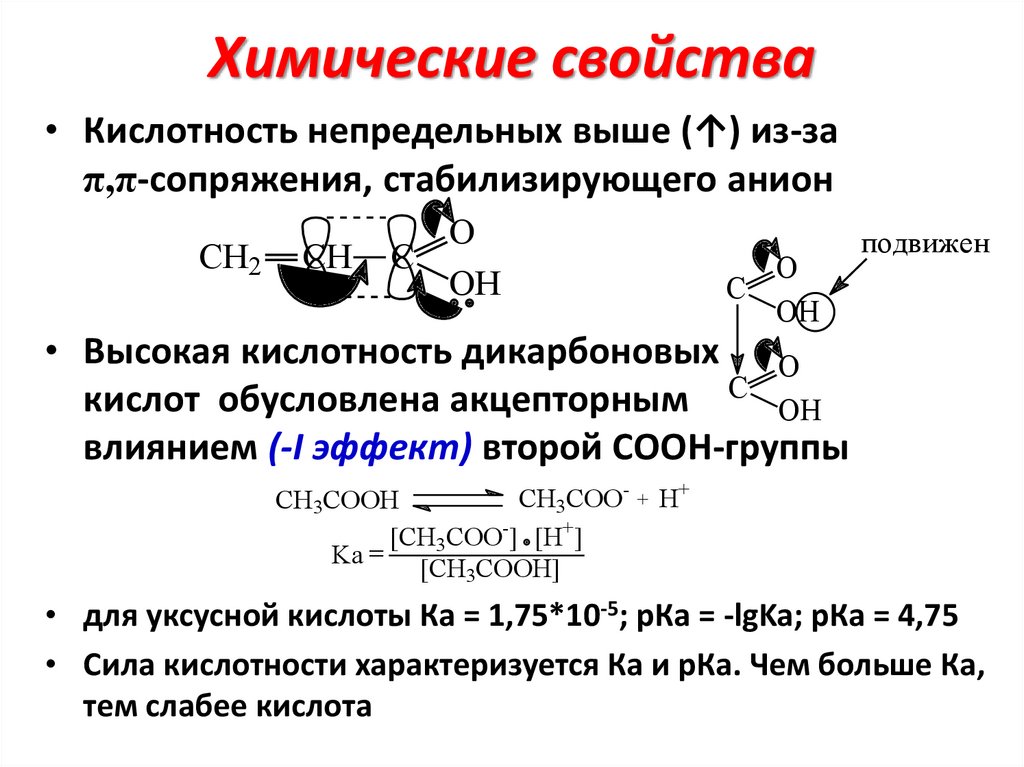
Химические свойства• Кислотность непредельных выше (↑) из-за
π,π-сопряжения, стабилизирующего анион
CH2
CH
O
C
OH
O
C
OH
подвижен
• Высокая кислотность дикарбоновых O
кислот обусловлена акцепторным C OH
влиянием (-I эффект) второй COOH-группы
CH3COO- + H+
CH3COOH
[CH3COO-] [H+]
Ka =
[CH3COOH]
• для уксусной кислоты Ка = 1,75*10-5; рКа = -lgKa; рКа = 4,75
• Сила кислотности характеризуется Ка и рКа. Чем больше Ка,
тем слабее кислота
15.
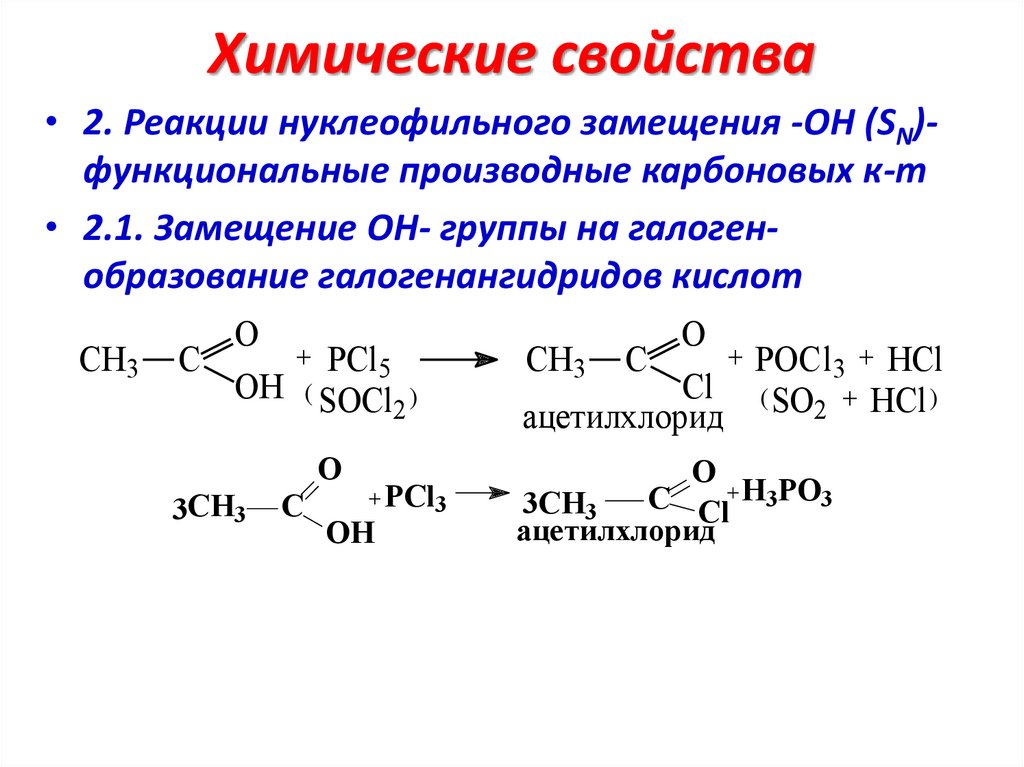
Химические свойства• 2. Реакции нуклеофильного замещения -ОН (SN)функциональные производные карбоновых к-т
• 2.1. Замещение ОН- группы на галогенобразование галогенангидридов кислот
CH3
O
+ PCl5
C
OH ( SOCl )
2
O
3CH3
C
OH
PCl3
O
+ POCl3 + HCl
CH3 C
Cl ( SO + HCl )
2
ацетилхлорид
O
C Cl H3PO3
3CH3
ацетилхлорид
16.
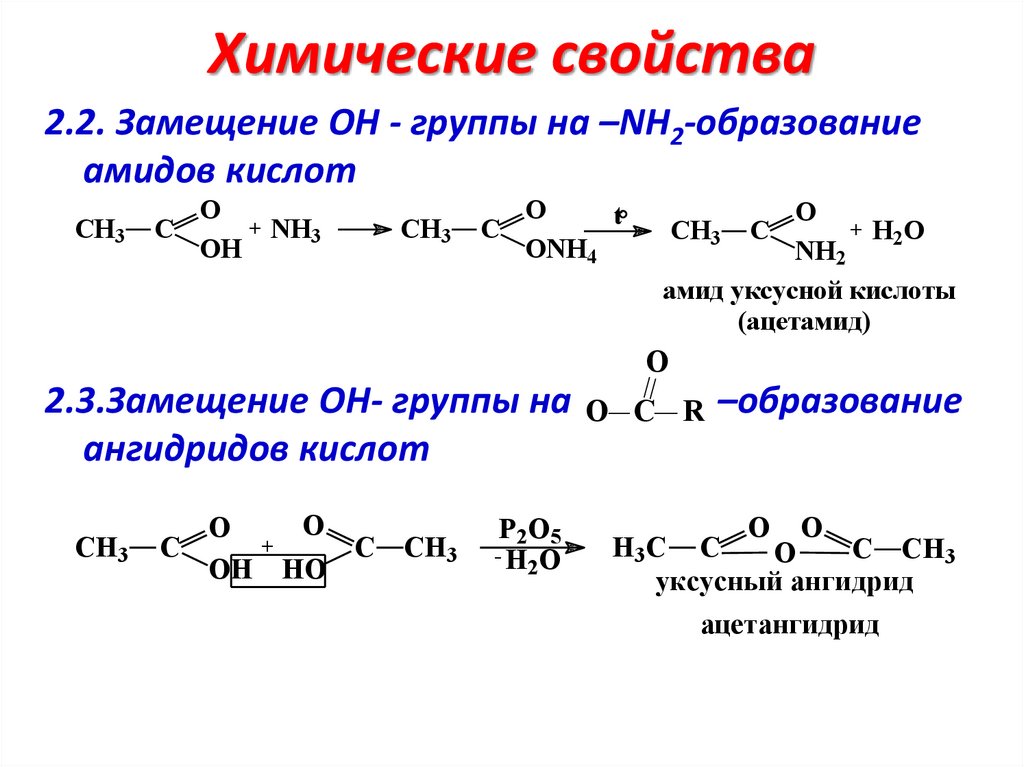
Химические свойства2.2. Замещение ОН - группы на –NH2-образование
амидов кислот
CH3
C
O
+ NH3
OH
CH3
C
O
t
ONH4
O
+ H2O
CH3 C
NH2
амид уксусной кислоты
(ацетамид)
O
2.3.Замещение ОН- группы на
ангидридов кислот
СH3
O
O
+
C
C CH3
OH HO
P2O5
-H O
2
O С R
–образование
O O
H3С C
C CH3
O
уксусный ангидрид
ацетангидрид
17.
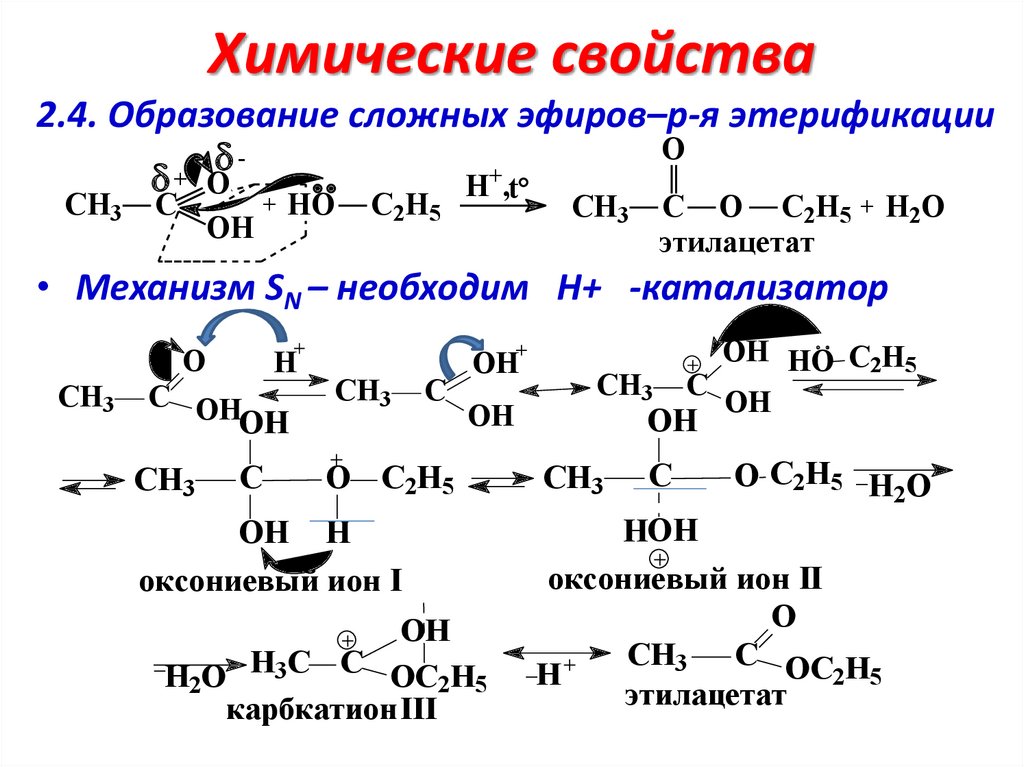
Химические свойства2.4. Образование сложных эфиров–р-я этерификации
O
+ O
H+,t
CH3
C
OH
+
HO
C2H5
CH3
C O C2H5
этилацетат
+
H2O
• Механизм SN – необходим Н+ -катализатор
O
CH3
H
C OH
OH
CH3
C
CH3
C
OH
OH
O C2H5
OH H
оксониевый ион I
OH
H2O H3C C OC2H5
карбкатион III
CH3
OH HO C2H5
C
OH
OH
CH3
C
O C2H5 H O
2
HOH
оксониевый ион II
O
CH3 C OC H
2 5
H
этилацетат
18.
Химические свойства3. Реакции идущие по СН-кислотному центру
3.1. Реакция Гелля-Фольгарда-Зелинского замещение α–Н на галогены
PCl3
H3C CH COOH Cl2 HCl H3C CH COOH Cl2
Cl
Cl
H
хлорпропионовая к та
H3C C COOH
HCl
Cl
дихлорпропионовая
3.2. Реакция присоединения HCl против правила
Марковникова
O
HCl
H2C CH C
OH
H2C CH2
COOH
Cl
хлорпропионовая к та
19.
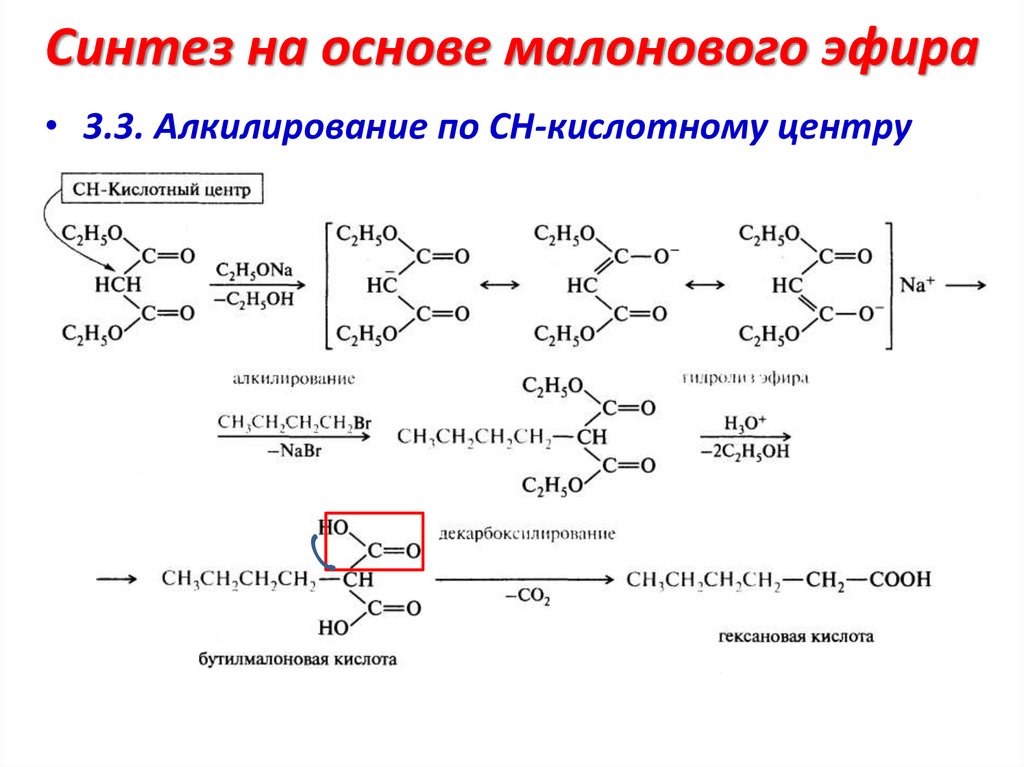
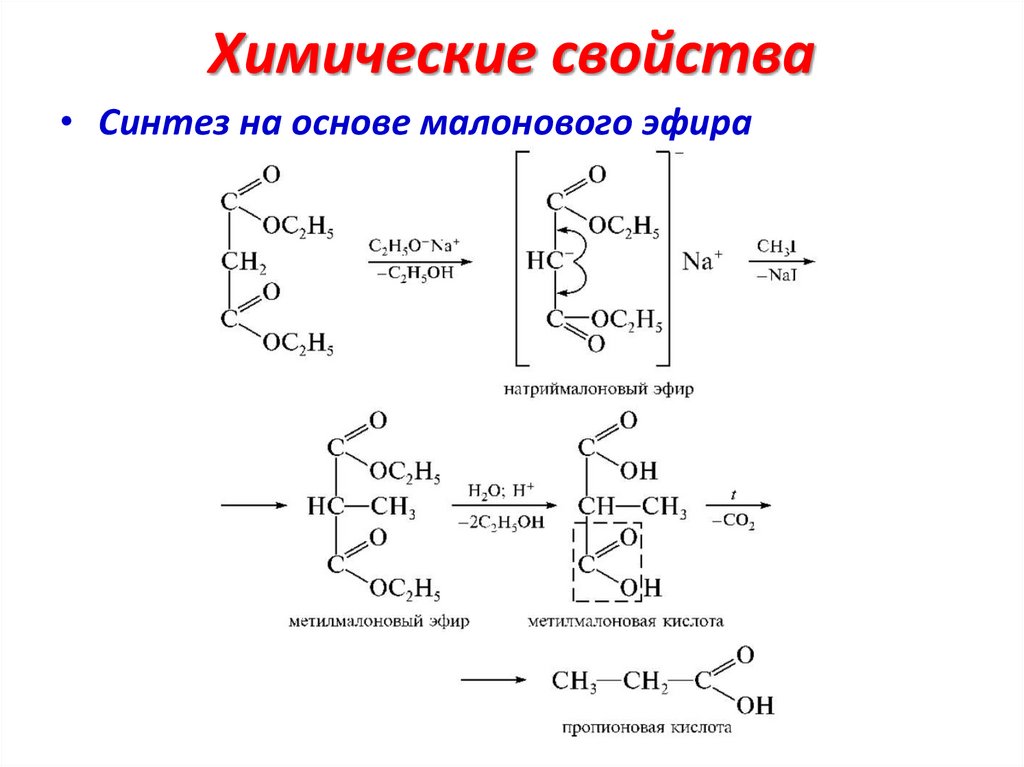
Синтез на основе малонового эфира• 3.3. Алкилирование по СН-кислотному центру
20.
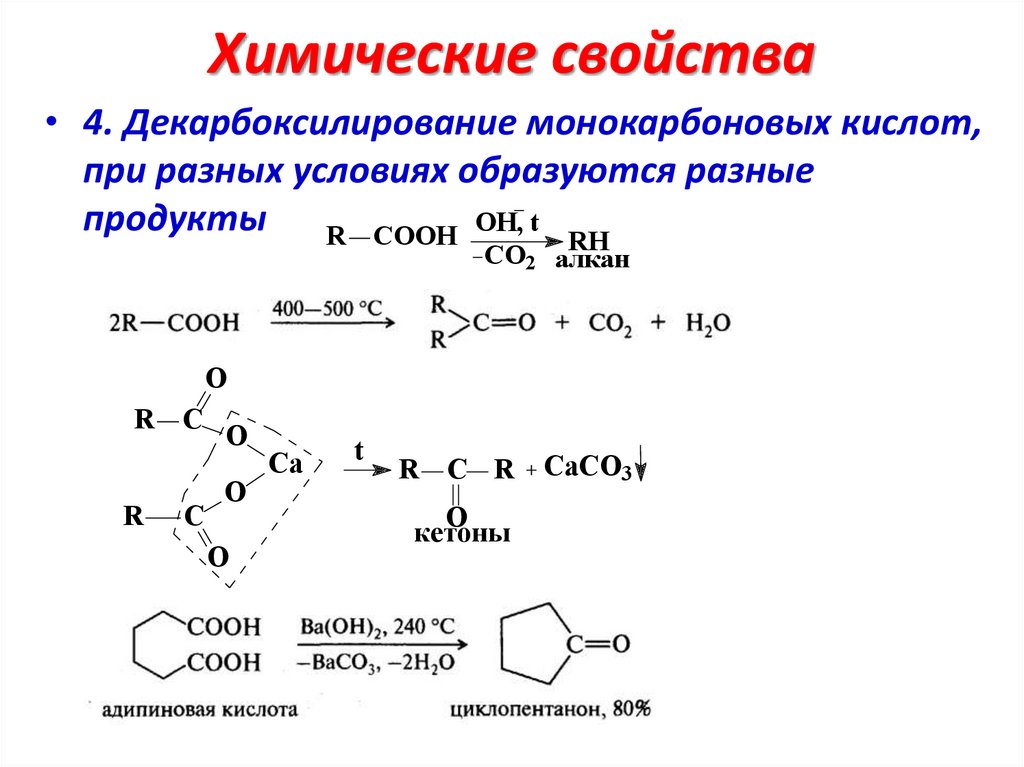
Химические свойства• 4. Декарбоксилирование монокарбоновых кислот,
при разных условиях образуются разные
продукты R COOH OH, t RH
CO2 алкан
O
R C
R
C
O
O
O
Ca
t
R C R
O
кетоны
CaCO3
21.
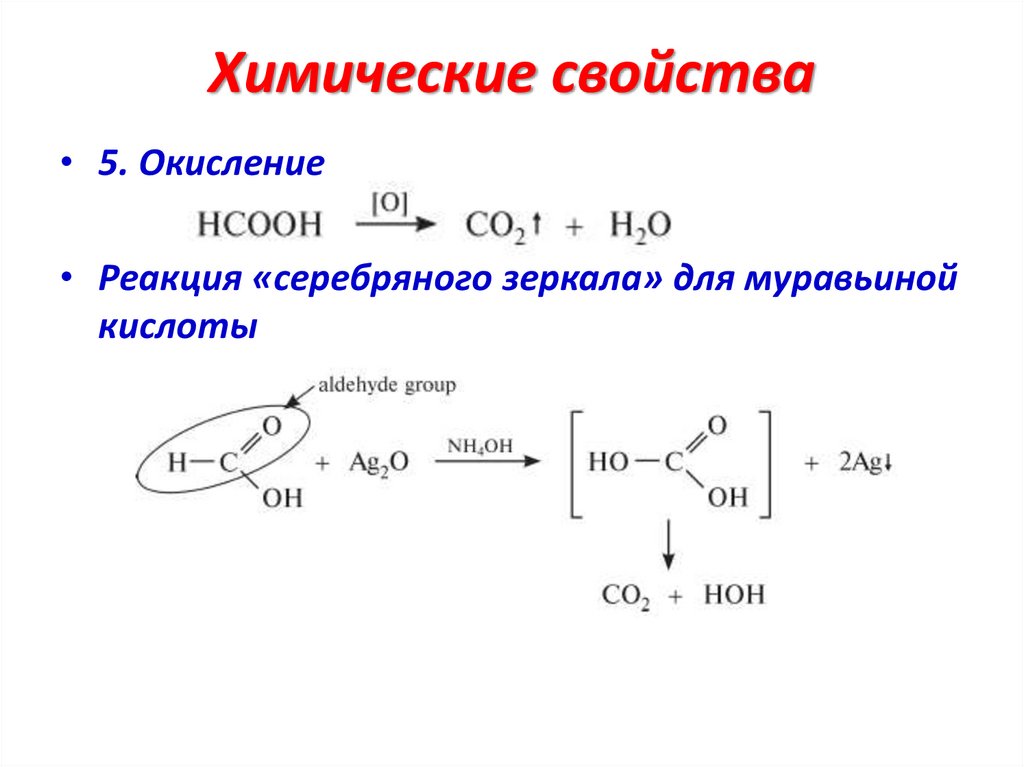
Химические свойства• 5. Окисление
• Реакция «серебряного зеркала» для муравьиной
кислоты
22.
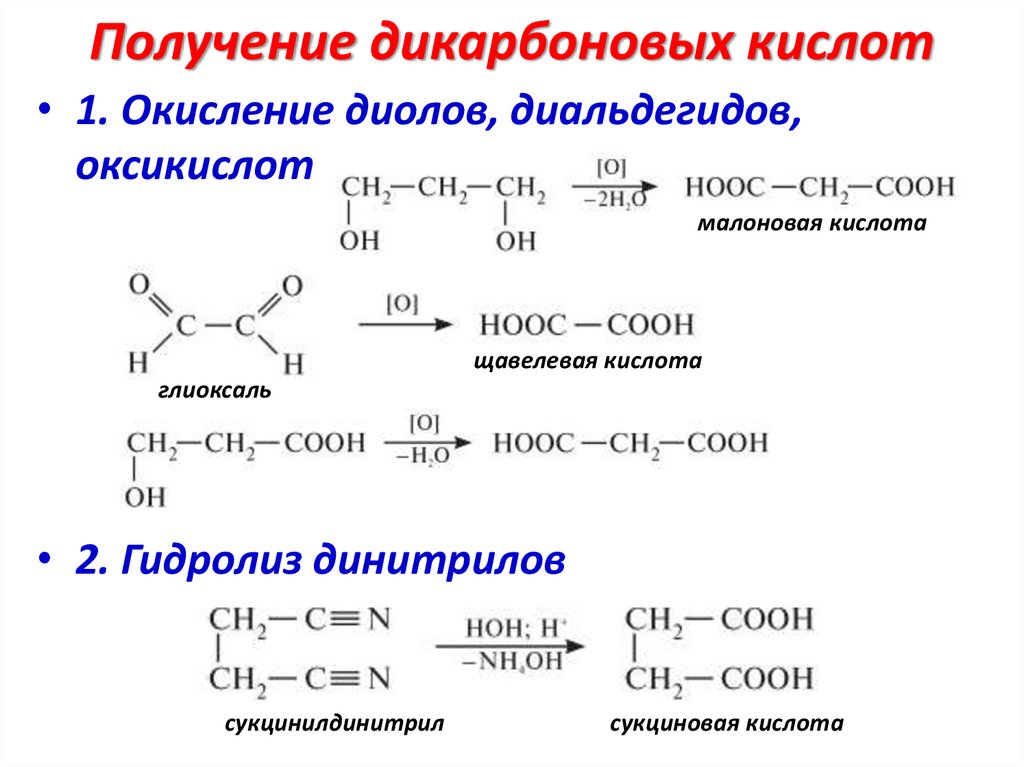
Получение дикарбоновых кислот• 1. Окисление диолов, диальдегидов,
оксикислот
малоновая кислота
щавелевая кислота
глиоксаль
• 2. Гидролиз динитрилов
сукцинилдинитрил
сукциновая кислота
23.
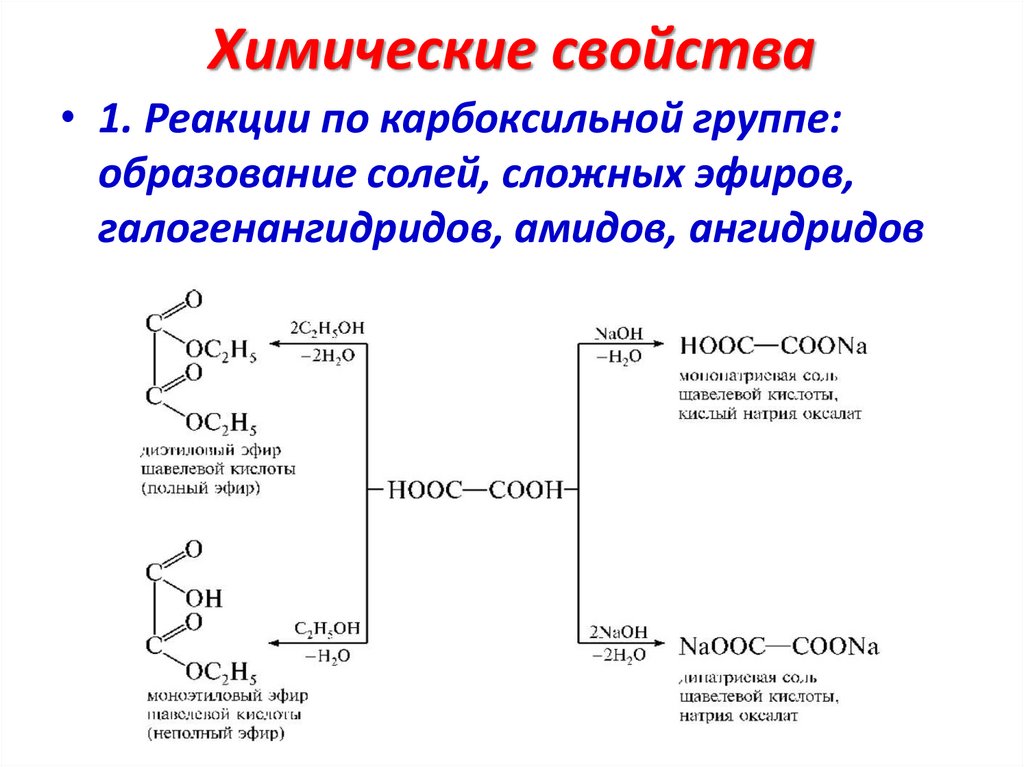
Химические свойства• 1. Реакции по карбоксильной группе:
образование солей, сложных эфиров,
галогенангидридов, амидов, ангидридов
24.
Химические свойства• 5.Поведение дикарбоновых кислот при нагревании
• 5.1. Декарбоксилирование (0-1 «С» между –СООН)
2000
HOOC COOH
HCOOH CO2
метановая
кислота
щавелевая к та
1500
t
HOOC CH2 COOH
CH3COOH CO2
малоновая кислота
этановая кислота
• 5.2. Дегидратация (2-3 «С» между –СООН)
H2C
C
O
OH
OH
C
H2 C
O
янтарная кислота
t
H2O
H2C
C
O
O
H2C C O
ангидрид
янтарной к ты
фуран 2,5 дион
O
NH3
H2O
NH
имид O
янтарной к ты
сукцинимид
25.
ХимическиеO свойстваO
CH2
H2C
C
OH
C OH
O
глутаровая кислота
CH2
t
H2O
O
O
глутаровый
ангидрид
• 5.3. Декарбоксилирование и дегидратация (4-5
«С» между –СООН)
H2C CH2
C
O
OH
C OH
O
адипиновая кислота
H2C CH2
СH2
СH2
СH2
СH2
O
O
O
C
O
C
Сa
t
O
H2O
CO2 циклопентанон
t
- CaCO
3
СH2
СH2
СH2
СH2
C
O
кетон
26.
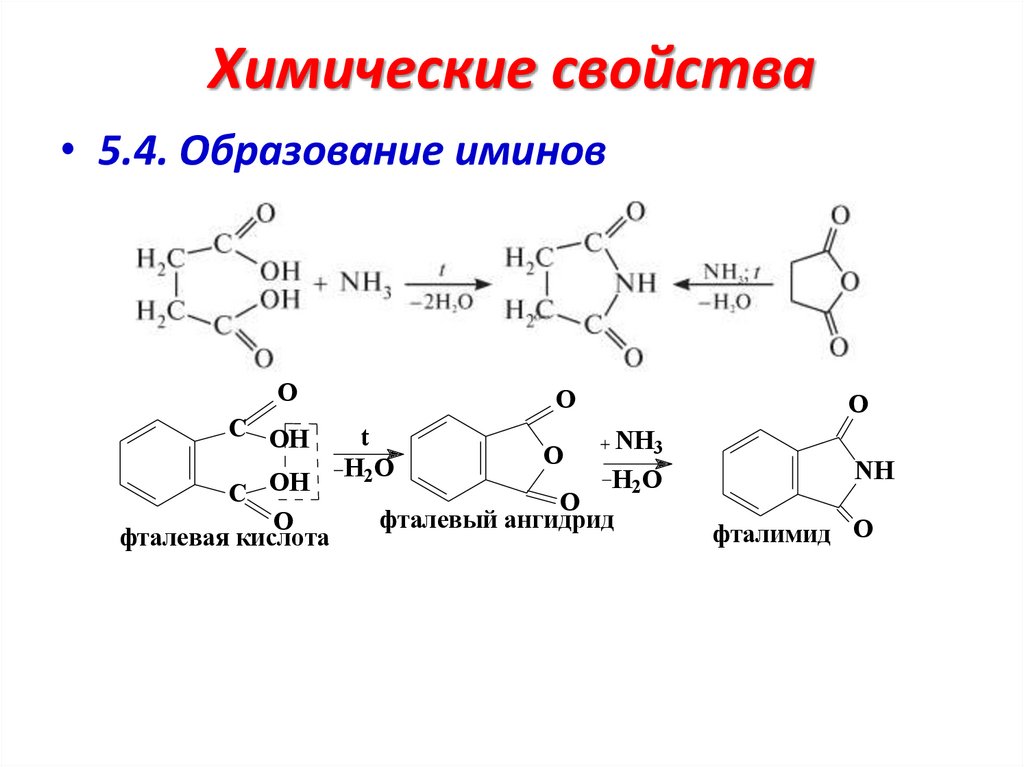
Химические свойства• 5.4. Образование иминов
O
С OH
С OH
O
фталевая кислота
O
t
H2O
O
O
NH3
H2O
O
фталевый ангидрид
NH
фталимид O
27.
Химические свойства• Синтез на основе малонового эфира
28.
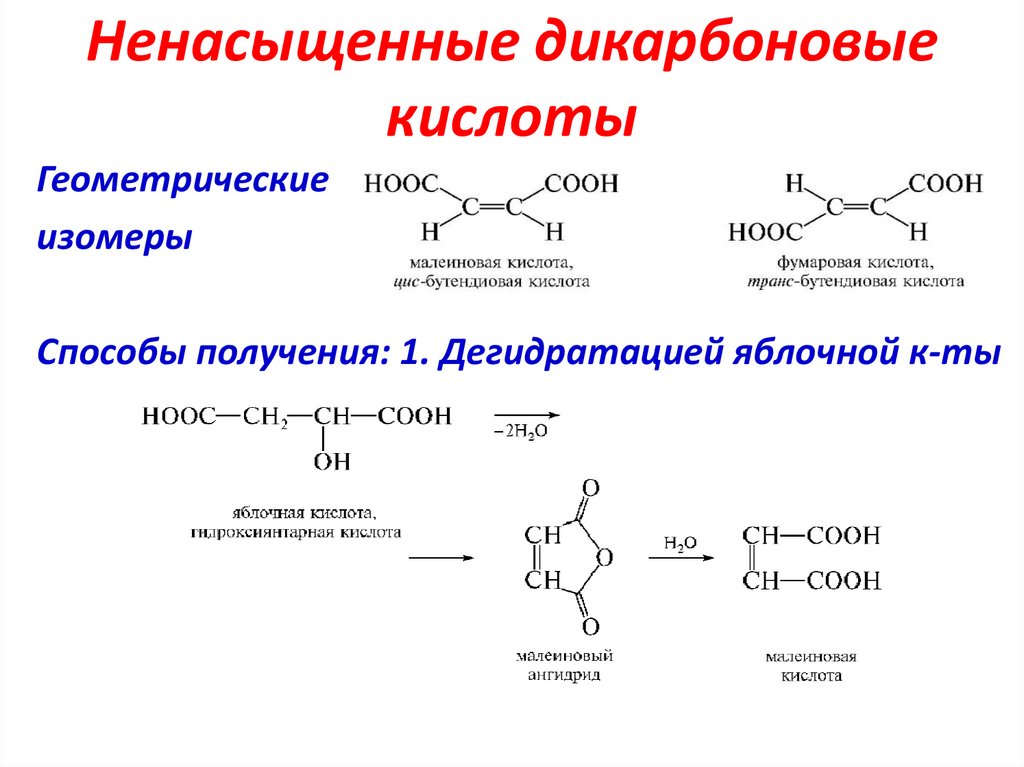
Ненасыщенные дикарбоновыекислоты
Геометрические
изомеры
Способы получения: 1. Дегидратацией яблочной к-ты
29.
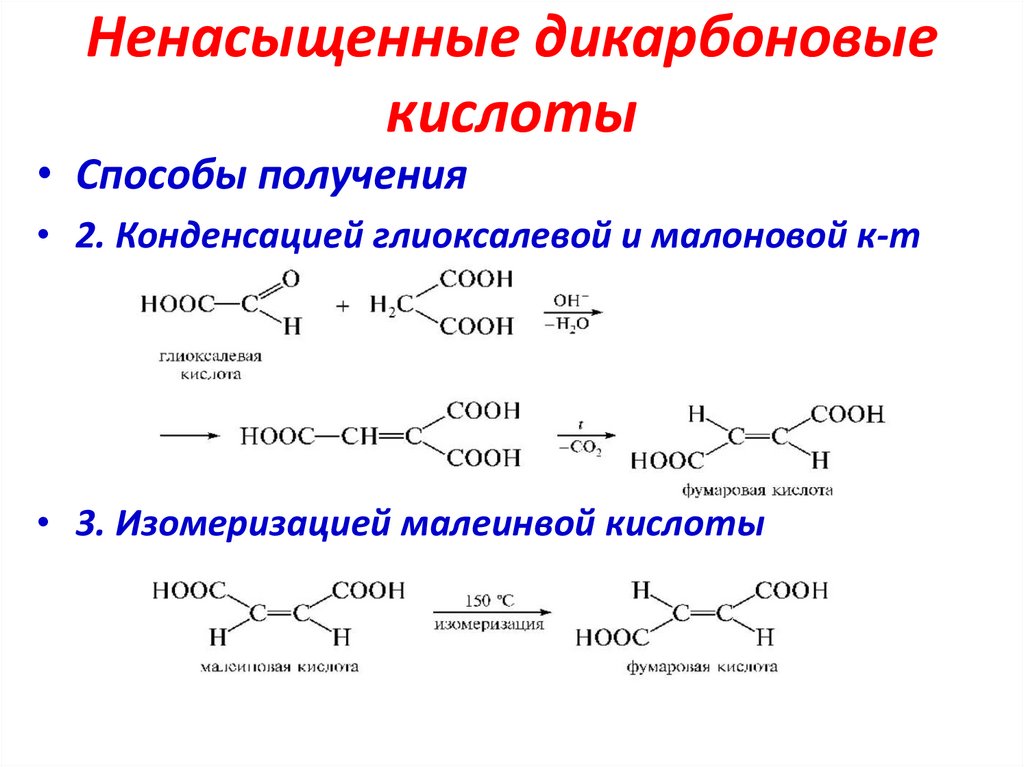
Ненасыщенные дикарбоновыекислоты
• Способы получения
• 2. Конденсацией глиоксалевой и малоновой к-т
• 3. Изомеризацией малеинвой кислоты
30.
Ненасыщенные дикарбоновыекислоты
• Химические свойства: 1. реакции по >C=C<
• 2. Дегидратация при нагревании (фумаровая к-та
ангидрид не образует)
31.
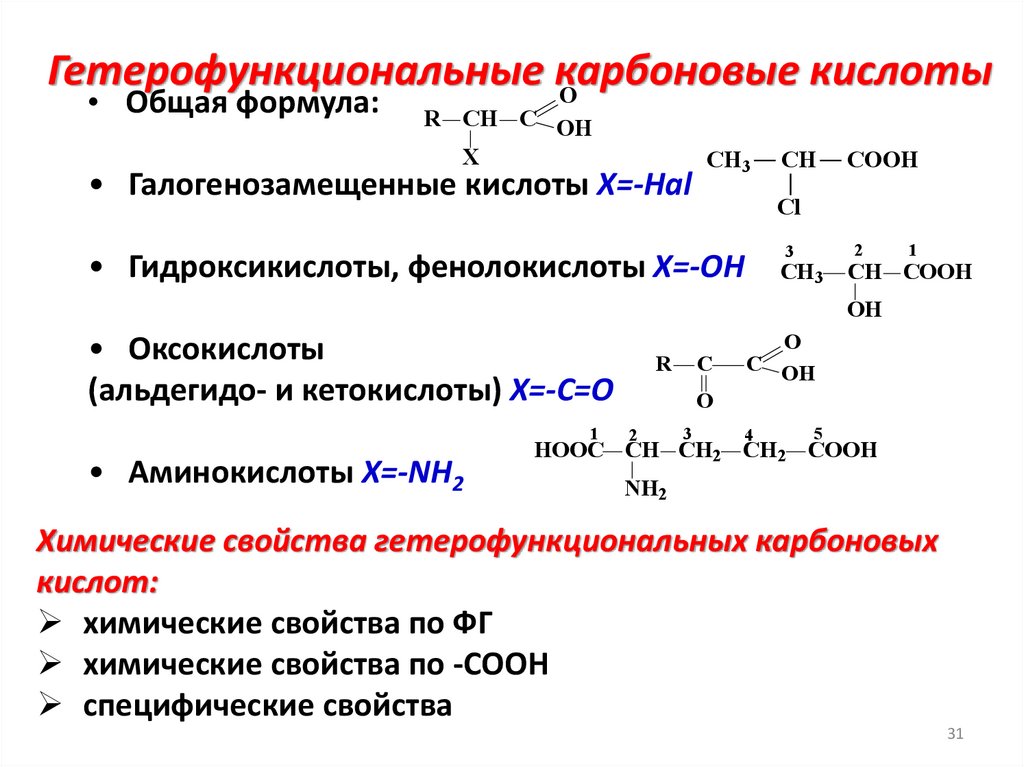
Гетерофункциональные карбоновыекислоты
O
• Общая формула:
R CH C OH
X
• Галогенозамещенные кислоты Х=-Наl
CH3
CH
COOH
Cl
3
• Гидроксикислоты, фенолокислоты Х=-ОН
CH3
2
1
CH COOH
OH
• Оксокислоты
(альдегидо- и кетокислоты) Х=-С=О
1
• Аминокислоты X=-NH2
R
C
O
C OH
O
2
3
4
5
HOOC CH CH2 CH2 COOH
NH2
Химические свойства гетерофункциональных карбоновых
кислот:
химические свойства по ФГ
химические свойства по -СООН
специфические свойства
31
32.
Галогенозамещенные карбоновые кислоты• Благодаря -I эффекту карбоксильной
CH3 CH
группы увеличивается подвижность Hal,
CI
он легко замещается на -OH, -CN, -NH2
группы, особенно, если находится в α положении
COOH
• Методы получения:
• Галогенирование
• Гидрогалогенирование непредельных кислот
33.
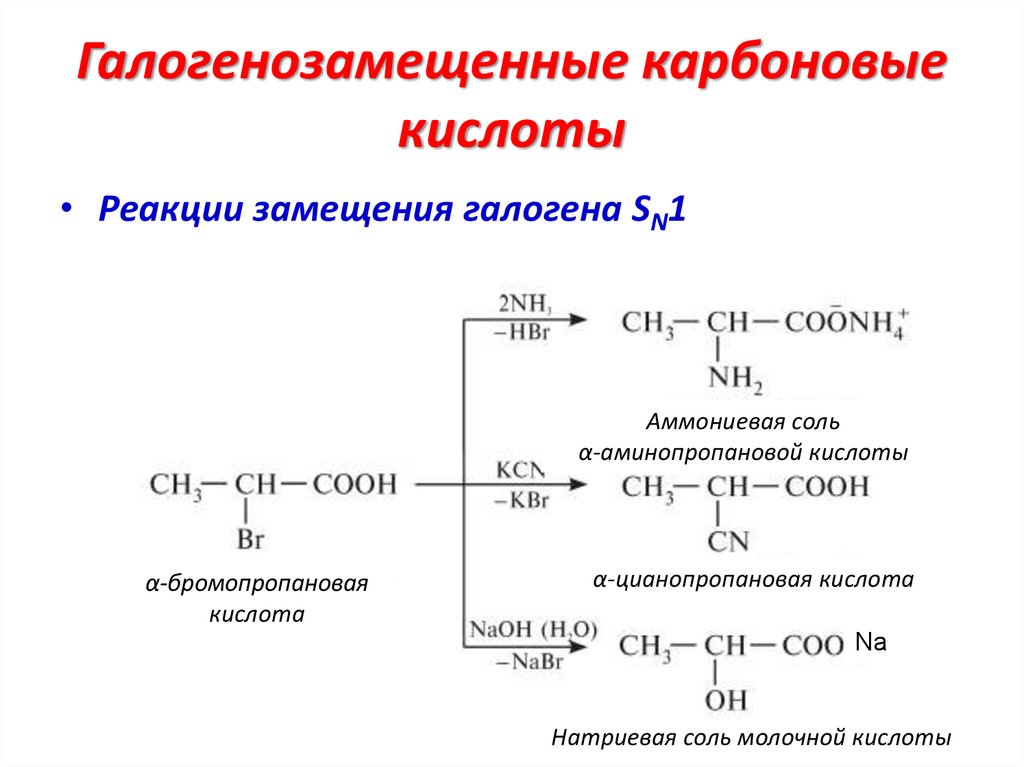
Галогенозамещенные карбоновыекислоты
• Реакции замещения галогена SN1
Аммониевая соль
α-аминопропановой кислоты
α-бромопропановая
кислота
α-цианопропановая кислота
Na
Натриевая соль молочной кислоты
34.
Гидроксикислоты• молочная кислота (лактат)
• 2-гидроксипропановая кислота
• α – гидроксипропионовая кислота
3
CH3
2
1
CH COOH
OH
1
2
3
4
3
4
• яблочная кислота (малат) HOOC CH CH2 COOH
• 2-гидроксибутандиовая кислота
• α – гидроксиянтарная кислота
• винная кислота (тартрат)
• дигидроксиянтарная кислота
• 2,3- дигидроксибутандиовая кислота
• лимонная кислота (цитрат)
• 2-гидрокси-1,2,3-трикарбоновая к-та
OH
2
1
HOOC CH CH
COOH
OH OH
1
CH2
COOH
2
HO C COOH
3
CH2
COOH
35.
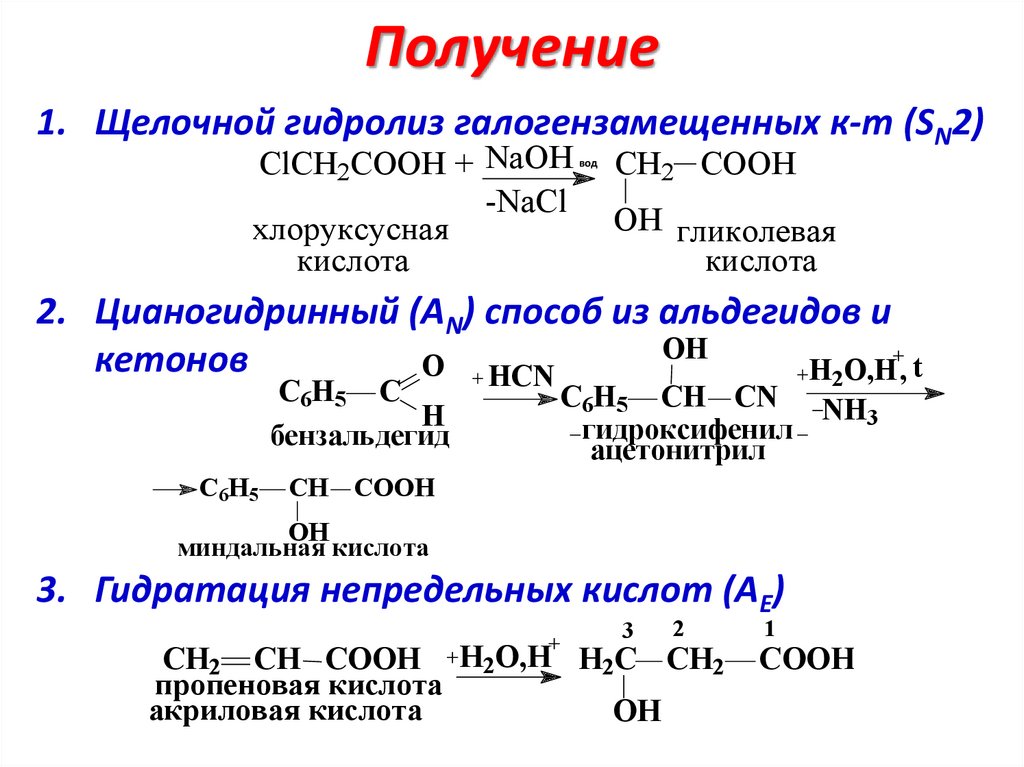
Получение1. Щелочной гидролиз галогензамещенных к-т (SN2)
ClCH2COOH + NaOH
-NaCl
хлоруксусная
кислота
вод
.
CH2 COOH
OH гликолевая
кислота
2. Цианогидринный (АN) способ из альдегидов и
OH
кетонов
O HCN
H2O,H, t
C6H5 C
H
бензальдегид
C6H5
C6H5 CH CN NH
3
гидроксифенил
ацетонитрил
CH COOH
OH
миндальная кислота
3. Гидратация непредельных кислот (АЕ)
3
2
CH2 CH COOH Н2O,H H2C CH2
пропеновая кислота
акриловая кислота
OH
1
COOH
36.
Химические свойства гидроксикислот1. Взаимодействие со щелочью, с натрием
R CH COOH
OH
NaOH R CH COONa
H2O
OH
R CH COOH
OH
2Na
H2
R CH COONa
2. Взаимодействие с кислотой
R CH COOH
OH
HCl
H2O
3.Окисление
R CH COOH
OH
R CH COOH
Cl
хлоркислота
[O]
H2O
R C COOH
O
оксокислота
4. Взаимодействие с галогенидами фосфора
R CH COOH
OH
PCl5
H2O
POCl3
R CH C O
Cl
Cl
ONa
37.
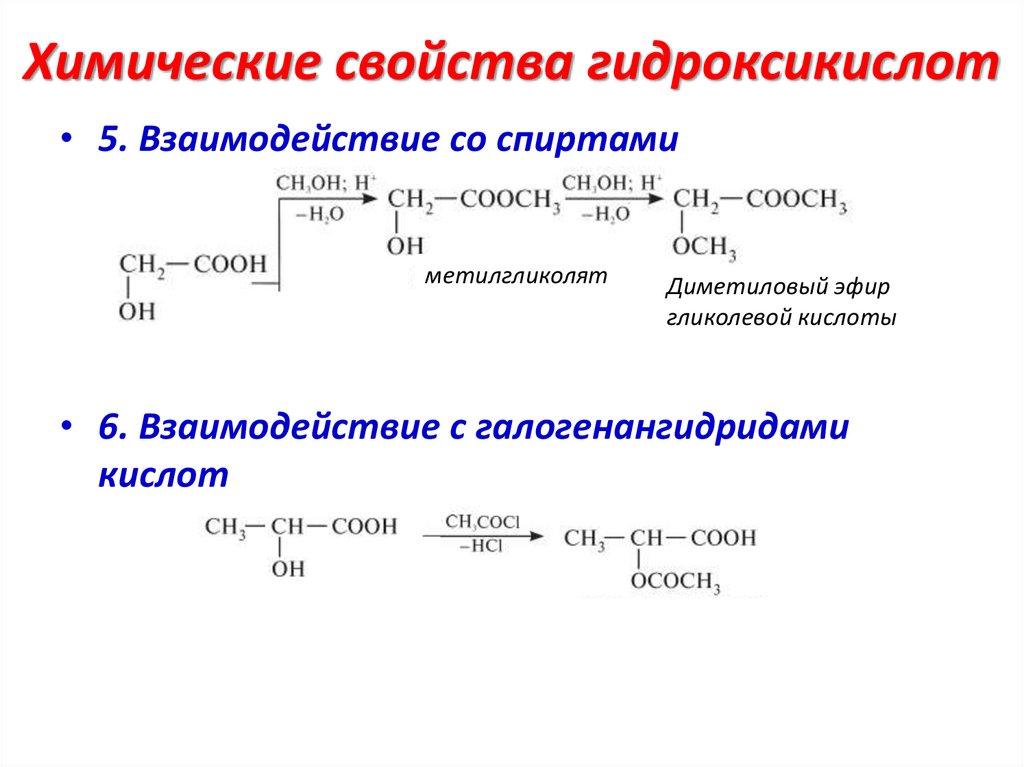
Химические свойства гидроксикислот• 5. Взаимодействие со спиртами
метилгликолят
Диметиловый эфир
гликолевой кислоты
• 6. Взаимодействие с галогенангидридами
кислот
38.
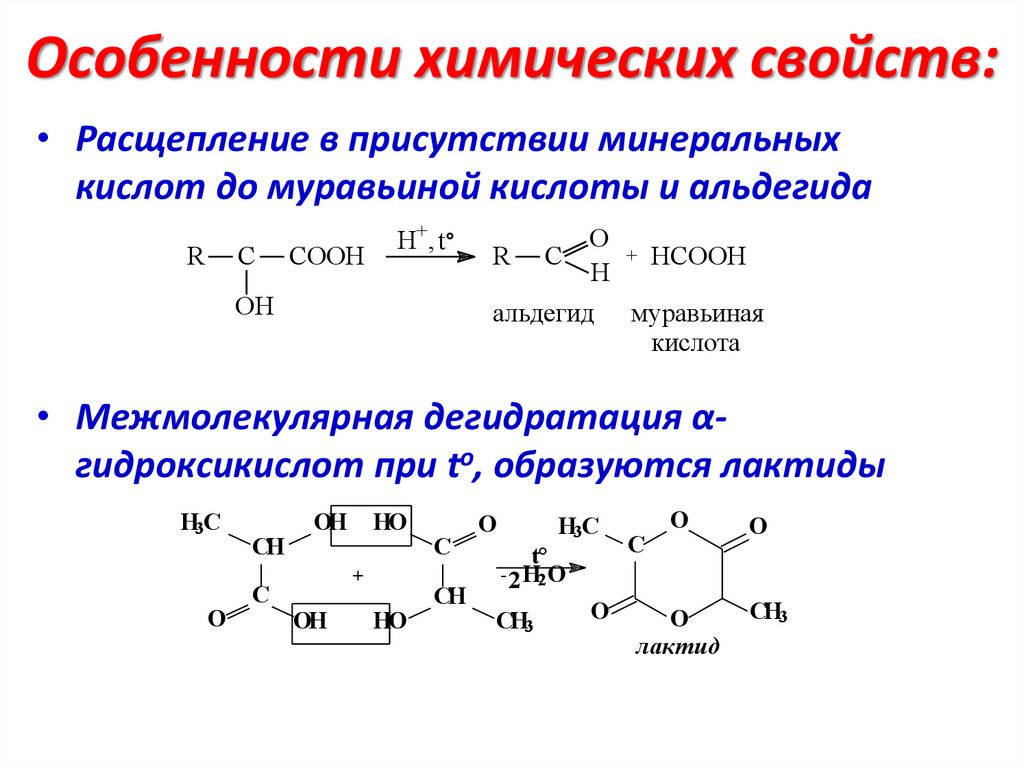
Особенности химических свойств:• Расщепление в присутствии минеральных
кислот до муравьиной кислоты и альдегида
R
C
COOH
H+, t
OH
R
C
O
H
альдегид
+
HCOOH
муравьиная
кислота
• Межмолекулярная дегидратация αгидроксикислот при to, образуются лактиды
H3C
O
CH
C
OH
HO
+
OH
HO
C
CH
O
H3C
t
- 2 H2O
CH3
O
C
O
O
лактид
O
CH3
39.
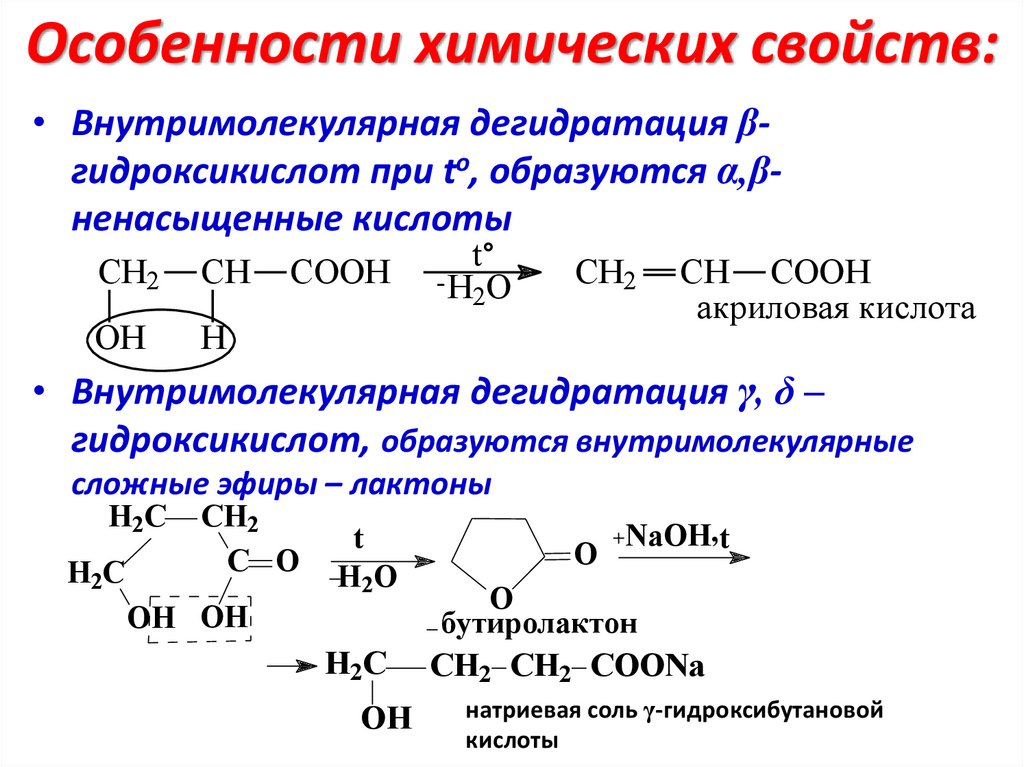
Особенности химических свойств:• Внутримолекулярная дегидратация βгидроксикислот при to, образуются α,βненасыщенные кислоты
СH2
CH
OH
H
COOH
t
-H O
2
CH2
CH COOH
акриловая кислота
• Внутримолекулярная дегидратация γ, δ –
гидроксикислот, образуются внутримолекулярные
сложные эфиры – лактоны
H2C
H2C
CH2
C O
t
H2O
OH OH
H2C
OH
O
NaOH,t
O
бутиролактон
CH2 CH2 COONa
натриевая соль γ-гидроксибутановой
кислоты
40.
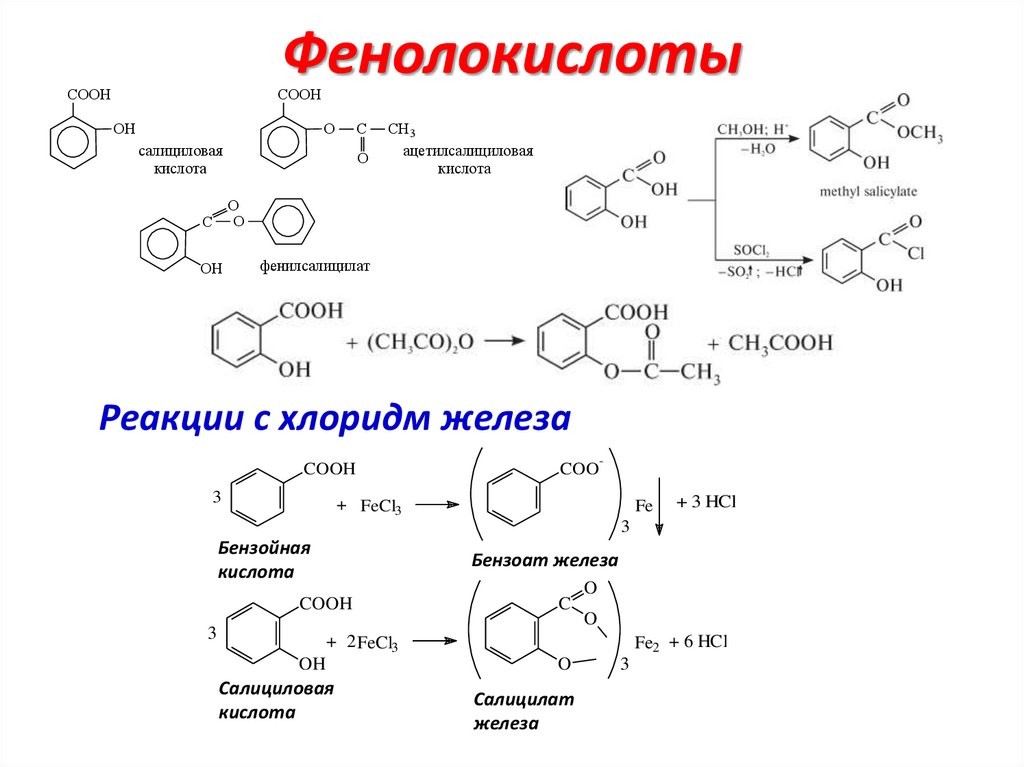
ФенолокислотыCOOH
COOH
OH
O
С
салициловая
кислота
O
СH3
ацетилсалициловая
кислота
O
O
С
OH
фенилсалицилат
Реакции с хлоридм железа
COOH
3
-
+ FeCl3
Fe
Бензоат
железа
ðîçîâûé
кислота
COOH
C
O
O
+ 2 FeCl3
OH
ñàëèöèëîâàÿ
Салициловая
êèñëîòà
кислота
+ 3 HCl
3
áåíçîéíàÿ
Бензойная
êèñëîòà
3
COO
Fe2 + 6 HCl
O
Салицилат
ñèíå-ôèîëåòîâûé
железа
3
41.
Химические свойстваароматических кислот
• -СООН мета-ориентант SE
Бензойная
кислота
• Декарбоксилирование
м-нитробензойная кислота
42.
Оксокислоты (альдегидо- и кето-)O
H
CH3
СOOH
С
C
глиоксиловая в незрелых фруктах
(глиоксалевая)
COOH
O
CH3
C
O
CH2
O
C
OC2H5
пировиноградная
в курсе биохимии
изучается
(пируват)
ацетоуксусный эфир (кислота)
-оксокислота
широко используется в синтезах
42
43.
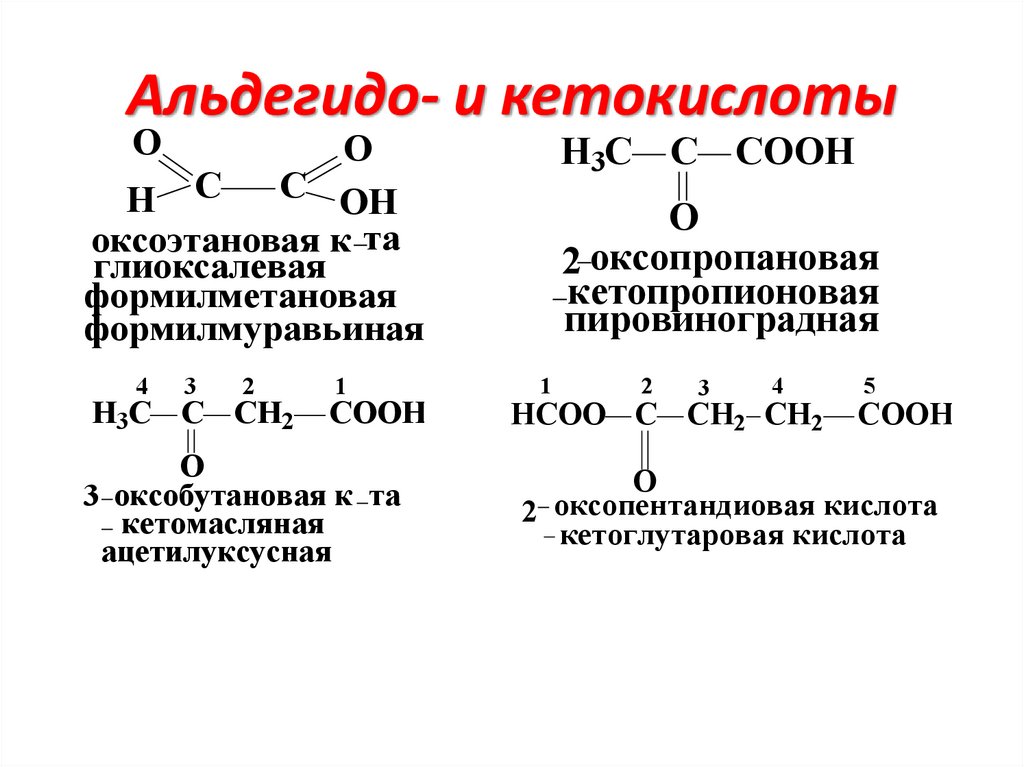
Альдегидо- и кетокислотыO
O
C OH
H C
оксоэтановая к та
глиоксалевая
формилметановая
формилмуравьиная
4
3
2
H3C C CH2
1
COOH
O
3 оксобутановая к та
кетомасляная
ацетилуксусная
H3С C COOH
O
2 оксопропановая
кетопропионовая
пировиноградная
1
2
3
4
HCOO C CH2 CH2
5
COOH
O
2 оксопентандиовая кислота
кетоглутаровая кислота
44.
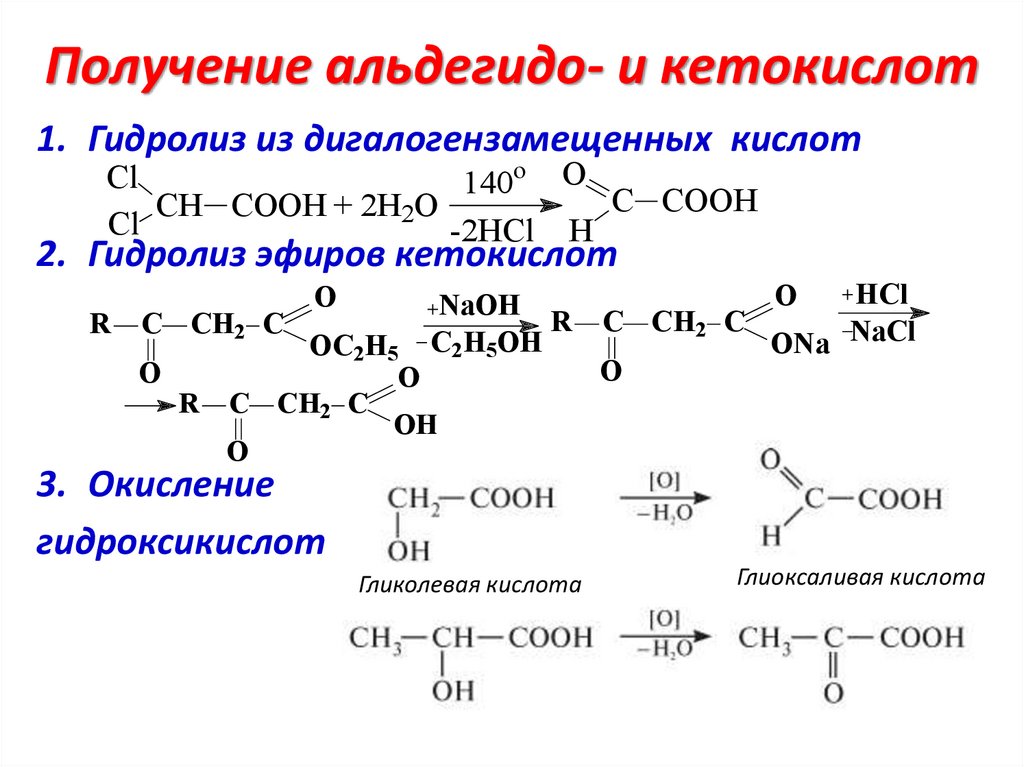
Получение альдегидо- и кетокислот1. Гидролиз из дигалогензамещенных кислот
Cl
140o O
C COOH
CH COOH + 2H2O
Cl
-2HCl H
2. Гидролиз эфиров кетокислот
R
C CH2 C
O
NaOH
R
C2H5OH
OC2H5
O
O
R C CH2 C
OH
O
HCl
C CH2 C
ONa NaCl
O
O
3. Окисление
гидроксикислот
Гликолевая кислота
Глиоксаливая кислота
45.
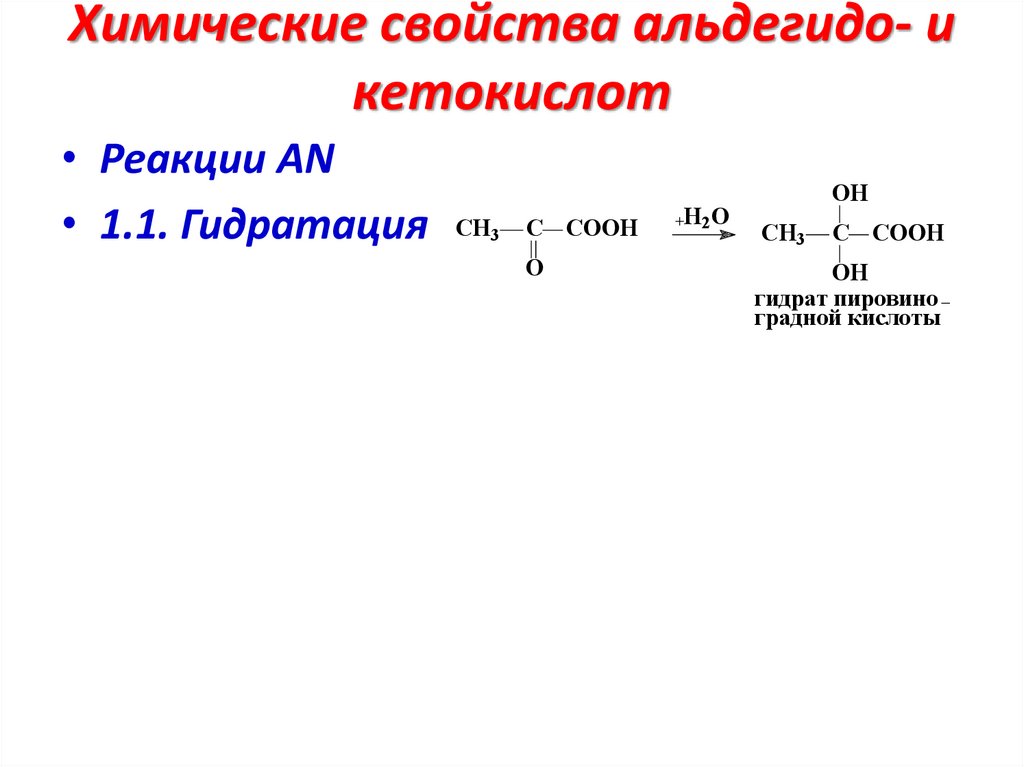
Химические свойства альдегидо- икетокислот
• Реакции АN
• 1.1. Гидратация
CH3
C COOH
O
H2O
OH
CH3
C COOH
OH
гидрат пировино
градной кислоты
46.
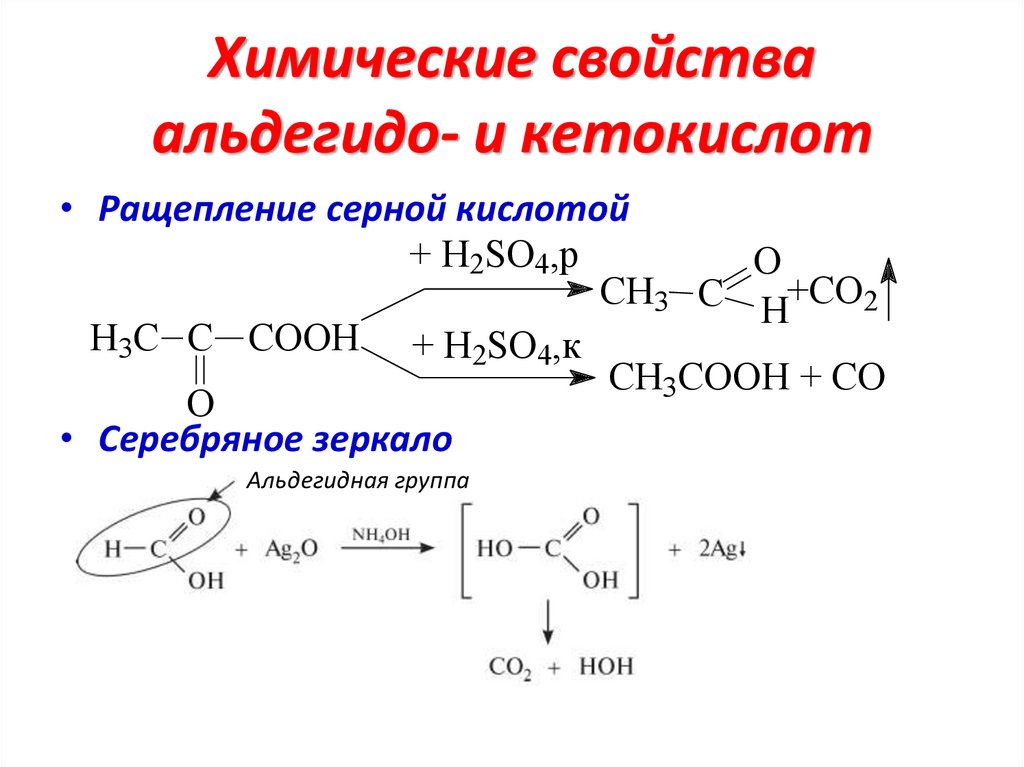
Химические свойстваальдегидо- и кетокислот
• Ращепление серной кислотой
+ H2SO4,p
O
CH3 C H+CO2
H3C C COOH + H2SO4,к
CH3COOH + CO
O
• Серебряное зеркало
Альдегидная группа
47.
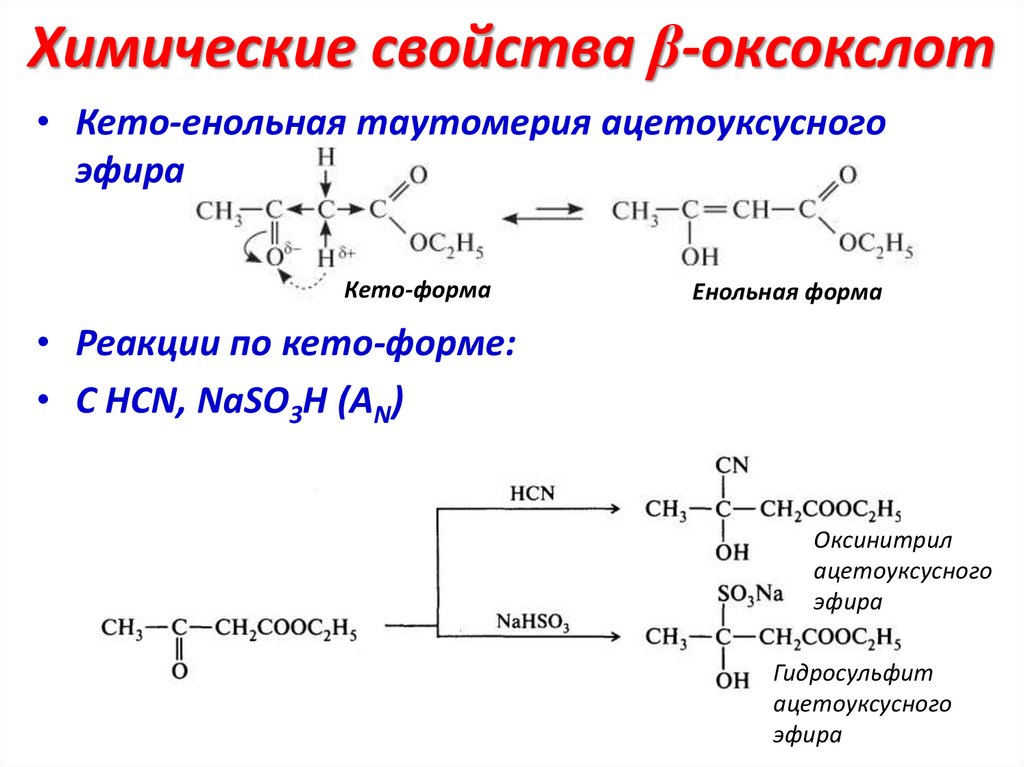
Химические свойства β-оксокслот• Кето-енольная таутомерия ацетоуксусного
эфира
Кето-форма
Енольная форма
• Реакции по кето-форме:
• С НCN, NaSO3H (AN)
Оксинитрил
ацетоуксусного
эфира
Гидросульфит
ацетоуксусного
эфира
48.
Химические свойства β-оксокслот• c H2 (AN)
• с гидроксиламином, гидразинами (АN-H2O)
Этил-β-гидроксибутират
Оксим ацетоуксусного эфира
49.
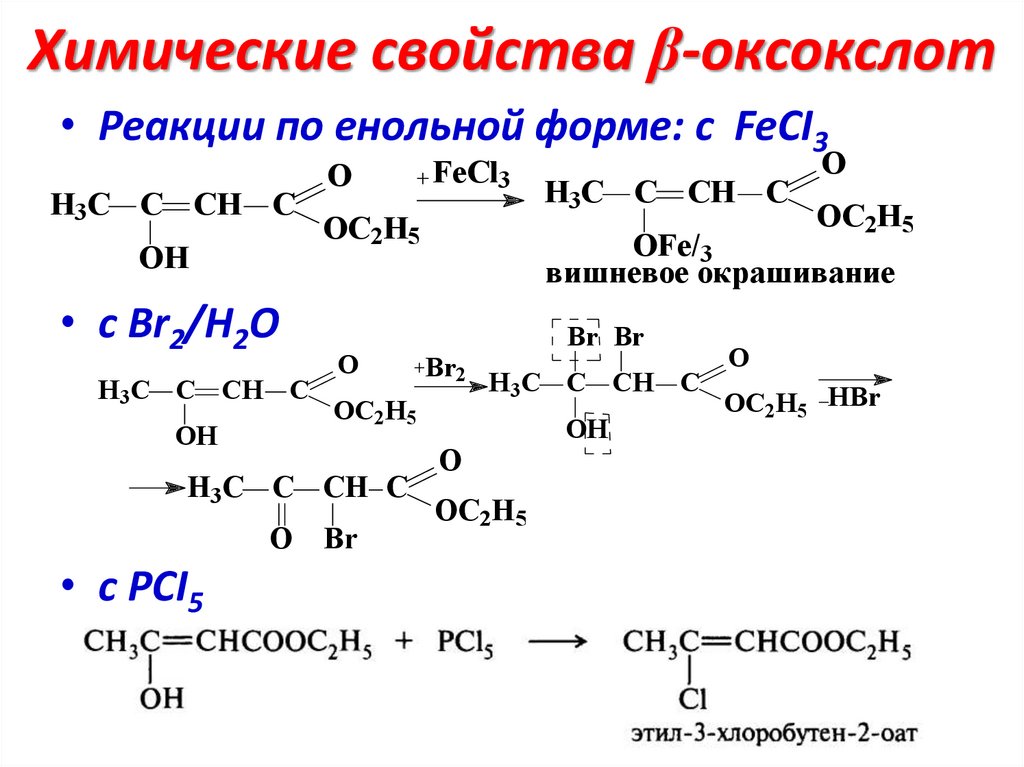
Химические свойства β-оксокслот• Реакции по енольной форме: с FeCI3
H3C C CH C
OH
• с Br2/H2O
H3C C CH C
OH
O
OC2H5
O
• c РСI5
Br
H3C C CH C
O
OC2H5
OFe/3
вишневое окрашивание
Br Br
Br2
OC2H5
H3C C CH C
O
FeCl3
H3C C CH C
O
OC2H5
OH
O
OC2H5 HBr
50.
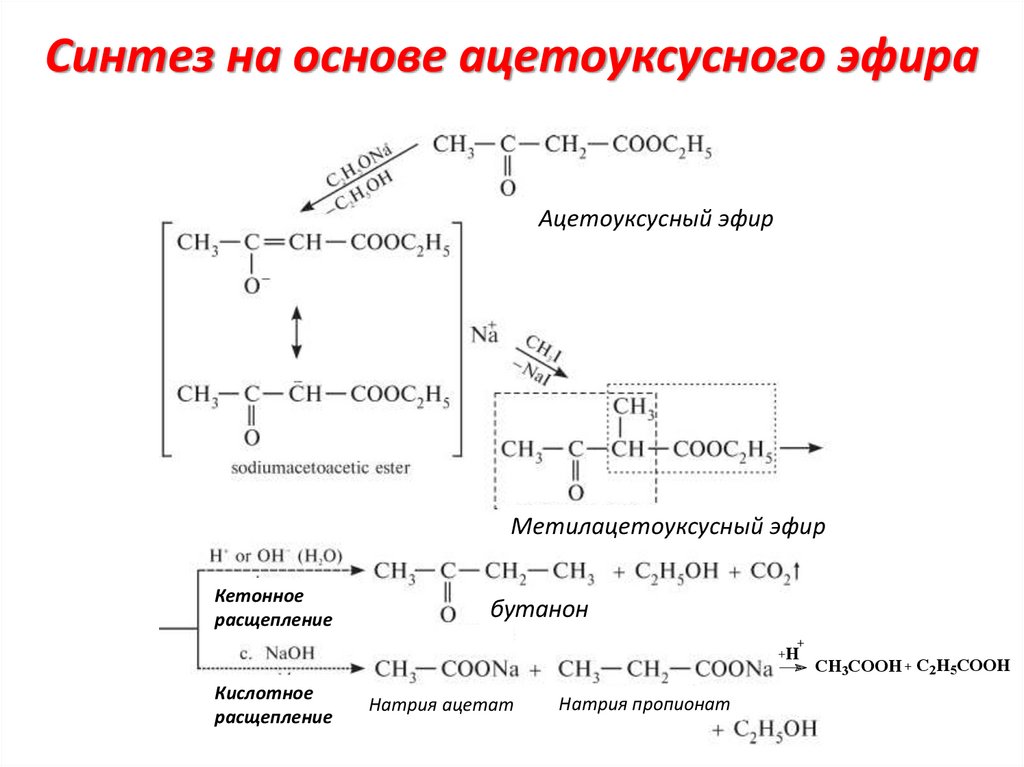
Синтез на основе ацетоуксусного эфираАцетоуксусный эфир
Метилацетоуксусный эфир
Кетонное
расщепление
бутанон
H
Кислотное
расщепление
Натрия ацетат
Натрия пропионат
CH3COOH C2H5COOH













 Химия
Химия








