Похожие презентации:
Галогены
1.
Галогены (греч. hals - соль + genes рождающий)2.
ГалогеныФтор
Хлор
Бром
Йод
3.
Бром -«зловонный» (вонючка)единственный неметалл, жидкий при
комнатной температуре
MgBr2+Cl2=MgCl2+Br2
фтор» -"разрушающий"
1886 г. французским химиком Анри
Муассаном. За это открытие фтора, а также
за изобретение электрической печи в 1906 г.
получил Нобелевскую премию по химии
номинирован был с Д.И. Менделеевым
Иод - "фиолетовый"
Куртуа получил иод при обработке
концентрированной серной кислотой золы
морских водорослей
4.
Природныесоединения
встречаются в
природе только в
связанном состоянии
В морской воде
содержатся хлорид
натрия, бромид
калия
5.
Хлор12-ый по химической
распространенности элемент
(5-ый среди неметаллов)
1774 г.
Шееле
отметил запах хлора,
схожий с запахом
царской водки, его
способность
взаимодействовать с
золотом и киноварью, а также
его отбеливающие свойств
6.
Хлор7.
Получение галогеновВ промышленности
Электролиз
расплава :2NaCl → 2Na + Cl2
раствора:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории
MnO2 + 4HCl
концентрированная соляной кислоты
с сильными окислителями
→ MnCl2 +
Cl2↑
+ 2H2O
2KMnO4 + 16HCl → 2MnCl2 + 2KCl+ 5Cl2↑ + 8H2O
K2Cr2O7 +14HCl → 2CrCl3 + 2KCl + 3Cl2↑+ 7H2O
KClO3 + 6HCl → KCl +
3Cl2↑ + 3H2O
K2Cr2O7 +14HCl → 2CrCl3 + 2KCl + 3Cl2↑+ 7H2O
8.
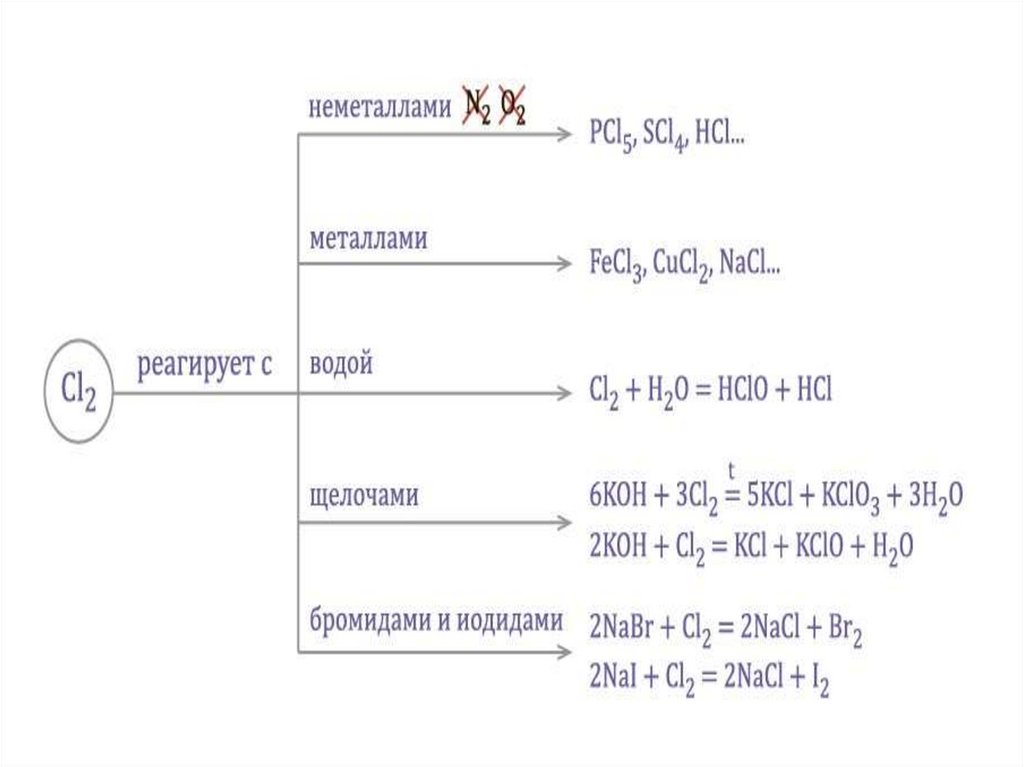
Химические свойства галогеновГалогены не реагируют с кислородом и азотом!!!
с неметаллами
Cl2+H2→2HCl (на свету)
5Cl2+2P→2PCl5 (90 °С)
2Cl2+Si→SiCl4 (340 °С)
S + Cl2 → SCl2
с металлами
Cl2 + F2 → 2ClF
= хлориды
3Cl2 + 2Fe → 2FeCl3
Железо – трехвалентное!!!
с водой Реакция диспропорционирования
Cl2 +H2O ↔HCl +HClO
Горячая вода
Cl2+6H2O↔5HCl+ HClO3
Раствор хлора в воде называют хлорной
водой, на свету кислота НСlO
разлагается на НСl и атомарный
кислород О, поэтому «хлорную воду»
надо хранить в темной склянке
9.
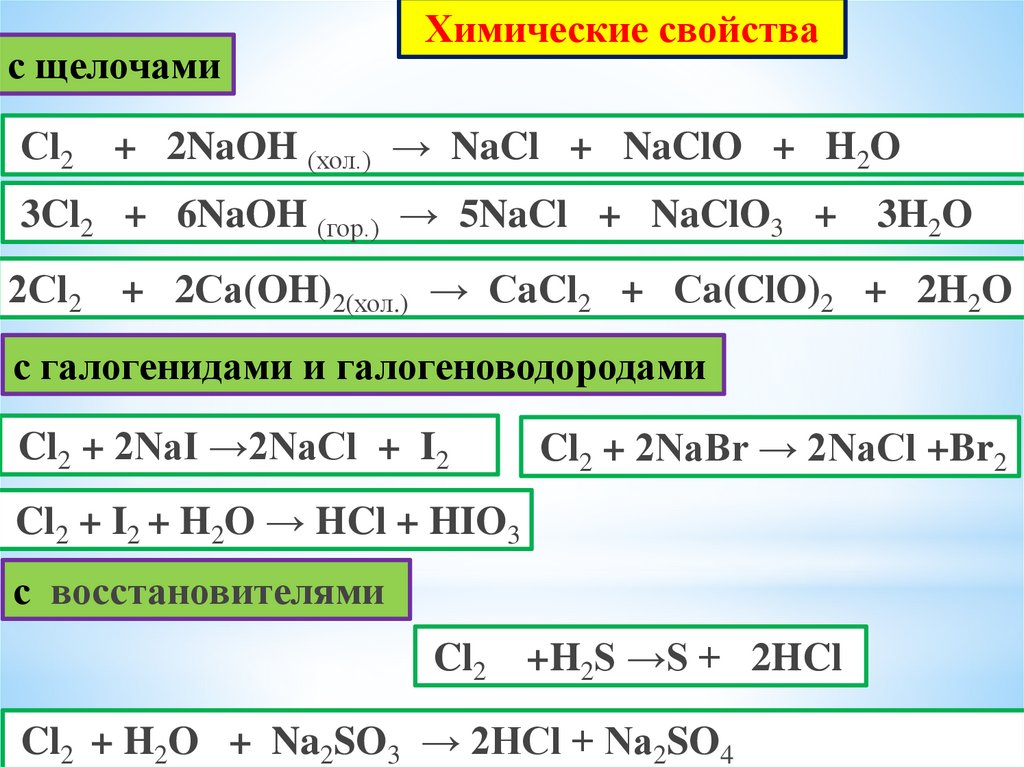
с щелочамиСl2
Химические свойства
+ 2NaOH (хол.) → NaCl + NaClO + H2O
3Cl2 + 6NaOH (гор.) → 5NaCl + NaClO3 +
2Сl2
3H2O
+ 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2 + 2H2O
с галогенидами и галогеноводородами
Cl2 + 2NaI →2NaCl + I2
Cl2 + 2NaBr → 2NaCl +Br2
Cl2 + I2 + H2O → HCl + HIO3
с восстановителями
Cl2
+H2S →S + 2HCl
Cl2 + H2O + Na2SO3 → 2HCl + Na2SO4
10.
11.
12.
13.
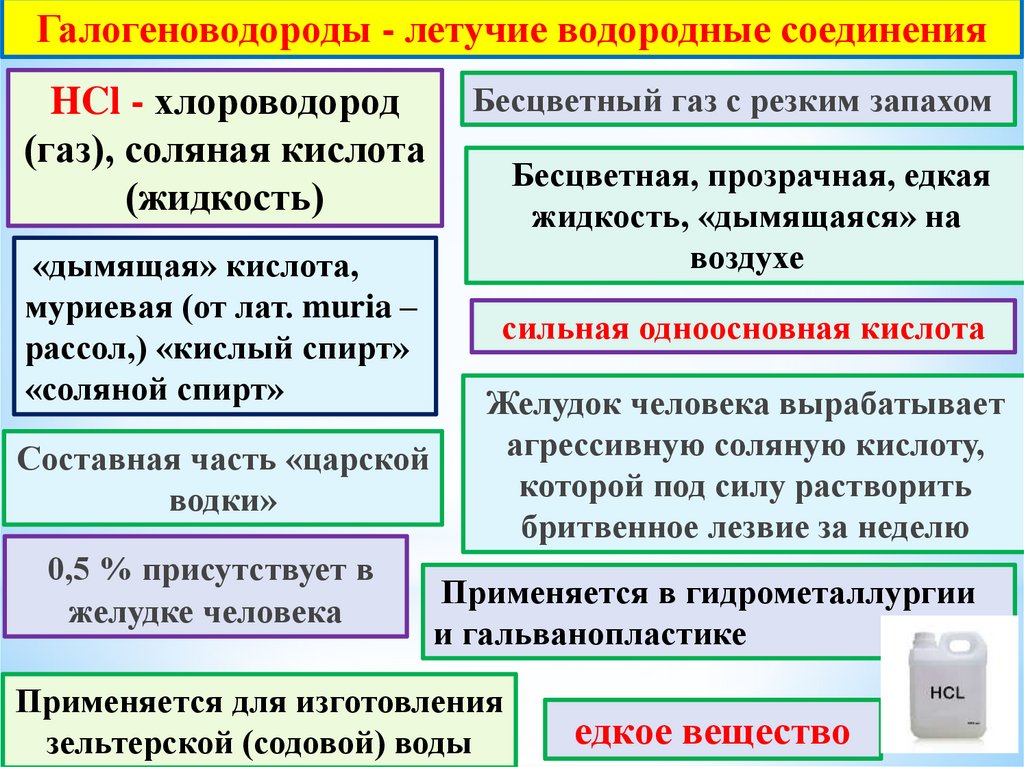
Галогеноводороды - летучие водородные соединенияHCl - хлороводород
(газ), соляная кислота
(жидкость)
«дымящая» кислота,
муриевая (от лат. muria –
рассол,) «кислый спирт»
«соляной спирт»
Составная часть «царской
водки»
0,5 % присутствует в
желудке человека
Бесцветный газ с резким запахом
Бесцветная, прозрачная, едкая
жидкость, «дымящаяся» на
воздухе
сильная одноосновная кислота
Желудок человека вырабатывает
агрессивную соляную кислоту,
которой под силу растворить
бритвенное лезвие за неделю
Применяется в гидрометаллургии
и гальванопластике
Применяется для изготовления
зельтерской (содовой) воды
едкое вещество
14.
ГалогеноводородыHF - фтороводород (газ),
фтороводородная (плавиковая)
кислота (жидкость)
Слабая одноосновная
кислота
Нельзя хранить в стекле
Бесцветная легкоподвижная жидкость с резким
запахом и обжигающим «уксусным» вкусом
пожаро- и
взрывобезопасна
Соли плавиковой кислоты фториды
Крупный потребитель фтороводородной кислоты —
алюминиевая промышленность
травления силикатного стекла (например — нанесение
надписей — для этого стекло покрывают парафином
Для травления кремния в полупроводниковой
промышленности
15.
ГалогеноводородыHBr - бромоводород (газ),
бромоводородная кислота
(жидкость)
Бесцветный тяжёлый
ядовитый газ, образует туман
в сыром воздухе, сильно
дымит на воздухе
Кислота - прозрачная
бесцветная или слегка
желтоватая жидкость
Газ - кислый вкус, очень
гигроскопичный
Сильная одноосновная кислота
бесцветный удушливый
газ, дымит на воздухе
HI – иодооводород (газ),
иодоводородная кислота
(жидкость)
бесцветная жидкость с резким
запахом
Самая сильная из
бескислородных кислот
Очень сильный
восстановитель
16.
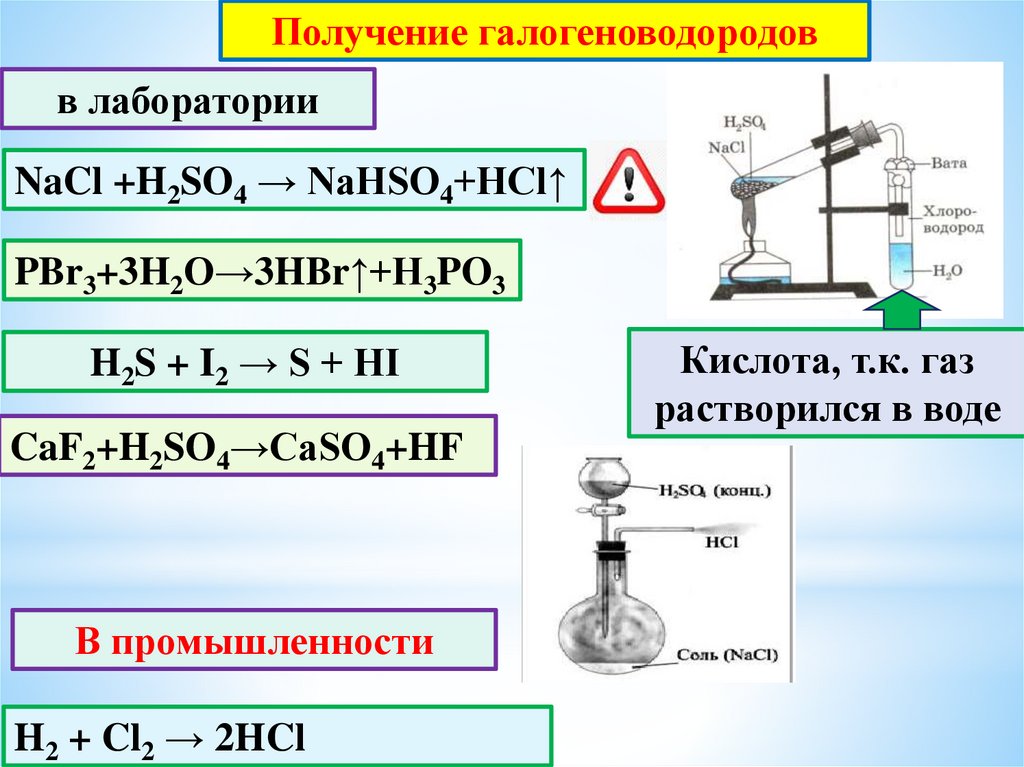
Получение галогеноводородовв лаборатории
NaCl +H2SO4 → NaHSO4+HCl↑
PBr3+3H2O→3HBr↑+H3PO3
H2S + I2 → S + HI
CaF2+H2SO4→CaSO4+HF
В промышленности
H2 + Cl2 → 2HCl
Кислота, т.к. газ
растворился в воде
17.
Общие свойства кислотиндикатор
металл
аммиак
кислота
основание
основный
амфотерный
соль
оксид
оксид/гидроксид
Реакция идет, если выделяется газ, выпадает осадок,
образуется вода или растворяется твердое вещество
Кислота - красненькая
Нельзя
18.
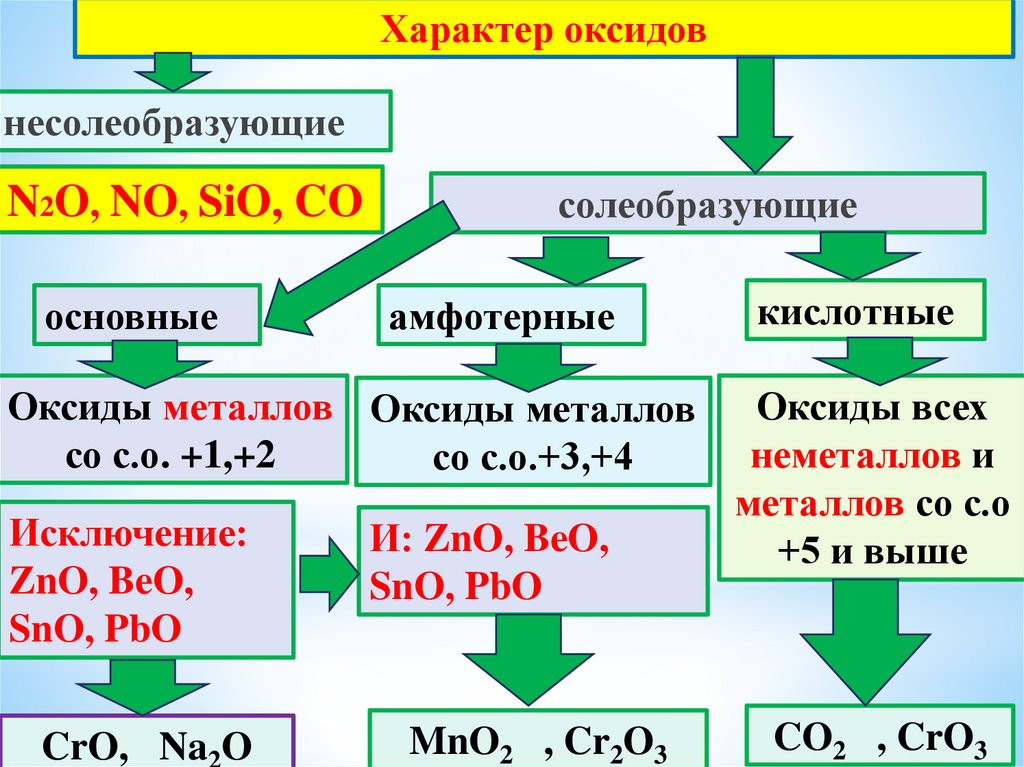
Характер оксидовнесолеобразующие
N2O, NO, SiO, CO
основные
солеобразующие
амфотерные
Оксиды металлов Оксиды металлов
со с.о. +1,+2
со с.о.+3,+4
Исключение:
ZnO, BeO,
SnO, PbO
CrO, Na O
И: ZnO, BeO,
SnO, PbO
MnO2 , Cr2O3
кислотные
Оксиды всех
неметаллов и
металлов со с.о
+5 и выше
CO2 , CrO3
19.
Химические свойстваМе до водорода в ряду напряжения –вытесняют Н2
Fe + 2HCl → FeCl2 + H2
Fe двухвалентный!!!
Основные и амфотерные оксиды = соли (хлориды)+Н2О
Na2O + 2HCl → 2NaCl + H2O
ZnO + 2HI → ZnI2 + H2O
С основаниями – реакция
нейтрализации
KOH + HCl → KCl + H2O
Амфотерные гидроксиды
Cr(OH) + 3HCl → CrCl + 3H O
20.
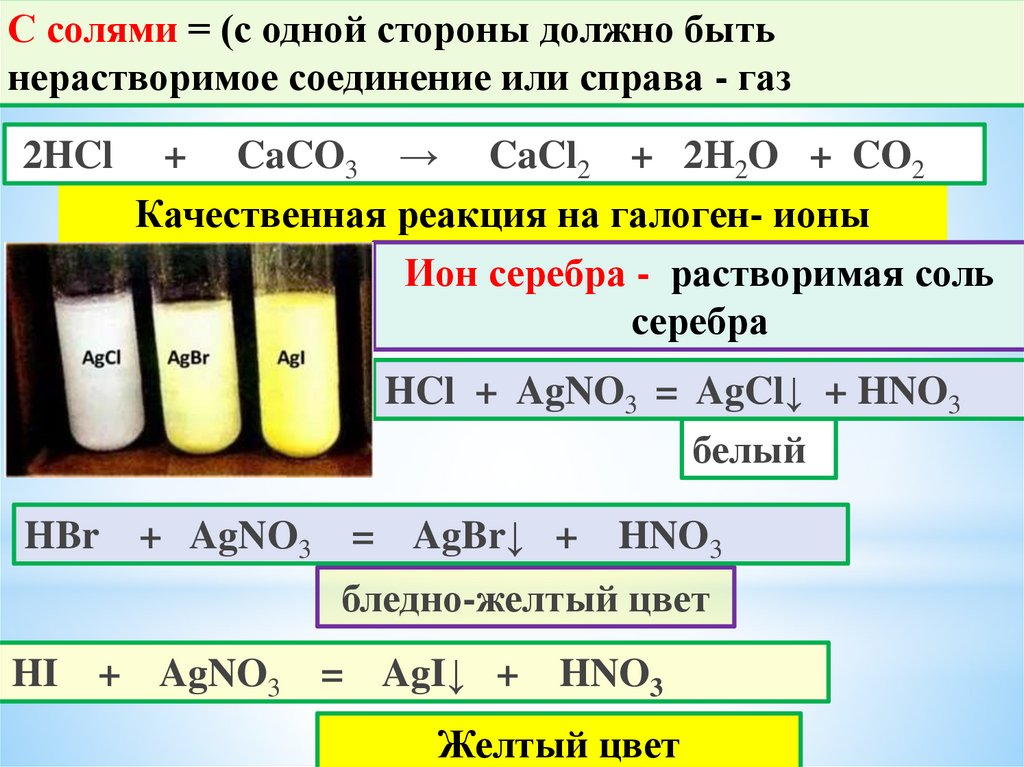
С солями = (с одной стороны должно бытьнерастворимое соединение или справа - газ
2HCl
+ CaCO3 → CaCl2 + 2H2O + CO2
Качественная реакция на галоген- ионы
Ион серебра - растворимая соль
серебра
HCl + AgNO3 = AgCl↓ + HNO3
белый
HBr + AgNO3
= AgBr↓ +
HNO3
бледно-желтый цвет
HI
+ AgNO3
= AgI↓ +
HNO3
Желтый цвет
21.
22.
Бромиды и бромовородород окисляются домолекулярного брома, а сера восстанавливается до
степени окисления +4 — выделяется сернистый газ
Иодиды и иодоводород окисляются до молекулярного
иода, а восстановление серы может протекать более
глубоко, до степени окисления -2 - сероводород
Хлориды и хлороводород — не очень активные
восстановители. При действии концентрированной
серной кислоты на твердые хлориды наблюдается
выделение хлороводорода. То есть протекает
вытеснение из соли более летучей кислоты, а не ОВР

















 Химия
Химия