Похожие презентации:
Теории кислот и оснований
1.
Теориикислот
и оснований
2. Учебная цель:
• 11.3.4.1 описать теорииАррениуса, Льюиса и
Бренстеда-Лоури и объяснять
границы их применимости
3.
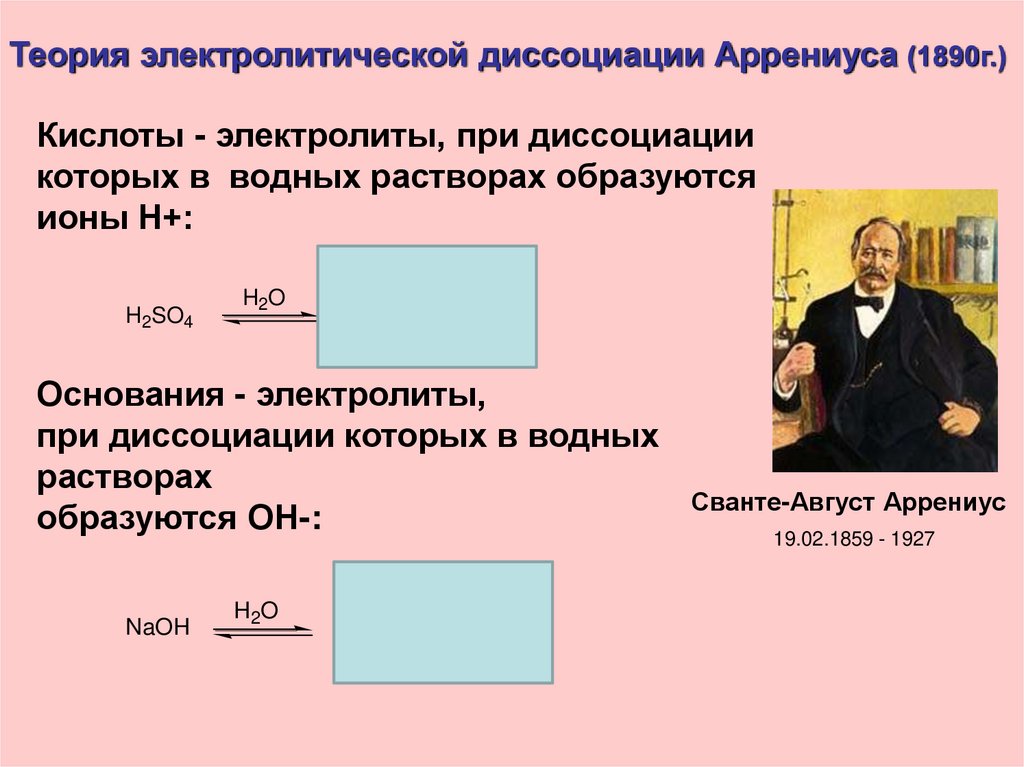
Теория электролитической диссоциации Аррениуса (1890г.)Кислоты - электролиты, при диссоциации
которых в водных растворах образуются
ионы Н+:
H2SO4
H2O
H
+ HSO4
Основания - электролиты,
при диссоциации которых в водных
растворах
образуются ОН-:
NaOH
H2O
Na
+
OH
Сванте-Август Аррениус
19.02.1859 - 1927
4.
Протонная теория, или теория кислот иоснований Бренстеда (1923)
Кислота - донор,
а основание - акцептор протонов;
кислоты и основания образуют
сопряженные пары;
протон образует катион оксония.
Йоханнес-Николаус
Брёнстед
22.02.1879 - 17.12.1947
AH
кислота
+
B
A
основание
сопряженное
основание
+
BH
сопряженная
кислота
5.
Протонная теория, или теория кислот и оснований БренстедаМерой кислотности является константа
кислотности (Ka)
Ka=[A-] [H3O+]/[AH]
Показатель кислотности:
pKa=-lgKa
"сильные" pKa < 0 и "слабые" pKa 2-15.7
Кислота
HI
HBr
H2SO4
HF
CH3COOH
H2O
ROH
NH3
рKa
-11
-9
-9
3.4
4.75
15.7
16-18
30
6.
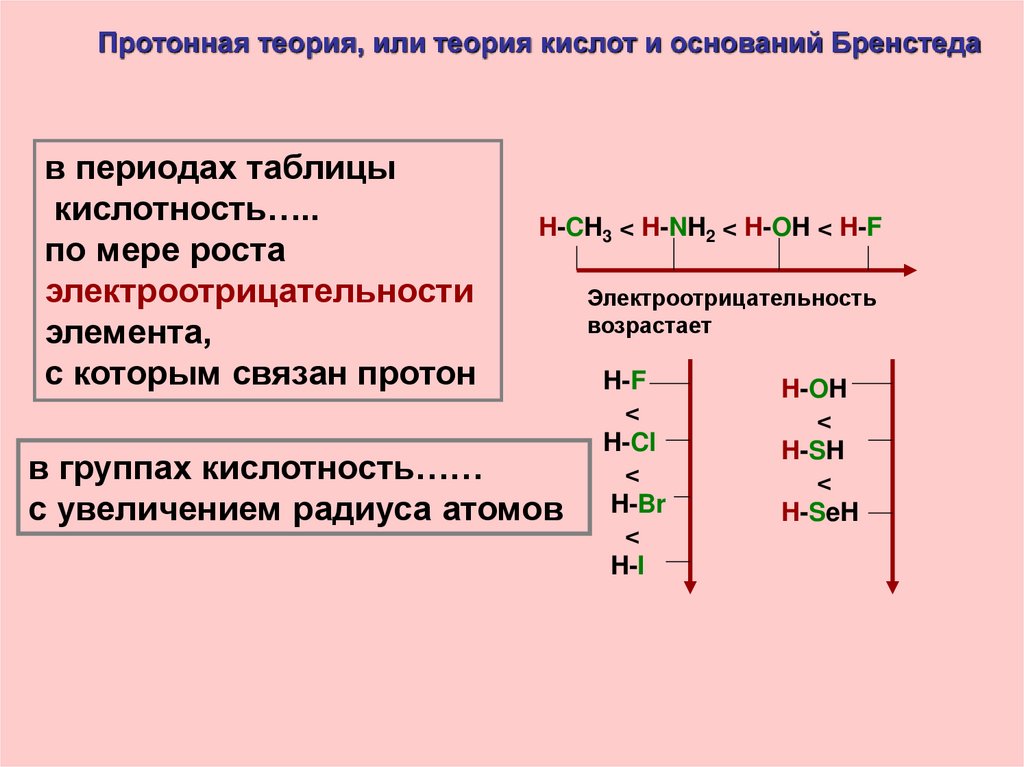
Протонная теория, или теория кислот и оснований Бренстедав периодах таблицы
кислотность…..
по мере роста
электроотрицательности
элемента,
с которым связан протон
H-CH3 < H-NH2 < H-OH < H-F
в группах кислотность……
с увеличением радиуса атомов
Электроотрицательность
возрастает
H-F
<
H-Cl
<
H-Br
<
H-I
H-OH
<
H-SH
<
H-SeH
7.
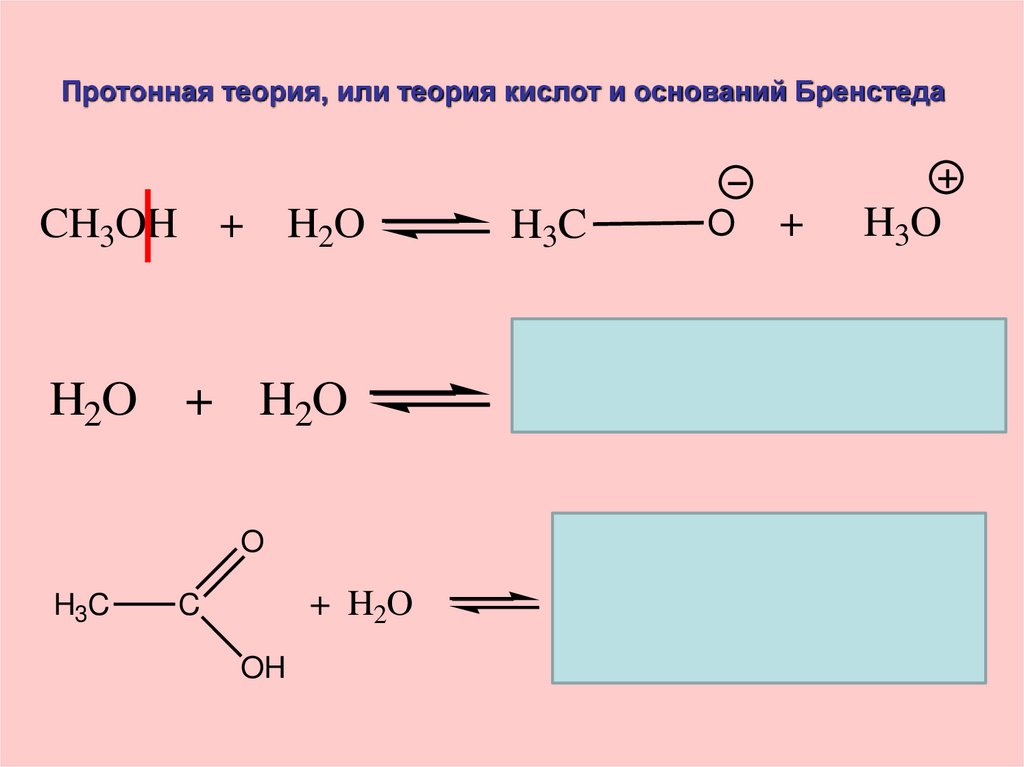
Протонная теория, или теория кислот и оснований БренстедаH2O
H3C
O
+
H3O
H2O + H2O
H
O
+
H3O
+
H3O
CH3OH +
O
O
H3C
+ H2O
C
OH
H3C
C
O
8.
Электронная теория кислот и оснований,или Теория Льиса (1926)
Наиболее общая теория
кислот и оснований
кислоты - это вещества, принимающие
Джилберт Ньютон Льюис
электронную пару (акцепторы),
23 октября 1875 г. – 23 марта 1946 г.
а основания - вещества, дающие
электронную пару (доноры)
электрофилы
Кислоты Льюиса - H+,все катионы, галогениды металлов II и III групп
таблицы Менделеева: AlX3, FeX3, SnX4, ZnX2 (X=F, Cl, Br, I).
нуклеофилы
Основания Льюиса - все анионы OH-, CH3COO-, NH2- и нейтральные
соединения, имеющие неподеленные электронные пары- H2O, ROH, , RCH=O,
NH3, R3N, RCH=CH2, R-C6H5 и др.
9. Закрепление:
Уровень АЗапишите уравнения ступенчатой диссоциации
H3PO4.
Уровень В
Запишите уравнения диссоциации:
1. HNO3 =
2. Ba(OH)2 =
3. Al2(SO4)3 =
4. Na2HPO4 =
5. MgOHCl =






 Химия
Химия








