Похожие презентации:
Елементи вторинної структури пептидів і білків
1.
ЕЛЕМЕНТИ ВТОРИННОЇ СТРУКТУРИ ПЕПТИДІВ І БІЛКІВа)
а) 310-спіраль (права);
б) a-спіраль (права);
в) p-спіраль (права);
г) спіраль PP I (права);
д) спіраль PP II (ліва);
е) антипаралельна
b-складчата структура;
ж) паралельна
b-складчата структура;
з) p-вигін; и) a-вигін;
к) b-вигин I типу;
и) b-вигин II типу;
м) g-вигин.
б)
в)
г)
д
)
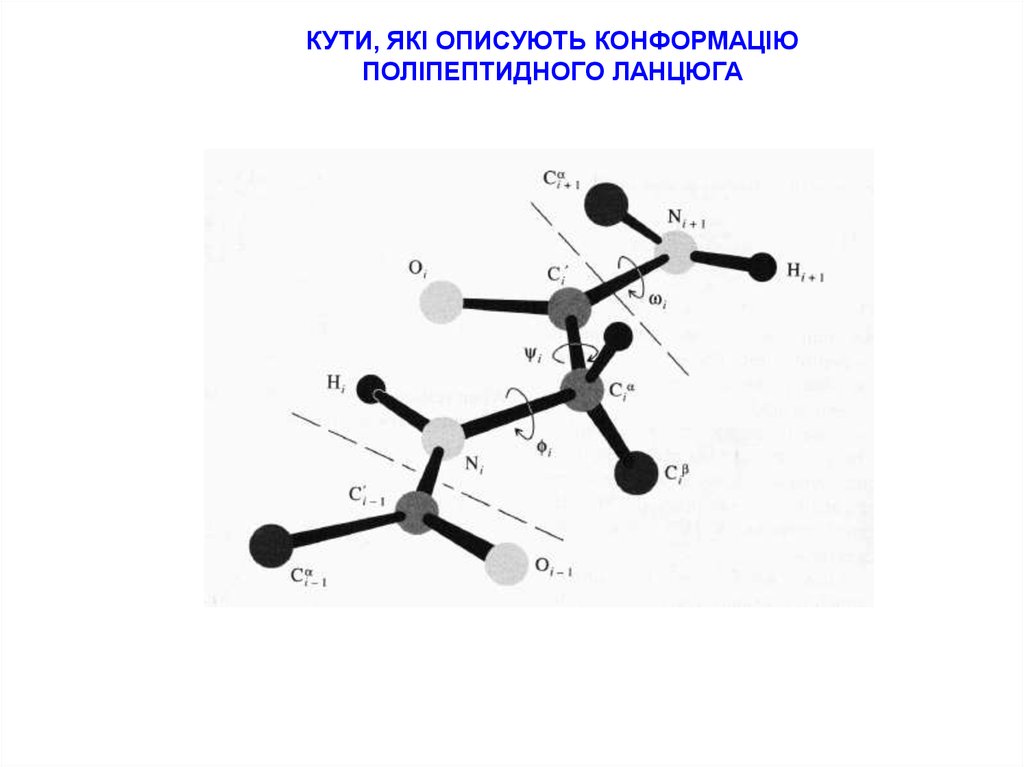
2.
КУТИ, ЯКІ ОПИСУЮТЬ КОНФОРМАЦІЮПОЛІПЕПТИДНОГО ЛАНЦЮГА
3.
ТИПОВІ ЗНАЧЕННЯ КУТІВ, ЩО ОПИСУЮТЬКОНФОРМАЦІЮ ПОЛІПЕПТИДНОГО ЛАНЦЮГА ДЛЯ
РІЗНИХ ЕЛЕМЕНТІВ ВТОРИННОЇ СТРУКТУРИ
j
y
w
310-спіраль
–60
–30
+180
a-спіраль
–57
–47
+180
π-спіраль
–55
–76
+180
спіраль поліпроліну I (PP I)
–83
+158
0
спіраль поліпролину II (PP II)
–76
+146
+180
паралельна b-складчата структура
–119
+113
–
антипаралельна b-складчата структура
–139
+135
–
b-вигини*
ji+1
yi+1
ji+2
тип I
–60
–30
–90
тип I'
+60
+30
+90
тип II
–60
+120
+80
тип II'
+60
–120
–80
тип III
–60
–30
–60
тип III'
+60
+30
+60
Елемент вторинної структури
4.
1Н-ЯМРСПЕКТР УБІКВІТІНУ
5.
ЗАЛЕЖНІСТЬ ШВИДКОСТІ ОБМІНУ NH ПРОТОНІВ ВІД рН6.
НАЙВАЖЛИВІШІ КОРЕЛЯЦІЇ В COSY СПЕКТРАХПЕПТИДІВ
а) всі нелабільні неароматичні
протони бокових ланцюгів (крім
bH-gCH3 Thr, dH-dH Pro, bH-bH Ser;
b) aH-bCH3 Ala, bH-gCH3 Thr;
c) aH-bH Val, Leu, Ile, Glu, Gln, Met,
Pro, Arg, Lys;
d) aH-bH Cys, Asp, Asn, Phe, Tyr,
His, Trp;
e) aH-aH Gly, aH-bH Thr, dH-dH Pro,
aH-bH, bH-bH Ser;
f) ароматичні протони, бокові
ланцюги Asn, Gln;
g) NH-aH;
h) dCH2-eNH Arg.
область “відбитків
пальців”
7.
TOCSY КОРЕЛЯЦІЇ – ВИЯВЛЕННЯ ОКРЕМИХ СПІНОВИХСИСТЕМ
8.
ПОРІВНЯННЯ TOCSY ТА COSY на прикладі кореляційамідних та аліфатичних протонів
9.
НАЙВАЖЛИВІШІ КОРЕЛЯЦІЇ В NOESY СПЕКТРАХПЕПТИДІВ
а) NH, NH-ароматичні, аром.-аром.;
b)NH, аром.-aH, dH Ser, bH Ser, Thr;
c) NH, аром.-аліф.;
d) aH, dH Pro, bH Ser, Thr- aH, dH Pro;
bH Ser, Thr;
e) aH, dH Pro; bH Ser, Thr-аліф.,
f) аліф.-аліф.
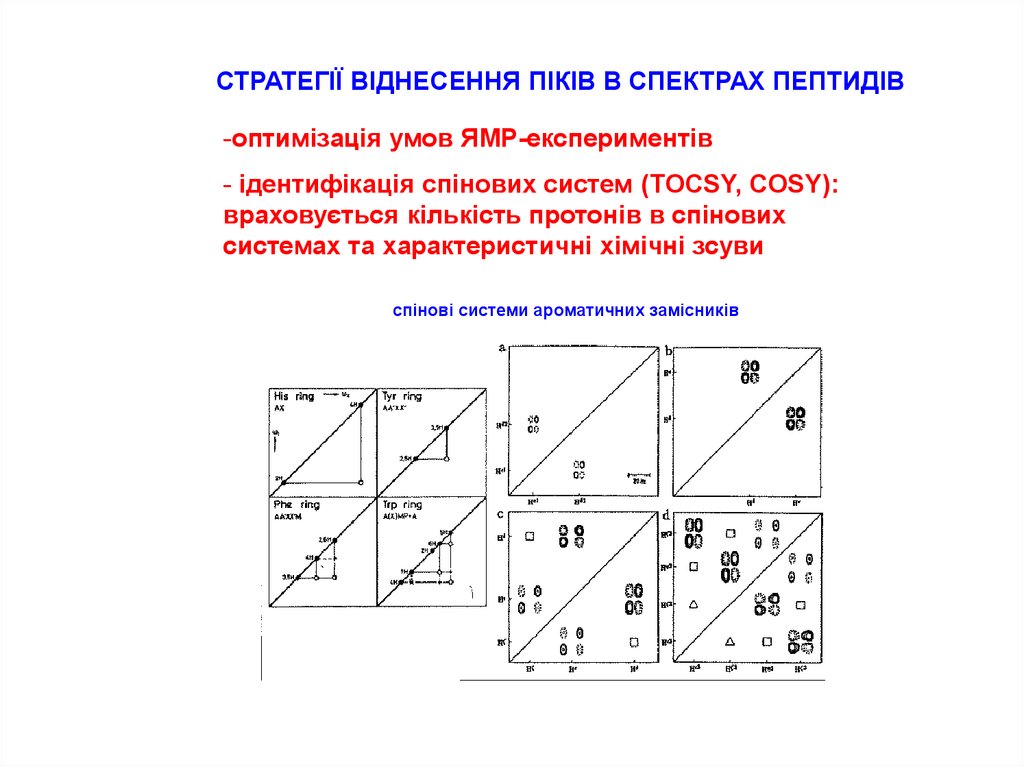
10.
СТРАТЕГІЇ ВІДНЕСЕННЯ ПІКІВ В СПЕКТРАХ ПЕПТИДІВ-оптимізація умов ЯМР-експериментів
- ідентифікація спінових систем (TOCSY, COSY):
враховується кількість протонів в спінових
системах та характеристичні хімічні зсуви
спінові системи ароматичних замісників
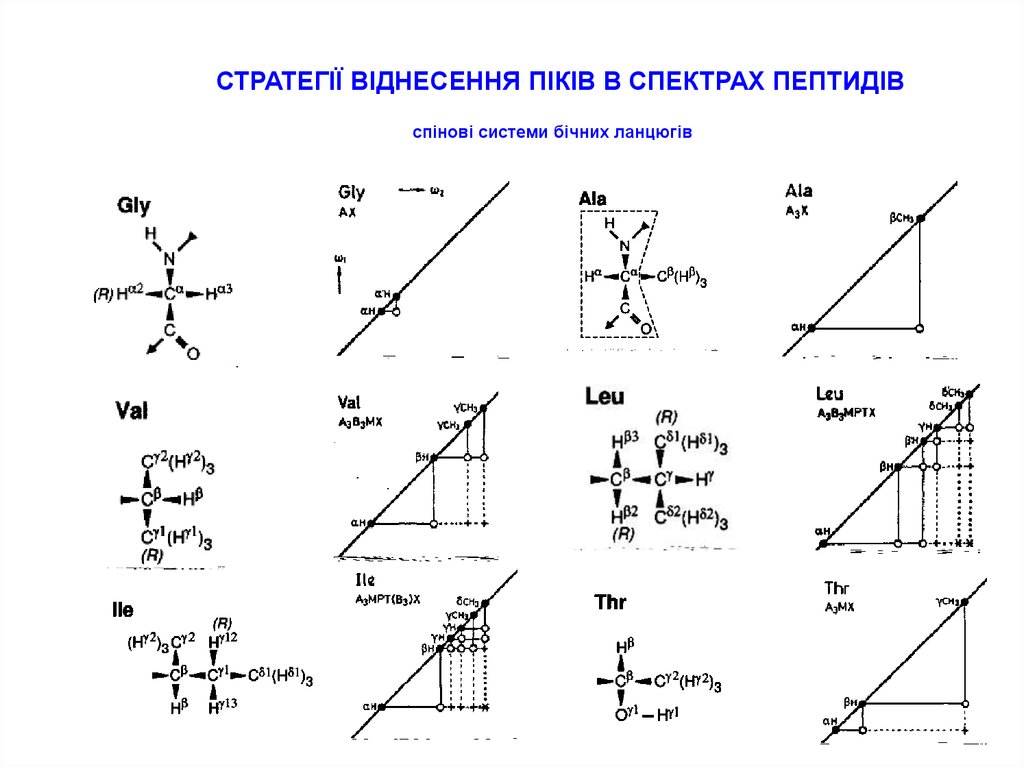
11.
СТРАТЕГІЇ ВІДНЕСЕННЯ ПІКІВ В СПЕКТРАХ ПЕПТИДІВспінові системи бічних ланцюгів
12.
СТРАТЕГІЇ ВІДНЕСЕННЯ ПІКІВ В СПЕКТРАХ ПЕПТИДІВспінові системи бічних ланцюгів
13.
СТРАТЕГІЇ ВІДНЕСЕННЯ ПІКІВ В СПЕКТРАХ ПЕПТИДІВспінові системи бічних ланцюгів
14.
СТРАТЕГІЇ ВІДНЕСЕННЯ ПІКІВ В СПЕКТРАХ ПЕПТИДІВтипові хімічні зсуви для random coil
пептидів
залишок
NH
Hα
Hβ
Ala
Cys(red)
Cys(ox)
Asp
Glu
Phe
Gly
His
Ile
Lys
8.24
8.32
8.43
8.34
8.42
8.30
8.33
8.42
8.00
8.29
4.32
4.55
4.71
4.64
4.35
4.62
3.96
4.73
4.17
4.32
1.39
2.93, 2.93
3.25, 2.99
2.72, 2.65
2.06, 1.96
3.14, 3.04
Leu
Met
Asn
Pro
Gln
Arg
Ser
Thr
Val
Trp
Tyr
8.16
8.28
8.40
8.32
8.23
8.31
8.15
8.03
8.25
8.12
4.34
4.48
4.74
4.42
4.34
4.34
4.47
4.35
4.12
4.66
4.55
1.62, 1.62
2.11, 2.01
2.83, 2.75
2.29, 1.94
2.12, 1.99
1.86, 1.76
3.89, 3.87
4.24
2.08
3.29, 3.27
3.03, 2.98
3.29, 3.16
1.87
1.84, 1.75
інші протони
gCH2 2.31, 2.31
2,6H 7.28; 3,5H 7.38; 4H 7.32
2H 8.58; 4H 7.29
gCH2 1.45, 1.16; gCH3 0.91; δCH3 0.86
gCH2 1.44, 1.44; δCH2 1.68, 1.68;
εCH2 2.99, 2.99; εNH3+ 7.81
gCH 1.59; δCH3 0.92, 0.87
gCH2 2.60, 2.54; εCH3 2.10
gNH2 7.59, 6.91
gCH2 2.02, 2.02; δCH2 3.63, 3.63
gCH2 2.36, 2.36; δNH2 7.52, 6.85
gCH2 1.63, 1.63; δCH2 3.20, 3.20; εNH 8.07
gCH3 1.21
gCH3 0.94, 0.93
2H 7.27; 4H 7.65; 5H 7.18; 6H 7.25; 7H 7.50
2,6H 7.14; 3,5H 6.84
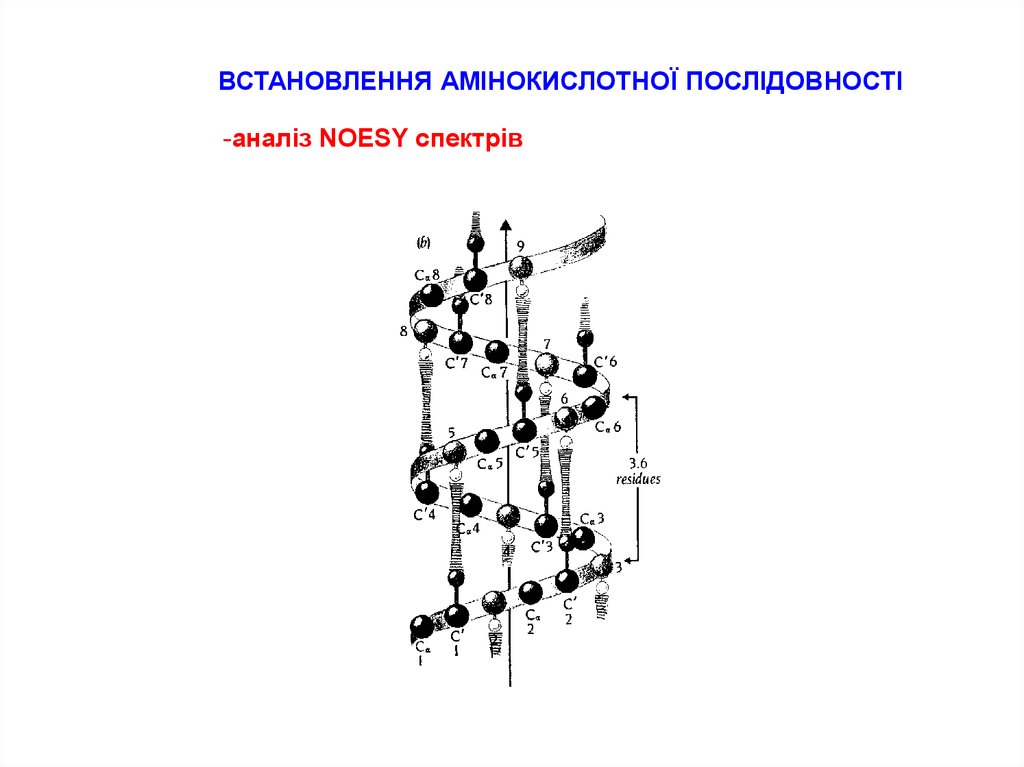
15.
ВСТАНОВЛЕННЯ АМІНОКИСЛОТНОЇ ПОСЛІДОВНОСТІ-аналіз NOESY спектрів
16.
ВСТАНОВЛЕННЯ АМІНОКИСЛОТНОЇ ПОСЛІДОВНОСТІ-аналіз NOESY + COSY спектрів
17.
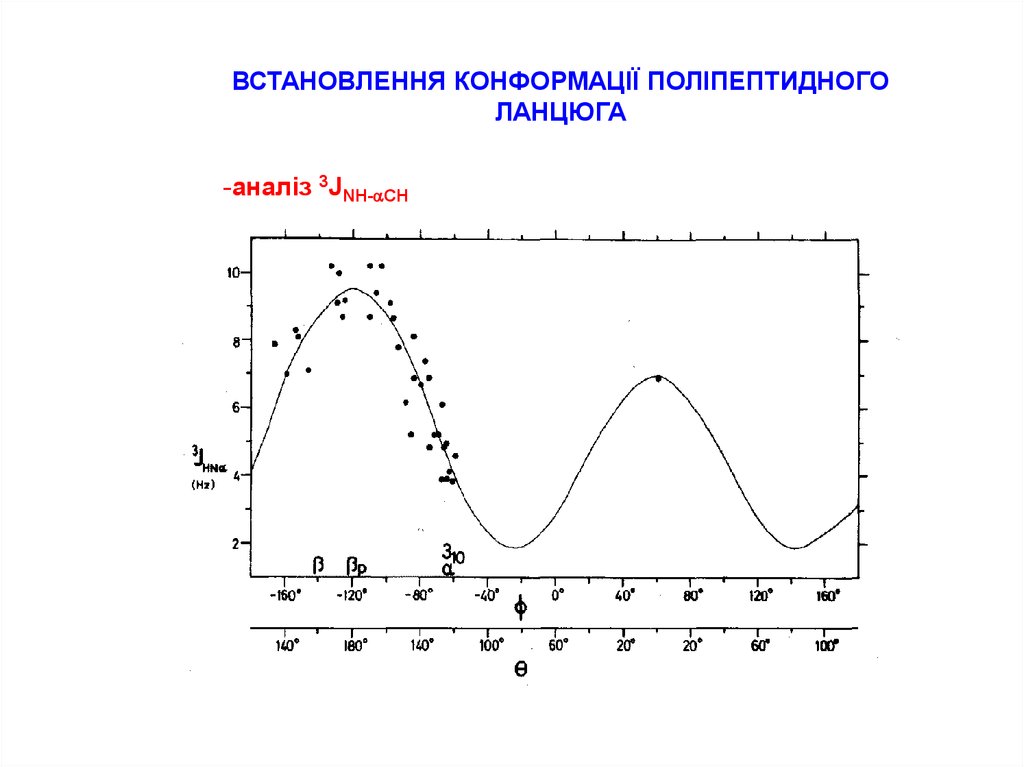
ВСТАНОВЛЕННЯ КОНФОРМАЦІЇ ПОЛІПЕПТИДНОГОЛАНЦЮГА
-аналіз 3JNH-aCH
18.
ВСТАНОВЛЕННЯ КОНФОРМАЦІЇ ПОЛІПЕПТИДНОГОЛАНЦЮГА
-аналіз 3JNH-aCH
ТЕОРЕТИЧНІ ЗНАЧЕННЯ 3JHN-αH ДЛЯ ТИПОВИХ
ЕЛЕМЕНТІВ ВТОРИННОЇ СТРУКТУРИ ПЕПТИДІВ
ЕЛЕМЕНТ
θ
α-спіраль
310-спіраль
антипаралельна
b-складчата структура
паралельна
b-складчата структура
-57˚
-60˚
3.9 Hz
4.2 Hz
-139˚
8.9 Hz
-119˚
9.7 Hz
3J
HN-Αh
19.
ВСТАНОВЛЕННЯ КОНФОРМАЦІЇ ПОЛІПЕПТИДНОГОЛАНЦЮГА














 Химия
Химия








