Похожие презентации:
Физиология системы гемостаза. Факторы тромбогенного риска и учение о тромбофилических состояниях
1. Физиология системы гемостаза. Факторы тромбогенного риска и учение о тромбофилических состояниях. Антитромботическая
профилактика и терапия, методылабораторного контроля.
Д.м.н. А.Н.Шилова
г.Новосибирск
2. Биологическая система, обеспечивающая, с одной стороны, сохранение жидкого состояния циркулирующей крови и достаточное
кровоснабжениеорганов, а с другой, предупреждение и быструю
остановку кровотечений из
наиболее ранимых сосудов
малого калибра обозначается как
система гемостаза.
3. Функционирование системы гемостаза определяется состоянием трех тесно взаимодействующих между собой морфо-функциональных
Функционирование системы гемостазаопределяется состоянием трех тесно
взаимодействующих между собой морфофункциональных компонентов:
- стенками кровеносных сосудов, в
первую очередь эндотелием и
субэндотелиальными структурами;
- клеточными элементами крови, в
первую очередь тромбоцитами;
- плазменными протеолитическими
системами – свертывающей,
плазминовой (фибринолитической),
калликреин-кининовой и комплемента.
4. ФУНКЦИИ ЭНДОТЕЛИЯ
В нормальных условиях обладает высокойтромборезистентностью за счет:
- Контактная инертность
- Синтез простациклина (PgI2)
- Наличие на мембране тромбомодулина
- Фиксация комплекса гепарин-антитромбин
- Стимулирует фибринолиз (синтез ТПА)
- Элиминация из крови активированных
факторов свертывания крови
5. ФУНКЦИИ ЭНДОТЕЛИЯ
При патологии меняет свой антитромботическийпотенциал на тромбогенный за счет:
секреции активатора адгезии тромбоцитов к
субэндотелию – фактора Виллебранда;
продукцией стимулятора агрегации тромбоцитов
– тромбоксана А2 путем активации в мембране
ЭК фосфолипазы А2 и фермента тромбоксансинтетазы;
Продукцией тканевого фактора (ТФ) – главного
активатора свертывания крови;
продукцией ингибиторов тканевого активатора
плазминогена – PAI-1 и PAI-2.
6. ФУНКЦИИ ТРОМБОЦИТОВ
- ангиотрофическая, поддерживают структуру ифункцию стенок микрососудов
- поддерживают спазм поврежденных сосудов
путем секреции вазоактивных веществ –
серотонина,β-тромбомодулина и др.
- образовывают в поврежденном сосуде
тромбоцитарную пробку (способность к адгезии и
агрегации)
- тромбоцитарные факторы участвуют в процессе
свертывания крови и в регуляции фибринолиза
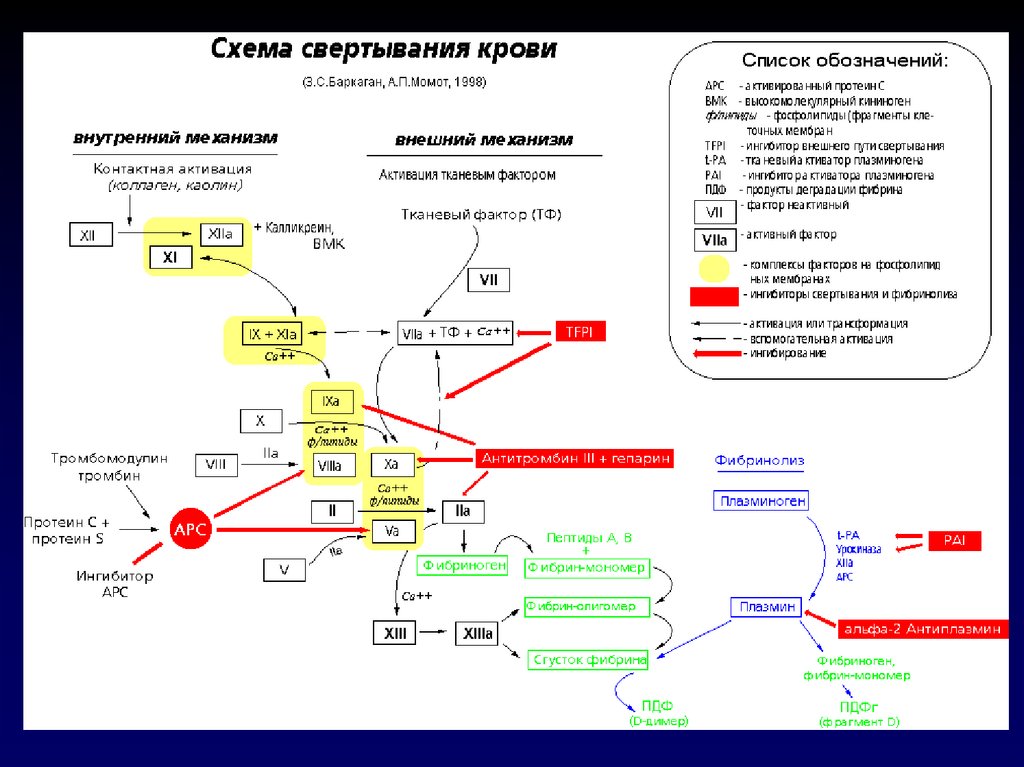
- стимулируют процесс репарации (за счет
ростового фактора)
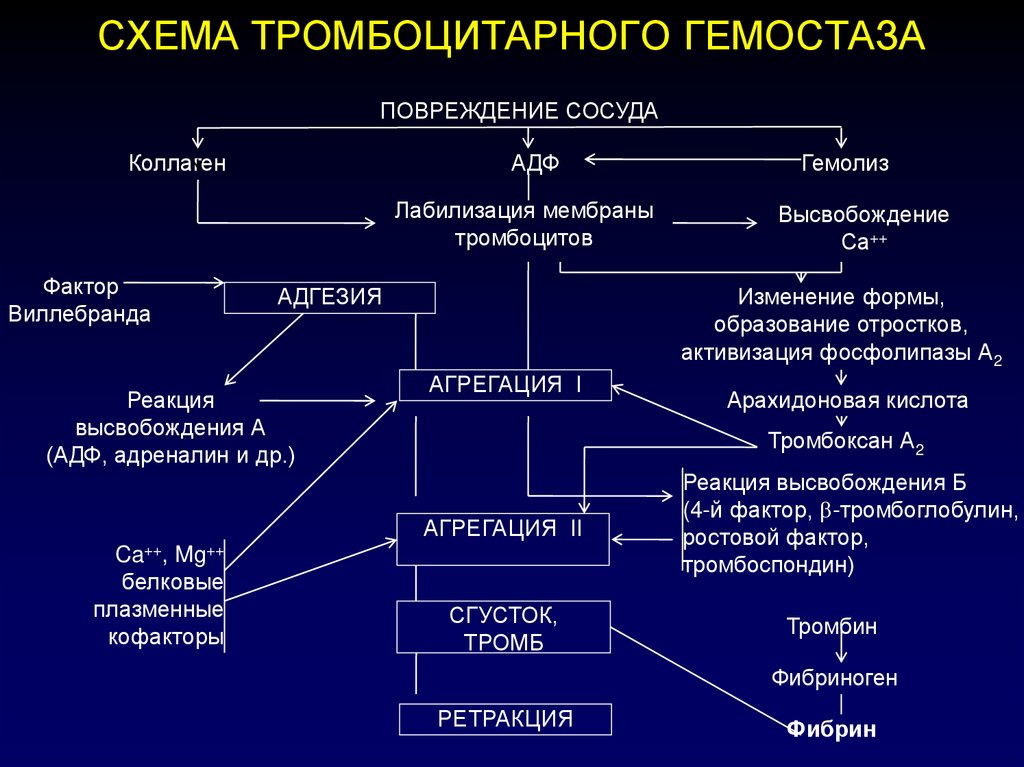
7. СХЕМА ТРОМБОЦИТАРНОГО ГЕМОСТАЗА
ПОВРЕЖДЕНИЕ СОСУДАКоллаген
АДФ
Лабилизация мембраны
тромбоцитов
Фактор
Виллебранда
АДГЕЗИЯ
Реакция
высвобождения А
(АДФ, адреналин и др.)
Высвобождение
Са++
Изменение формы,
образование отростков,
активизация фосфолипазы А2
АГРЕГАЦИЯ I
Арахидоновая кислота
Тромбоксан А2
АГРЕГАЦИЯ II
Ca++, Mg++
белковые
плазменные
кофакторы
Гемолиз
СГУСТОК,
ТРОМБ
Реакция высвобождения Б
(4-й фактор, -тромбоглобулин,
ростовой фактор,
тромбоспондин)
Тромбин
Фибриноген
РЕТРАКЦИЯ
Фибрин
8.
9.
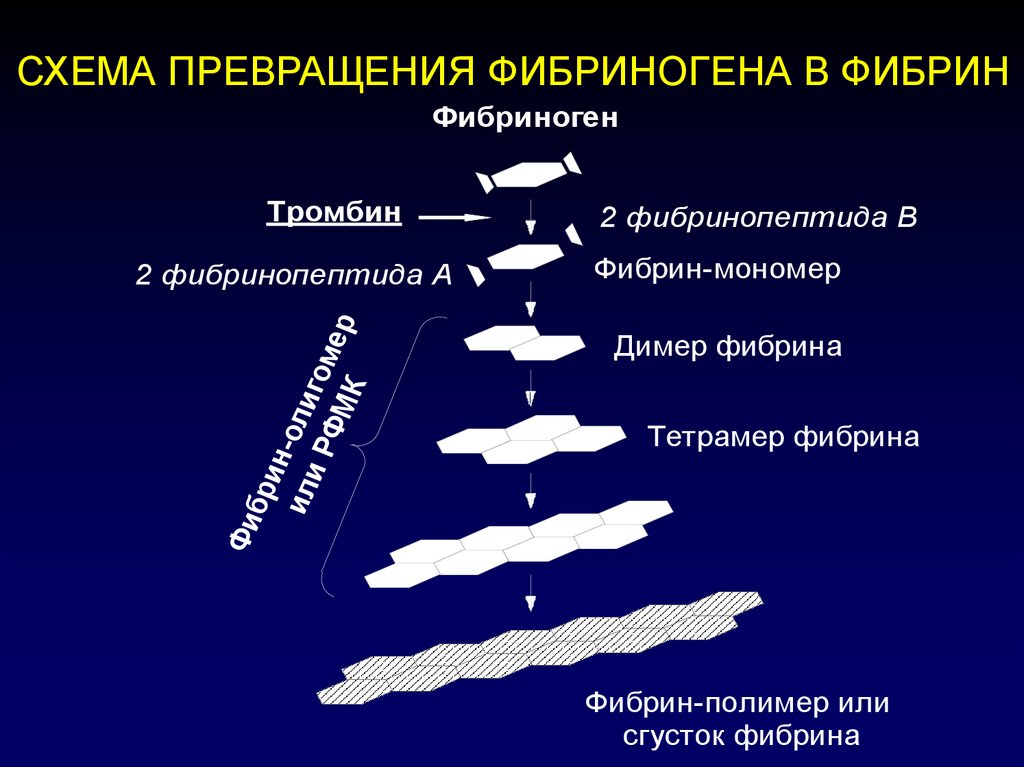
СХЕМА ПРЕВРАЩЕНИЯ ФИБРИНОГЕНА В ФИБРИНФибриноген
2 фибринопептида В
2 фибринопептида А
Фибрин-мономер
Фи
бри
н
ил -оли
и Р гом
ФМ
ер
К
Тромбин
Димер фибрина
Тетрамер фибрина
Фибрин-полимер или
сгусток фибрина
10. По оценкам экспертов Ассоциации флебологов России в нашей стране ежегодно венозный тромбоз возникает у 240 000 человек, у 100
000 из которыхразвивается ТЭЛА.
11. В условиях многопрофильного стационара ТЭЛА наблюдается у 15-20 из 1000 лечившихся пациентов. С ней связаны 5-10% госпитальной
летальности.12. При инсультах и ортопедических вмешательствах тромбозы глубоких вен (ТГВ) развиваются более чем у половины пациентов.
13. При абдоминальных хирургических вмешательствах и операциях на грудной клетке ТГВ встречается у каждого третьего пациента.
14. В терапевтических стационарах ТГВ возникают у 17% больных, а при инфаркте миокарда в 22% случаев.
15. Венозные тромбоэмболические осложнения во время беременности и в послеродовом периоде встречаются в 5,5 раз чаще, чем у
небеременных женщин, апосле родов в 3-6 раз чаще,
чем до родов.
16. Частота тромбоэмболических осложнений в акушерстве варьирует от 0,6 до 5 на 1000 беременных.
17. Актуальность проблемы тромботических осложнений обусловлена не только тяжестью течения заболевания и высокой летальностью, но и
трудностями диагностики.18. ТРОМБОЗ ГЛУБОКИХ ВЕН (ТВГ) И ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ (ТЭЛА)
Важная медицинская проблема: высокая заболеваемость и смертностьСлучаев в год
Внутрибольничная
смертность
Суммарная заболеваемость
ТЭЛА: 5-10%
Бессимптомные формы
Не диагностируются
Не лечатся
Не диагностируются
Более половины из
расчетных 600000
случаев в год не
диагностируются
Около 2/3 случаев
протекают
бессимптомно, не
диагностируются или
не лечатся
Anderson et al. Clin Chest Med. 1995;16:235-251
Bick. Thrombosis/Hemostasis. 1999;5:2-9.
От 5% до 10% всех
внутрибольничных
летальных исходов
ежегодно
приходится на
ТЭЛА
19. Трудности диагностики, частота ВТЭ и ограниченные возможности оказания эффективной медицинской помощи (около 50% больных с
массивной ТЭЛА погибают в течение30 мин от начала ее возникновения)
позволяют говорить о том, что самым
главным в борьбе с этой патологией
является ПРОФИЛАКТИКА.
20. Для эффективного ведения профилактики необходимо знать ситуации сопровождающиеся развитием ВТЭ.
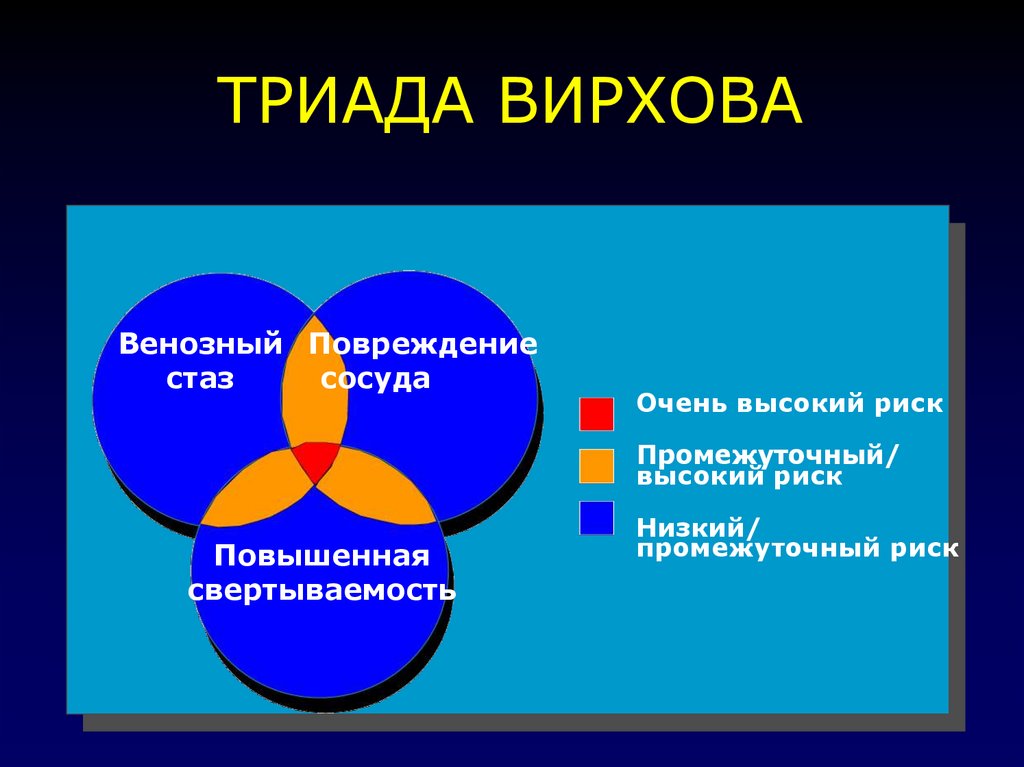
21. ТРИАДА ВИРХОВА
Венозный Повреждениестаз
сосуда
Очень высокий риск
Промежуточный/
высокий риск
Повышенная
свертываемость
Низкий/
промежуточный риск
22. Система гемостаза реагирует на различные внешние и внутренние агрессивные факторы. Выраженный дисбаланс при взаимодействии
клеточных иферментативных участников,
обеспечивающих гемостаз, у больных с
различными заболеваниями является
причиной развития как
геморрагических, так и тромботических
осложнений, нередко опасных для
жизни.
23. ФОРМУЛИРОВКА ПОНЯТИЙ И ТЕРМИНОЛОГИЯ
Факторы риска тромбозаСостояние тромботической готовности
Тромбофилия
24. ФАКТОРЫ ТРОМБОГЕННОГО РИСКА – все факторы предрасполагающие к развитию тромбоза.
25. ФАКТОРЫ ТРОМБОГЕННОГО РИСКА
врожденныеГлубокий дефицит физиологических
антикоагулянтов
Мутации генов – участников
гемостатических реакций
Стойкое увеличение концентрации
и/или активности факторов
свертывания крови I, II, VIII, IX или IX
Врожденная депрессия фибринолиза
26. ФАКТОРЫ ТРОМБОГЕННОГО РИСКА (продолжение)
врожденныеГипергомоцистеинемия в связи с
дефектом ферментов, участвующих в
метаболизме метионина
Ряд гематологических заболеваний,
сопровождающихся патологией
эритроцитов и тромбоцитов
(врожденные полиглобулии, синдром
«липких» тромбоцитов)
Сосудистые аномалии
27. ФАКТОРЫ ТРОМБОГЕННОГО РИСКА
приобретенныеПожилой возраст
Атеросклероз
Пороки сердца и сосудов
Длительная иммобилизация
Аутоиммунные заболевания
Онкологические заболевания
Химиотерапия
Операция или травма
28. ФАКТОРЫ ТРОМБОГЕННОГО РИСКА (ПРОДОЛЖЕНИЕ)
приобретенныеОжирение
Варикозная болезнь
Катетеризация вен, особенно
длительное нахождение катетера в вене
Воспалительные заболевания кишечника
Нефротический синдром
Беременность
Прием эстрогенов
29. ФАКТОРЫ ТРОМБОГЕННОГО РИСКА
Хирургические больныеЛокализация хирургического
вмешательства
Техника операции
Продолжительность операции
Тип анестезии
Наличие инфекции
Степень послеоперационной
иммобилизации
30. До настоящего времени нет единого взгляда на значимость тех или иных факторов риска и стандартизированных подходов к оценке
величины тромбогеннойопасности, поскольку невозможно
предопределить в каждом
конкретном случае их критичность.
31. Мерой оценки реализации факторов тромбогенного риска является наличие состояния тромботической готовности. Это лабораторный
феномен, посредствомкоторого «in vitro» специальными
методами анализа гемостаза
распознаются активация тромбоцитов и
процессы образования фибрина,
подавление фибринолитических реакций,
повреждение эндотелия кровеносных
сосудов.
(А.П.Момот и др., 2011)
32. МАРКЕРЫ ТРОМБОТИЧЕСКОЙ ГОТОВНОСТИ
Повышение уровня маркеров тромбинемии- Фрагмент протромбина 1+2; ТАТ; РФМК;
Фибринопептид А; Д-димер
Маркеры активации тромбоцитов
- Повышение агрегации тромбоцитов;
Тромбоцитарный фактор 4
Маркеры эндотелиальной дисфункции
- Фактор Виллебранда; Эндотелин 1
Повышение уровня гомоцистеина
Повышение вязкости крови и плазмы
- содержание гемоглобина; содержание
эритроцитов, гиперфибриногенемия >5г/л
33. Ведущим шагом к предотвращению сосудистой катастрофы может быть широкое внедрение технологий распознавания состояния
тромботическойготовности, наличие которой дает
основание для проведения
первичной или вторичной
тромбопрофилактики.
34. ТРОМБОФИЛИЯ – состояние, объединяющее все наследственные (генетически детерминированные) и приобретенные (вторичные,
симптоматические)нарушения в системе гемостаза,
которым свойственна повышенная
наклонность к раннему появлению и
рецидивированию тромбозов.
(З.С.Баркаган, 2005)
35. В 2008 г. Американская коллегия торакальных врачей по антитромботической и тромболитической терапии определила ТРОМБОФИЛИЮ, как
наличие одного илиболее следующих признаков: дефицит
антитромбина, дефицит протеина С, дефицит
протеина S, резистентность фактора Va к
протеину С, мутация фактора V Лейден, мутация
протромбина, ГГЦ, гомозиготное носительство
термолабильного варианта
метилентетрагидрофолатредуктазы,
антифосфолипидных антител, увеличение
активности фактора VIII или дефицит протеина
Z. (Bates S.M. et al., 2008)
36. ТРОМБОФИЛИЯ – патологическое состояние, вызванное комбинацией врожденных и/или приобретенных факторов риска, реализованных
развитием тромбоза (тромбозов),объективные сведения о котором
(которых) могут быть получены в
настоящий момент или по данным
индивидуального анамнеза.
(А.П.Момот и др., 2010)
37. Клинические ориентиры, помогающие в диагностике врожденных форм тромбофилии
Развитие первичного тромботического эпизода ввозрасте до 40 лет;
Спонтанный тромбоз (с исключением АФС, онкологии
и др. приобретенных тромбофилий);
Рецидивы тромбоза;
Нетипичная локализация тромбоза
(мезентериальные, почечные, церебральные вены);
Наличие семейного тромботического анамнеза;
Отсутствие клинических факторов риска развития
тромбоза (онкология, оперативные вмешательства);
Неэффективность гепаринотерапии (дефицит АТ-III);
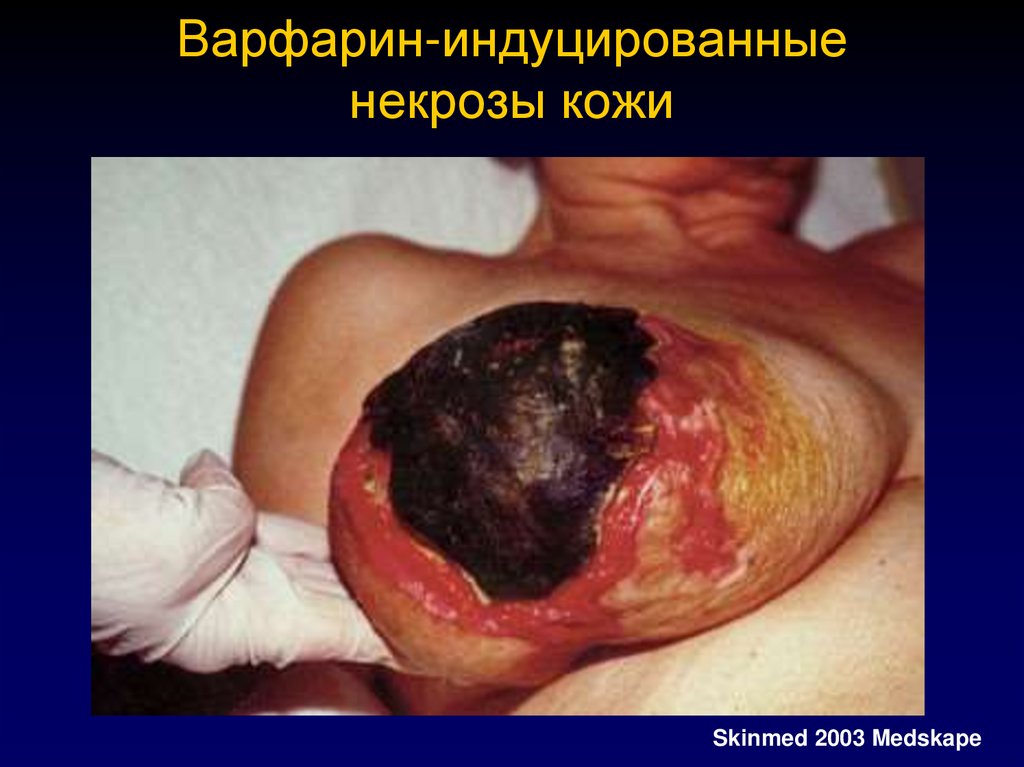
Появление кожных «варфариновых» некрозов.
38. Клиническая манифестация Фульминантная пурпура
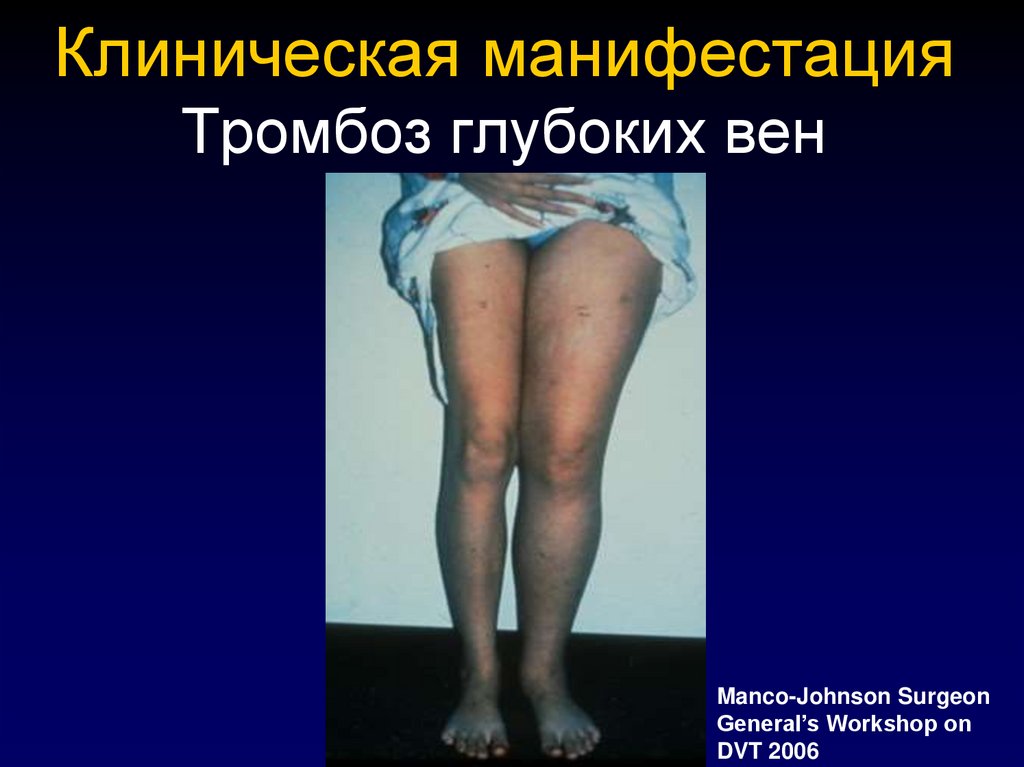
emedicine.medscape.com39. Клиническая манифестация Тромбоз глубоких вен
Manco-Johnson SurgeonGeneral’s Workshop on
DVT 2006
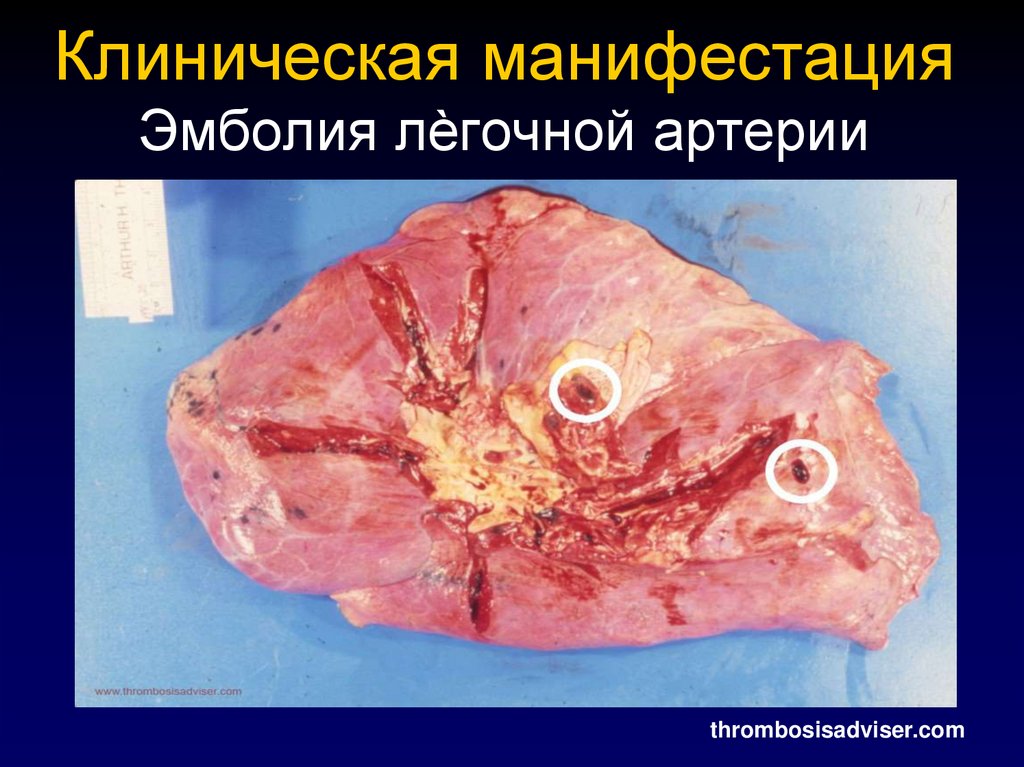
40. Клиническая манифестация Эмболия лѐгочной артерии
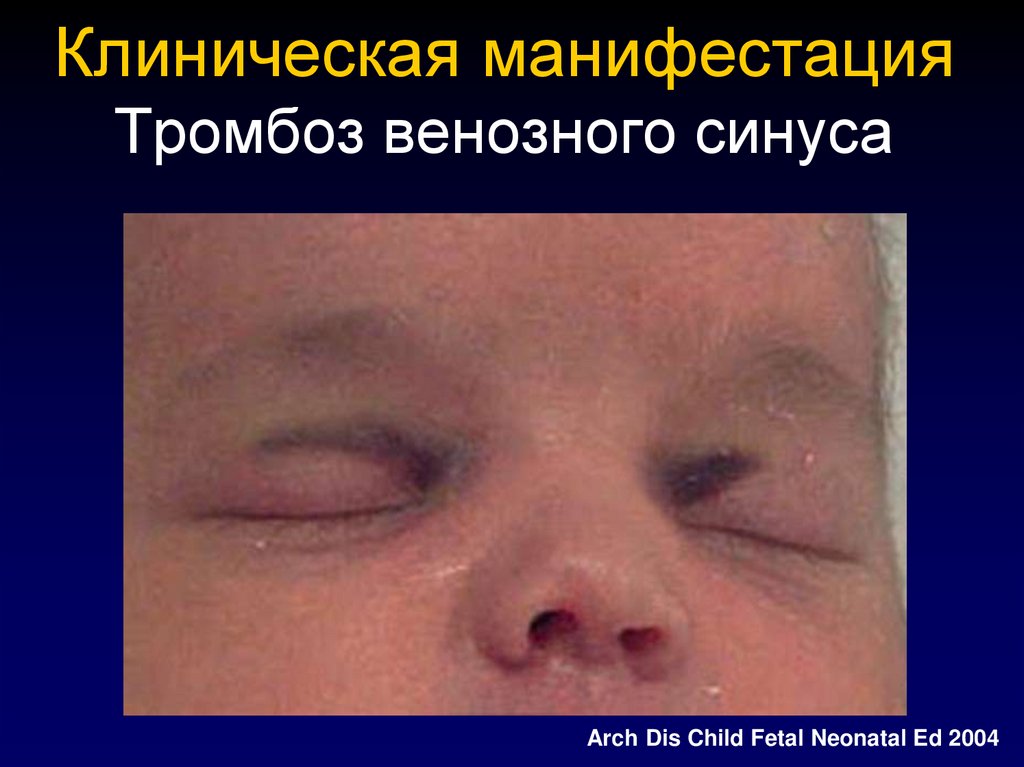
thrombosisadviser.com41. Клиническая манифестация Тромбоз венозного синуса
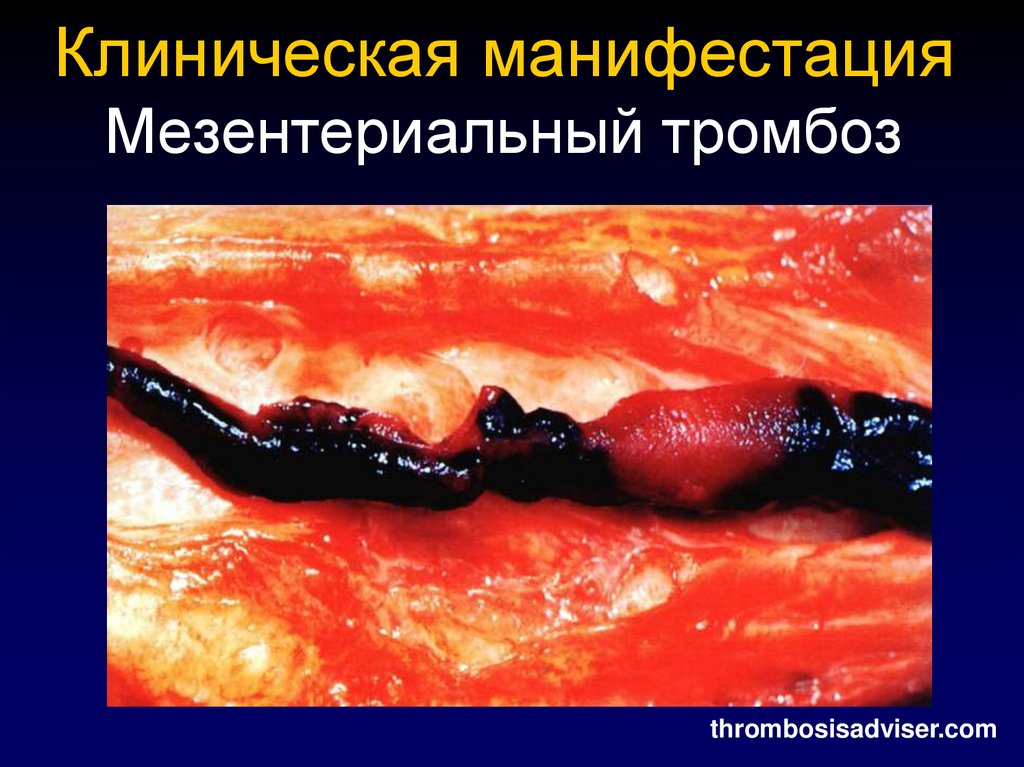
Arch Dis Child Fetal Neonatal Ed 200442. Клиническая манифестация Мезентериальный тромбоз
thrombosisadviser.com43. ПОДХОДЫ К АНТИТРОМБОТИЧЕСКОЙ ПРОФИЛАКТИКЕ И ТЕРАПИИ
МедикаментозныеПрямые
антикоагулянты
(НМГ,НГ)
Непрямые
антикоагулянты
Антиагреганты
Тромболитики
Механические
Переменная
пневматическая
компрессия
Лечебный
компрессионный
трикотаж
Фильтр в нижней
полой вене (кавафильтр)
44.
АНТИАГРЕГАНТЫПРОБЛЕМА
«Аспиринорезистентность»
Контроль функции тромбоцитов
45.
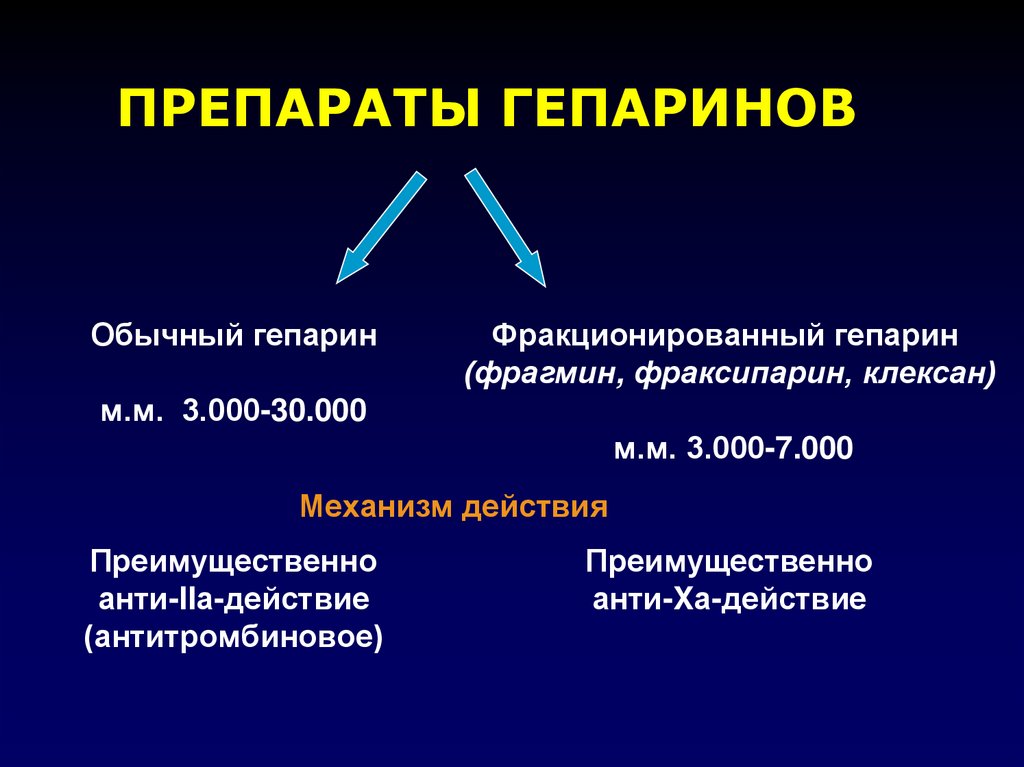
ПРЕПАРАТЫ ГЕПАРИНОВОбычный гепарин
Фракционированный гепарин
(фрагмин, фраксипарин, клексан)
м.м. 3.000-30.000
м.м. 3.000-7.000
Механизм действия
Преимущественно
анти-IIа-действие
(антитромбиновое)
Преимущественно
анти-Xа-действие
46. НЕФРАКЦИОНИРОВАННЫЙ ГЕПАРИН (НГ)
ДостоинстваНедостатки
Непостоянный
фармакокинетический
профиль, непредсказуемый
клинический ответ
Часто требуется
госпитализация
Коррекция дозы требует
лабораторного контроля
Может вызвать
гепарининдуцированную
тромбоцитопению (ГИТ)
Может вызвать остеопению
Эффективность
Привычен для
врачей
Обратимость
действия (протамин)
Быстрое начало
действия
47. НИЗКОМОЛЕКУЛЯРНЫЙ ГЕПАРИН (НМГ)
ДостоинстваЭффективность
Фиксированный режим
дозирования
– выпускается для
применения один раз
в сутки
Лабораторный контроль
требуется редко
Удобен для
амбулаторного и
домашнего применения
Риск ГИТ меньше, чем
при использовании НГ
Недостатки
Подкожные инъекции для
некоторых пациентов могут
быть затруднительны
(лечение в домашних
условиях)
Не полностью обратимый
эффект
У пациентов с очень большой
и очень маленькой массой
тела лабораторный контроль
может быть затруднен
У больных с почечной
недостаточностью
дозирование может быть
затруднено
48. СРАВНЕНИЕ НМГ И НГ ПРЕИМУЩЕСТВА НМГ
Предсказуемый клинический ответ90% биодоступность
Предсказуемая зависимость от дозы
Назначение в фиксированных дозах
Отсутствие необходимости лабораторного
контроля
Эквивалентная или более низкая частота
кровотечений
Более низкий риск гепарининдуцированной
тромбоцитопении (ГИТ)
– более безопасны при повторном и
длительном применении
Hirsch. Circulation. 1998;98:1575-1582
49. Гепарин-индуцированная тромбоцитопения (ГИТ)
- развивается у 1-5% больных- в 30% случаев осложняется рикошетными тромбозами
1.Ранняя ГИТ-1 – возникает в первые 3-4 дня
применения препарата, как правило, умеренная и
бессимптомная, не требует отмены гепарина, нужен
более тщательный контроль за динамикой
тромбоцитов.
2.Иммунная ГИТ-2 – обусловлена выработкой
аутоантител к комплексу «гепарин-тромбоцитарный
фактор 4», возникает на 6-14 день от начала
применения гепарина, требует немедленного отказа от
дальнейших введений гепарина и перехода на другие
методы
антитромботической
терапии
(арикстра,
сулодексид и др.).
50. ТРИ ГЛАВНЫХ ВОПРОСА ПРИ ПРИМЕНЕНИИ ГЕПАРИНОВ
ТромбозыПревосходят ли НМГ стандартные методы
лечения (НГ)?
Существует ли самый лучший препарат
НМГ?
Каковы клинические показания к их
применению?
– периоперационная профилактика
– длительная профилактика
– лечение
51. СУЩЕСТВУЮЩИЕ В НАСТОЯЩЕЕ ВРЕМЯ НМГ
Торговое наименованиеМетод приготовления
Дальтепарин (Фрагмин)
Контролируемая азотнокислая
деполимеризация
Эноксапарин (Клексан/Ловенокс) Бензилирование с последующим
щелочным гидролизом
Надропарин (Фраксипарин)
Фракционирование,
оптимизированная азотнокислая
деполимеризация
Сандопарин (Цертопарин)
Обработка изоамилнитратом
Тинзапарин (Инногеп)
Обработка гепариназой
Ревипарин (Кливарин)
Обработка азотной кислотой
Ардепарин (Нормифло)
Перекисное расщепление
НМГ Меркле
Перекисное расщепление
Флуксум
Перекисное расщепление
Минипарин
Обработка азотной кислотой
Fareed et al. Thrombosis/Hemostasis. 1997;3(suppl. 1):S38-S52
52.
В связи с наличием значительного числаНМГ, закономерным является вопрос об их
отличиях - существуют ли они?
Американская федеральная организация,
в обязанности которой входит контроль за
качеством допущенных на рынок США
лекарственных средств дает
недвусмысленный ответ:
...каждый НМГ представляет собой
отдельный препарат со своими
собственными характеристиками,
дозировками и осложнениями...
53.
Современные клинические данныеоправдывают применение НМГ для
первичной тромбопрофилактики
НМГ обладают более высокой
эффективностью, чем НГ, в сочетании с
большим удобством – отсутствием
необходимости лабораторного контроля и
упрощенным режимом дозирования
Длительное применение НМГ дает
существенные преимущества, по
сравнению с непродолжительной
профилактикой в условиях стационара
54.
ЛАБОРАТОРНЫЙ КОНТРОЛЬ ЗА ЛЕЧЕНИЕМОБЫЧНЫМ ГЕПАРИНОМ
Основные методы:
АПТВ
• Уровень РФМК в плазме
• Количество тромбоцитов
Должное значение:
индекс АПТВ 1,5-2,5
норма (до 5,0 мг%)
отсутствие снижения
Вспомогательные:
• Активность антитромбина III
более 80%
55. Антикоагуляция в остром периоде ТЭЛА
Антикоагулянты играют ключевую роль влечении больных с острой ТЭЛА.
Цель антикоагулянтной терапии –
профилактика ранней смерти и
рецидивирования клинически
выраженного или фатального ВТЭ при
приемлемой частоте геморрагических
осложнений!
56. Антикоагулянтная терапия
Быстрая антикоагуляция может бытьдостигнута только при парентеральном
введении антикоагулянтов:
Внутривенная инфузия
нефракционированного гепарина (НФГ);
П/к инъекции низкомолекулярных гепаринов
(НМГ);
П/к инъекции фондапаринукса (5 мг для
пациентов с массой тела менее 50 кг, 7,5 мг
для пациентов с массой тела 50 – 100 кг, 10
мг для пациентов с массой тела более 100 кг).
57. Антикоагулянтная терапия
Внутривенное введение нефракционированного гепарина ввиде болюса 80 ед. /кг, с последующей инфузией 18 ед./кг/ час.
НФГ препарат выбора у пациентов с высоким риском
кровотечения, его антикоагулянтное действие быстро
нейтрализуется. Рекомендован пациентам для которых
рассматривается проведение первичной реперфузии , лицам у
которых клиренс креатинина < 30 мл/мин
Контроль: АЧТВ (в 1,5 – 2,5 раза выше максимального
значения нормы) через 4 часа после болюса, далее каждые 3
часа, после каждой коррекции дозы или 1 раз в сутки при
достижении целевой терапевтической дозы!
Время свертываемости
Контроль тромбоцитов в клиническом анализе !
58. Антикоагулянтная терапия
Активированное частичноетромбопластиновое время
Изменение дозировки
< 35 секунд
80 Ед./кг болюс
увеличить скорость инфузии на
4 Ед./ кг в час.
35 – 45 секунд
40 Ед./кг болюс
увеличить скорость инфузии на
2 Ед./ кг в час.
46 – 70 секунд
Без изменений
71-9 секунд
Уменьшить скорость инфузии на 2 ЕД /
кг в час
> 90 секунд
Остановить вливание в течение 1 часа,
затем уменьшите скорость инфузии на 3
ЕД / кг в час
59. ПОКАЗАНИЯ К ЛАБОРАТОРНОМУ КОНТРОЛЮ (МОНИТОРИРОВАНИЮ) ДОЗИРОВКИ НМГ
Профилактическое применение НМГ в лабораторномконтроле не нуждается
Лечебное применение НМГ требует лабораторного
контроля в случаях:
1.Подбора дозы (до ликвидации тромбинемии)
2.При ожирении (нельзя расчитывать дозу НМГ на массу
тела)
3.При онкотромбозах (выраженная тромбинемия)
4.При беременности (учитывая задержку жидкости и вес
плода и околоплодных вод)
5. При ДВС-синдромах
6. У лиц преклонного возраста, особенно перенесших
инсульт и страдающих артериальной гипертензией
60. НМГ и фондапаринукс натрия (арикстра), разрешенные к применению для лечения острой ТЭЛА
ДозировкаИнтервал
Эноксапарин
1,0 мг/кг
1,5 мг/кг
Каждые 12 часов
Один раз в сутки
Тинзапарин
175 Ед./кг
Один раз в сутки
Дальтепарин
100 МЕ/кг
200 МЕ/кг
Каждые 12 часов
Один раз в сутки
Надропарин
86 МЕ/кг
171 МЕ/кг
Каждые 12 часов
Один раз в сутки
Фондапаринукс
натрия
5 мг (масса тела менее 50 кг)
10 мг (масса тела 50 – 100 кг)
10 мг (масса тела > 100 кг)
Один раз в сутки
61. Антикоагулянтная терапия
Фондапаринукс – селективный ингибиторXа фактора – альтернатива НФГ, НМГ при
ГИТ!
Период полувыведения 15 -20 часов –
назначается 1 раз в сутки.
Противопоказание - больные с тяжелой
почечной недостаточностью ( клиренс
креатинина < 20 мл/м)
При клиренсе креатинина 30 -50 мл/ мин
вводится половинная доза препарата.
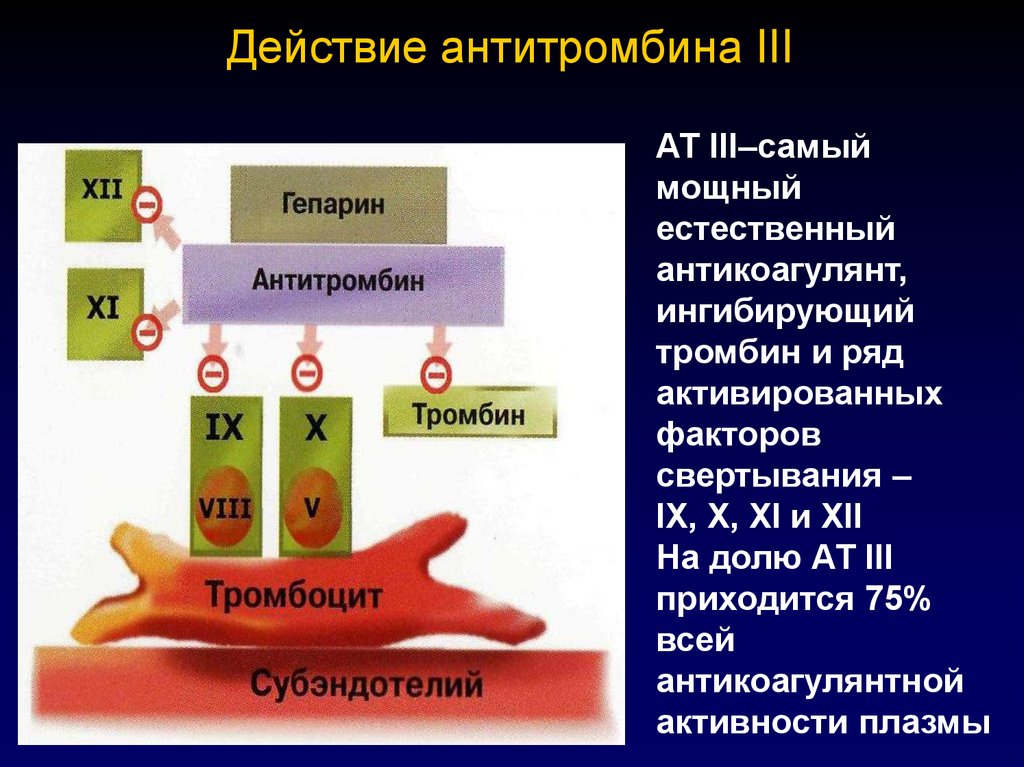
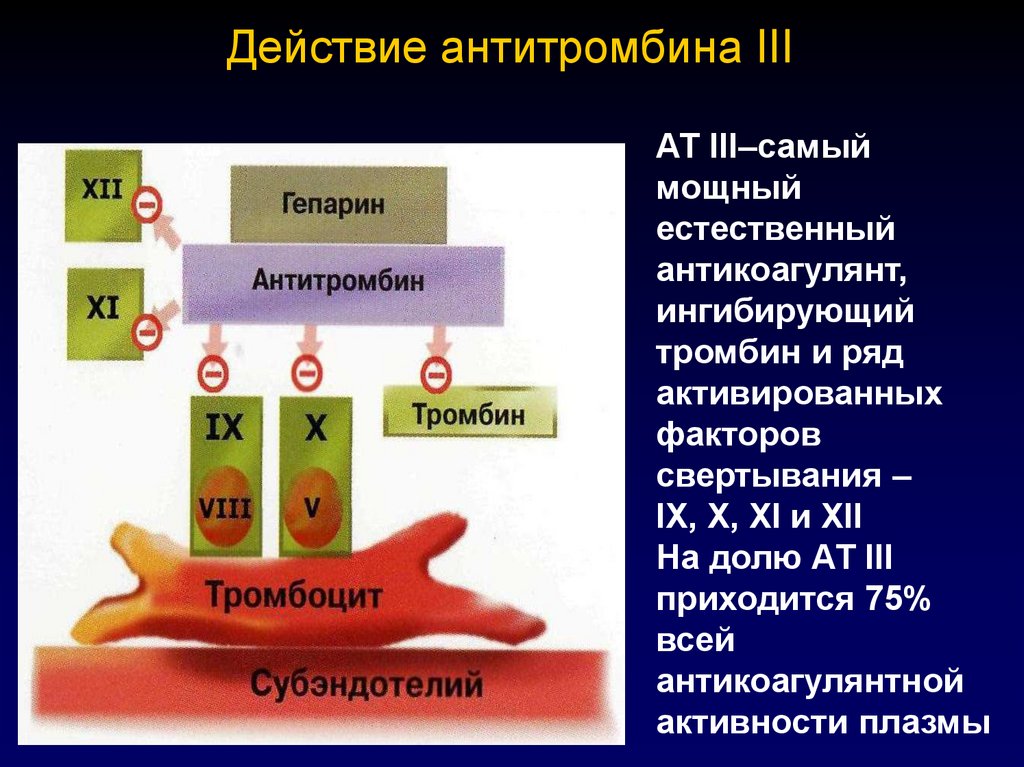
62. Действие антитромбина III
АТ III–самыймощный
естественный
антикоагулянт,
ингибирующий
тромбин и ряд
активированных
факторов
свертывания –
IX, X, XI и XII
На долю АТ III
приходится 75%
всей
антикоагулянтной
активности плазмы
63. •Аутосомно-доминантное наследование (гетерозиготы) •Гомозиготы не описаны •70 –160/100.000 (0,2–0,5%) •Тромбозы – у 2 –5% до 20
Дефицит антитромбина•Аутосомно-доминантное наследование
(гетерозиготы)
•Гомозиготы не описаны
•70 –160/100.000 (0,2–0,5%)
•Тромбозы – у 2 –5% до 20 лет, к 50
годам –у 80%
Goldenberg 2008 Hematology
64. Концентрат антитромбина III
Флаконы по 500 и 1000 МЕДозирование на курс
терапии в зависимости от
клинической ситуации
При повышенном
потреблении 1МЕ
Антитромбина
увеличивает уровень в
плазме на 1%
Терапевтический уровень
в плазме: 80-120%
65. Основные показания к применению концентрата АТ III
Врожденный и приобретенный дефицит АТ IIIменее 70% для профилактики тромботических
осложнений. Хирургические вмешательства,
беременность и роды у больных с врожденным
дефицитом АТIII. Отсутствие эффекта при
терапии гепарином. Наличие или риск развития
ДВС (сочетанная травма, септические
осложнения, шок, преэклампсия).
66. Расчет дозы концентрата АТ III
Доза рассчитывается на основании определенияактивности АТ III в плазме больного до начала
лечения и в процессе терапии каждые 6 часов.
Начальная доза должна быть достаточной для
достижения нормального уровня.
Дополнительные дозы необходимы если АТ III
снижается ниже 70%.
Доза (МЕ) = масса тела (кг) x (100 –
содержание в плазме [%]) x 0,5
67. Антикоагулянтная терапия
После парентерального введенияантикоагулянтов назначают пероральные
антагонисты витамина К.
При отсутствии лечения
парентеральными антикоагулянтами
частота повторных ВТЭ в
3 раза выше!
68. ОСОБЕННОСТИ ПРИМЕНЕНИЯ АНТИКОАГУЛЯНТОВ НЕПРЯМОГО ДЕЙСТВИЯ
Возможность длительного непрерывногоприема для профилактики и лечения
тромбозов (при обязательном лабораторном
контроле)
Относительная дешевизна препаратов (в
сравнении с низкомолекулярными гепаринами)
Необходимость внимательного
лабораторного контроля для предотвращения
кровотечений
69. ВИДЫ НЕПРЯМЫХ АНТИКОАГУЛЯНТОВ
1924 г. - штат Дакота (США) - выявлен случай геморрагическогозаболевания коров после употребления сладкого клевера
1939 г. - этот агент идентифицирован как дикумарол
1948 г. - синтезирован более мощный препарат – варфарин
С 1950-х годов - непрямые антикоагулянты стали играть
главную роль в профилактике тромбоэмболии
Кумарины
Индандионы
- варфарин
(мареван, кумадин)
- пелентан
(диндерал, неодикумарин,
дикумарил)
- синкумар (аценокумарин,
аценокумарол)
- фенилин
(фениндион,
диндеван,
фенилининдандион)
- омефин
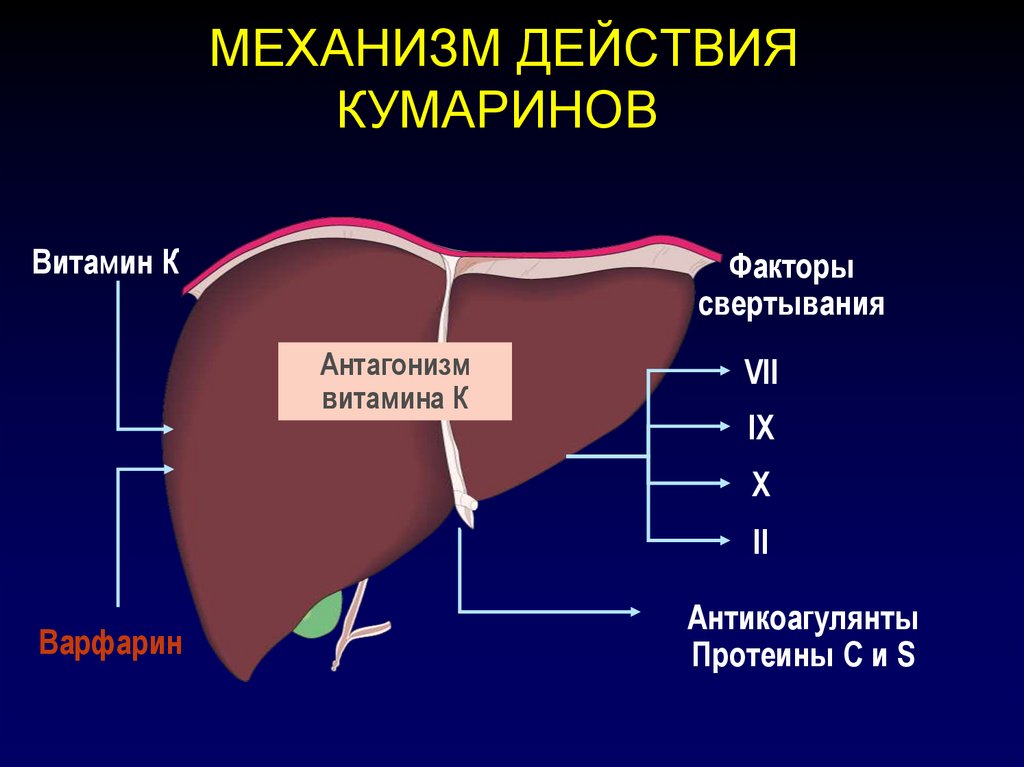
70. МЕХАНИЗМ ДЕЙСТВИЯ КУМАРИНОВ
Витамин КФакторы
свертывания
Антагонизм
витамина К
VII
IX
X
II
Варфарин
Антикоагулянты
Протеины С и S
71. РАСЧЕТ РЕЗУЛЬТАТОВ ПРОТРОМБИНОВОГО ТЕСТА
МНО(
ПВ больного в секундах
нормальное ПВ в секундах
)
МИЧ
МНО = Международное нормализованное отношение
МИЧ = Международный индекс чувствительности
Устаревший вариант
ПТИ =
Нормальное ПВ в секундах
x 100 (%)
ПВ больного в секундах
72. ОСНОВНЫЕ ПОКАЗАНИЯ ДЛЯ ПРИМЕНЕНИЯ ВАРФАРИНА (I)
В кардиологической практике:При пароксизмальной и постоянной мерцательной
аритмии
Острая и хроническая аневризма сердца с
пристеночным тромбозом
Пристеночный тромбоз полостей сердца
Механические клапаны сердца
При дилатационной миокардиопатии
После комиссуротомии
После перенесенного ИМ и шунтирования (в
сочетании с аспирином – 75 мг/день)
73. ОСНОВНЫЕ ПОКАЗАНИЯ ДЛЯ ПРИМЕНЕНИЯ ВАРФАРИНА (II)
При необходимости пролонгированияантикоагулянтной профилактики и терапии у
больных с высоким риском венозных
тромбоэмболий:
в ортопедии
в онкологической практике
при тромбофилиях
при варикозной болезни с вторичными тромбозами
и венозной недостаточности
при длительной катетеризации сосудов
74. ОТНОСИТЕЛЬНЫЕ ПРОТИВОПОКАЗАНИЯ К ТЕРАПИИ ВАРФАРИНОМ
БеременностьСитуации, когда риск кровотечения выше,
чем потенциальная клиническая выгода от
терапии антикоагулянтами
- Приём алкоголя и наркотиков
- Пациенты с деменцией и психотическим
состоянием не находящиеся под наблюдением
75. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ДОЗУ И АНТИКОАГУЛЯНТНЫЙ ЭФФЕКТ ВАРФАРИНА
Ослабляют антикоагулянтныйэффект
Усиливают антикоагулянтный
эффект
Повышенное поступление витамина
К с пищей (вегетарианское питание)
Недостаточное поступление
витамина К с пищей
Стимуляция активности системы
Недостаточная адсорбция витамина
цитохрома Р450 в печени,
К в кишечнике (малабсорбция,
повышающий метаболизм варфарина обструкция желчевыводящих путей)
(медикаменты, хронический
алкоголизм)
Генетическая резистентность к
варфарину
Недостаточная продукция витамина К
в кишечнике (антибиотики)
Снижение катаболизма факторов II,
VII, IX, X, протеинов С и S и витамина
К при гипотиреозе
Снижение синтеза факторов
свертывания (болезни печени, острая
алкогольная интоксикация)
Повышение катаболизма факторов II,
VII, IX, X, протеинов С и S и витамина
К при гипертиреозе
76. МЕТОДИКА ПЕРЕХОДА С ГЕПАРИНОВ НА ВАРФАРИН
1. Лечение варфарином можно начинать параллельно сгепаринотерапией.
2. В первые 4-5 дней больной должен принимать варфарин
одновременно с продолжающимся введением гепарина (пик
антитромботического эффекта варфарина – через 96
часов).
3. Гепарин отменяют одномоментно, когда МНО достигает
необходимых терапевтических значений.
77. ВАРФАРИН (ИНФОРМАЦИЯ О ДОЗИРОВКЕ)
Индивидуальная доза согласночувствительности пациента (по показателям
МНО)
Использование больших доз не рекомендуется
- Риск возникновения кровотечения
- Большие дозы не обеспечивают быстрого
наступления эффекта
Низкие начальные дозы (2,5 мг) рекомендуются
пожилым и ослабленным пациентам, а также
пациентам с болезнью печени
Контроль МНО регулярно
*Harrison L, et al. Ann Intern Med 1997;126:133-136.
78. МЕТОДЫ МОНИТОРИНГА ЭФФЕКТОВ АНТИКОАГУЛЯНТОВ НЕПРЯМОГО ДЕЙСТВИЯ
Контроль за дозированием (по параметру МНО впротромбиновом тесте) проводится с целью
предупреждения геморрагических осложнений.
Мониторинг достигаемых эффектов (по
ликвидации тромбинемии). Позволяет ответить на
вопрос в какой степени с помощью проводимой
терапии удалось предупредить угрозу повторного
возникновения тромбоза, а также нарастание
массы уже имеющихся тромботических
осложнений.
79. ПРИЗНАКИ ПЕРЕДОЗИРОВКИ ВАРФАРИНА
Признаки кровотечения:Кровь в стуле и моче
Чрезмерное менструальное кровотечение
Образование синяков
Обильные носовые
кровотечения/кровоточивость дёсен
Кровоточивость при поверхностных поражениях
Кровотечения из патологических образований
(опухоль, язва и других)
80. ВАРФАРИН: ГЛАВНЫЙ ПОБОЧНЫЙ ЭФФЕКТ - КРОВОТЕЧЕНИЕ
ВАРФАРИН: ГЛАВНЫЙ ПОБОЧНЫЙ ЭФФЕКТ КРОВОТЕЧЕНИЕФакторы, которые могут вызвать риск
кровотечения:
- Интенсивное воздействие антикоагулянтов
- Сопутствующие заболевания
- Применение других препаратов
- Неточное следование инструкции по
применению
81. ОСОБОЕ ВНИМАНИЕ К ПОЖИЛЫМ: ПОВЫШЕННЫЙ РИСК КРОВОТЕЧЕНИЯ
С увеличением возраста - увеличиваетсячувствительность к обычным дозам
(при этом начальная доза должна составлять
2-2,5 мг/сутки)
Повышенная частота сопутствующих
заболеваний
Большее количество лекарств принимаемых по
другим показаниям (лекарственное
взаимодействие)
Повышенный риск кровотечения, независимо от
указанных причин
82. Терапия кровотечений
Протромплекс препарат плазменныхфакторов свертывания крови
II: 600 МЕ
VII: 500 МЕ
IX: 600 МЕ
Х: 600 МЕ
Цитрат натрия
Гепарин (>0.5 МЕ/1 МЕ фактора IX)
Антитромбин III (15 -30 МЕ)
Протеин С (400 МЕ)
83.
Протромплекс 600 показания:Для лечения и профилактики кровотечений
при оперативных вмешательствах у
пациентов с приобретенным дефицитом
факторов протромбинового комплекса,
например, при дефиците, вызванном
лечением антагонистами витамина К или
передозировкой антагонистов витамина К, в
случаях, когда требуется быстрая
коррекция дефицита.
84. ВАРФАРИН ОГРАНИЧЕНИЯ
• Высокий риск кровотечения• Риск некрозов кожи
• Трудно мониторировать
• Трудно дозировать у маленьких детей
• Резистентность
Streif 1999 Blood
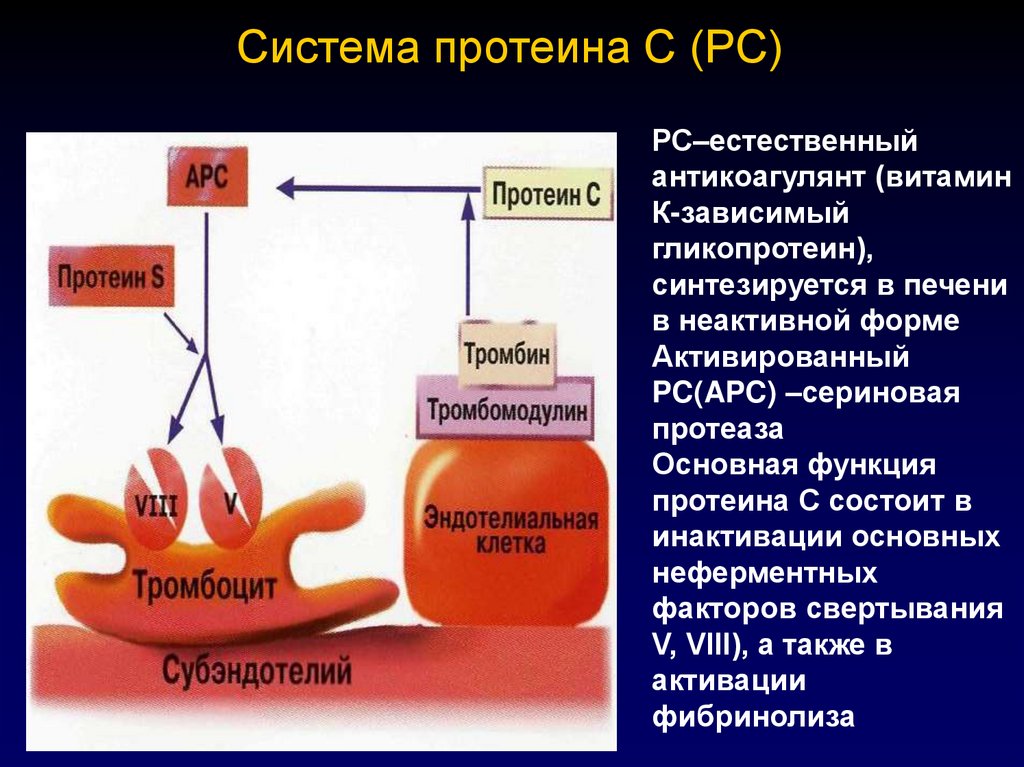
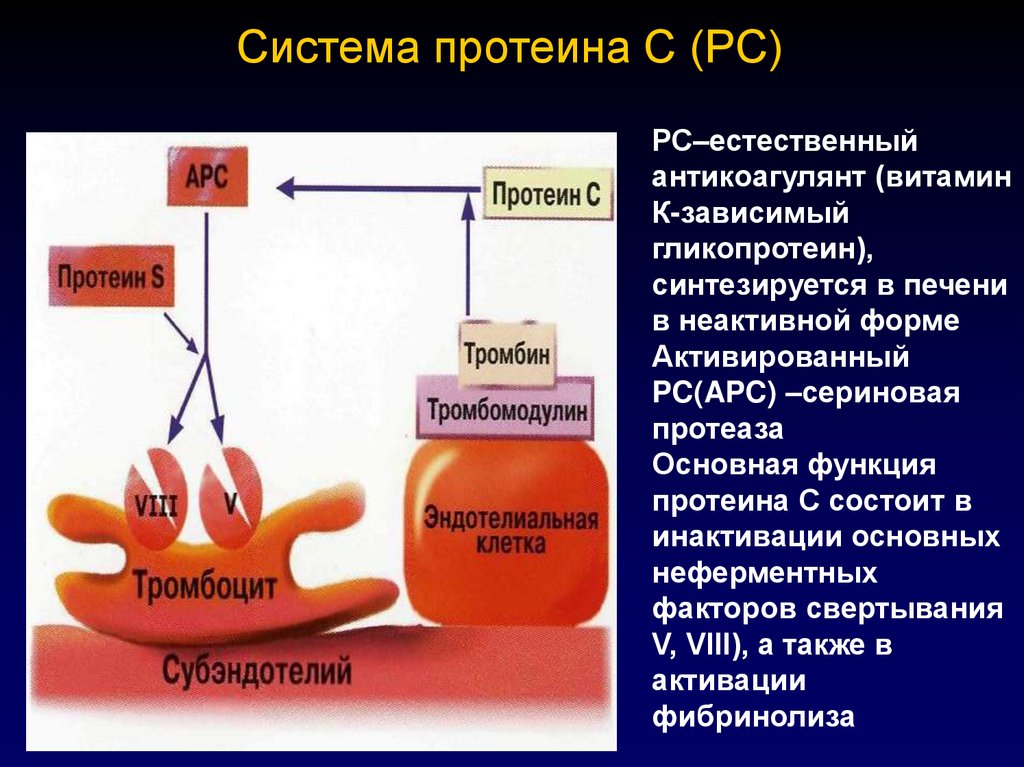
85. Система протеина С (РС)
РС–естественныйантикоагулянт (витамин
К-зависимый
гликопротеин),
синтезируется в печени
в неактивной форме
Активированный
PC(APC) –сериновая
протеаза
Основная функция
протеина С состоит в
инактивации основных
неферментных
факторов свертывания
V, VIII), а также в
активации
фибринолиза
86.
Дефицит протеина С• Аутосомно-доминантное
наследование
• 1/200 –500
• тромбозы у 2 –5%
87. Варфарин-индуцированные некрозы кожи
Skinmed 2003 Medskape88.
Дефицит протеина СТерапия
–Варфарин (умеренные дозы!) +
–Протеин C (Сепротин) до МНО 2-3
89.
Дефицит протеина САктивность протеина С в
сыворотке больного должна быть
доведена до 100% в начале
курса лечения и в течение всего
курса лечения должна
поддерживаться на уровне
свыше 25%.
Рекомендуемая начальная доза
сепротина 60-80 МЕ/кг.
90.
Показания к применению Сепротина-Фульминантная пурпура, кумарининдуцированный некроз кожи.
-Для профилактики больным с
дефицитом протеина С при
хирургическом вмешательстве, в
начале курса лечения варфарином,
если эффект от лечения
варфарином не достаточен, если
невозможно провести курс лечения
варфарином.
91. ОБУЧЕНИЕ ПАЦИЕНТОВ
Обучение основным концепциямбезопасности и эффективной
антикоагулянтной терапии.
Обсуждение важности регулярного
контроля свёртывания крови (МНО).
Информация о невозможности приёма
некоторых лекарств и алкоголя.
92. Длительная антикоагуляция и вторичная профилактика
Онкологическим пациентам назначаютНМГ, как более безопасное и
эффективное лечение в сравнении с
варфарином, как минимум 6 месяцев.
[Lee A.Y ; Kakkar A.K.]
После шести месячного курса лечения
НМГ, рекомендуется продолжить лечение
НМГ или АВК столько, сколько
заболевание будет считаться активным.
93. Современные требования к антикоагулянтам
Возможность амбулаторного использованияОтсутствие необходимости лабораторного
контроля
Отсутствие необходимости участия
медперсонала
Доказанная эффективность
Безопасность при длительном использовании
94. НПОАК в лечении ТЭЛА
Антикоагуляция: новые оральные антикоагулянтыКак альтернатива комбинации парентеральной антикоагуляции с АВК
рекомендована антикоагуляция ривароксабаном (ксарелто) 15 мг два
раза в сутки 3 недели, далее 20 мг 1 раз в сутки
I
B
Как альтернатива комбинации парентеральной антикоагуляции с АВК
рекомендована антикоагуляция апиксабаном (эликвис) 10 мг два раза в
сутки – 7 дней, далее 5 мг 2 раза в сутки
I
B
Как альтернатива лечению АВК, после парентеральной антикоагуляции
в острой фазе рекомендовано назначение дабигатрана (прадакса) 150 мг
два раза в сутки или 110 110 мг два раза в сутки в возрасте ≥ 80 лет или
получающих лечение верапамилом
I
B
Как альтернатива лечению АВК, после парентеральной антикоагуляции
в острой фазе рекомендовано назначение эдоксабана*
I
B
Новые оральные антикоагулянты (ривароксабан, апиксабан,
дабигатран, эдоксабан) не рекомендованы пациентам с тяжелыми
нарушениями функции почек
III
A
Рекомендации европейского общества кардиологов
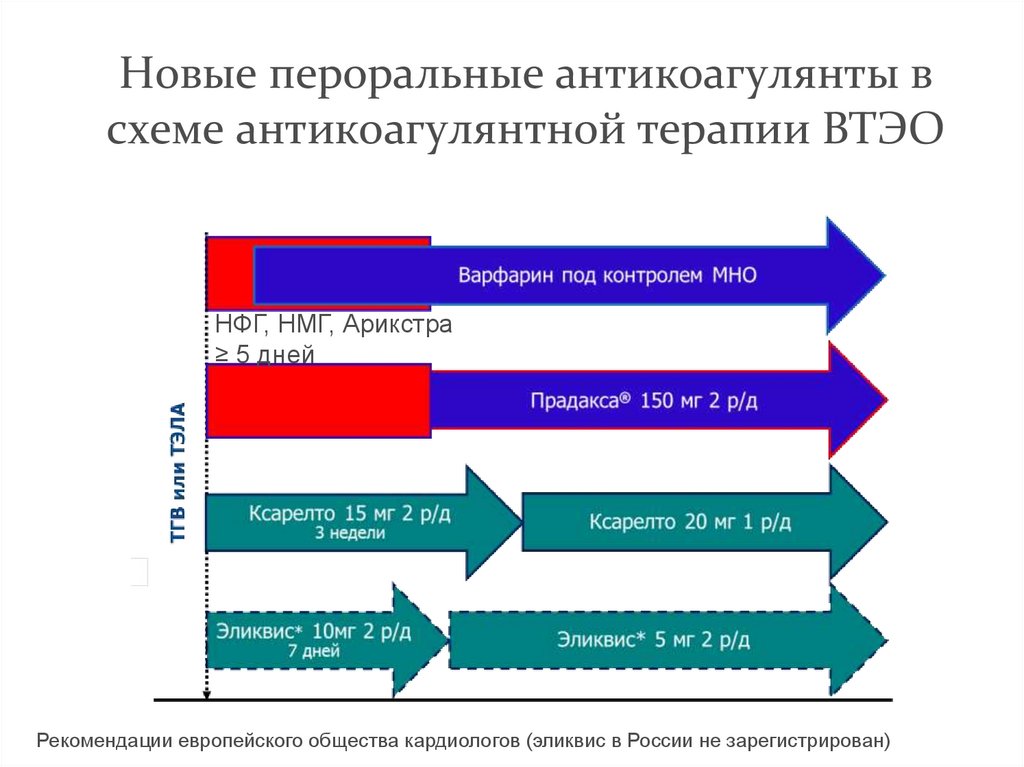
95. Новые пероральные антикоагулянты в схеме антикоагулянтной терапии ВТЭО
НФГ, НМГ, Арикстра≥ 5 дней
Рекомендации европейского общества кардиологов (эликвис в России не зарегистрирован)
96. НПОАК в лечении и профилактике ВТЭ (регистрация в России)
Дабигатран (прадакса) прямойобратимый ингибитор IIа-фактора
(тромбин)
Ривароксабан (ксарелто) прямой
ингибитор Ха фактора свертываемости
97. Рекомендации по длительности антикоагуяции после ТЭЛА
РекомендацииУ пациентов с ТЭЛА на фоне транзиторного (обратимого) фактора риска оральная антикоагуляция
рекомендуется в течение 3 месяцев.
У пациентов с неспровоцированной ТЭЛА оральная антикоагуляция рекомендуется в течение, по
меньшей мере, 3 месяцев.
У пациентов с первым эпизодом неспровоцированной ТЭЛА и низким риском кровотечений следует
рассмотреть продленную оральную антикоагуляцию.
У пациентов со вторым эпизодом неспровоцированной ТЭЛА рекомендована неопределенная
длительность антикоагулянтной терапии.
Ривароксабан (20 мг один раз в сутки), дабигатран (150 мг два раза в сутки или 110 мг два раза в
сутки для пациентов в возрасте >80 лет или одновременно получающих лечение верапамилом) или
апиксабан (2,5 мг два раза в сутки) должны рассматриваться как альтернатива для АВК (за
исключением пациентов с тяжелым нарушением функции почек), если необходима продленная
антикоагулянтная терапия.d
У пациентов, которые получают продленную антикоагуляцию, следует с регулярными интервалами
проводить повторную оценку соотношения риск-польза для продолжения этого лечения.
У пациентов, которые отказываются принимать или неспособны переносить оральные
антикоагулянты в какой-либо форме, с целью продленной вторичной профилактики ВТЭ можно
рассмотреть применение аспирина.
У пациентов с ТЭЛА и злокачественными новообразованиями на первые 3-6 месяцев следует
рассмотреть применение НМГ подкожно в подобранной по массе тела дозе.
У пациентов с ТЭЛА и злокачественными новообразованиями следует рассмотреть возможность
продленной антикоагуляции (после первых 3-6 месяцев) в течение неопределенно долгого времени,
или пока новообразование не будет излечено.
Класса
Уровень
b
I
В
I
А
IIа
В
I
В
IIа
Вe
I
С
IIb
В
IIа
В
IIа
С
98.
Исследование RE-COVER – дабигатран в сравнении с варфарином прилечении острой симптоматической венозной тромбоэмболии
Результаты:
-Эффективность
сопоставима с варфарином в лечении ТГВ и ТЭЛА
(ОР 1,09 (95% ДИ 0,76 –1,57)
- Безопасность
- снижение больших и клинически значимых кровотечений на 52 %
(ОР 0,73 (95% ДИ: 0,48-1,1)
- Все кровотечения на 33% в сравнении с варфарином
(ОР 0,71 (95% ДИ: 0,59-0,85)
ВТЭО – венозное тромбоэмболическое осложнение = острый симптомный проксимальный тромбоз глубоких ве
или ТЭЛА
Schulman S et al. Treatment of Acute Venous Thromboembolism with Dabigatran or Warfarin and Pooled Analysis. Circulation 2013;
Published online before print December 16, 2013, doi: 10.1161/CIRCULATIONAHA.113.004450. Электронный ресурс медицинского жур
Circulation American Heart Association. http://circ.ahajournals.org/content/early/2013/12/10/CIRCULATIONAHA.113.004450
Schulman S et al. Extended Use of Dabigatran, Warfarin, or Placebo in Venous Thromboembolism . N Engl J Med 2013;368:8:709-718
99.
Исследование ENSTEIN (DVT, PE)– ривароксабан всравнении с варфарином при лечении острой
симптоматической венозной тромбоэмболии
Результаты:
Эффективность сопоставима с варфарином в
лечении острого ТГВ и ТЭЛА
(ОР 1,12 (95% ДИ 0,75 –1,68)
Безопасность
Большие и клинически значимые небольшие
кровотечения регистрировались в 2 группах лечения с
равной частотой (ОР 0,90 (95% ДИ: 0,76 -1,07)
Большие кровотечения в группе ривароксабана
встречались менее часто, чем в группе стандартного
лечения (1,1% против 2,2 % ОР 0,49; 95 ДИ 0,31-0,79)
100. НПОАК для продленного лечения
Рандомизированное двойное слепоеисследование EINSTEIN Exstension
Оценивало
эффективность
и
безопасность
ривароксабана в контексте продленного лечения
ВТЭ.
6 – 12 месячный курс лечения ривароксабаном 20 мг в
сутки сравнивался с плацебо.
Ривароксабан
превосходил
плацебо
по
эффективности (1,3 % против 7,1 %; ОР 0,18; ДИ 0,09 0,39)
Нефатальные большие кровотечения 0,7 % против 0 %
плацебо.
101. НПОАК в лечении и вторичной профилактике ТГВ/ТЭЛА – преимущества для специалистов
Ниже риск развития кровотечений по сравнению сварфарином
Высокая эффективность, сопоставимая с эффективностью
варфарина
НПОАК доказавший свою эффективность и безопасность
по сравнению с варфарином и плацебо, как средство
долговременной профилактики рецидивов ТГВ/ТЭЛА
Простота в использовании
Единая дозировка на протяжении всего курса лечения
Не требует лабораторного контроля
102. НПОАК: путь к более простой и более безопасной антикоагулянтной терапии
НПОАКНе требуется мониторинг
антикоагуляции
Коррекция дозы нужна не
для всех препаратов
Мало пищевых и лекарственных
взаимодействий
Быстрое начало и окончание
действия
Широкий терапевтический
диапазон
Отсутствие специфического
антидота
Варфарин
Требуется постоянный/частый
мониторинг антикоагуляции
Частая коррекция дозы
Многочисленные пищевые и
лекарственные взаимодействия
Медленное начало
медленное окончание действия
Узкий терапевтический диапазон
Антидот в РФ не зарегистрирован
103. ДИАГНОСТИКА И ТЕРАПИЯ ДВС-СИНДРОМА
104. ДВС синдром – общепатологический процесс, в основе которого лежит множественное микротромбообразование с активацией и
последующимистощением всех звеньев системы
гемостаза и блокадой
микроциркуляции в органах с более
или менее выраженной их
дисфункцией и дистрофией.
105. ЭТИОЛОГИЯ – все терминальные состояния и разновидности шока – все острые инфекционно-септические заболевания – тяжелые травмы и
травматичные хирургическиевмешательства
– при острой массивной кровопотере
– все виды острого внутрисосудистого гемолиза
– при ряде форм акушерской патологии
– острые массивные деструкции органов (ожоги,
острые панкреатиты)
– отравления гемокоагулирующими змеиными ядами
106.
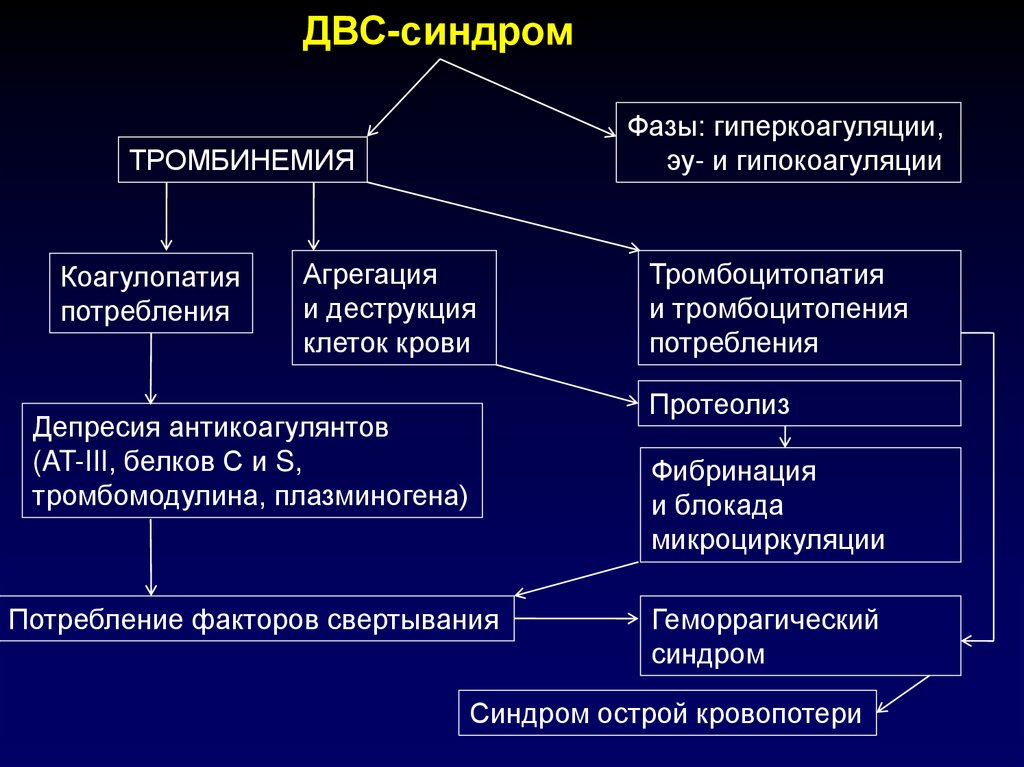
ДВС-синдромФазы: гиперкоагуляции,
эу- и гипокоагуляции
ТРОМБИНЕМИЯ
Коагулопатия
потребления
Агрегация
и деструкция
клеток крови
Тромбоцитопатия
и тромбоцитопения
потребления
Протеолиз
Депресия антикоагулянтов
(AT-III, белков С и S,
тромбомодулина, плазминогена)
Фибринация
и блокада
микроциркуляции
Потребление факторов свертывания
Геморрагический
синдром
Синдром острой кровопотери
107.
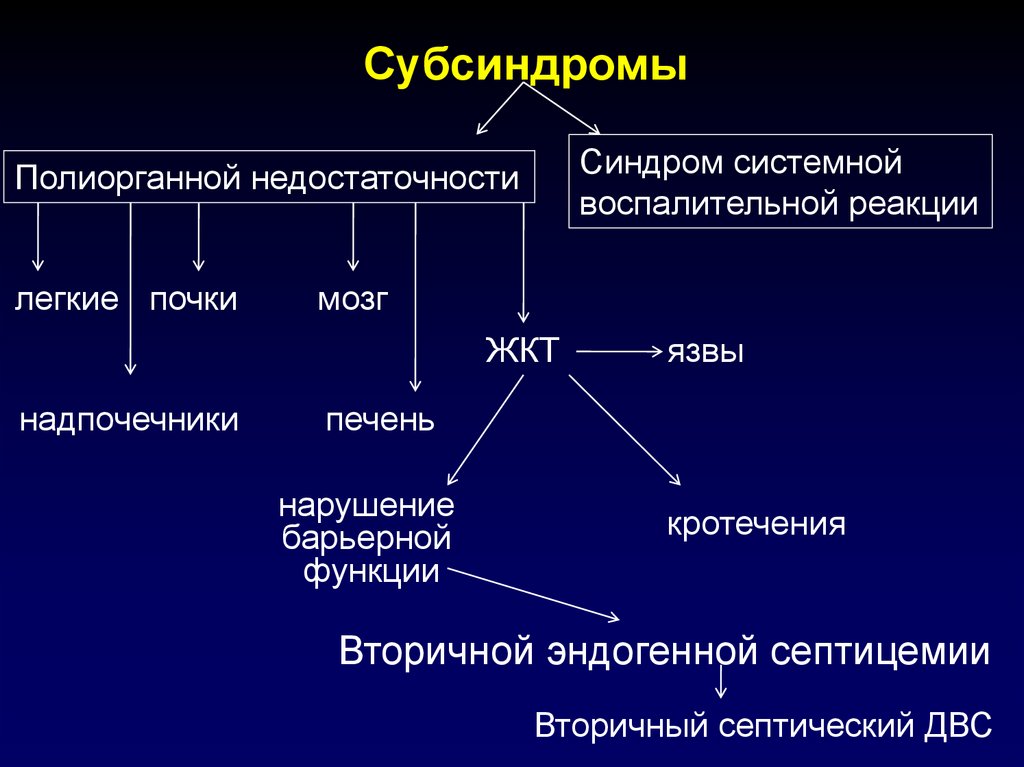
СубсиндромыСиндром системной
воспалительной реакции
Полиорганной недостаточности
легкие почки
мозг
ЖКТ
надпочечники
язвы
печень
нарушение
барьерной
функции
кротечения
Вторичной эндогенной септицемии
Вторичный септический ДВС
108. Главный принцип распознавания ДВС-синдрома – ситуационная диагностика, играющая решающую роль в его выявлении и ранней терапии.
109. Сочетание блокады микроциркуляции в органах с полиорганной недостаточностью и глубокой гипокоагуляцией крови с политопной
кровоточивостью характерно толькодля ДВС-синдрома и не наблюдается
ни при каких других геморрагических
диатезах.
110. При ряде видов патологии ДВС-синдром является единственно возможной формой нарушения гемостаза (при шоковых и терминальных
состояниях, сепсисе иожогах, остром внутрисосудистом
гемолизе, при ряде форм акушерской
патологии, укусах змей). В подобных
случаях тактически правильно считать ДВС
свершившимся фактом и немедленно
начинать его терапию.
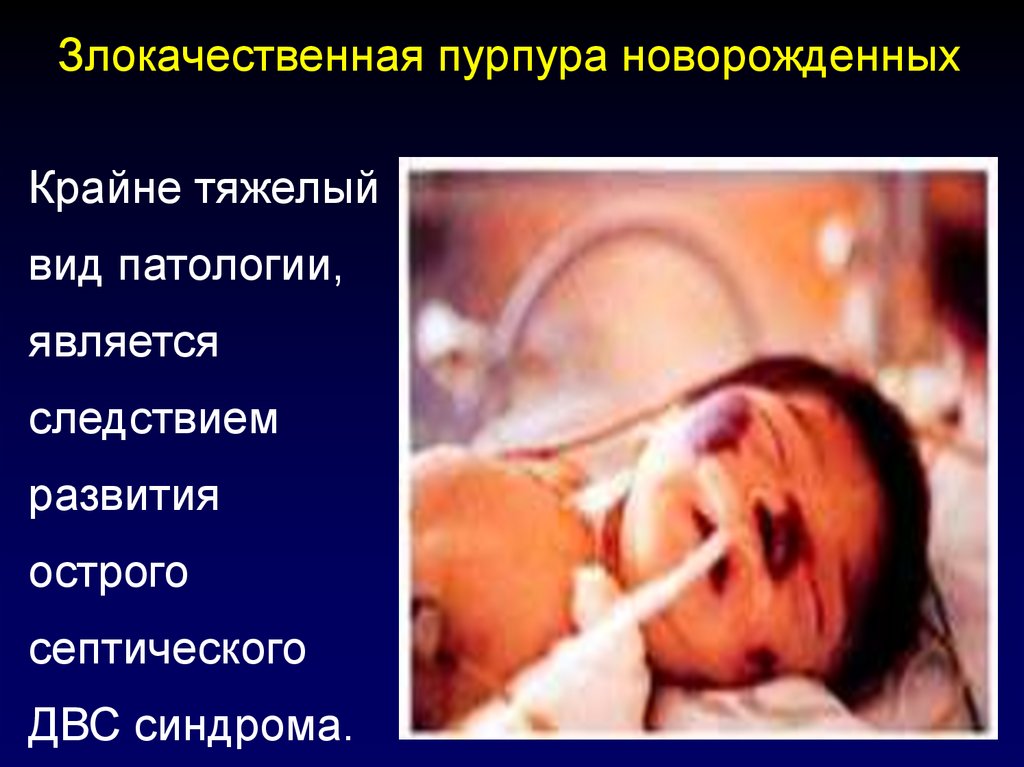
111. Злокачественная пурпура новорожденных
Крайне тяжелыйвид патологии,
является
следствием
развития
острого
септического
ДВС синдрома.
112. Злокачественная пурпура новорожденных Особая тяжесть заболевания, протекающего с тяжелым шоком, обширными геморрагиями в коже,
слизистых оболочках и внутреннихорганах, развитием некрозов кожи,
пальцев, ушных раковин, связана с
глубокой депрессией физиологических
антикоагулянтов (до 10% и ниже).
113. Лабораторная диагностика необходима для уточнения тяжести ДВС синдрома (по степени потребления основных компонентов системы
гемостаза),а также для подбора и оценки
эффективности проводимой
терапии.
114. Лабораторная диагностика является определяющей в ряде случаев подострого течения ДВС синдрома, особенно в тех случаях когда
клинические егопризнаки (ПОН, кровоточивость)
еще мало выражены или
запаздывают.
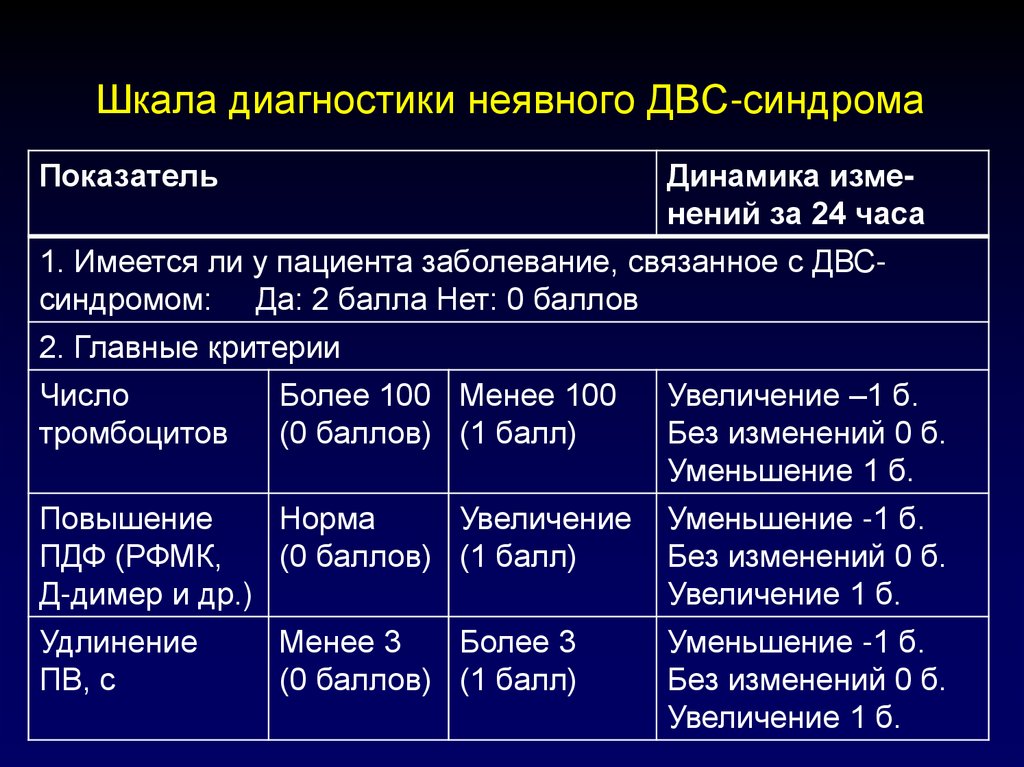
115. Шкала диагностики неявного ДВС-синдрома
ПоказательДинамика изменений за 24 часа
1. Имеется ли у пациента заболевание, связанное с ДВСсиндромом: Да: 2 балла Нет: 0 баллов
2. Главные критерии
Число
тромбоцитов
Более 100 Менее 100
(0 баллов) (1 балл)
Увеличение –1 б.
Без изменений 0 б.
Уменьшение 1 б.
Повышение
Норма
Увеличение
ПДФ (РФМК,
(0 баллов) (1 балл)
Д-димер и др.)
Уменьшение -1 б.
Без изменений 0 б.
Увеличение 1 б.
Удлинение
ПВ, с
Уменьшение -1 б.
Без изменений 0 б.
Увеличение 1 б.
Менее 3
Более 3
(0 баллов) (1 балл)
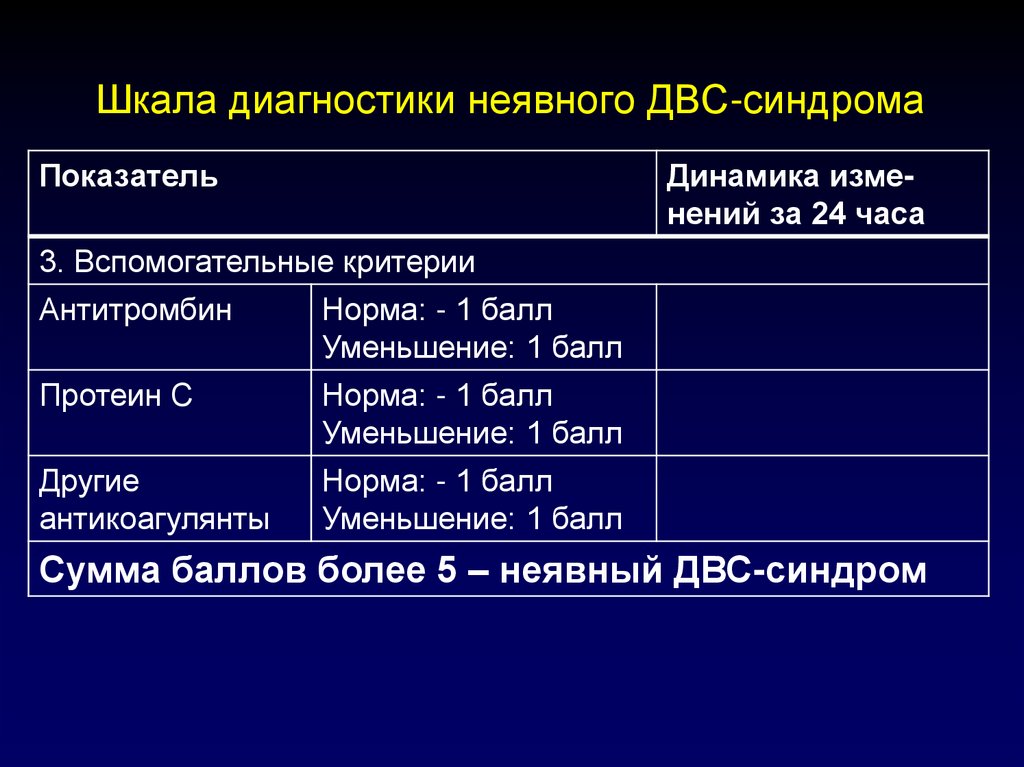
116. Шкала диагностики неявного ДВС-синдрома
ПоказательДинамика изменений за 24 часа
3. Вспомогательные критерии
Антитромбин
Норма: - 1 балл
Уменьшение: 1 балл
Протеин С
Норма: - 1 балл
Уменьшение: 1 балл
Другие
антикоагулянты
Норма: - 1 балл
Уменьшение: 1 балл
Сумма баллов более 5 – неявный ДВС-синдром
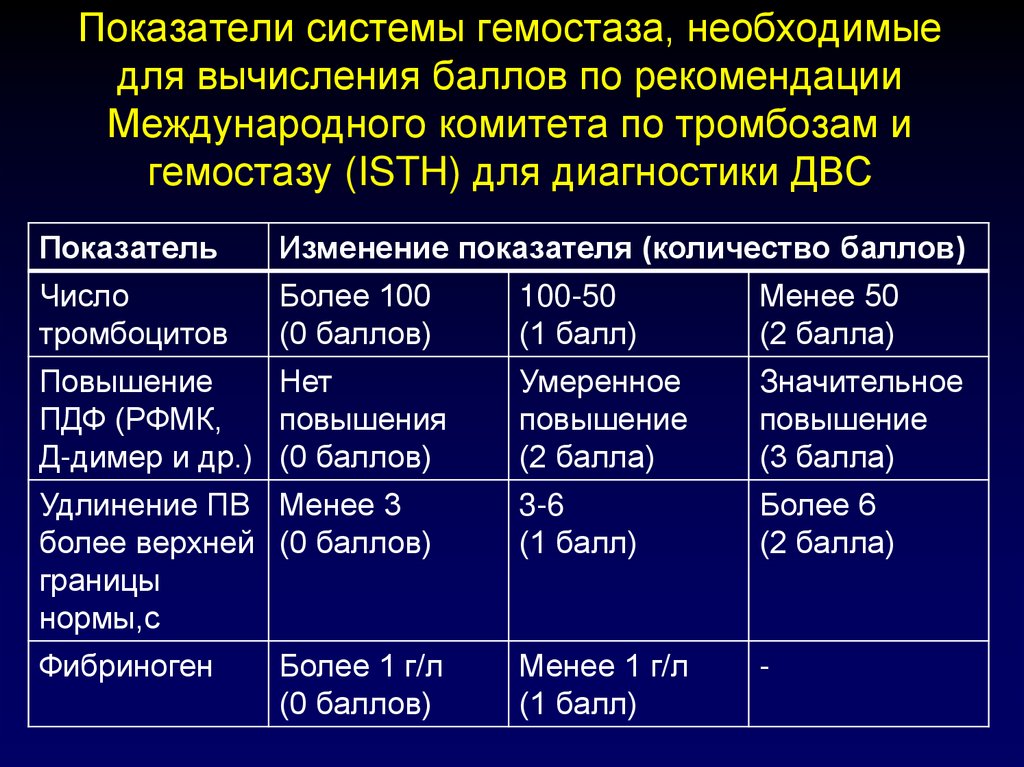
117. Показатели системы гемостаза, необходимые для вычисления баллов по рекомендации Международного комитета по тромбозам и
гемостазу (ISTH) для диагностики ДВСПоказатель
Изменение показателя (количество баллов)
Число
тромбоцитов
Более 100
(0 баллов)
100-50
(1 балл)
Менее 50
(2 балла)
Повышение
Нет
ПДФ (РФМК,
повышения
Д-димер и др.) (0 баллов)
Умеренное
повышение
(2 балла)
Значительное
повышение
(3 балла)
Удлинение ПВ Менее 3
более верхней (0 баллов)
границы
нормы,с
3-6
(1 балл)
Более 6
(2 балла)
Фибриноген
Менее 1 г/л
(1 балл)
-
Более 1 г/л
(0 баллов)
118. В тех клинических ситуациях, когда сумма баллов равна или превышает 5, верифицируется явный ДВС синдром.
119. Важнейшим проявлением острого и подострого ДВС синдрома является неуклонно прогрессирующее на всем протяжении процесса снижение
содержания и активностиважнейших физиологических
антикоагулянтов – протеина С и
антитромбина III.
120. Действие антитромбина III
АТ III–самыймощный
естественный
антикоагулянт,
ингибирующий
тромбин и ряд
активированных
факторов
свертывания –
IX, X, XI и XII
На долю АТ III
приходится 75%
всей
антикоагулянтной
активности плазмы
121. Система протеина С (РС)
РС–естественныйантикоагулянт (витамин
К-зависимый
гликопротеин),
синтезируется в печени
в неактивной форме
Активированный
PC(APC) –сериновая
протеаза
Основная функция
протеина С состоит в
инактивации основных
неферментных
факторов свертывания
V, VIII), а также в
активации
фибринолиза
122. Исследования физиологических антикоагулянтов высоко значимы для оценки тяжести дисфункции системы гемостаза и индивидуализации
прогноза, поскольку в тех случаяхкогда в процессе лечения
антикоагулянтный потенциал крови
закономерно и без срывов нарастает
прогноз почти всегда благоприятен.
123. При лабораторной диагностике и мониторировании ДВС синдрома необходимо учитывать влияние на результаты исследований
гепаринемии, гемодилюции,наблюдающейся при массивной инфузионной
терапии, гиперцитратемии
забор крови на исследование производить не
ранее чем через 1 час после окончания
объемных трансфузий.
124. Общие принципы лечения
Этиотропная терапия – лечение основного(фонового патологического процесса).
Ранние и повторные трансфузии СЗП для
замещения убыли физиологических
антикоагулянтов, плазминогена и факторов
свертывания.
Терапия СЗП впервые была предложена и
апробирована З.С.Баркаганом.
125. Методика трансфузий СЗП
Общая суточная доза 800 – 4000 мл, но неменее 15-20 мл/кг массы тела.
Перед введением СЗП должна быть
разморожена и подогрета до +36 … +37 С.
Переливания СЗП должны всегда
предшествовать трансфузиям
эритроцитарной массы, в этом случае
соотношение объемов этих сред должно
быть не менее 3:1.
126. Методика трансфузий СЗП
Поскольку СЗП является объемнымкровезаменителем, ее количество должно быть
учтено при расчете общего количества
вводимых жидкостей.
Для предупреждения цитратной интоксикации и
гипокальциемии при переливании СЗП показано
введение 5-10 мл 10%-го раствора хлорида
кальция на каждые 400-500 мл плазмы.
127. При некоторых видах ДВС синдрома (злокачественная пурпура новорожденных) показано внутривенное введение концентрата протеина С
(сепротина).Активность протеина С в сыворотке больного
должна быть доведена до 100% в начале
курса лечения и в течение всего курса
лечения должна поддерживаться на уровне
свыше 25%.
Рекомендуемая начальная доза 60-80 МЕ/кг.
128.
При тяжелых ДВС синдромах, связанных сбольшой крово- и плазмопотерей (ожоги, крашсиндром, синдром массивных гемотрансфузий),
когда больным вводятся большие объемы
плазмозаменителей, трансфузии СЗП менее
эффективны для купирования ДВС синдрома.
Трансфузии СЗП проблематичны у пациентов
при перегрузке гемоциркуляции,
сопровождающейся ОПН.
Перспективно
использование СЗП с концентратом АТ III.
129. Преимущества комбинации СЗП с препаратом АТ III
Снижение трансфузионной нагрузки насосудистое русло.
Повышение эффективности заместительной
терапии СЗП за счет более полного
восстановления дефицита про- и
антикоагулянтов в отличие от изолированных
трансфузий концентрата АТ III.
130. Преимущества комбинации СЗП с препаратом АТ III
Уменьшение риска вирусинфицирования всвязи со снижением числа доноров плазмы.
Ускорение оказания помощи (концентрат АТ III
не требует размораживания).
Данный подход более экономичен в сравнении
с использованием для заместительной терапии
только концентрата АТ III.
131. Концентрат антитромбина III
Флаконы по 500 и 1000 МЕДозирование на курс
терапии в зависимости от
клинической ситуации
При повышенном
потреблении 1МЕ
Антитромбина
увеличивает уровень в
плазме на 1%
Терапевтический уровень
в плазме: 80-120%
132. Расчет дозы концентрата АТ III
Доза рассчитывается на основании определенияактивности АТ III в плазме больного до начала
лечения и в процессе терапии каждые 6 часов.
Начальная доза должна быть достаточной для
достижения нормального уровня.
Дополнительные дозы необходимы если АТIII
снижается ниже 70%.
Доза (МЕ) = масса тела (кг) x (100 –
содержание в плазме [%])
133. Плазмаферез при ДВС синдроме
Используется при тяжелой эндогеннойинтоксикации, ОПН, гепаторенальном
синдроме. При краш-синдроме, ожоговом и
септическом шоке плазмаферез
способствует стабилизации гемодинамики и
вместе с гемодиализом является средством
профилактики и терапии ОПН. Проводится
ежедневно, с удалением за сеанс до 500 мл
плазмы.
134. Гепарин при ДВС синдроме
В связи с тем, что гепаринизация усиливаеттенденцию к кровоточивости, ускоряет
снижение содержания в крови АТ III и
потенцирует агрегацию тромбоцитов в
настоящее время гепарин используется
лишь в малых дозах (1-2 тыс МЕ на каждые
400-500 мл плазмы) и лишь для прикрытия
трансфузий СЗП.
135. Купирование кровотечений
При глубокой тромбоцитопении в терминальной фазеДВС и массивных кровотечениях в комплексную
терапию включаются трансфузии тромбоцитов.
Показано введение 4-6 доз концентрата тромбоцитов.
При неэффективности других средств лечения и
продолжения угрожающего жизни кровотечения
перспективно применение рекомбинантного фактора
VIIa в дозах 60-90 мкг/кг.
При кровотечениях, при наличии деструктивных
изменений в органах и сепсисе к терапии добавляют
введение антипротеаз.
136. Оценка эффективности лечения
Основные клинические критерии –купирование геморрагического синдрома,
обратное развитие органных нарушений.
Лабораторные критерии – динамика
активности АТIII, уровень РФМК, Dдимера, количество тромбоцитов в крови и
фибриногена.
137. Критическое снижение (фибриноген, тромбоциты, МНО, АПТВ) СЗП Криопреципитат Фактор VII Тромбоциты Протромплекс 600 Истощение
противосвертывающей системы:антитромбин III
протеин С
138.
Своевременная диагностика острого иподострого ДВС синдрома, раннее
подключение этиотропной и
патогенетической терапии, с учетом вида
патологии и особенностей течения
болезни, являются обязательным
условием эффективной борьбы с этим
тяжелым осложнением, характерным для
критических и неотложных состояний.





















































































































 Медицина
Медицина








