Похожие презентации:
Количественные характеристики вещества
1.
КОЛИЧЕСТВЕННЫЕХАРАКТЕРИСТИКИ
ВЕЩЕСТВА.
2.
Химическое количество – физическаявеличина, прямо пропорциональная
числу частиц (атомов, молекул,
формульных единиц), содержащихся в
данной порции вещества.
3.
n – химическое количество;измеряется в молях;
3
V – объем; измеряется в дм
3
(чаще всего) или же в см ;
m – масса; измеряется в г
(чаще всего) или же в кг.
4.
n=m/Mm=n*M
5.
1 моль – порция вещества,которая содержит столько же
частиц, сколько атомов
содержится в порции
углерода массой 0,012 кг.
6.
N=n*Na, где Na –постоянная Авогадро (число
Авогадро), которое имеет
постоянное значение
23
-1
6,02;10 моль .
n= N/Na
7.
Молярная масса вещества– это величина, равная
отношению массы любой
порции этого вещества к
его химическому
количеству.
8.
M=m/nm=M*n
n=m/M
9.
Отношение объема порции любого газа кего химическому количеству в этой же
порции всегда будет постоянной
величиной.
Vm=V/n
V=n*Vm
n=V/Vm
10.
Установлено, что принормальных условиях
0
(температура 0 C и
давление 101325 Па или
101,325 кПа) Vm= 22,4
3
дм /моль.
11.
Формулавещества
Химическое
количество
вещества, n
CaS
Fe2O3
Масса
вещества, m
22 г
3,60 моль
Na2CO3*10H2O
Неизвестное
вещество Х
Молярная
масса
вещества, M
120 г
0,15 моль
2,70 г
12.
ФормулаХимическое Объем
Масса
газообразног количество вещества, V вещества, m
о вещества вещества, n
NO2
2,6 моль
CH4
SO2
24 г
11,2 дм3
13.
В сосуде содержится 4,34*1023молекул воды. Вычислите химическое
количество воды в этом сосуде и
массу воды.
Рассчитайте химическое количество и
массу Na2CO3, если известно, что
N=8,12*1023.
14.
Домашнеезадание: параграф
4 №4, №6, №8,
№9



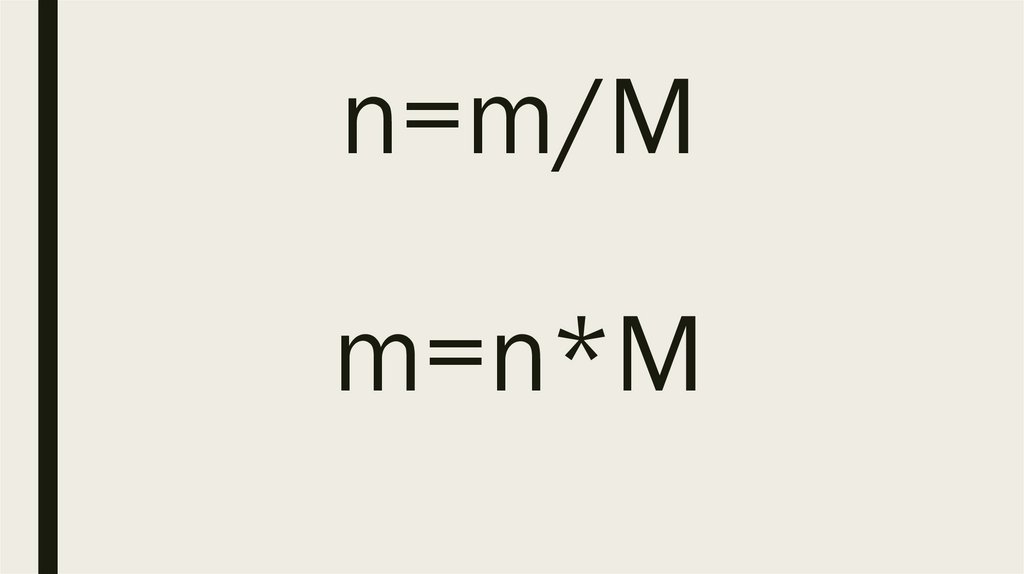











 Химия
Химия








