Похожие презентации:
Сера
1.
2.
Сера – распространенный элемент.В природе – виде
самородной серы: входит в состав различных минералов и
горных пород.
Важнейшие природные минералы серы: FeS2 — железный
колчедан, или пирит, ZnS — цинковая обманка,
или сфалерит (вюрцит), PbS — свинцовый блеск, или галенит,
HgS — киноварь, Sb2S3 — антимонит, Cu2S — халькозин, CuS —
ковеллин, CuFeS2 — халькопирит. Кроме того, сера присутствует
в нефти, природном угле, природных газах и сланцах.
3.
Сера как химический элемент.Находится в VIA группе 3 периода. Неметалл.
16 протонов, 16 электронов, 16 нейтронов.
2е-, 8е-, 6е-.
Максимальная степень окисления +6, минимальная
степень окисления (N группы - 8) – 2.
4.
5.
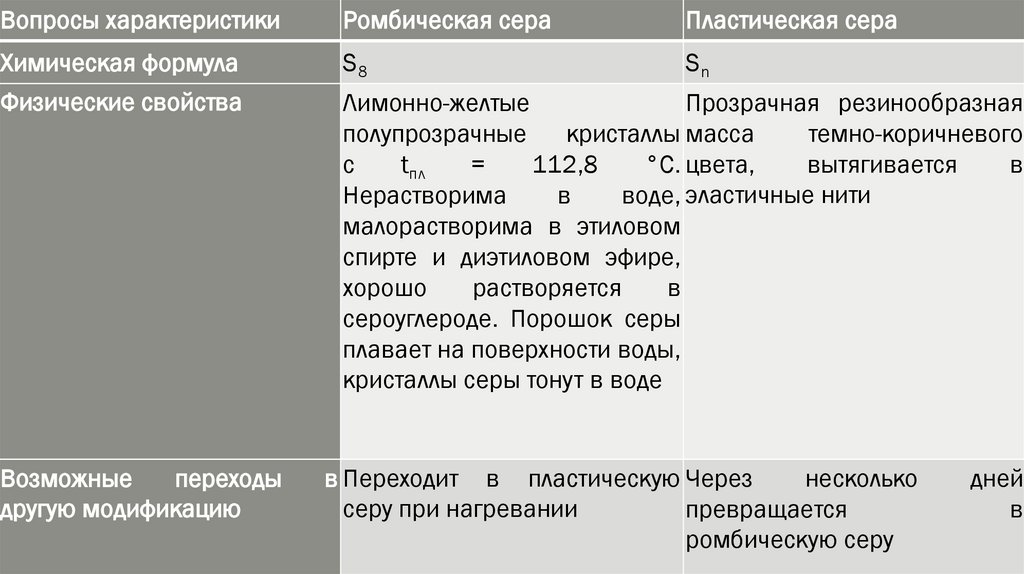
Вопросы характеристикиРомбическая сера
Пластическая сера
Химическая формула
S8
Sn
Физические свойства
Лимонно-желтые
Прозрачная резинообразная
полупрозрачные
кристаллы масса
темно-коричневого
с
tпл
=
112,8
°С. цвета,
вытягивается
в
Нерастворима
в
воде, эластичные нити
малорастворима в этиловом
спирте и диэтиловом эфире,
хорошо
растворяется
в
сероуглероде. Порошок серы
плавает на поверхности воды,
кристаллы серы тонут в воде
Возможные
переходы
другую модификацию
в Переходит в пластическую Через
несколько
серу при нагревании
превращается
ромбическую серу
дней
в
6.
Химические свойства серы.Окислительные свойства серы
(S0 + 2ē → S-2)
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2Al + 3S –→ Al2S3
Zn + S –→ ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S — 2ē → S+2; S — 4ē → S+4; S — 6ē → S+6)
3) c кислородом:
S + O2 = SO2
4) c галогенами (кроме йода):
S + Cl2→ SCl2
S + 3F2 → SF6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4+ 6NO2 + 2H2O
7.
8.
9.
Получение серы1. Промышленный метод — выплавление из руды с
помощью водяного пара.
2.Неполное окисление сероводорода (при недостатке
кислорода): 2H2S + O2 → 2S + 2H2O
3. Реакция Вакенродера: 2H2S + SO2 → 3S + 2H2O
10.
Домашнее задание:параграф 19 №6, №8
стр 104









 Химия
Химия








