Похожие презентации:
Защитно-компенсаторные процессы
1.
Кацапенко К.Д.Защитнокомпенсаторные
процессы
2.
Приспособлением, илиадаптацией (от лат. adaptatio —
приспособление), называется
совокупность физиологических
реакций организма,
направленных на сохранение
относительного постоянства его
гомеостаза в условиях
изменяющейся внешней среды.
Общий адаптационный синдром
(от греч. syndrome — слияние) —
совокупность защитноприспособительных реакций
организма на различные
раздражители — стрессоры
(холод, тепло, мышечное
перенапряжение, травма,
инфекционный агент,
интоксикация и др.)
3.
• Компенсаторнымипроцессами называются
сложные реакции и
морфофункциональные
изменения в организме,
направленные на
выравнивание
нарушенного гомеостаза
под действием
экстремальных и
патогенных (экзогенных
или эндогенных)
раздражителей.
4.
Фаза становления компенсации (повышениеинтенсивности обмена веществ с включением в
работу резервных структур).
Фаза закрепления ( характеризуется устойчивым
восстановлением равновесного состояния системы
или органа).
Фаза истощения или декомпенсация ( может
возникать в разное время после полного или
неполного выздоровления в результате врожденной
или приобретенной недостаточности
компенсаторных процессов).
5.
К приспособительным икомпенсаторным
процессам относят:
• регенерацию,
• гипертрофию и
гиперплазию,
• организацию и
гистологическую
аккомодацию,
• перестройку тканей и
метаплазию,
• трансплантацию.
6.
Шок• Понятие шок не относится к числу точно детерминированных.
• Причиной шока является — болевое (или другое сверхсильное) воздействие, или
быстро наступающие генерализованные расстройства кровообращения, ведущие к
глубокому падению системного артериального давления.
• Шок — патологическое состояние рефлекторной природы, возникающее при
воздействии на организм сверхсильного раздражителя, вызывающего
перераздражение нервной системы, которое сменяется глубоким нисходящим
торможением, и ведущее к тяжёлым расстройствам гемодинамики дыхания и
обмена веществ.
• Неприятие некоторыми исследователями ведущей роли болевого фактора в
развитии шока связано с тем, что далеко не всегда проводится четкая грань между
болью и ноцицепцией, а с другой стороны не принимается во внимание, что эти
понятия чрезвычайно близки.
7.
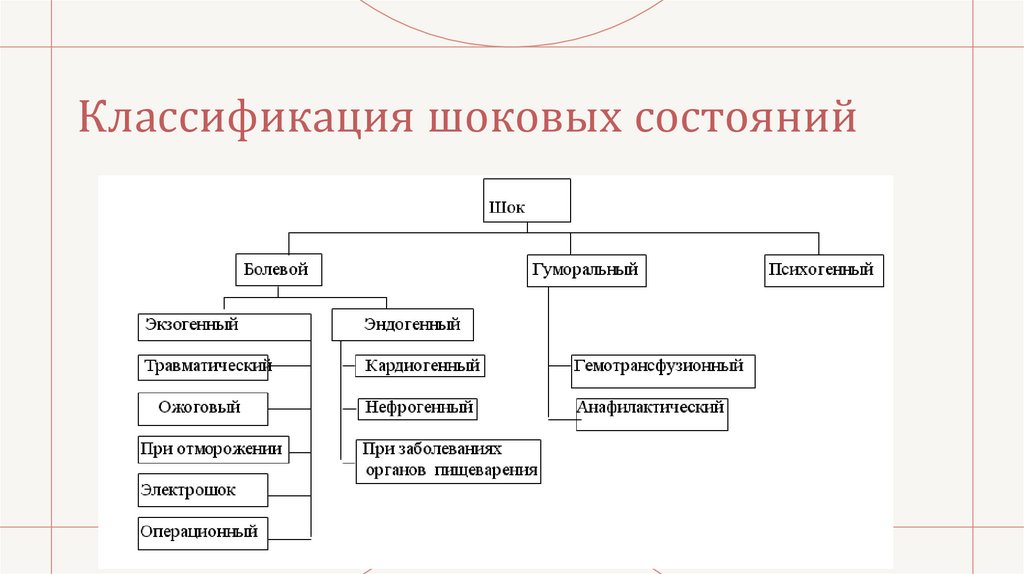
Классификация шоковых состояний8.
Механизмы развития шокаВ развитии шока участвует ряд патогенетических механизмов.
• Неврогенный (пусковой) механизм. Шокогенный фактор вызывает перераздражение
нервной системы, сменяющееся глубоким нисходящим торможением. Оба эти фактора —
и перевозбуждение, и торможение — ведут к нарушению нервно-гуморальной регуляции
организма Неврогенный механизм является главным, пусковым (и в дальнейшем —
поддерживающим) механизмом шока. При болевом шоке неврогенный фактор включается
в связи с болевой (ноцицептивной) импульсацией.
9.
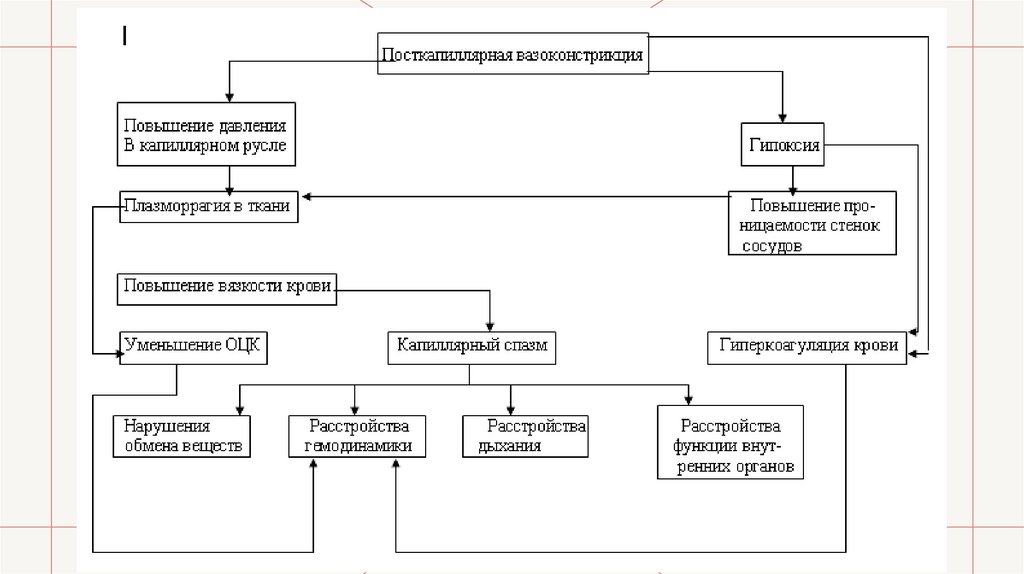
• Микроциркуляторный механизм. Вследствие нарушения регуляции шокогеннымфактором возникает пост-капиллярная вазоконстрикция, которая приводит к повышению
давления в капиллярном русле из-за нарушенного оттока крови. В результате этого
начинается плазморагия в ткани, что ведет к двум патогенетическим проявлениям:
уменьшению объема циркулирующей крови и капиллярному стазу. Кроме того, в результате
посткапиллярной вазоконстрикции нарушается микроциркуляция крови, в тканях возникает
состояние гипоксии, которая вызывает повышение проницаемости сосудисто-тканевых
мембран и тем самым усиливает плазморагию в ткани. В то же время гипоксия в сочетании
с посткапиллярной вазоконстрикцией (вследствие первой изменяются физико-химические
свойства крови, а вторая может нарушить целостность стенок сосудов) вызывает
гиперкоагуляцию крови, которая в свою очередь усиливает капилллярный стаз. Последний
вместе с уменьшением объема циркулирующей в сосудистой системе крови ведет к
возникновению расстройств гемодинамики и дыхания, нарушениям обмена веществ, а все
это вместе — к расстройствам функций внутренних органов. Поскольку капиллярная
вазоконстрикция носит тотальный характер, этот микроциркуляторный механизм можно
считать основным патогенетическим механизмом шока.
10.
11.
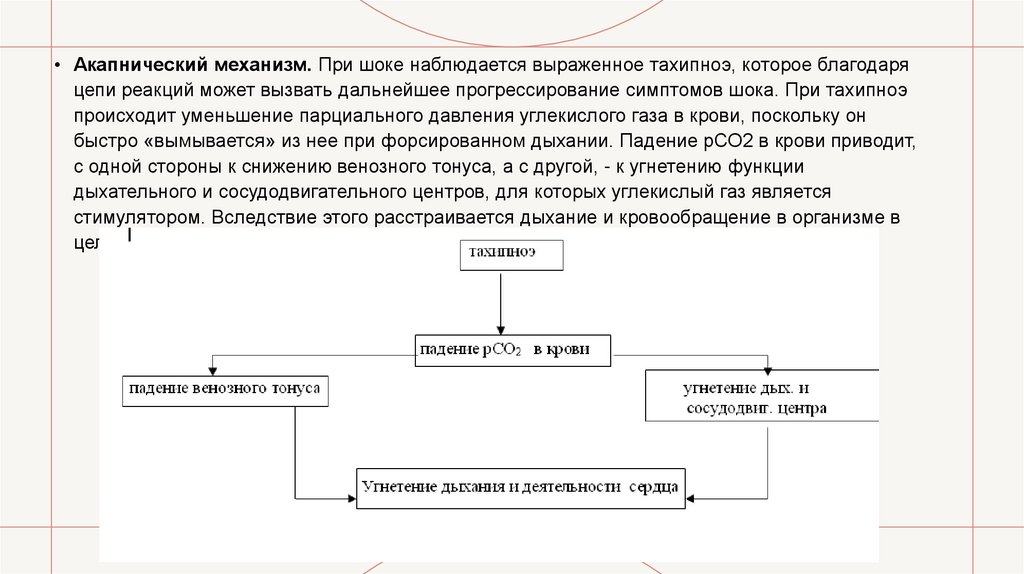
• Акапнический механизм. При шоке наблюдается выраженное тахипноэ, которое благодаряцепи реакций может вызвать дальнейшее прогрессирование симптомов шока. При тахипноэ
происходит уменьшение парциального давления углекислого газа в крови, поскольку он
быстро «вымывается» из нее при форсированном дыхании. Падение рСО2 в крови приводит,
с одной стороны к снижению венозного тонуса, а с другой, - к угнетению функции
дыхательного и сосудодвигательного центров, для которых углекислый газ является
стимулятором. Вследствие этого расстраивается дыхание и кровообращение в организме в
целом
12.
• Токсемический механизм. Рядом исследователей шока высказывалась мысль о том, что в егопатогенезе могут играть роль образующиеся в организме токсические вещества. Однако таких,
специфических для шока, метаболитов обнаружено не было, хотя некоторые БАВ играют
важную роль в возникновении токсемии.
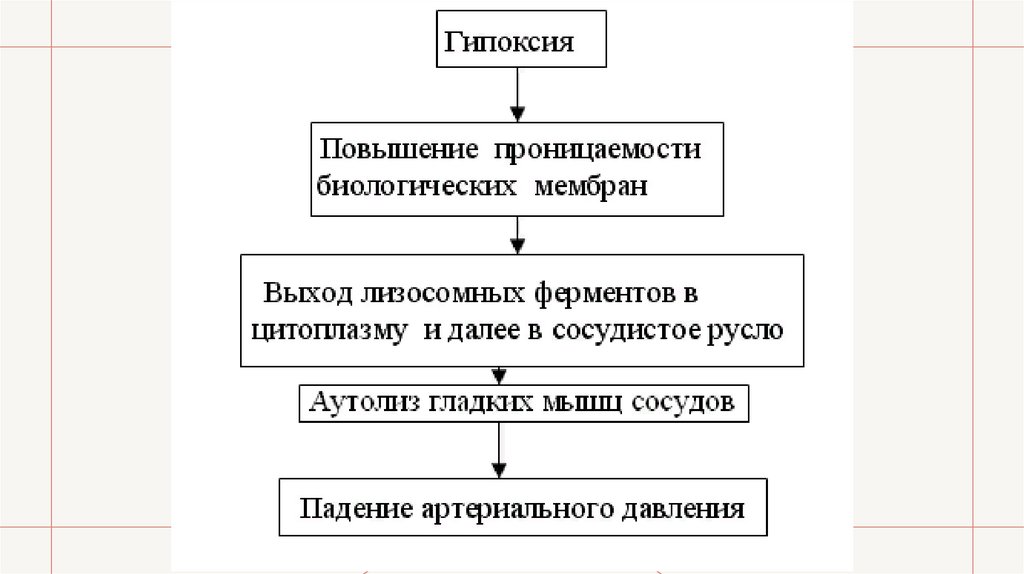
• Вследствие возникшей при шоке гипоксии повышается проницаемость всех мембран, в том
числе и лизосомных. В результате этого ферменты лизосом в большом количестве выходят в
цитоплазму клеток и через их мембраны попадают в сосудистое русло, где они могут вызвать
переваривание гладких мышц сосудистой стенки, что в свою очередь приведет к
катастрофическому падению артериального давления, поскольку поражение этих мышц не
позволяет сосудам поддерживать свой тонус на необходимом уровне. Именно лизосомный
механизм лежит в основе резчайшего падения артериального давления при необратимых
формах шока.
• Особая форма токсемии развивается при так называемом krash-синдроме (синдром
длительного раздавливания), когда какая-либо часть тела (чаще всего — конечности) в течение
длительного времени подвергается раздавливающему действию каких-либо тяжелых предметов
(при землетрясениях, железнодорожных и автокатастрофах и др.). В этом случае в
раздавленных тканях накапливаются токсические метаболиты, которые, пока эти ткани
сдавлены, не попадают в общий кровоток. При освобождении сдавленных частей тела
токсические вещества поступают в кровеносные сосуды и обуславливают тяжелейшую
интоксикацию организма.
13.
14.
Нарушение функций некоторыхорганов при шоке
• Хотя при шоке страдают функции практически всех внутренних органов, особо следует
остановиться на двух: «шоковых легких» и «шоковых почках». Во-первых, альтерация этих
органов при шоке характеризуется своеобразным симптомокомплексом, что и позволило дать им
такие специфические названия. Во-вторых, поражение именно этих органов в динамике шокового
процесса дает толчок к его дальнейшему прогрессированию и включает ряд других
патогенетических механизмов.
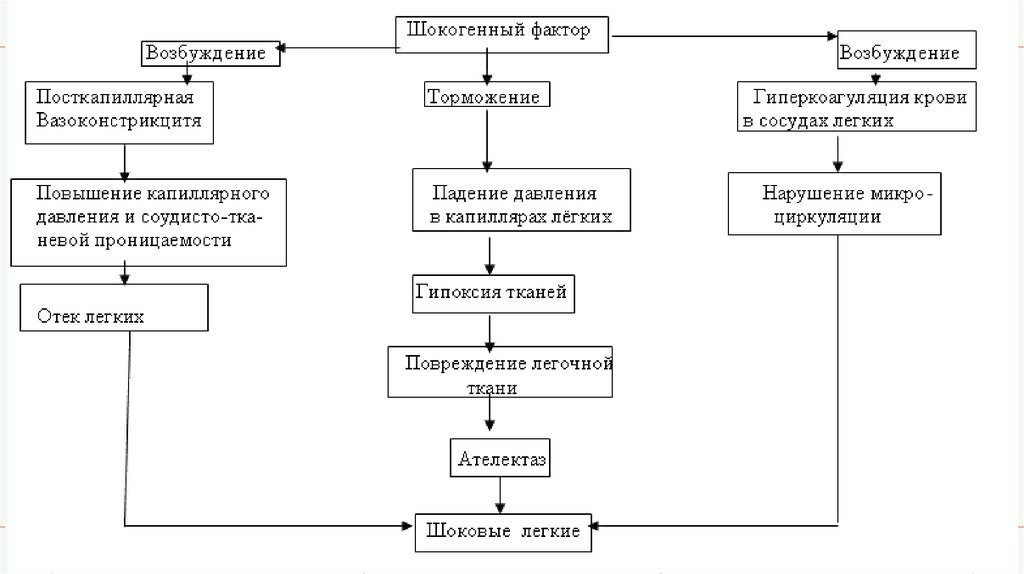
• При возбуждении, характерном для начальной фазы шока, возникает посткапиллярная
вазоконстрикция в сосудах малого круга кровообращения, что, благодаря развивающемуся
вследствие этого повышению сосудисто-тканевой проницаемости, вызывает отек легких,
поскольку имеет место плазморрагия в полость альвеол.
• Возникающая в этот же период гиперкоагуляция крови резко усугубляет нарушения
микроциркуляции в легочной ткани. При развитии торможения в возбудимых системах организма
падает давление в капиллярах легких, что резко усугубляет их гипоксию. Легкие при этом
повреждаются, что и становится основой возникновения легочных ателектазов.
Сочетание ателектазов с отеком и нарушениями микроциркуляции и составляет основу развития
«шоковых легких».
15.
16.
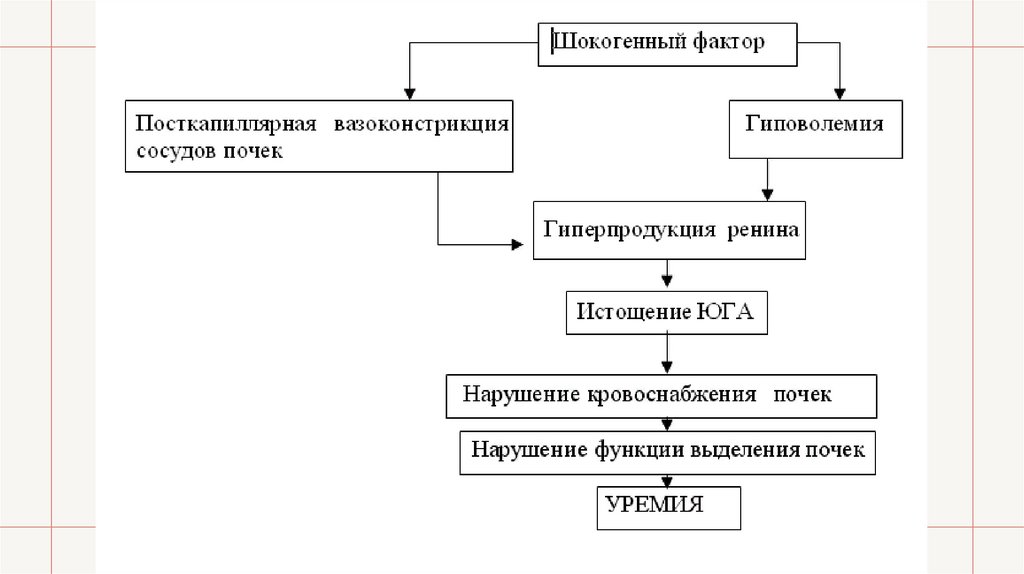
• «Шоковые почки». Шокогенный фактор вызывает уменьшение объема циркулирующейв сосудистой системе крови (состояние гиповолемии) и посткапиллярную
вазоконстрикцию в почках. Оба эти фактора, инициируя состояние ишемии почечной
ткани, ведут к гиперфункции юкстагломерулярного аппарата (ЮГА) почек,
продуцирующего ренин. В результате длительной гиперфункции ЮГА истощается, что
приводит к дальнейшему нарушению кровообращения в почках, поскольку ренин
является важным фактором поддержания на необходимом уровне тонуса их сосудов.
Нарушение кровоснабжения ведет к гибели части нефронов, вследствие чего страдает
выделительная функция почек. Когда этим процессом будет охвачена значительная
часть паренхимы почек, разовьется почечная недостаточность и ее заключительная
фаза — уремия.
• Как уже указывалось выше, при шоке в той или иной степени тотально поражаются все
органы и системы. Однако мы подробно остановились лишь на механизмах
формирования «шоковых легких» и «шоковых почек», поскольку патологические
процессы, развивающиеся в этих органах при шоке, сами по себе являются важными
факторами поддержания состояния шока
17.
18.
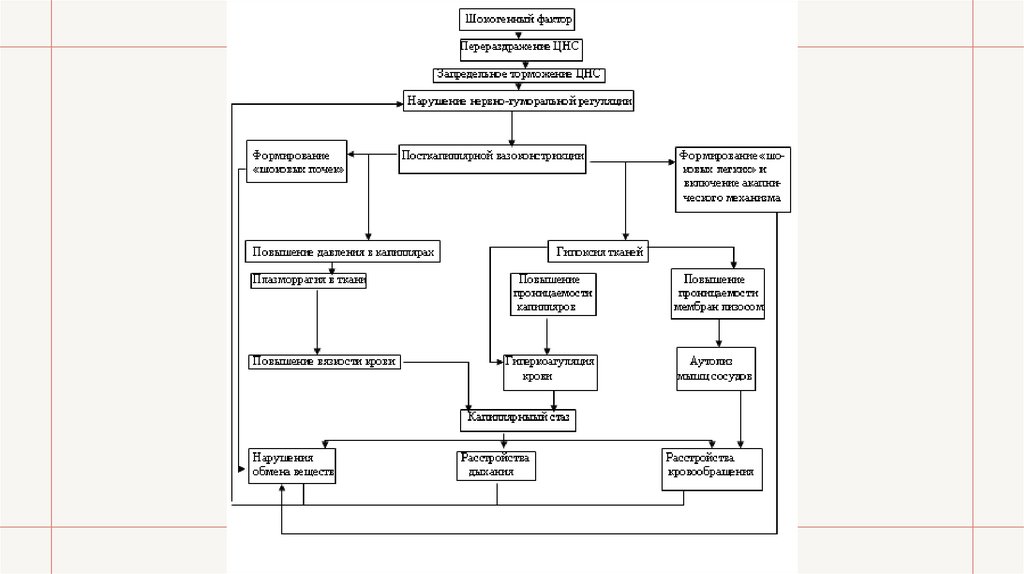
Общий патогенез шока• Шокогенный фактор вызывает перераздражение нервной системы, сменяющееся затем глубоким
нисходящим торможением. В результате этих регуляторных нарушений во всех органах и тканях
развивается пост капиллярная вазоконстрикция, которая через ряд промежуточных реакций
приводит к формированию капиллярного стаза, «шоковых легких» и «шоковых почек».
Возникшая при шоке гипоксия вызывает повышение проницаемости лизосомных мембран и
включает токсемический механизм; «шоковые легкие» запускают акапнический механизм, и все
это вместе приводит к глубоким расстройствам дыхания, кровообращения и обмена веществ.
• Примечательным является то, что при шоке возникает порочный круг: ряд сформировавшихся в
его процессе звеньев патогенеза усиливает функционирование уже имевшихся патогенетических
механизмов, а расстройства дыхания, кровообращения и обмена веществ, в свою очередь,
усиливают все патогенетические механизмы шока. Таким образом, происходит нарастающее
самоуглубление патологического процесса, прекратить которое весьма непросто.
19.
20.
Динамика шока• В клинической картине шока различаются две фазы.
• Вначале развивается относительно кратковременная эректильная фаза, рактеризующаяся резким
генерализованным возбуждением. Применительно к патогенезу шока эректильная фаза соответствует
состоянию перераздражения нервных элементов и перевозбуждения центральной нервной системы В этот
период отмечается повышение артериального давления, тахикардия, ускорение кровотока по сосудам.
Наблюдается спазм кровеносных сосудов во внутренних органы, в том числе — и в сердечной мышце. Эти
изменения связаны с активацией симпатоадреналовой системы в результате развития в начале шока
состояния стресса и носят приспособительный характер.
• В период стресса в кровь выбрасываются большие количества кортикоидов, являющихся стабилизаторами
биалогичеких мембран. Благодаря этому, на поздних стадиях констатируются меньшие изменения сосудистотканевой проницаемости и ОЦК, что предотвращается включение лизосомно-токсемического механизма
(или, во всяком случае, уменьшает его влияние на динамику шока). Таким действием обладают
глюкокордикоиды. Увеличенный выброс минералокортикоидов, в частности, альдостерона, приводит к
усилению реабсорбции в почечных канальцах и задержке в организме натрия, который повышает
чувствительность гладкомышечных элементов сосудистой стенки к прессорному влиянию катехол аминов.
Это способствует подъёму, а на более поздних стадиях шока препятствует падению артериального
давления. Выброс адреналина, вызывает тахикардию, приводит к увеличению минутного объёма сердца и
улучшению токсигенации тканей.
21.
• Для эректильной фазы шока характерно также тахипноэ, которое в начальном периоде шока также играетприспособительную роль, усиливаю оксигенацию тканей.
• В эректильной фазе отмечается разлитое возбуждение ЦНС, однако, в конце этой фазы наблюдаются
извращённые реакции нервных элементов на раздражение, вплоть до развития фаз парабиоза. Например, в
начале наступает уравнительная (продромическая) фаза, когда раздражители разной силы вызывает
одинаковую ответную реакцию, что было показано в эксперименте при раздражении у животного, находящегося в
эректильной фазе шока, депрессорного нерва. Затем наступает парадоксальная фаза, когда сильное
раздражение даёт меньший эффект, нежели слабое.
• Вслед за эректильной развивается торпидная фаза шока, характеризующаяся глубоким угнетением всех
функций. Наступает резкое падение артериального давления: при лёгком шоке – до 90-100 мм. рт. ст., при шоке
средней тяжести – до 70-80 мм. рт. ст., при тяжёлом шоке - до 40-60 мм. рт. ст. Надо заметить, что снижение
артериального давления не всегда соответствует тяжести шока. Нередко встречаются случаи, когда в начале
торпидной фазы артериальное давление снижено незначительно, а затем наступает его катастрофическое
падение. В торпидной фазе отмечается значительное уменьшение ОЦК – на 30-40 % от исходного уровня; в
связи с плазморрагией наступает сгущение крови, повышение её вязкости, что значительно замедляет кровоток
и создает основу для усиленной гемокоагуляции. В торпидной фазе, как правило, снижается венозное давление.
Пульс резко учащен, иногда до 200 уд./мин, слабого наполнения. При углубленин шока тахикардия может
смениться брадикардией, что является весьма неблагоприятным прогностическим признаком, поскольку
свидетельствует об истощении ресурсов сердечной мышцы. Нарастает тахипноэ, что ведет к усилению
акапнического механизма. Развивается глубокое торможение нервных центров на самых различных уровнях
ЦНС. Парадоксальная фаза парабиоза сменяется тормозящей.
• Оценивая взаимосвязь двух стадий шока, следует сказать, что чем более выраженно и длительно протекает
эректильная фаза, тем менее тяжелой будет торпидная, поскольку защитные механизмы, направленные против
развития патогенетических механизмов, формируются именно в эректильной фазе.
22.
Особенности отдельных видов шока• Ожоговый шок. В его патогенезе важную роль играют следующие факторы. Во-первых, для ожогового шока
характерна сильнейшая боль, поскольку обожженные ткани становятся источником мощной болевой
импульсации. Вследствие этого эректильная фаза ожогового шока чрезвычайно кратковременна (обычно ее не
видят, поскольку она заканчивается до прибытия врача или помещения больного в стационар). Поэтому
торпидная фаза при ожоговом шоке протекает крайне тяжело
• Во-вторых, при ожоговом шоке ОЦК снижается вследствие не только сосудистых расстройств, но и в результате
интенсивнейшей плазморрагии через обожженную поверхность. Больной теряет огромное количество жидкости
и степень сгущения крови при ожоговом шоке значительно выше, чем при шоке любой другой этиологии .
Поэтому при ожоговом шоке следует переливать больному не цельную кровь, а плазму или физиологический
раствор, с тем, чтобы разбавить эритроцитарную массу (предпочтительны кровезамещающие жидкости,
содержащие высокомолекулярные коллоиды, которые создают высокое онкотическое давление в сосудистом
русле, восстанавливая ОЦК).
• В-третьих, в данной ситуации наблюдается интоксикация за счет всасывания с обширной раневой поверхности
продуктов распада тканей. Поэтому в комплекс терапевтических мероприятий при ожоговом шоке обязательно
входит дезинтоксикация организма, заключающаяся во введении больших количеств жидкости, содержащей
глюкозу, витамины, а также проведение гемодиализа и гемосорбции. В-четвертых, обожженная поверхность
представляет собой обширные раневые ворота инфекции, что требует соответствующих мероприятий
(проведение антибактериальной терапии, содержание больных в палатах со стерильным воздухом и др.).
23.
• Электрошок. Этот вид шока наступает в результате поражения электрическим током иотносится к группе болевых шоков, что и определяет комплекс терапевтических
мероприятий. Однако при электрошоке имеется ряд особенностей, которые требуют
особого внимания и специфической терапии.
1. Если электрический ток прошел через все тело или через грудную клетку, то возможно
развитие фибрилляции желудочков сердца Поэтому, в данном случае, при оказании
такому пострадавшему первой помощи следует применить закрытый массаж сердца, а
при наличии необходимой аппаратуры — электрическую дефибрилляцию сердца.
Параллельно проводится искусственное дыхание.
2. При прохождении электрического токи через голову возможно глубочайшее угнетение
дыхательного и сосудодвигательного центров, в связи с чем нередко приходится часами
проводить искусственное дыхание и массаж сердца до тех пор, пока не восстановится
деятельность этих центров.
3. В месте поражения электрический ток вызывает электролиз тканей — появляются
знаки тока, что ведет к развитию долго не заживающих и с трудом поддающихся лечению
местных повреждений.
24.
• Кардиогенный шок. При массивном инфаркте миокарда больной может впасть в состояниекардиогенного шока, летальность при котором достигает 90%. В патогенезе этого тяжелого
состояния важную роль играют следующие три фактора:
1. Интенсивный болевой синдром, возникающий в результате ишемии обширных участков
миокарда и накопления в нем недоокисленных продуктов.
2. Отек миокарда, развивающийся вследствие резкого повышения сосудисто-тканевой
проницаемости в сердечной мышце.
3. Сосудистая недостаточность (коллапс), являющаяся выражением тотальных нарушений
гемодинамики в организме при массивном инфаркте миокарда.
• В связи со сказанным терапия кардиогенного шока должна наряду с ликвидацией болевого
синдрома включать мероприятия по быстрому снижению проницаемости мембран
(внутривенное введение глюкокортикоидов) и степени отека миокарда (применение
диуретиков, дренаж лимфы, в том числе и хирургическое дренирование грудного
лимфатического протока) и нормализация сосудистого тонуса.
25.
• Гемотрансфузионный шок. Он возникает при переливании больному несовместимойкрови. Образующийся при этом комплекс «антиген-антитело» является чрезвычайным
раздражителем для сосудистых интерорецепторов, вследствие чего и возникает мощный
поток афферентной импульсации в высшие нервные центры. Это было доказано
следующими опытами (С.М.Павленко, 1942). У животного отсепаровывался участок
кровеносного сосуда, соединенный с организмом лишь нервными стволами. Если этот
отрезок сначала отмывался от крови, а затем в него вводилась чужеродная кровь, то
расстройств функций организма не наступало. Если же в нем была собственная кровь, то
при введении в него чужеродной крови развивалась картина гемотрансфузионного шока;
такое же введение в предварительно денервированный отрезок сосуда к шоку не
приводило.
• При гемотрансфузионном шоке имеются свои клинические особенности, связанные с тем,
что при нем наступает гемолиз эритроцитов. Продукты гемолиза особенно сильно
повреждают почки, и больной, даже благополучно выйдя из состояния
гемотрансфузионного шока, может скончаться в более позднем периоде процесса при
явлениях почечной недостаточности. Поэтому в комплекс терапевтических мероприятий
при гемотрансфузионном шоке обязательно должны быть включены гемодиализ и
гемосорбция.
26.
Понятие о коллапсеКоллапс — это острая сосудистая недостаточность, характеризующаяся
падением артериального и венозного давления и уменьшением массы
циркулирующей в сосудистой системе крови.
По этиологическому фактору различают следующие виды коллапса:
геморрагический (при массивной кровопотере);
токсико-инфекционный;
панкреатический;
ортостатический;
аноксический.
27.
Механизмы коллапса и принципы егопатогенетической терапии
• Общим для всех видов коллапса является нарастающая острая сосудистая недостаточность . Возникнув, она
приводит к уменьшению ОЦК, в связи с чем уменьшается минутный объем сердца и снижается транспорт
кислорода к тканям. Развившаяся в результате этого гипоксия вызывает увеличение сосудисто-тканевой
проницаемости, плазморрагию, дальнейшее снижение тонуса сосудистой стенки, что вызывает прогрессирующее
падение артериального давления. Эти явления еще более усиливают гипоксию и, лавинообразно нарастая,
процесс углубляется.
• При лечении коллапса любой этиологии прежде всего необходимо направить основные терапевтические
мероприятия на поднятие артериального давления, увеличение ОЦК и ликвидацию гипоксии. Для этого
переливают кровь и кровезамещающие жидкости. В целях снижения сосудисто-тканевой проницаемости
внутривенно вводят глюкокортикоиды. При коллапсе поднять артериальное давление можно с помощью
катехоламинов или ангиотензина, поскольку в данном случае нет основания ожидать парадоксальных реакций со
стороны сосудов. Улучшение дыхания достигается ингаляцией газовых смесей, содержащих повышенное
количество кислорода и углекислоты. Вообще, терапевтические мероприятия при коллапсе аналогичны тем,
которые рекомендуются при шоке, за исключением наркоза и местного обезболивания, поскольку при коллапсе
(если только он не является компонентом шока) нет патогенного потока афферентной импульсации в высшие
нервные центры.
28.
Особенностиотдельных видов
коллапса
• Геморрагический коллапс. Он обычно возникает в
том случае, когда происходит массивная
кровопотеря. Его патогенетические механизмы были
описаны выше. К сказанному следует добавить, что
при геморрагическом коллапсе развивается острая
постгеморрагическая анемия, которая требует
самостоятельной терапии (в частности, стимуляции
кроветворения).
29.
• Токсико-инфекционный коллапс. Он можетвозникнуть при инфекционных заболеваниях,
для возбудителей которых характерно
наличие эндотоксинов, высвобождающихся
при гибели бактериальной клетки
(возбудитель крупозной пневмонии —
пневмококк, возбудители пищевых токсикоинфекций и др.) Эти эндотоксины обладают
парализующим действием на мышечный
аппарат сосудистой стенки, и при массивной
гибели микроорганизмов (что может быть и
при естественном выздоровлении, как,
например, при крупозной пневмонии, и при
массивной антибактериальной терапии) они
высвобождаются в большом количестве и
могут вызвать состояние коллапса.
30.
• Панкреатический коллапс. Этот видколлапса возникает при тяжелой
травме живота, ведущей к
размозжению ткани поджелудочной
железы, а также при остром
панкреатите. И в том, и в другом
случае протеолитические ферменты
панкреатического сока поступают в
сосудистое русло, вызывают
аутопереваривание стенок сосудов и
падение сосудистого тонуса, в
результате чего развивается коллапс.
Поскольку его возникновение связано
с необратимыми нарушениями в
сократительном аппарате сосудистой
стенки, лечение этого вида коллапса
исключительно трудно.
31.
• Ортостатическийколлапс. Он возникает при
резком переходе из
горизонтального положения в
вертикальное после
длительного, многодневного
постельного режима. 3а это
время тонус сосудов может
настолько снизиться, что при
переходе в вертикальное
положение кровь
переместится в
расположенные внизу тела
отделы сосудистой системы. У
людей, страдающих
гипотонической болезнью,
ортостатический коллапс
может возникнуть даже после
быстрого подъема с постели
после ночного сна.
32.
• Аноксический(гипоксический)
коллапс. При быстром
снижении парциального
давления кислорода во
вдыхаемом воздухе
вследствие наступающего
кислородного голодания
тканей падает тонус
гладких мышц сосудов, а
далее развитие коллапса
базируется на уже
разобранных выше
механизмах.
33.
КОМА• Кома (от греч. komu — сон) — тяжкое
патологическое состояние, характеризующееся
потерей сознания, расстройством рефлекторной
деятельности и глубокими нарушениями дыхания,
кровообращения и обмена веществ.
• Коматозные состояния развиваются в результате
тяжелых расстройств метаболизма вследствие
патологии эндокринных желез, печени, почек, при
отравлении некоторыми ядами биологического и
небиологического происхождения, при ряде
инфекционных заболеваний. Ведущими
моментами в патогенезе любого вида комы
являются прямое угнетение деятельности
центральной нервной системы токсическими
продуктами, а также нарушения мозгового
кровообращения, ведущие к гипоксии нервных
центров.
34.
Печеночная кома.• Этот вид комы возникает при глубоком тотальном повреждении паренхимы печени (при гепатитах, циррозах
печени, ее токсическом поражении).
• В динамике развития печеночной комы различают три стадии. Первая из них носит название угрожающей
комы и характеризуется повышенной раздражительностью и быстрой психической истощаемостью больных,
извращением их суточного режима (днем спят, а ночью бодрствуют), тремором, неприятным вкусом во рту,
легкой желтухой, повышенной кровоточивостью и зудом. При биохимическом исследовании крови
обнаруживается глубокое расстройство функции печени.
• Эта первая стадия сменяется прекомой, для которой свойственно нарастание интенсивности указанных
выше симптомов, в том числе усиление тремора, который приобретает «хлопающий» характер,
возникновение психотических состояний, периодическая потеря сознания, появление «печеночного» запаха
изо рта (запах гнилого мяса).
• Третья стадия — собственно кома. На этой стадии указанные выше нарушения прогрессируют на фоне
потери сознания и расстройств рефлекторной деятельности. Поскольку способность печени к регенерации
чрезвычайно (одними из наиболее часто встречающихся видов ком являются диабетическая и
гипогликемическая комы) велика, организм может самостоятельно выйти из состояния печеночной комы,
которая через некоторое время развивается повторно, и в конце концов больной погибает.
• В основе возникновения печеночной комы лежит отравление организма собственными метаболитами
вследствие нарушения так называемой барьерной функции печени, прежде всего — аммиаком,
образующимся в больших количествах при расщеплении в организме поступающих с пищей белков.
35.
Почечная кома.• Она развивается на заключительных этапах уремии, то есть на фоне почечной
недостаточности, и связана с возникновением некомпенсированного ацидоза и глубокими
нарушениями электролитного баланса организма, прежде всего, обмена магния.
Терапевтический эффект при почечной коме может быть достигнут лишь с помощью
гемодиализа (подключение искусственной почки).
Малярийная кома.
• Это состояние возникает при тропической малярии. Разрушение эритроцитов во время
малярийного приступа вызывает отравление организма продуктами распада как самого
плазмодия, так и эритроцитов. Вследствие массивного распада последних возникает также
тяжелая гемолитическая анемия.
• Встречаются также аноксическая кома при резком снижении парциального давления
кислорода во вдыхаемом воздухе), эклампсическая кома (при токсикозе беременности),
апоплексическая кома (при массивном кровоизлиянии в мозг), надпочечниковая кома (при
недостаточности надпочечников), тиреотоксическая кома (на заключительных стадиях
гипертиреоза, приводящего к тяжелой интоксикации организма тиреоидными гормонами),
гипохлоремическая кома (при неукротимой рвоте беременных) и др.
36.
Реактивность ирезистентность
организма
37.
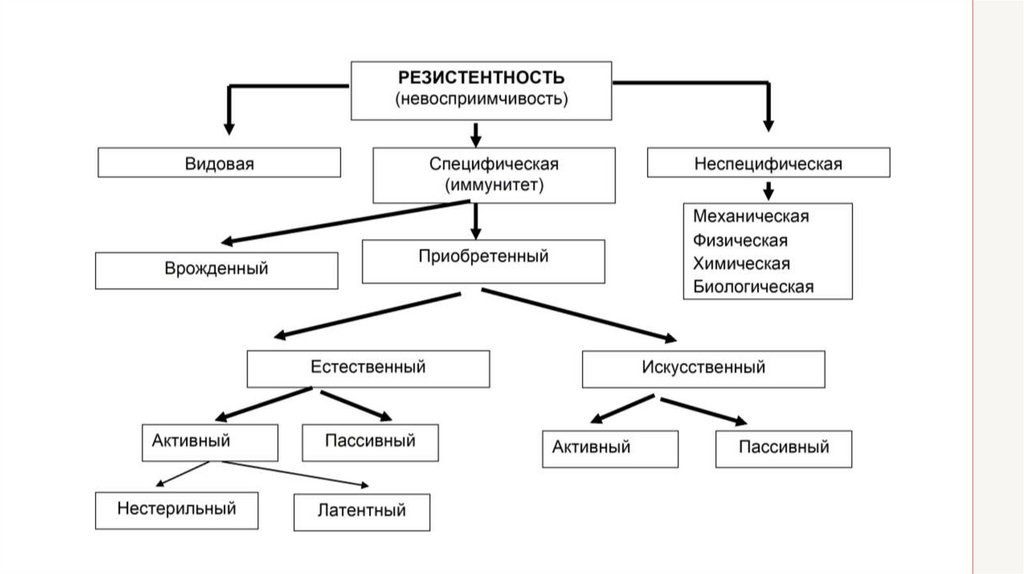
• Реактивность (от лат. reactio — противодействие) — способностьорганизма отвечать изменением жизнедеятельности на воздействия
окружающей среды.
• Благодаря изменениям реактивности в организме вырабатывается
его резистентность (от лат. resisto — сопротивление), т. е.
устойчивость к болезнетворным факторам.
• Эти два свойства организма (отвечать и противостоять) дают
возможность животному существовать в изменяющихся условиях
окружающей среды. Реактивность организма выражена в его
двигательных, пищевых, ориентировочных и других условных и
безусловных рефлексах. А это позволяет животному приспособиться
и противостоять воздействию факторов внешней среды, иначе
животное гибнет.
38.
39.
• Под естественной резистентностью (от лат. resistio — сопротивление) понимают устойчивость организма кнеблагоприятным факторам внешней среды. Она базируется
на механизмах защиты, сформировавшихся в процессе
эволюции и закрепленных генетическим кодом. Поэтому
существование животных каждого вида обусловлено средой
их обитания. Вместе с тем окружающие организм условия
постоянно меняются. Эти изменения улавливаются
рецепторным аппаратом, анализируются и сопоставляются
клетками центральной нервной системы с последующей
передачей информации эффекторным органам. Возникает
ответная реакция на раздражитель. Поэтому естественная
резистентность неотделима от понятия реактивности.
40.
Виды реактивности• Под действием условий внешней среды формируются
физиологическая и патологическая реактивность.
• Физиологическая реактивность зависит от
наследственности, пола, возраста животного, от
питания, окружающей температуры, содержания
кислорода и других факторов среды, в которых
обитает организм.
• Патологическая реактивность зависит от тех же
факторов, что и физиологическая, но проявляется
под действием необычных раздражителей и может
быть неспецифической и специфической. Примерами
такой реактивности являются состояния при шоке,
наркозе, при действии тепла, холода и т. д. Так, при
травматическом шоке угнетается фагоцитоз,
выносливость к инфекционным и другим
раздражителям, меняется чувствительность к
лекарственным препаратам.
41.
Влияние внешнихфакторов на
реактивность
• Большое влияние на реактивность оказывает
кормление животных. Полноценное питание
повышает устойчивость организма к
воздействию патогенных факторов.
Некачественное, недостаточное питание,
наоборот, снижает устойчивость.
• Перегревание, переохлаждение (особенно
резкие), чрезмерная эксплуатация животного
снижает устойчивость организма, подавляет его
защитные механизмы. Подобные изменения
наблюдаются весной и осенью в связи с резкими
повышениями температуры, влажности,
атмосферного давления. Ослабляют
реактивность также отравления, чрезмерное облучение ультрафиолетовыми лучами.
42.
Зависимость организма от состояния нервнойи эндокринной систем, вида, возраста,
пола, индивидуальных особенностей.
• Ответные реакции организма на действие раздражителей возникают при
обязательном участии нервной системы. Благодаря нервной системе,
особенно её высшему отделу-коре головного мозга, организм способен
устанавливать связь с внешним миром. Например, ослабление функции
коры головного мозга вследствие её перенапряжения снижает
реактивность организма к бактериальным токсинам, химическим ядам,
антигенам. У крыс с сильным уравновешенным, подвижным типом нервной
деятельности под влиянием отравления бактериальными токсинами
возникали менее тяжёлые нарушения высшей нервной деятельности, чем
у крыс со слабым типом.
43.
• Реактивность у животного резкоменяется при удалении коры
головного мозга, а также после
длительного и глубокого наркоза.
Действия раздражителей
ослабляются в случае
преобладания в коре тормозных
процессов. На реактивности
организма могут сказываться
различные повреждения спинного
мозга. Перерезка спинного мозга
ослабляет устойчивость голубей к
сибирской язве.
• Существенно влияет на
реактивность организма и вегетативная нервная система. При
возбуждении парасимпатического
отдела нервной системы в
организме увеличивается
образование антител и
комплементарная активность крови,
наблюдается усиление
реактивности.
44.
• В механизме реактивности имеют значение и эндокринные железы: гипофиз,надпочечники, щитовидная железа и др. Подавление их функции понижает реактивность
организма, и наоборот, повышение их активности усиливает реакцию организма на
раздражение.
• Возбуждение парасимпатического отдела нервной системы ведёт к выделению в кровь
норадреналина и адреналина, усиливает обмен веществ и повышает реактивность
организма.
• В механизме реактивности важное значение имеют гипофиз, надпочечники, щитовидная
и поджелудочные железы. Гормоны гипофиза влияют на организм через другие железы
внутренней секреции. При удалении надпочечников снижается устойчивость организма
к инфекции, электрическому току, травме. При введении гормонов коркового слоя
надпочечников защитные силы организма повышаются. При удалении щитовидной
железы наблюдается увеличение секреции гипофизарного адренокортикотропного
гормона. Гипертиреоидизм вызывает торможение секреции указанного гормона и
чувствительность животных к анафилаксии, ядам и инфекции повышается.
Недостаточность инсулярного аппарата поджелудочной железы снижает устойчивость
организма к туберкулёзу и другим патогенным микробам.
45.
• Животные одного вида не болеют болезнями другоговида. В зависимости от возраста у животных
выявляют особенности их реагирования на действие
раздражителей окружающей среды. У молодняка в
самом раннем возрасте обычно наблюдают
пониженную реактивность, что определяется
неполным развитием нервной, эндокринной, иммунной и других систем.
• Молодым животным свойственны свои заболевания.
Такие болезни, как диспепсия, колибактериоз,
сальмонеллёз, рахит поражают преимущественно
новорожденных. Молодняк менее приспособлен к
колебаниям температуры внешней среды.
Новорожденные менее чувствительны к
дифтерийному и столбнячному токсину, чем
взрослые.
• С развитием нервной системы возрастает
реактивность организма. Наиболее увеличена и
усложнена реактивность в период полового
созревания в результате совершенствования нервной
системы, барьерных систем. В старческом возрасте
реактивность понижается из-за ослабления функций
барьерных систем и реакций нервной системы.
46.
• Реактивность организма зависит от пола. Женский организм более устойчив к недостаткукислорода, кровопотере, голоданию.
• Реактивность зависит от индивидуальных особенностей организма, окружающей температуры,
содержания кислорода и других факторов среды. Чем менее организованно животное и чем
менее у него развита нервная система, тем в более простой форме выражена его реактивность.
• Реактивность простейших и многих беспозвоночных определяется обменом веществ, который
изменяется при неблагоприятных воздействиях внешней среды. Такая гипореактивность
позволяет переносить значительную гипоксию, низкие температуры и др. Наиболее
высокоорганизованные животные иначе реагируют на пониженное содержание кислорода. Их
центральная нервная система и, прежде всего, кора головного мозга особенно чувствительна к
недостатку кислорода. При гипоксии наблюдается возбуждение центральной нервной системы, в
результате активируется дыхание, выбрасываются в кровяное русло запасы эритроцитов и тем
самым увеличивается дыхательная функция крови, повышается её минутный объем. Эти
изменения направлены на усиление доставки кислорода в ткани и облегчение его утилизации.
• Такие простые рефлексы, как оборонительный (отдёргивание конечности при уколе, ожоге) или
реакция «освобождения» (кашель, рвота) организма от вредных агентов (микробы, пыль, яды) и
сложные реакции организма (лихорадка, воспаление, аллергия) являются механизмами реактивности, определяющими её приспособительное значение.
47.
Иммунологическая реактивность• Она является составной частью саморегуляции, обеспечивающей гомеостаз и адаптацию
животных к меняющимся условиям окружающей среды. Иммунологическая реактивность
проявляется в виде иммунитета, реакции биологической несовместимости тканей,
повышенной чувствительности.
• Функционирование иммунной системы обеспечивается центральными и периферическими
органами иммуногенеза.
• К центральным органам относят красный костный мозг, тимус и у птиц — фабрициеву
сумку;
• к периферическим — селезёнку, систему мононуклеарных фагоцитов (моноциты,
циркулирующие в крови и фиксированные в тканях) и микрофагальную систему
(нейтрофилы, эозинофилы, базофилы), лимфатические узлы и лимфоидные образования
респираторных органов и пищеварительного тракта (пейеровы бляшки, миндалины), кровь
и лимфу.
48.
• Дифференцировка лимфоидной стволовой клетки в лимфоциты начинается позже — после её попадания вособое микроокружение, имеющееся в таких органах, как тимус (Т-лимфоциты) и у птиц бурса (В-лимфоциты).
• Находясь в тимусе, Т-клетки дифференцируются в три самостоятельные популяции:
• Т-хелперы — распознают с помощью активированного макрофага антигены, несущие чужеродную генетическую
информацию, и стимулируют В-лимфоциты;
• Т-супрессоры — лимфоидные клетки, тормозящие активность других лимфоцитов;
• Т-эффекторы — специфически разрушают клетки-мишени.
Тимус — зависимая система реализует иммунный ответ клеточного типа.
• Бурса — зависимая система ответственна за реализацию гуморального иммунного ответа.
• Т-система контролирует работу В-системы.
• При иммунном ответе В-лимфоциты преобразуются в иммунобласты, которые становятся плазмобластами, а
плазмобласты — плазматическими клетками, способными синтезировать антитела. Плазматические клетки
синтезируют и секретируют иммуноглобулины.
• Установлено пять классов иммуноглобулинов: G, М, A, D, E.
• Классическими антителами являются IgG. Их количество достигает 80% от всех иммуноглобулинов. Они активно
связывают такие антигены, как вирусы, бактерии, экзотоксины, lgM первыми появляются на попадание антигена и
составляют 7-10% общей активности антител. IgA находятся в сыворотке крови и в слизистых оболочках
дыхательных путей, полости рта, кишечника, мочевыводящих путей, в молозиве, слюне, слезах, поте и т. д. IgD и
IgE считаются важнейшими в аллергических реакциях.
49.
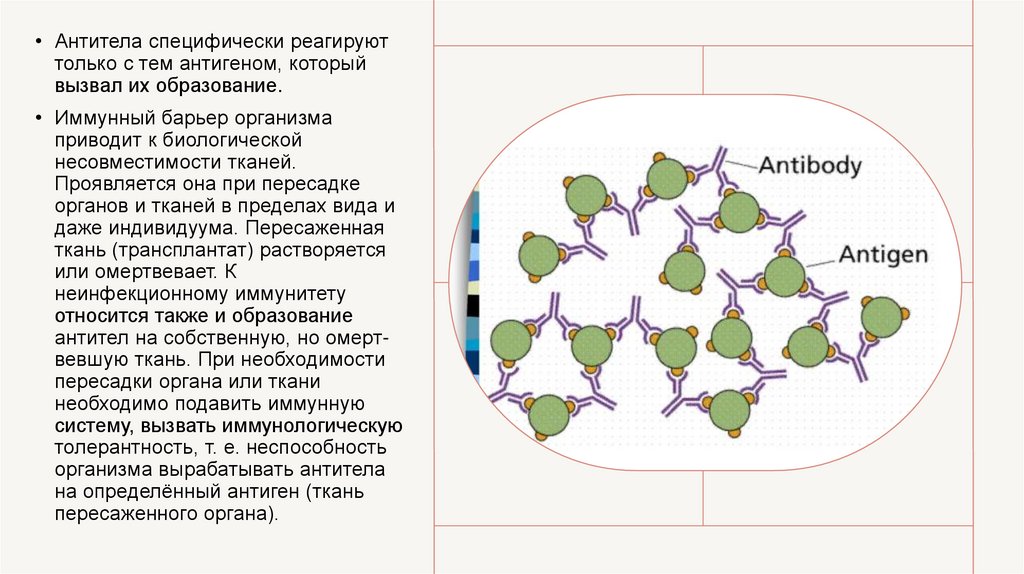
• Антитела специфически реагируюттолько с тем антигеном, который
вызвал их образование.
• Иммунный барьер организма
приводит к биологической
несовместимости тканей.
Проявляется она при пересадке
органов и тканей в пределах вида и
даже индивидуума. Пересаженная
ткань (трансплантат) растворяется
или омертвевает. К
неинфекционному иммунитету
относится также и образование
антител на собственную, но омертвевшую ткань. При необходимости
пересадки органа или ткани
необходимо подавить иммунную
систему, вызвать иммунологическую
толерантность, т. е. неспособность
организма вырабатывать антитела
на определённый антиген (ткань
пересаженного органа).
50.
Барьерные системы организмаДля противодействия раздражителям имеется ряд неспецифических защитных механизмов
(барьеров).
К таким структурам относится:
• кожа с её производными,
• слизистые оболочки,
• кости.
51.
• Кожа обладает барьерными свойствами благодарямногослойному эпителию и его производным
(волосы, шерсть, перья, копыта, рога), наличию
рецепторных образований, клеток макрофагальной
системы, секрета, выделяемого железистым
аппаратом. Она представляет собой барьер для
проникновения большинства патогенных микробов.
Она обладает способностью к самоочищению путём
слущивания эпителия, выделения секретов потовыми
и сальными железами. Кожа обладает
бактерицидными свойствами по отношению ко
многим микроорганизмам, что объясняется кислой
реакцией, создаваемой секретами. Постоянная
аутомикрофлора способна выделять вещества,
губительно действующие на антагонистов
патогенных возбудителей. Кожные покровы содержат
клетки макрофагальной системы — клетки
Ларгенганса.
• Барьерные свойства кожи зависят от общего
состояния организма, от полноценного кормления,
ухода за покровными тканями, характера
эксплуатации. Недостаточный уход за кожей вымени
коров может привести к маститу.
52.
• Слизистые оболочки ротовой полости, пищевода, желудочнокишечного тракта, дыхательных и мочеполовых путей,покрытые эпителием представляют собой барьер для
проникновения различных вредоносных агентов. Неповрежденная слизистая механическое препятствие для
проникновения различных вредоносных агентов. Благодаря
наличию ресничек мерцательного эпителия с поверхности
дыхательных путей выводятся во внешнюю среду инородные
тела, микробы, попадающие с вдыхаемым воздухом.
Повреждение слизистой рта предупреждается усилением
слюноотделения, повреждение конъюнктивы — обильным
отделением слезной жидкости, повреждение слизистой носа —
серозным экссудатом. Секреты желёз слизистых оболочек
обладают бактерицидными свойствами. В слюне, слезной
жидкости, секрете, отделяемом слизистой дыхательных путей,
находится лизоцим-фермент мурамидаза способный к лизису
ста- фило- и стрептококков.
53.
• Благодаря хлористо-водородной кислоте желудочный сок подавляет размножениемикрофлоры.
• Защитную роль играет микрофлора, заселяющая слизистую оболочку кишечника,
мочеполовых органов здоровых животных.
• Для защиты слизистых покровов, разделяющих внешнюю и внутреннюю для
организма среду, созданы иммунологические механизмы, которые осуществляют
функцию первой защиты против природных антигенных структур, — макрофаги,
иммуноглобулины.
• Костная ткань предохраняет центральные нервные образования от механических
повреждений. Позвонки защищают спинной мозг от травм, а кости черепа —
головной мозг, подкорковые структуры. Ребра выполняют защитную функцию в
отношении лёгких и сердца. Длинные трубчатые кости оберегают основной орган
кроветворения — красный костный мозг.
• Если вредный раздражитель сохраняет свою патогенность и проникает в кровь и
внутренние органы, то подключаются внутренние барьеры: лимфатические узлы,
печень, селезёнка, костный мозг, гематоэнцефалический барьер —
неспецифические факторы защиты.
54.
Неспецифические факторы защиты• Они представляют собой компоненты эндогенного механизма, обеспечивающего генетически
обусловленное постоянство внутренней среды.
• Центральное звено неспецифической защиты организма представлено двумя системами клеток
— мононуклеарной фагоцитирующей системой(МФС) и системой полиморфноядерных
лейкоцитов(ПМЯЛ).
• Основная структурная единица МФС — макрофаги. К этим клеткам относятся активированные
циркулирующие в крови моноциты, гистиоциты соединительной ткани, купферовские клетки печени, легочные, плевральные и перитонеальные макрофаги. Все эти клетки образуются из
стволовых клеток красного костного мозга. Макрофаги осуществляют бактерицидную активность
благодаря фагоцитозу, образованию фаголизоом и перевариванию лизосомальными
ферментами. Они способны секретировать большое количество биологически активных веществ.
• Полиморфноядерные лейкоциты (нейтрофилы, базофилы, эозинофилы) также участвуют в
фагоцитозе.
55.
• Система комплемента — полифункциональная ферментная система, участвующая включевых гомеостатических реакциях, таких как опсонизация, стимуляция фагоцитоза,
цитолиз, нейтрализация вирусов, медиация воспаления, индукция иммунного ответа.
• Система интерферонов. Интерфероны представляют собой низкомолекулярные
пептиды с небольшим количеством аминокислот и углеводов. Они видоспецифичны, в
большом количестве находятся в сыворотке крови, моче.
• В защитном механизме действия важное значение принадлежит функциональным
изменениям в рибосомах, которые становятся неспособными к вирусной репликации.
• Выделены и изучены два типа интерферонов. К первому относят альфа- и бетаинтерферон. Альфа-интерфироны характеризуются противовирусным и
антипролиферативным действием. Бета-интерферонподавляет развитие внутриклеточных микобактерий, возбудителей токсоплазмоза, пролиферацию опухолевых
клеток.
• Ко второму типу интерферонов относят гамма-интер- ферон, который наряду с
противовирусной активностью участвует в регуляции иммунного ответа, усиливает антителогенез, цитотоксическое влияние макрофагов и естественных киллеров.
56.
• Система лизоцима. Лизоцим — это фермент из группы гликозидаз. Онсекретируется постоянно, выявляется во всех органах и тканях. К
грамположительным бактериям проявляет самостоятельную
бактерицидную активность, в отношении грамотрицательных бактерий он
действует совместно с комплементом цитолитически, проникая через
повреждённую им стенку бактерий.
• Система пропердина. Пропердин — белок сыворотки крови глобулинового
типа, обладает бактерицидными свойствами по отношению ко многим
патогенным и условно патогенным микроорганизмам. Под его влиянием
инактивируются вирусы гриппа, герпеса, грамотрицательные бактерии.
Уровень пропердина в крови животных отражает состояние их
резистентности, чувствительности к инфекционным заболеваниям.
• Неспецифические механизмы защиты предупреждают болезнетворное
действие попавшего во внутреннюю среду чужеродного фактора. Через
систему макрофагов они включают Т- и В-системы иммунитета.
57.
Аллергическая реактивность, ее виды,фазы и механизм развития
• Аллергия (от греч. allos — иной, ergon — действие) — качественно изменённая
реакция организма на вещества аллергической природы (аллергены).
• Аллергены могут быть экзогенного(внешнего) и эндогенного (внутреннего)
происхождения. К экзогенным относятся белковые вещества животного и
растительного происхождения, микроорганизмы, вирусы, грибы, сыворотка крови,
шерсть, пух, пыльца и др., липиды, сложные углеводы и даже ряд неорганических
соединений, лекарственные вещества, пищевые, бытовые.
• Эндогенные аллергены подразделяют на естественные (мозг, хрусталик глаза,
половые железы, щитовидная железа) и приобретённые (холодовые, ожоговые,
лучевые и т. д.).
58.
Различают нескольковидов аллергий:
• анафилаксию,
• сывороточную болезнь,
• инфекционную,
• лекарственную,
• поллиноз,
• местные проявления
аллергии,
• аутоаллергию.
59.
Хотя признаки аллергий различны, патогенез их общий.Аллергия протекает в три стадии: иммунологическую, биохимическую или патохимическую,
патофизиологическую или стадию функциональных и структурных нарушений.
• Иммунологическая стадия начинается при первой встрече организма с аллергеном и
заканчивается взаимодействием антитела с антигеном. В этот период происходит
сенсибилизация организма, т. е. повышение чувствительности. Сенсибилизация бывает
активной: при введении антигена включается иммунологическая система. При введении
животному готовых антител возникает пассивная сенсибилизация.
• Биохимическая стадия аллергии возникает, если в сенсибилизированный организм
повторно попадает специфический аллерген, между антителом и аллергеном возникает
физико-химическая реакция и образуется макромолекулярный иммунный комплекс,
состоящий из аллергена и антитела, который фиксируется в тканях и вызывает ряд изменений обмена веществ. Сущность биохимической стадии заключается в образовании
или активации биологически активных веществ. Все это приводит к возникновению следующей стадии.
60.
На патофизиологической стадии происходят изменения:• со стороны системы кровообращения; снижение артериального давления обусловлено
действием брадикинина, ацетилхолина, гистамина и серотонина. Амины и брадикинин
повышают проницаемость сосудов, что ведёт к развитию отёков;
• со стороны дыхания кинины, серотонин и гистамин вызывают сокращение неисчерченной
мышечной ткани бронхов, что ведёт к нарушению вентиляции лёгких и развитию
кислородного голодания;
• со стороны системы крови активируется свёртывающая система крови посредством
активации фактора Хагемана и противосвёртывающая благодаря освобождению гепарина.
Кровь в аорте и крупных сосудах с пониженной свертываемостью, в капиллярных сосудах —
тромбоз;
• со стороны нервной системы: амины и кинины являются медиаторами болевой
чувствительности, они вызывают боль, жжение, зуд.
Поток импульсов от рецепторов, рефлекторные влияния, возникающие при аллергическом
процессе, нарушение кровоснабжения и газообмена могут привести к тяжёлым нарушениям
функции ЦНС, вплоть до шока.
61.
Анафилаксия и её стадии• Анафилаксия (от греч. аnа- обратное, рhylaxis-защита) — вид аллергической реакции
немедленного типа. Анафилаксия — состояние повышенной чувствительности организма на
повторное, парентеральное введение аллергена. Анафилаксия протекает в три стадии:
сенсибилизации, анафилактического шока и десенсибилизации.
• Сенсибилизация (от лат. sensiblis — чувствительный) — повышенная чувствительность к
аллергену; результат появления в организме специфических аллергических антител. Для
образования антител в организм достаточно ввести сотые или тысячные доли грамма чужеродного
белка — активная сенсибилизация. Наибольшее количество антител образуется на 14-21-й день
после введения, а затем уменьшается. Состояние повышенной чувствительности возникает не
сразу, а через определённое время (латентный период). Продолжительность латентного периода
зависит от вида животного, его состояния, чистоты аллергена, величины сенсибилизирующей
дозы. Он составляет от 8 до 25 дней, иногда 300-400 дней после сенсибилизации. Так, у морской
свинки латентный период 12-14 дней. Состояние сенсибилизации может продолжаться в течение
2-х и более месяцев. Латентный период равен времени образования антител и появления их в
крови.
62.
• Пассивная сенсибилизация осуществляется с помощью парентерального введения антител,содержащихся в сыворотке сенсибилизированного животного, и вызывается введением
сравнительно больших доз сыворотки активно-сенсибилизированного животного (для морской
свинки 5-10 мл, для кролика 15-20 мл). Возникает она через 18-24 часа после введения
сыворотки. Считают, что это время необходимо для того, чтобы антитела сыворотки успели
фиксироваться в тканях нервной системы и других тканях организма.
• Анафилактический шок — тяжёлый симптомокомплекс, возникающий при повторном
парентеральном введении сенсибилизированному животному разрешающей дозы
анафилактогена. Разрешающая доза минимум в 10-100 раз превышает сенсибилизирующую.
• Анафилактический шок возникает через 1-2 минуты после введения разрешающей дозы. Время
его развития — от нескольких секунд до получаса, и чем быстрее он развивается, тем
неблагоприятней исход. Наиболее частые проявления анафилактического шока — нарушение со
стороны органов дыхания и кровообращения. Первые его симптомы — беспокойство, одышка,
кашель, как следствие бронхоспазма или отёка гортани, нарушение функции желудочнокишечного тракта (приступообразные боли живота, тошнота, рвота, понос). Возможны судороги,
непроизвольное мочеиспускание и дефикация, аллергические отёки разных участков тела.
63.
• У различных животных анафилактический шок протекает по-разному. Внекоторых органах выявляются наибольшие повреждения, которые в
значительной степени определяют все последующие изменения в
организме, такие органы называют шоковыми. Так, например, у морской
свинки шоковым органом являются легкие. В связи с сокращением
гладких мышц происходит спазм бронхиол. Это ведёт к затруднению
выдоха. Альвеолы растягиваются, легкие вздуваются, т. е. развивается
острая эмфизема. Возникает асфиксия и животное гибнет.
64.
• Десенсибилизация (от лат. de — снятие, отсутствие) — снятиечувствительности. После перенесения анафилактического шока
у животных возникает нечувствительность даже к большим
дозам анафилактогена — антианафилаксия. Она развивается
через 10-15 минут от внутривенного введения антигена. Ее
продолжительность различна в зависимости от вида животного,
его реактивности, способа введения антигена.
65.
Местные проявления аллергии• Если кролику ввести под кожу 0,5-1 мл лошадиной сыворотки, то белок быстро
рассасывается, не давая никакой заметной реакции на месте введения. Повторное
введение(4-5 раз) в той же дозе и на том же месте вызывает воспалительно-некротическую
реакцию кожи. Эти изменения назвали феноменом Артюса- Сахарова — учёных, открывших
реакцию. Однако данный феномен нельзя рассматривать только как местный процесс. При
его возникновении обнаруживают изменения и в других органах и тканях (на вскрытии).
Следовательно, этот феномен есть местное проявление общей аллергической реакции
сенсибилизированного организма. Механизм развития его заключается в следующем:
антиген, попадая в ткань, соединяется с антителами (преципитинами); образующийся осадокпреципитат оказывает токсическое действие на ткани кровеносных сосудов, нервные
окончания, нервные стволы, основное вещество соединительной ткани и вызывает в них
вышеупомянутые некротические изменения.
66.
Аллергическаядиагностика
• При некоторых инфекционных и
инвазионных болезнях (сап, туберкулёз,
эхинококкоз и т. д.) в организме образуются
антитела и животные становятся
чувствительными к вытяжкам из культур
этих же микробов или экстракты из
гельминтов. Такое явление используется
для диагностики ряда болезней животных и
человека. Исходя из этого явления проводят
туберкулинизацию (выявляют
туберкулёзных животных), маллеинизацию
(выявляют больных сапом лошадей) и т. д.




















































 Медицина
Медицина








