Похожие презентации:
Гидролиз солей
1.
2.
Гидролиз от греч. «гидро» - вода,«лизис» - разложение.
Гидролиз солей – реакция обмена между солью и водой,
приводящая к образованию слабого
электролита.
3.
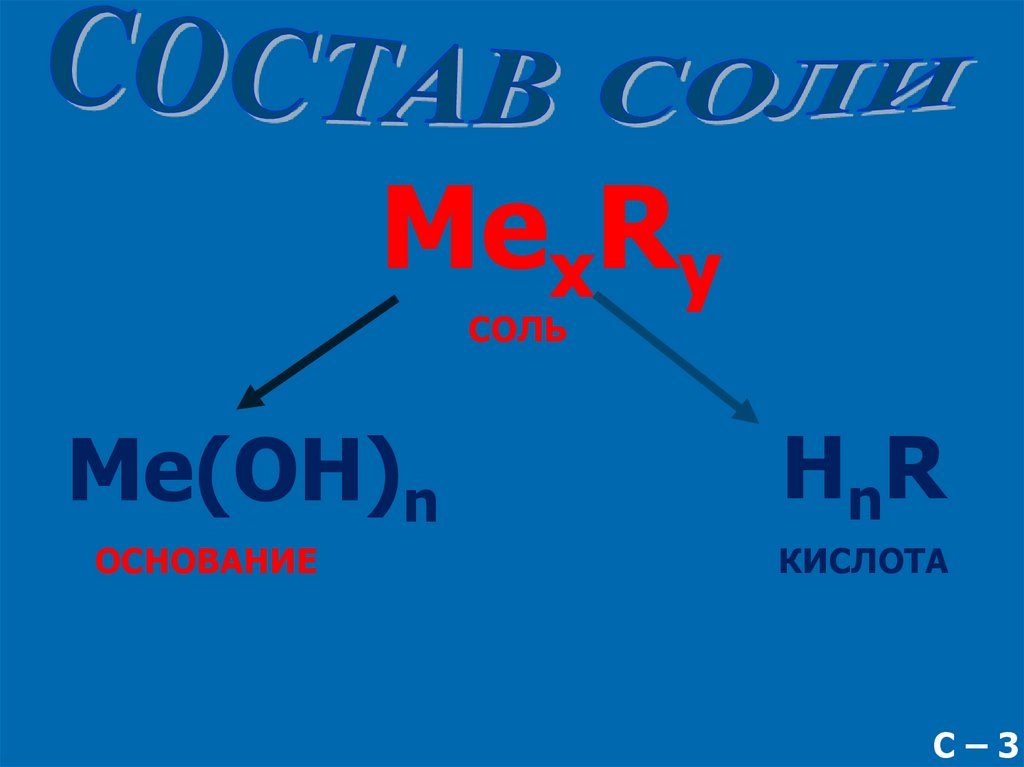
MexRyСОЛЬ
Me(OH)n
ОСНОВАНИЕ
HnR
КИСЛОТА
C–3
4.
КислотаОснования
Слабые Слабые – все
CH3COOH, нерастворимые в воде
H2CO3, H2S; основания и NH4OH
H3PO4
Сильные – щёлочи
Сильные (исключение: NH4OH)
НСl, HBr, HI,
НNО3, НСlO4,
Н2SO4
5.
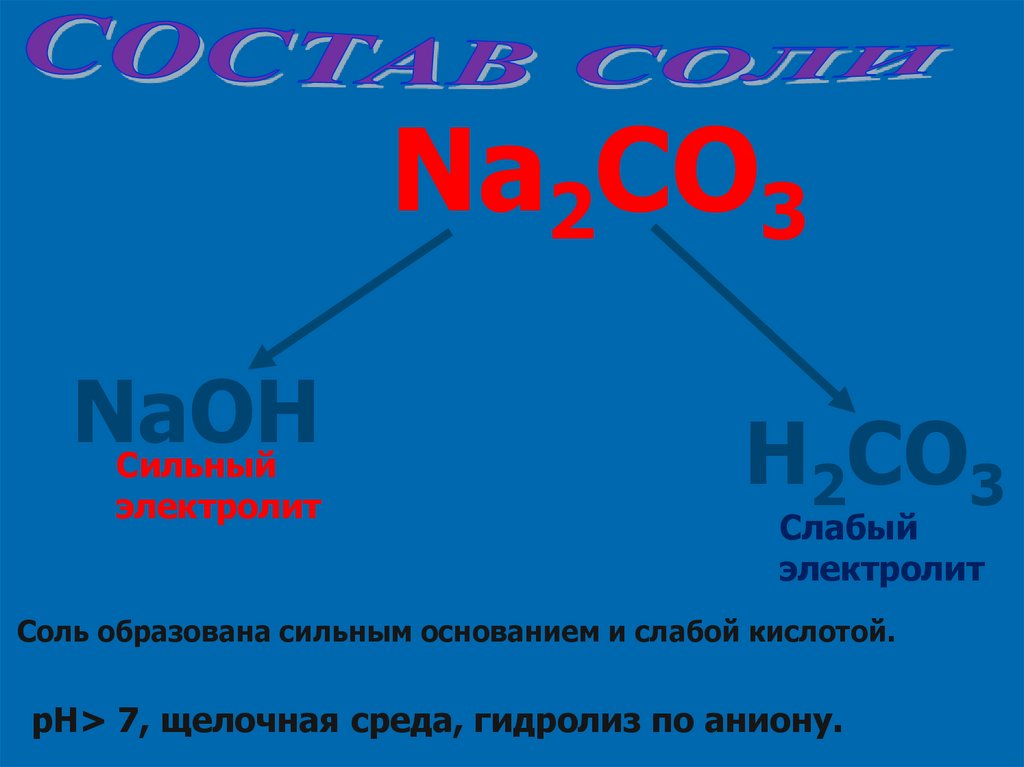
Na2CO3NaOH
Сильный
электролит
H2CO3
Слабый
электролит
Соль образована сильным основанием и слабой кислотой.
pH> 7, щелочная среда, гидролиз по аниону.
6.
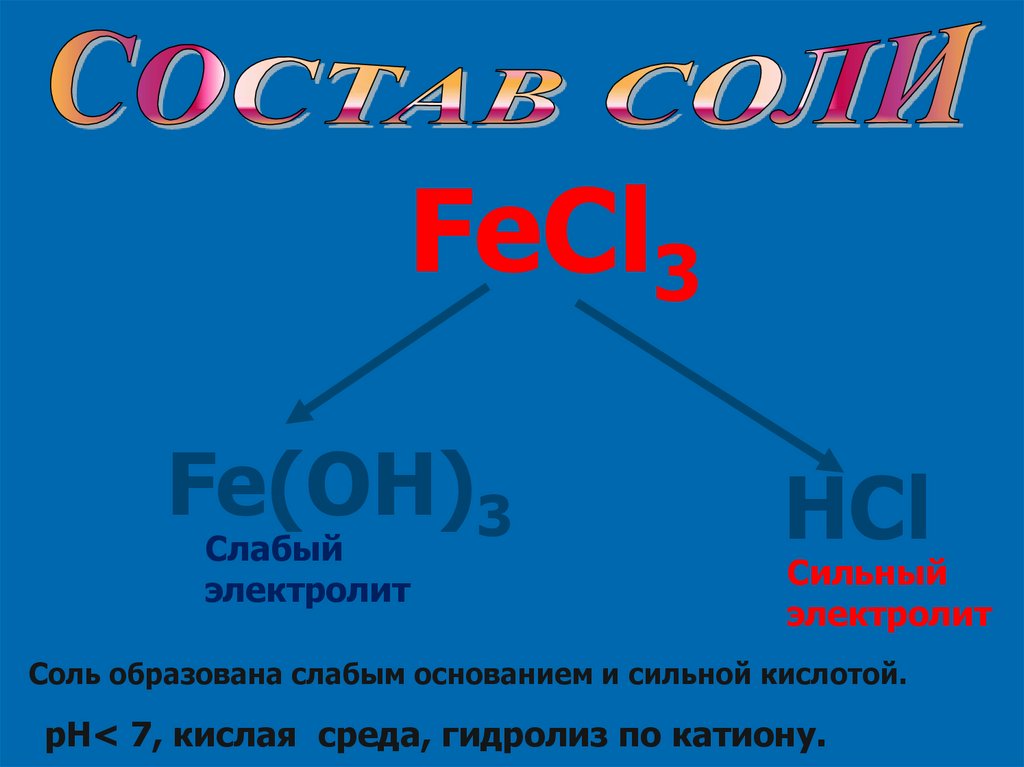
FeCl3Fe(OH)3
Слабый
электролит
HCl
Сильный
электролит
Соль образована слабым основанием и сильной кислотой.
pH< 7, кислая среда, гидролиз по катиону.
7.
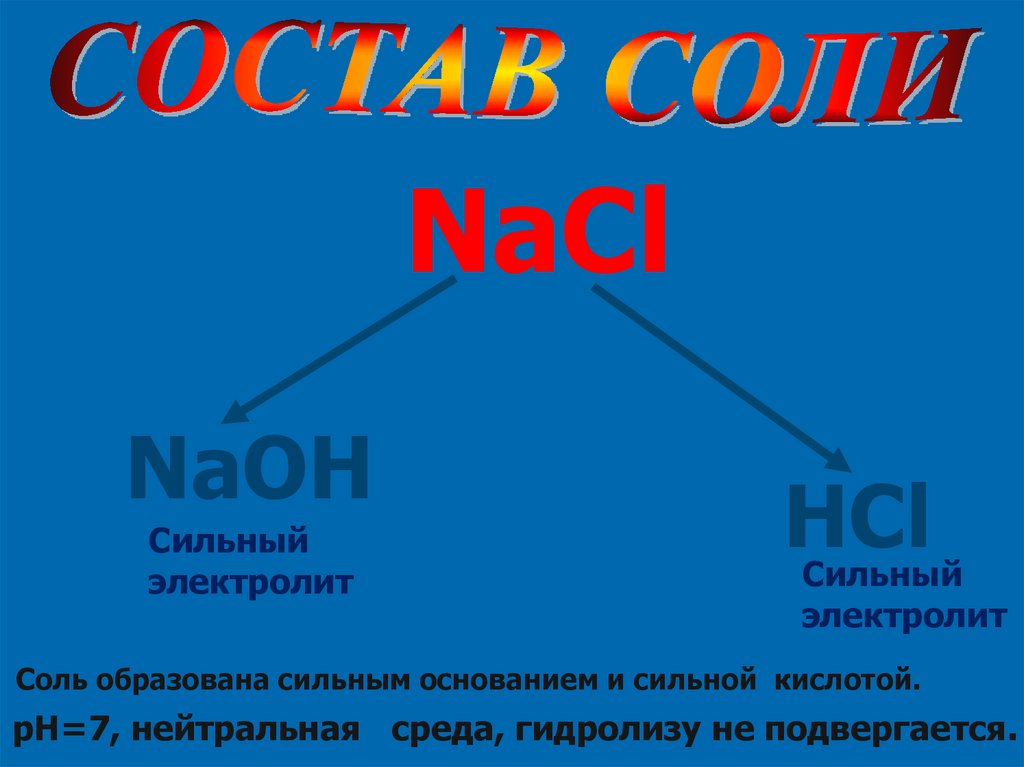
NaClNaOH
Сильный
электролит
HCl
Сильный
электролит
Соль образована сильным основанием и сильной кислотой.
pH=7, нейтральная среда, гидролизу не подвергается.
8.
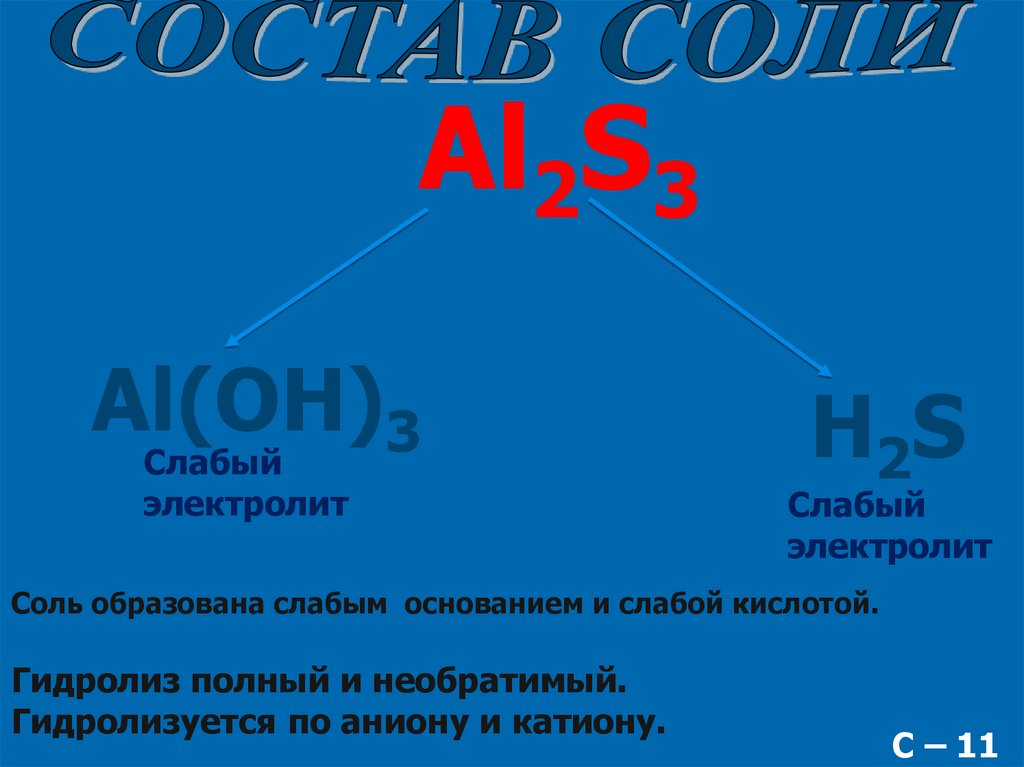
Al2S3Al(OH)3
Слабый
электролит
H2S
Слабый
электролит
Соль образована слабым основанием и слабой кислотой.
Гидролиз полный и необратимый.
Гидролизуется по аниону и катиону.
C – 11
9.
ЗАПИСАТЬ ГИДРОЛИЗ, УКАЗАТЬ:Какое значение рН (рН ≥7, рН ≤ 7) имеют
растворы этих солей? Какая среда? Как
проходит гидролиз.
K2SO4;
CrCl3;
Li2CO3;
SrCl2;
CuSO4; СН3СООNa;
Al(NO3)3 ; K2SiO3
NH4Br;
LiCl;




 Химия
Химия








