Похожие презентации:
Гидролиз солей
1.
Тема:Гидролиз солей
2.
Гидролизсолей
–
реакция ионного обмена
соли
с
водой
с
образованием слабого электролита
(вода, слабая кислота, слабое
основание)
3.
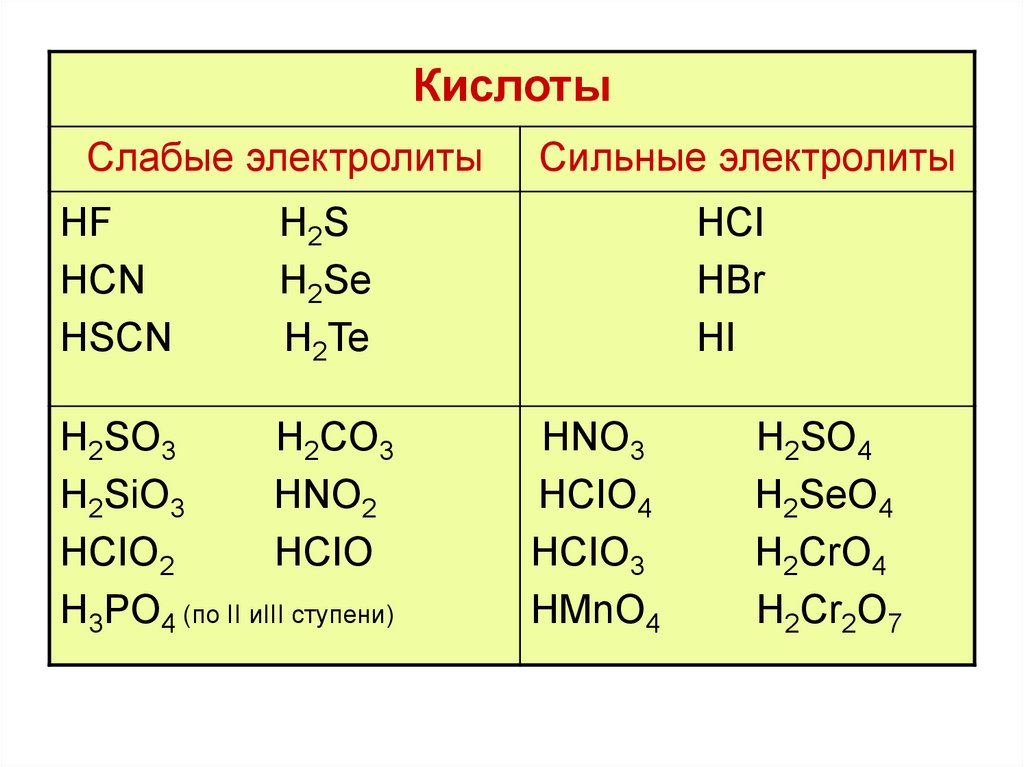
КислотыСлабые электролиты
HF
HCN
HSCN
Сильные электролиты
H2S
H2Se
H2Te
H2SO3
H2CO3
H2SiO3
HNO2
HCIO2
HCIO
H3PO4 (по II иIII ступени)
HCI
HBr
HI
HNO3
HCIO4
HCIO3
HMnO4
H2SO4
H2SeO4
H2CrO4
H2Cr2O7
4.
ОснованияСильные электролиты
Слабые электролиты
щелочи
МеОН,
все остальные,
где Ме: Li, Na, K, Rb, Cs нерастворимые в воде
основания Mg(OH)2 ,
Fe(OH)2, Cu(OH)2
основания Mе(OH)2,
в т.ч. и амфотерные
где Ме: Са, Sr, Ba, Ra
гидроксиды
5.
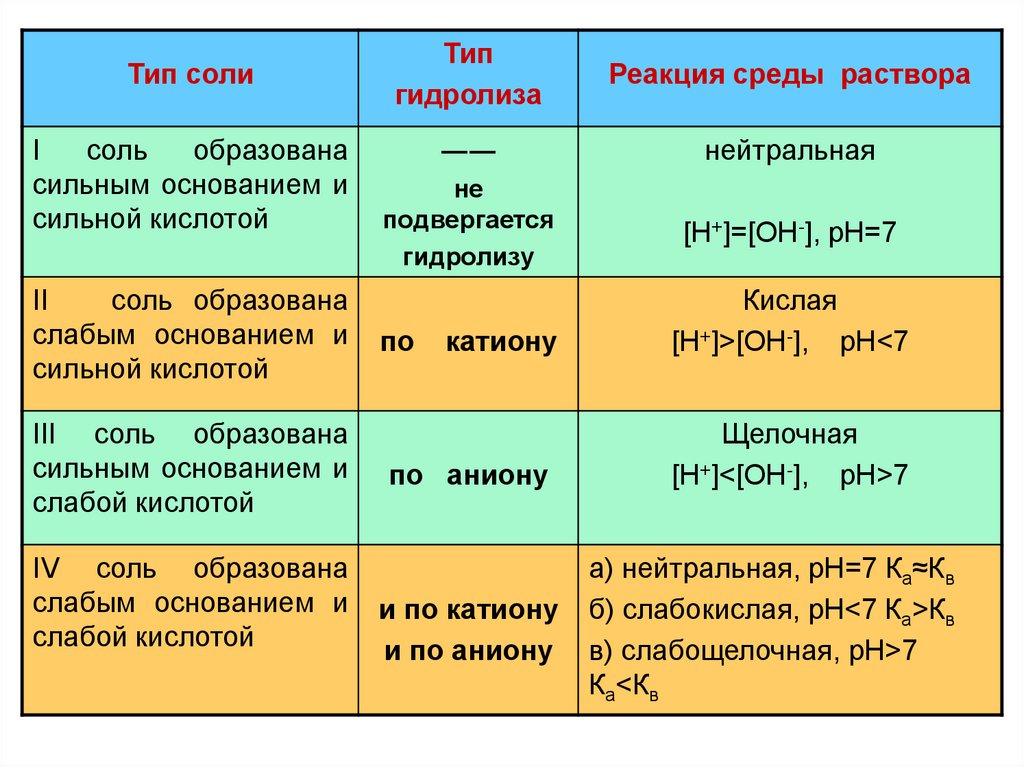
Тип солиI
соль
образована
сильным основанием и
сильной кислотой
II
соль образована
слабым основанием и
сильной кислотой
III соль образована
сильным основанием и
слабой кислотой
IV соль образована
слабым основанием и
слабой кислотой
Тип
гидролиза
Реакция среды раствора
――
нейтральная
не
подвергается
гидролизу
[Н+]=[ОН-], рН=7
по
катиону
по аниону
и по катиону
и по аниону
Кислая
[Н+]>[ОН-], рН<7
Щелочная
[Н+]<[ОН-], рН>7
а) нейтральная, рН=7 Ка≈Кв
б) слабокислая, рН<7 Ка>Кв
в) слабощелочная, рН>7
Ка<Кв
6.
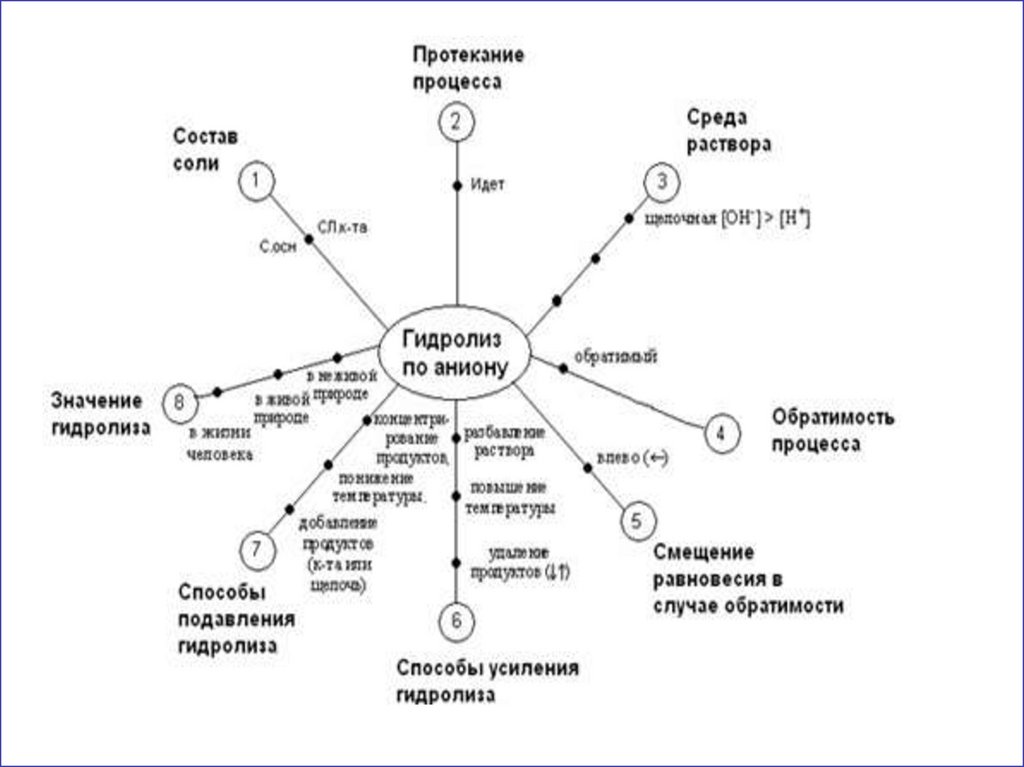
7. ГИДРОЛИЗ ПО АНИОНУ
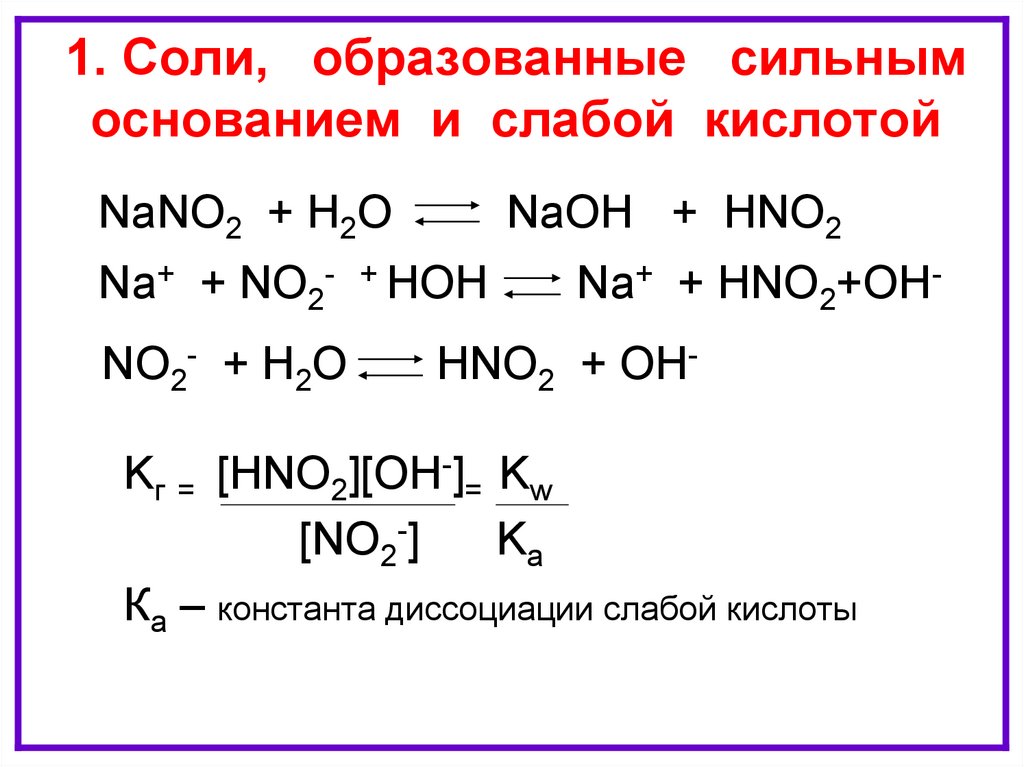
1. Соли, образованные сильнымГИДРОЛИЗ
ПО
АНИОНУ
основанием и слабой кислотой
NaNO2 + H2O
Na+ + NO2NO2- + H2O
NaOH + HNO2
+ HOH
Na+ + HNO2+OH-
HNO2 + OH-
Kг = [HNO2][OH-]= Kw
[NO2-]
Kа
Ка – константа диссоциации слабой кислоты
8.
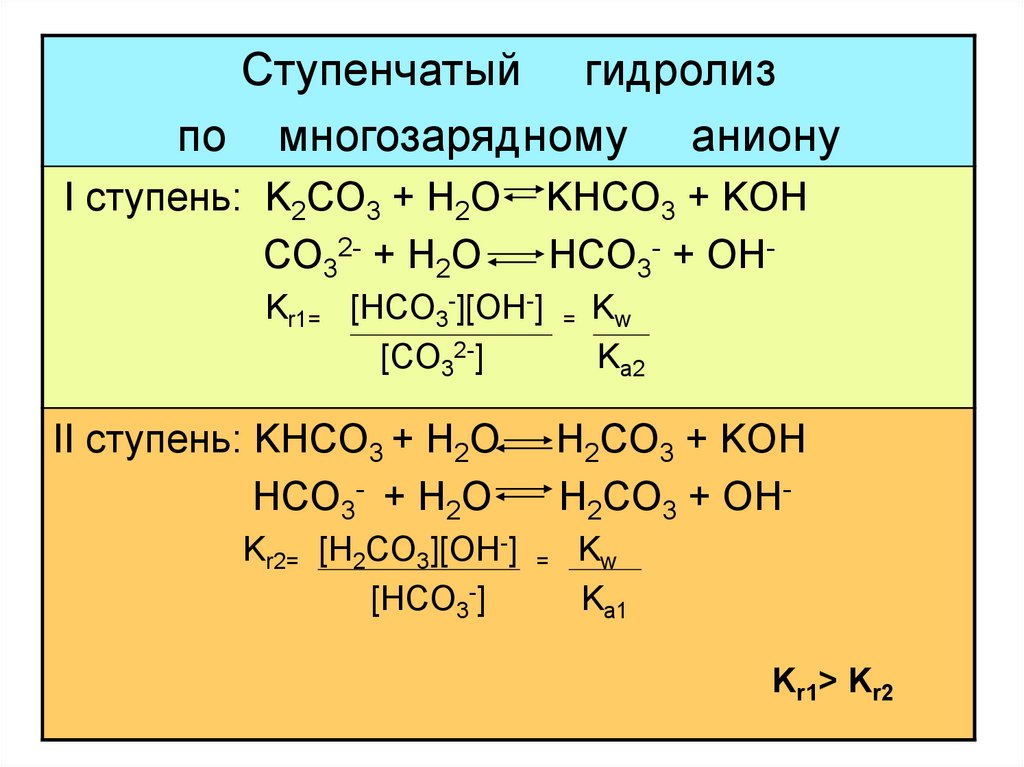
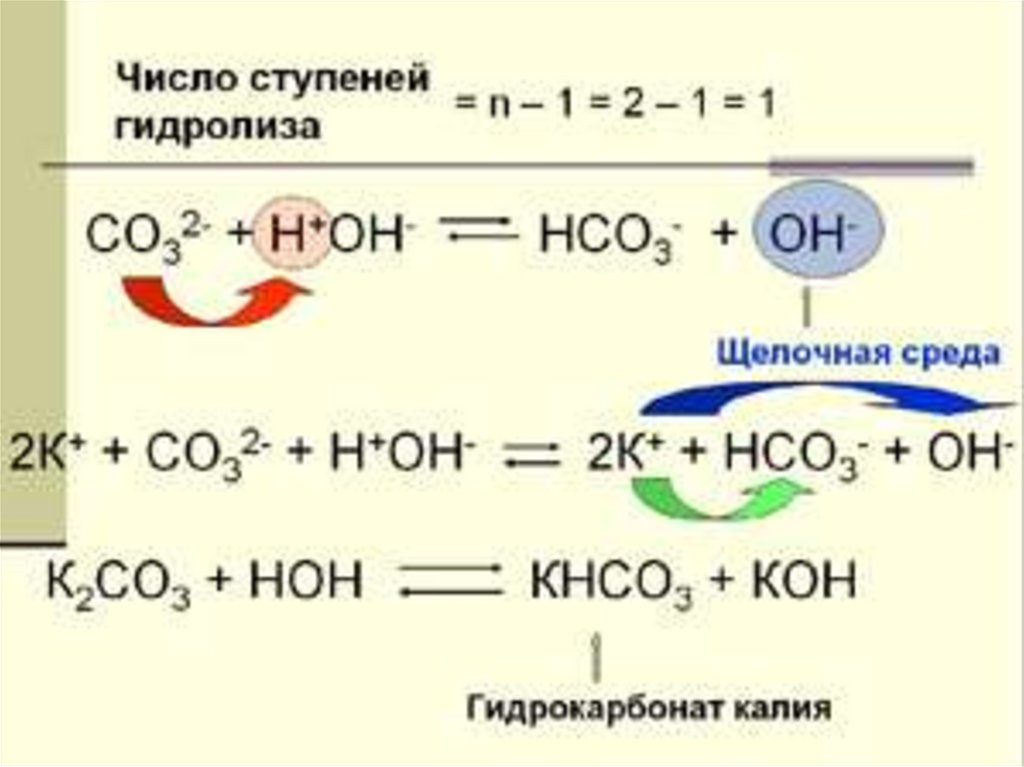
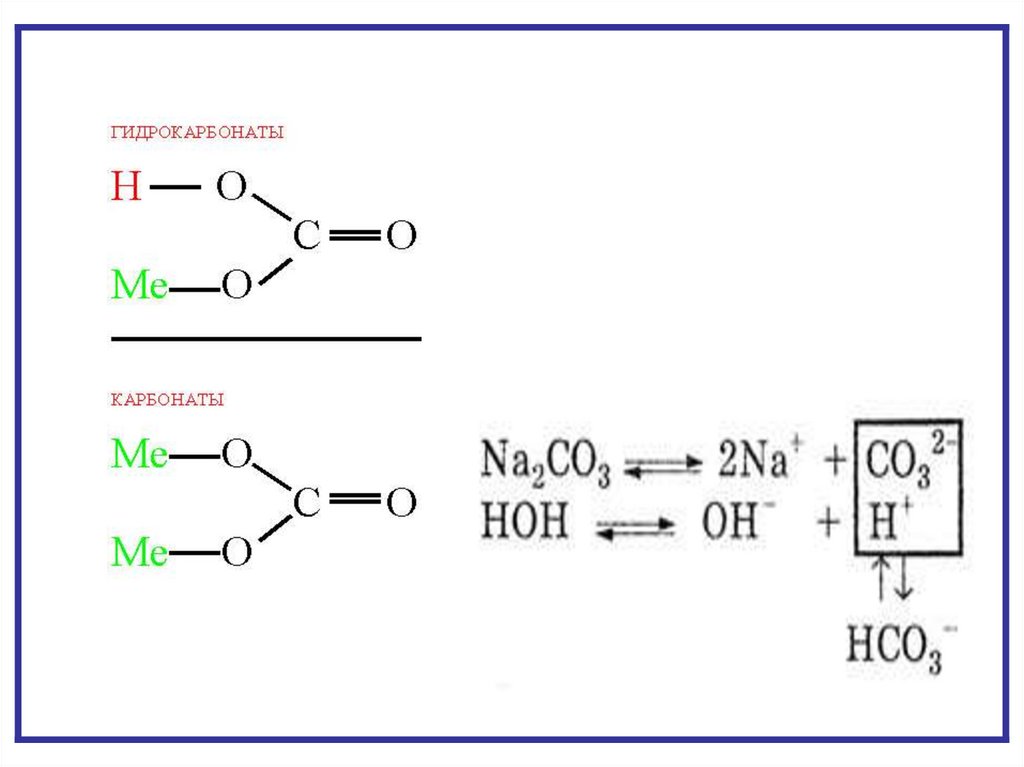
Ступенчатый гидролизпо многозарядному аниону
I ступень: K2CO3 + H2O
CO32- + H2O
KHCO3 + KOH
HCO3- + OH-
Kr1= [HCO3-][OH-]
[CO32-]
II ступень: KHCO3 + H2O
HCO3- + H2O
Kr2= [H2CO3][OH-]
[HCO3-]
=
Kw
Kа2
H2CO3 + KOH
H2CO3 + OH=
Kw
Kа1
Kr1> Kr2
9.
10.
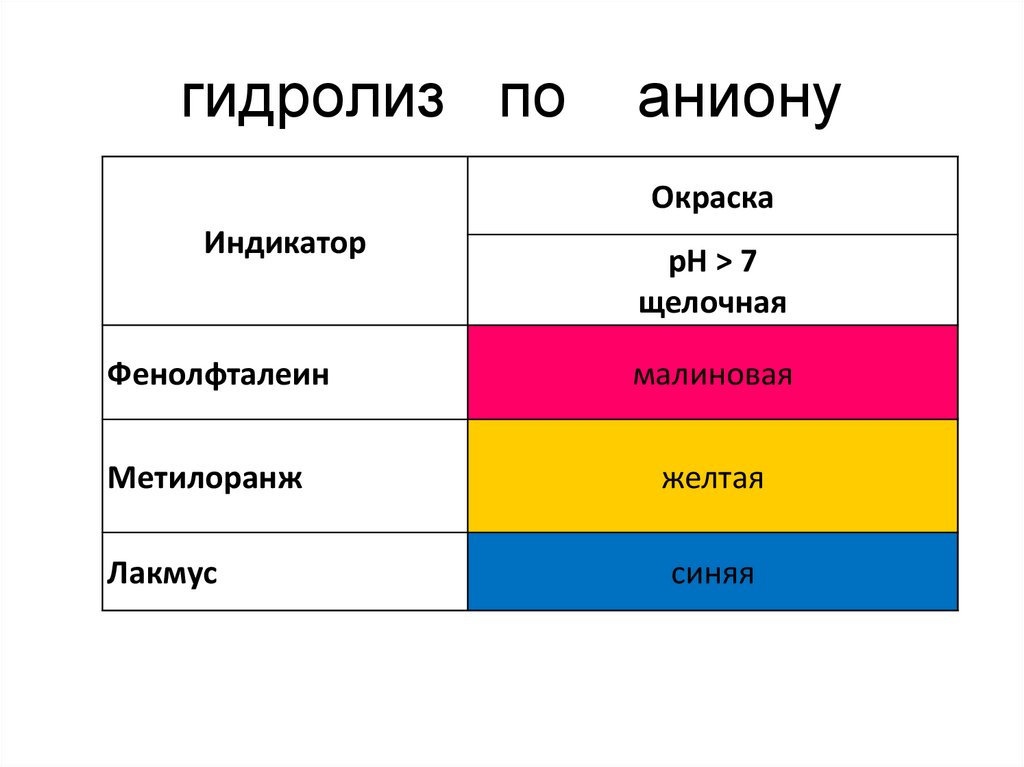
11. гидролиз по аниону
ОкраскаИндикатор
Фенолфталеин
рН ˃ 7
щелочная
малиновая
Метилоранж
желтая
Лакмус
синяя
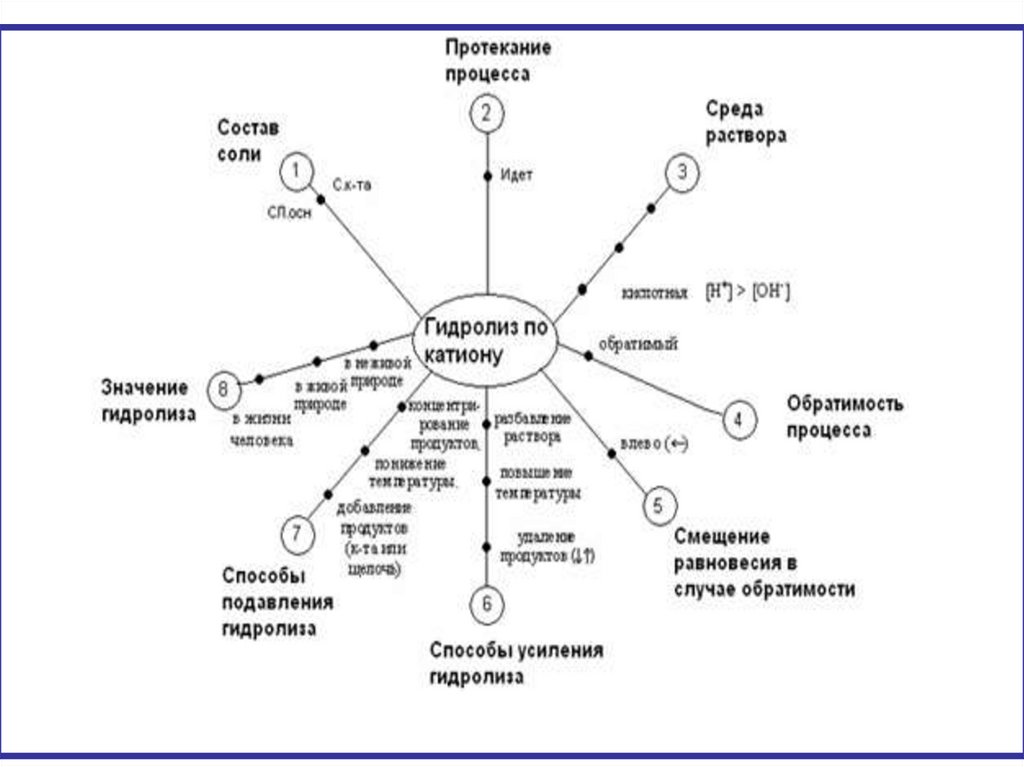
12. ГИДРОЛИЗ ПО КАТИОНУ
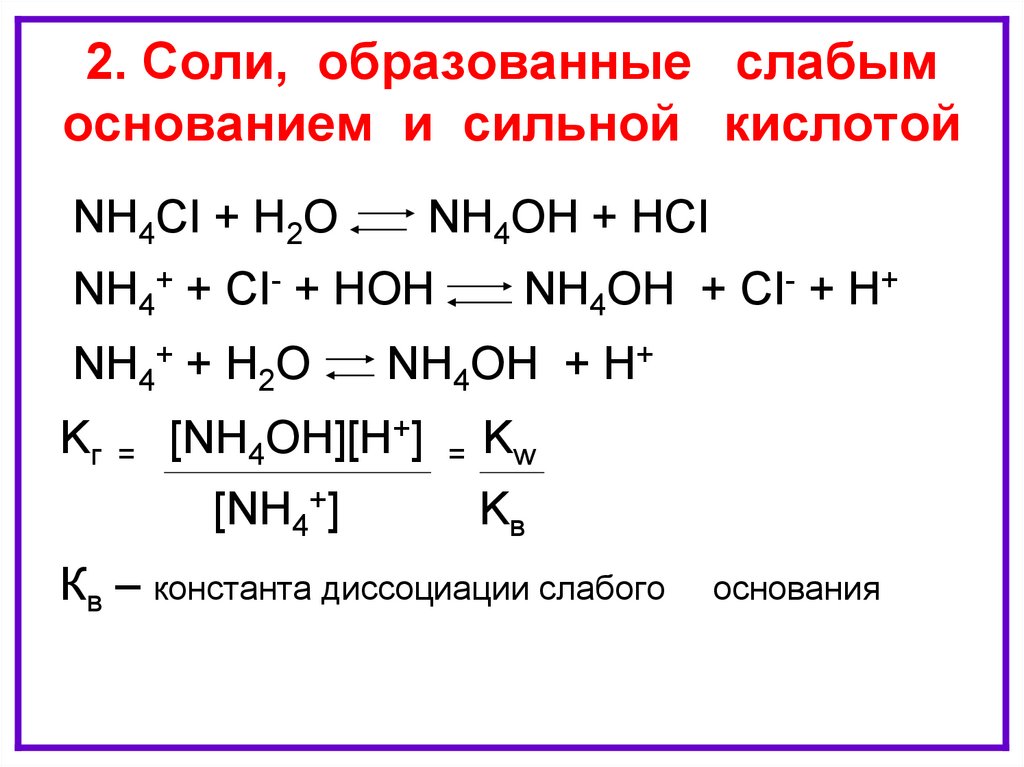
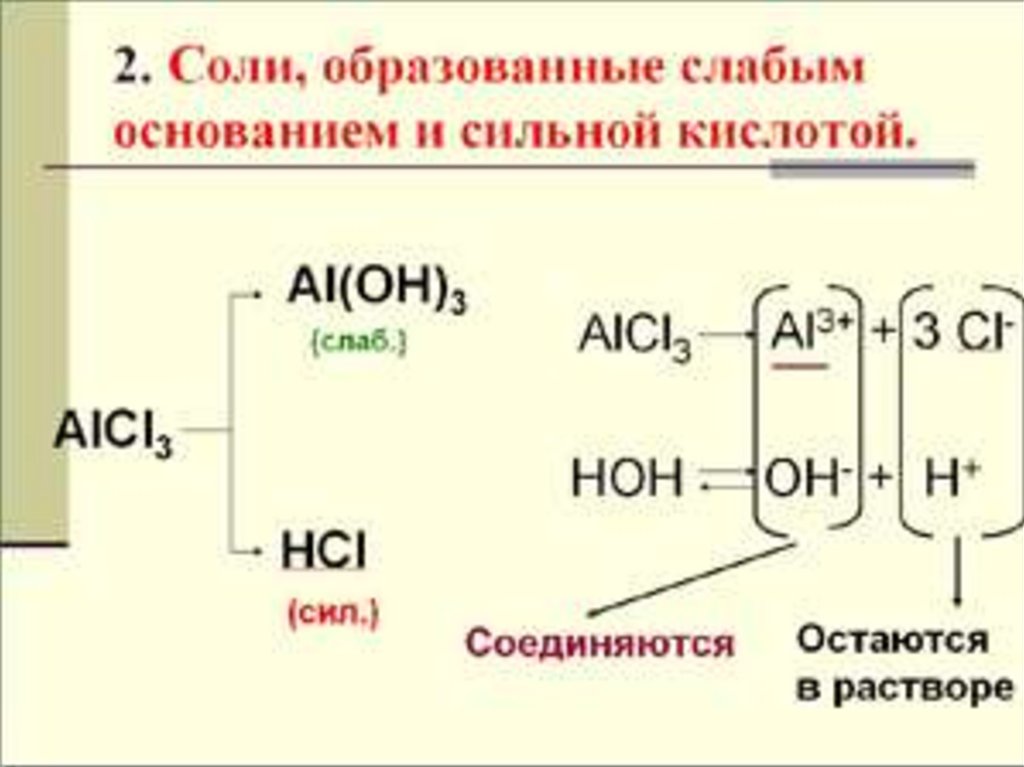
2. Соли, образованные слабымГИДРОЛИЗ
ПО
КАТИОНУ
основанием и сильной кислотой
NH4CI + H2O
NH4OH + HCI
NH4+ + CI- + HOH
NH4+ + H2O
Kг
=
NH4OH + H+
[NH4OH][H+]
[NH4+]
NH4OH + CI- + H+
=
Kw
Kв
Кв – константа диссоциации слабого
основания
13.
Ступенчатый гидролизпо многозарядному катиону
I ступень
MgCI2 + H2O MgOHCI + HCI
Mg2+ + H2O
MgOH+ + H+
Kr1= [MgOH+][H+] = Kw
[Mg2+]
Kв2
II ступень
MgOHCI + H2O
Mg(OH)2 + HCI
MgOH+ + H2O
Mg(OH)2 + H+
Kr2= [Mg(OH)2][H+] = Kw
[MgOH+]
Kв1
Kr1> Kr2
14.
15.
16.
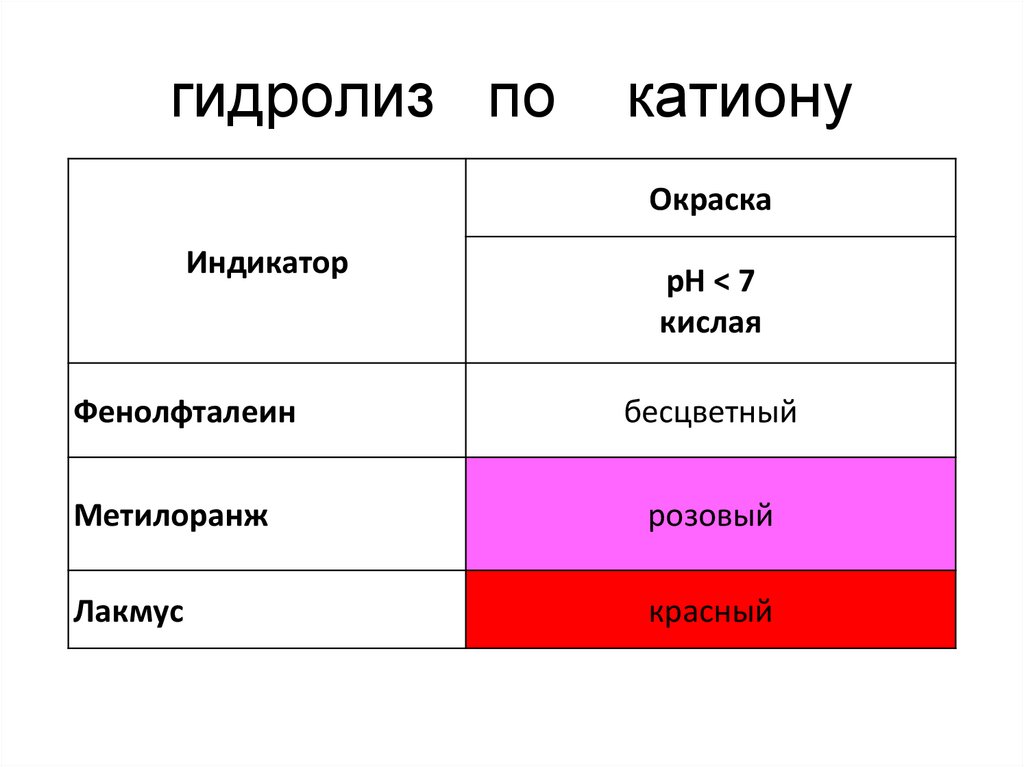
17. гидролиз по катиону
ОкраскаИндикатор
Фенолфталеин
рН ˂ 7
кислая
бесцветный
Метилоранж
розовый
Лакмус
красный
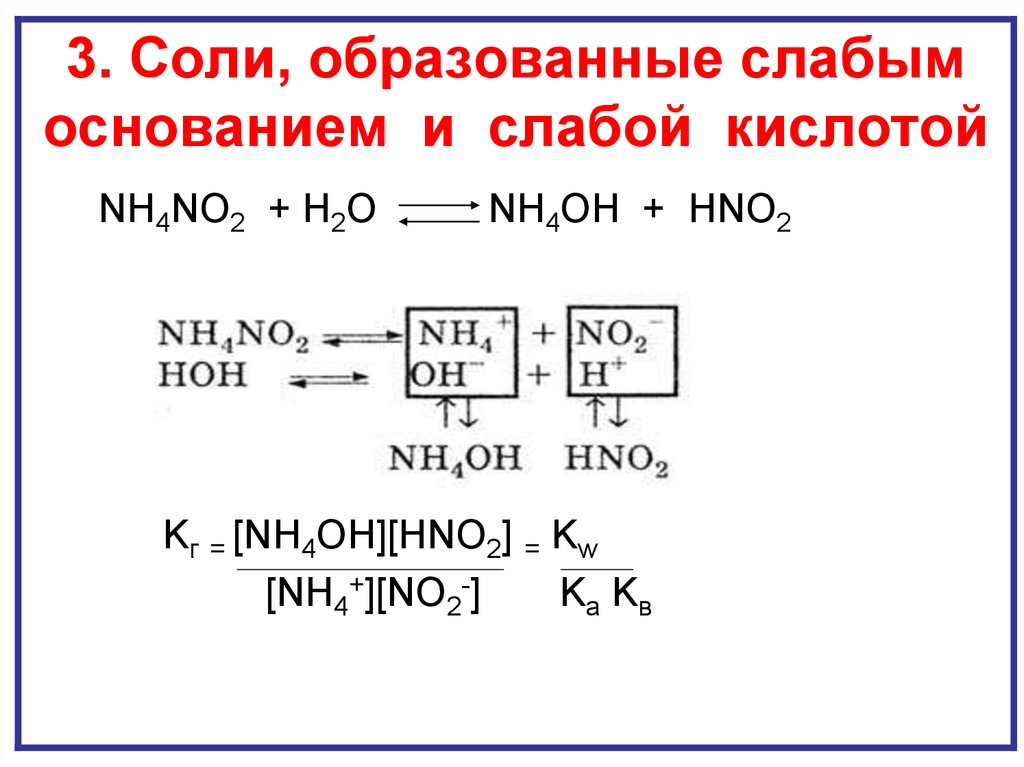
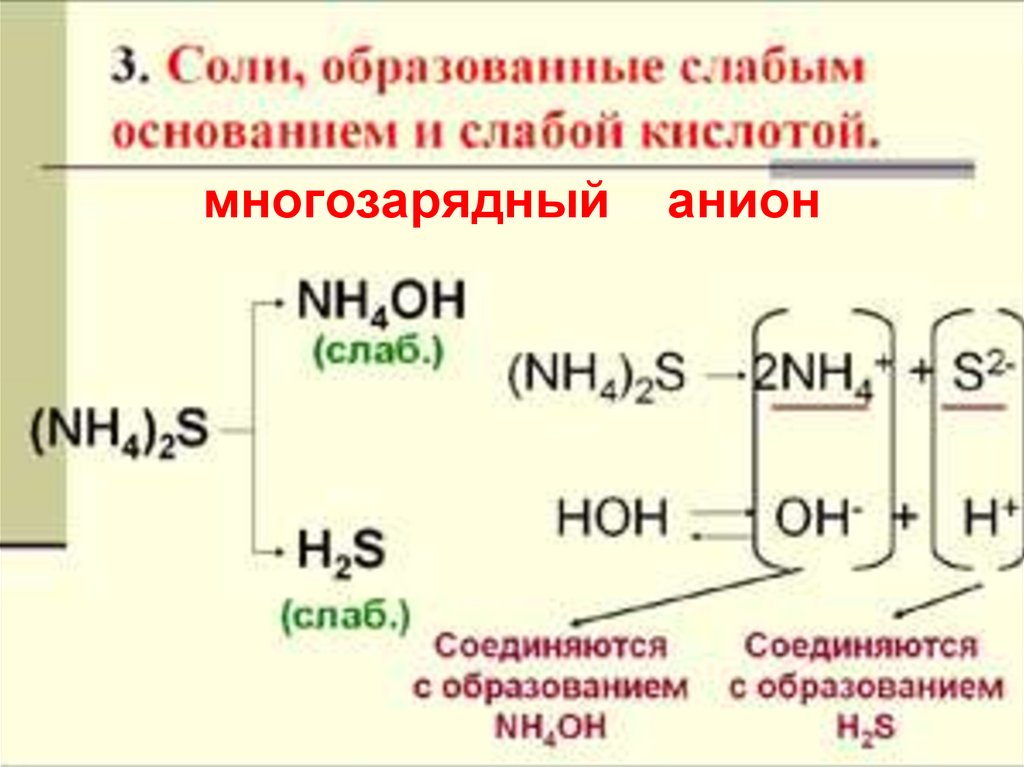
18. ГИДРОЛИЗ И ПО КАТИОНУ И ПО АНИОНУ
3. Соли, образованные слабымГИДРОЛИЗ И ПО КАТИОНУ И ПО АНИОНУ
основанием и слабой кислотой
NH4NO2 + H2O
NH4OH + HNO2
Kг = [NH4OH][HNO2] = Kw
[NH4+][NO2-]
Kа Kв
19. многозарядный анион
20.
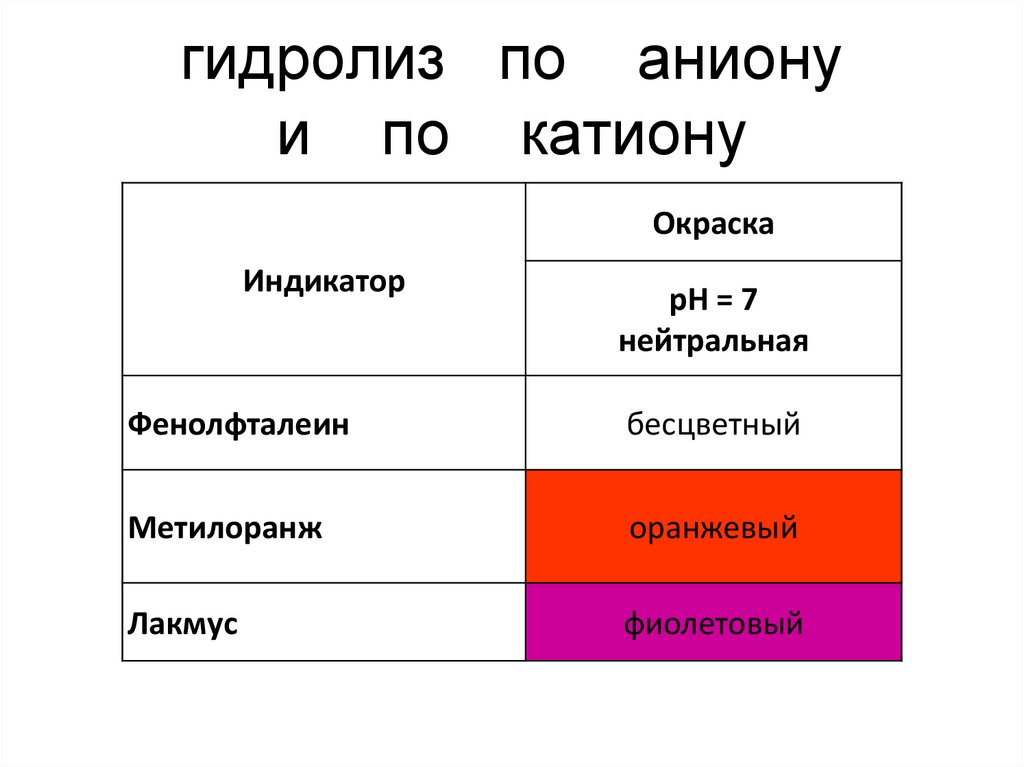
21. гидролиз по аниону и по катиону
ОкраскаИндикатор
рН = 7
нейтральная
Фенолфталеин
бесцветный
Метилоранж
оранжевый
Лакмус
фиолетовый
22.
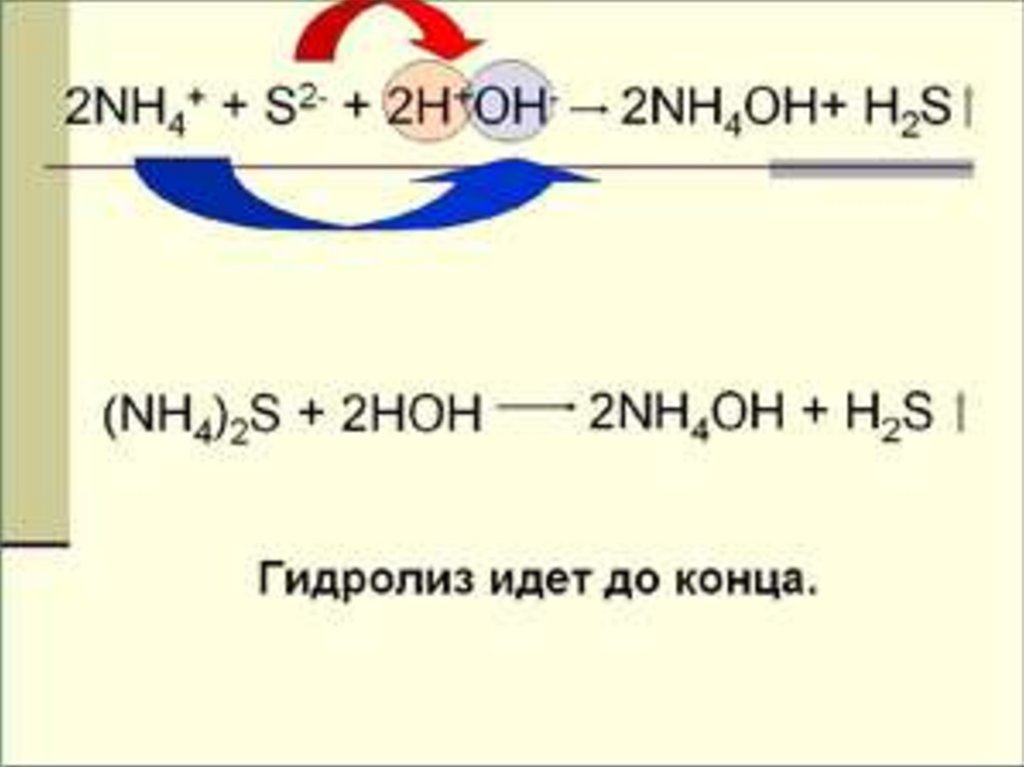
Гидролиз некоторых солей такжеидет до конца, например,
Al2S3 + 6H2O → 2 Al(OH)3 ↓ + 3 H2S↑,
т.к.
образуются
осадок
газообразное вещество
и
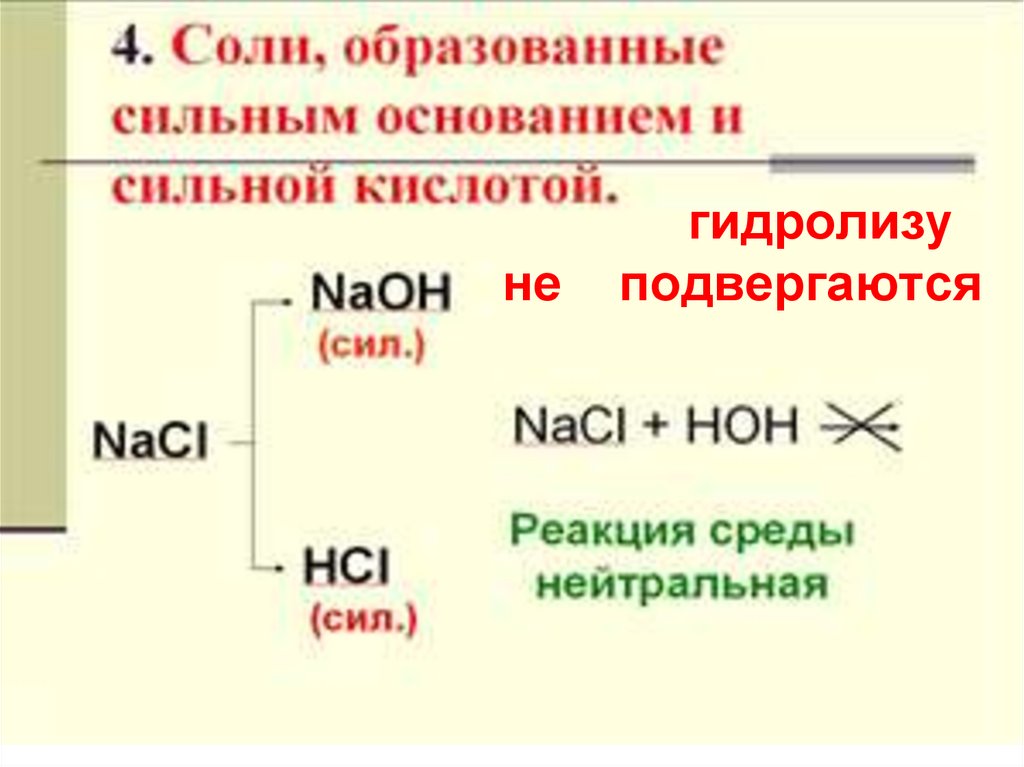
23. гидролизу не подвергаются
негидролизу
подвергаются
24.
25.
26.
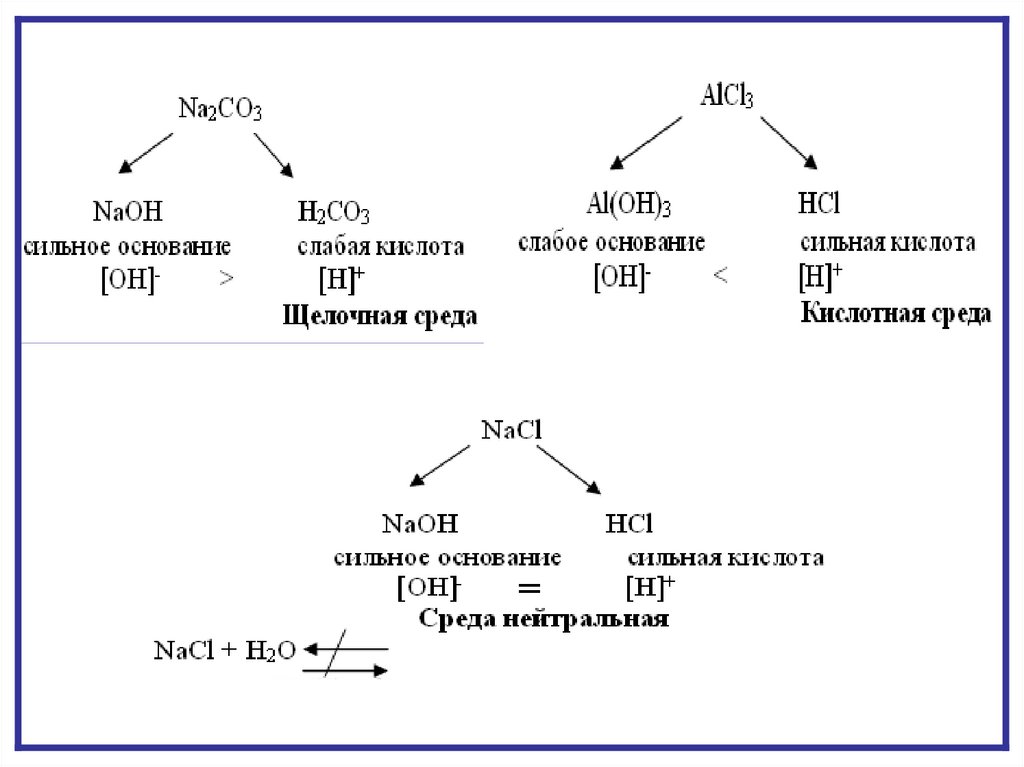
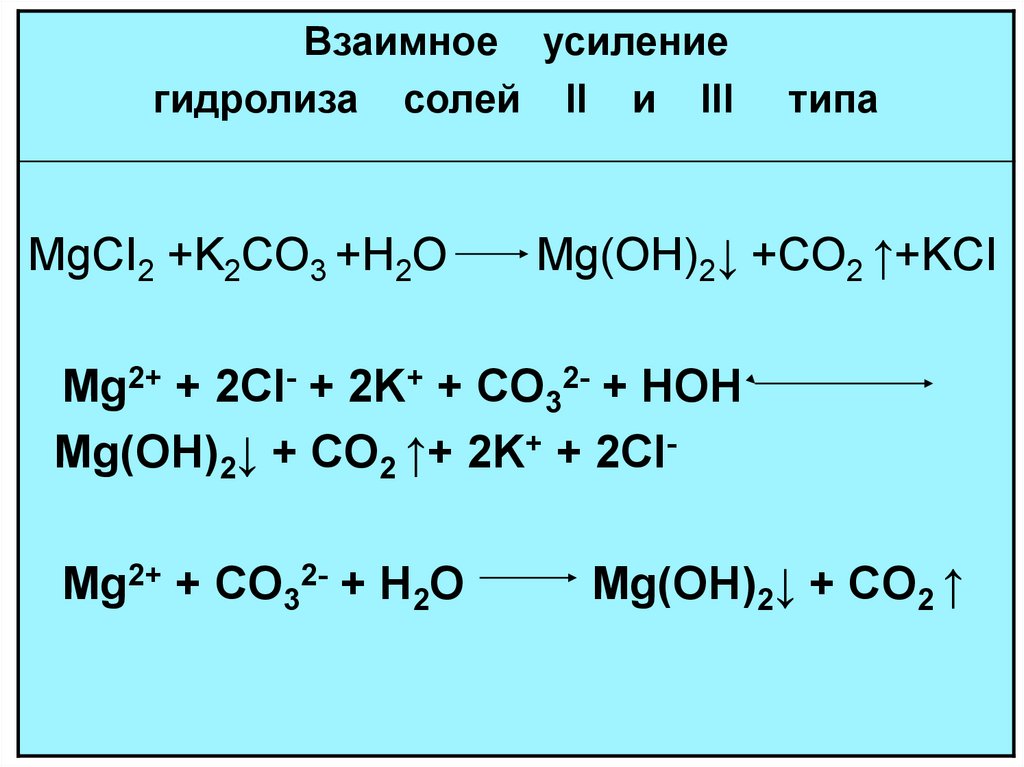
Взаимное усилениегидролиза солей II и III
MgCI2 +K2CO3 +H2O
типа
Mg(OH)2↓ +CO2 ↑+KCI
Mg2+ + 2CI- + 2K+ + CO32- + HOH
Mg(OH)2↓ + CO2 ↑+ 2K+ + 2CIMg2+ + CO32- + H2O
Mg(OH)2↓ + CO2 ↑









 Химия
Химия








