Похожие презентации:
Потенциометрия. Потенциометрическое титрование
1.
Потенциометрия.Потенциометрическое
титрование
Хрусталева А.А.
2.
Теоретические основыэлектрохимических методов
Электрохимические методы основаны на изучении и использовании
процессов, протекающих на поверхности электрода или в
приэлектродном пространстве.
Основной узел любого электрохимического прибора –
электрохимическая ячейка.
Виды электрохимических ячеек:
Гальванический элемент;
Электролитическая ячейка.
Каждая ячейка содержит два электрода:
электрод сравнения и индикаторный электрод.
2
3.
• К электрохимическим методам анализа относятся методы,основанные на измерении электрических параметров
анализируемых систем (количества электричества, прошедшего через
раствор; силы предельного диффузионного тока; электропроводности
электролита; потенциала электрода, погруженного в исследуемый раствор, и др.),
изменяющихся в результате определенных реакций.
Классификация электрохимических методов анализа
1. По способу выполнения:
• Прямые (ионометрия, кулонометрия, потенциометрия, полярография и др.).
• Косвенные (титриметрия с электрохимическими методами индикации).
• Инверсионные (инверсионная вольтамперометрия и др.).
2. По количеству вещества, участвующему в электродном
процессе:
• Все вещество участвует в электродном процессе (электрогравиметрия,
прямая кулонометрия и др.).
• Лишь незначительная доля вещества подвергается
электропревращению (полярография, вольтамперометрия, прямая
потенциометрия и др.).
4.
Потенциометрический метод анализа• Потенциометрия основана на измерении потенциала,
возникающего между электродом и раствором (или, точнее,
ЭДС гальванического элемента), величина которого зависит
от количества (концентрации) или качества (природы)
определяемого компонента.
• Такой электрод называют индикаторным. Таким образом,
потенциал электрода в потенциометрии – аналитический
сигнал.
5.
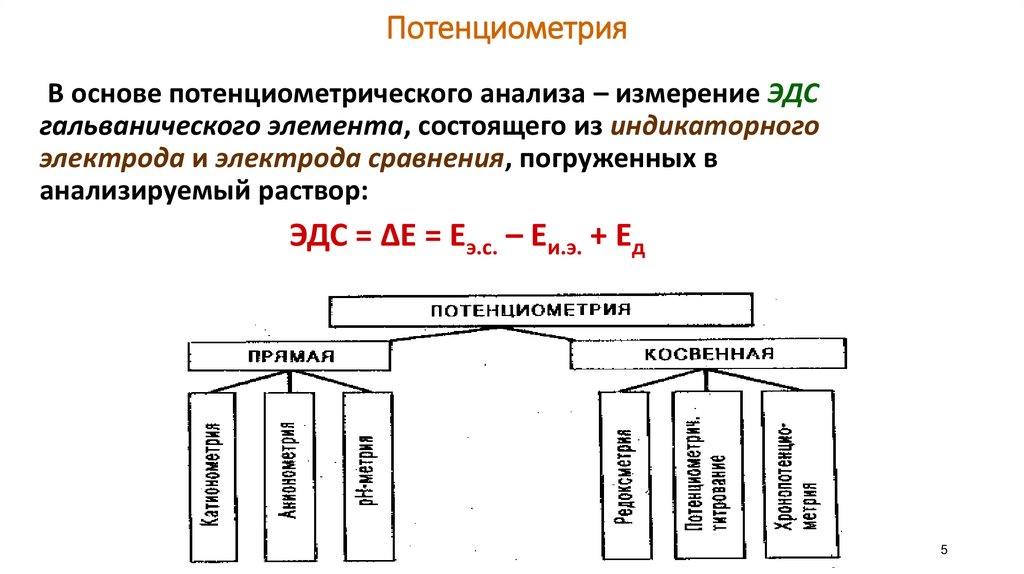
ПотенциометрияВ основе потенциометрического анализа – измерение ЭДС
гальванического элемента, состоящего из индикаторного
электрода и электрода сравнения, погруженных в
анализируемый раствор:
ЭДС = ∆Е = Еэ.с. – Еи.э. + Ед
МККОС. Л.К. № 9. Попова Людмила Федоровна
5
6.
Понятия и термины, используемые в потенциометрии• Электроды – совокупность 2, 3 или 4-х контактирующих фаз, на границах которых возникают
скачки электрических потенциалов. Контактирующими фазами являются электролиты, металлы или
полупроводники.
• Электрохимическая ячейка. Состоит из пары электродов, погруженных в один общий или два
разных электролита, находящихся в непосредственном контакте или соединенных солевым мостиком.
Электрохимические ячейки, в которых электрическая энергия образуется за счет химической реакции,
называют гальваническими элементами.
• Мембранная ячейка – ячейка, состоящая из мембранного электрода и двух электродов с
металлической основой (электроды сравнения)
• Электродвижущая сила – разность электродных потенциалов правого е1 и левого е концов
правильно разомкнутого гальванического элемента.
• Электродная реакция (полуреакция) – реакция, протекающая на границе раздела фаз,
составляющих электрод.
• Солевой мостик (электролитический ключ) – трубка, наполненная концентрированным раствором
электролита и погруженного своими концами в два других электролита, являющихся основными
частями электрохимической ячейки.
• Электродный потенциал (обычно условный потенциал) – ЭДС гальванического элемента,
состоящего из стандартного водородного и исследуемого электродов.
7.
8.
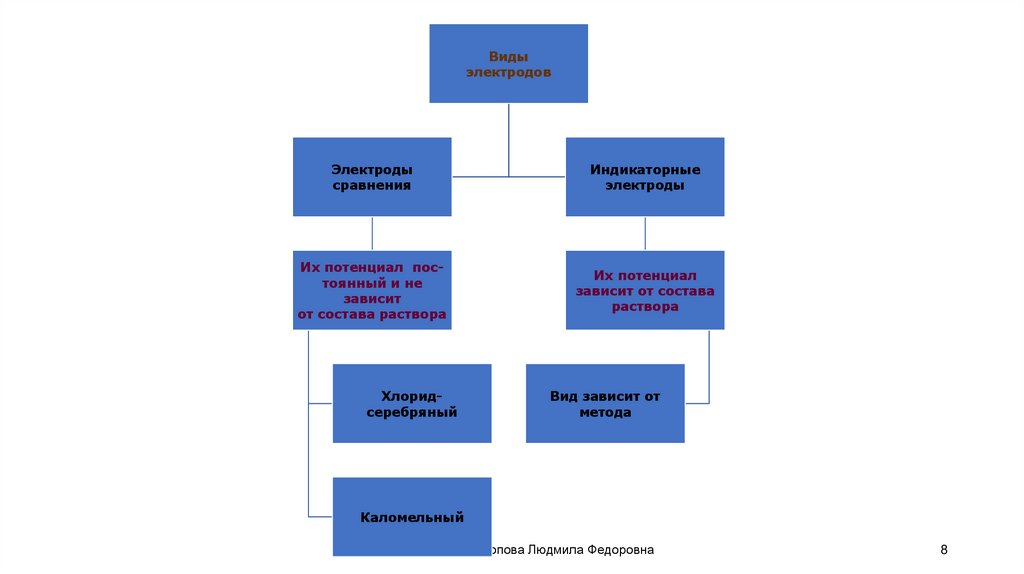
Видыэлектродов
Электроды
сравнения
Индикаторные
электроды
Их потенциал постоянный и не
зависит
от состава раствора
Их потенциал
зависит от состава
раствора
Хлоридсеребряный
Вид зависит от
метода
Каломельный
МККОС. Л.К. № 9. Попова Людмила Федоровна
8
9.
Электроды, используемыев электрохимии
• Согласно электрохимическим реакциям электроды, используемые в
потенциометрии, различают по роду.
• Электроды первого рода (обратимые относительно катиона, общего с
материалом электрода):
Металлические электроды;
Амальгамные электроды;
Газовые электроды (водородный).
• Электроды второго рода (обратимые относительно аниона, общего с
материалом электрода):
Электроды сравнения (хлоридсеребряный, каломельный);
Газовые электроды (хлорный).
• Электроды третьего рода (редокс-электроды):
Металлические электроды, погруженные в редокс-систему;
Хингидронный электрод.
9
10.
11.
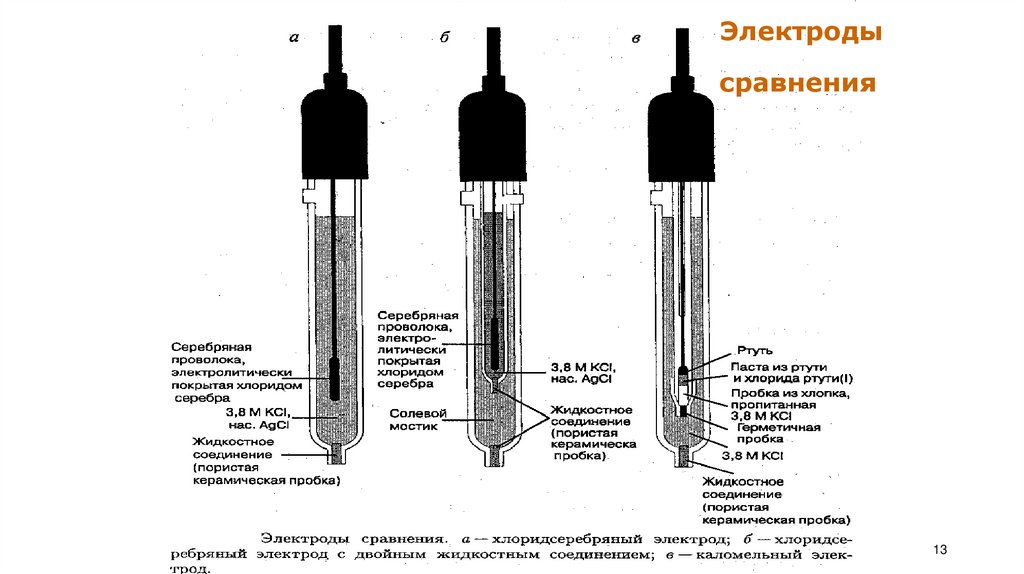
Электроды 2 -го рода: каломельный, меркурсульфатный Их используют вкачестве электродов сравнения.
12.
13.
Электродысравнения
МККОС. Л.К. № 9. Попова Людмила Федоровна
13
14.
Прямая потенциометрияВ основе метода – зависимость равновесного
потенциала индикаторного электрода от концентрации
иона в анализируемом растворе, выражаемое
уравнением Нернста:
2,3 RT
Е Е
lg C
nF
0
где E0 – стандартный (нормальный ) потенциал электрода при концентрации определенных ионов 1моль · экв/л (справочная величина);
R – универсальная газовая постоянная, равная 8,314 Дж/(град.моль);
Т – абсолютная температура, °К;
n – заряд иона;
F – постоянная Фарадея 96500 Кл/моль;
14
15.
Оборудование для потенциометрии15
16.
Концентрацию определяемых ионов находятодним из методов количественного анализа:
• 1. Метод градуировочного графика E = f(C).
• 2. Метод добавок (анализ сложных по составу и сильно
разбавленных растворов).
• 3. Метод градуировки электрода по растворам с точно
известной концентрацией определяемых ионов (буферные
растворы) - ионометрия.
17.
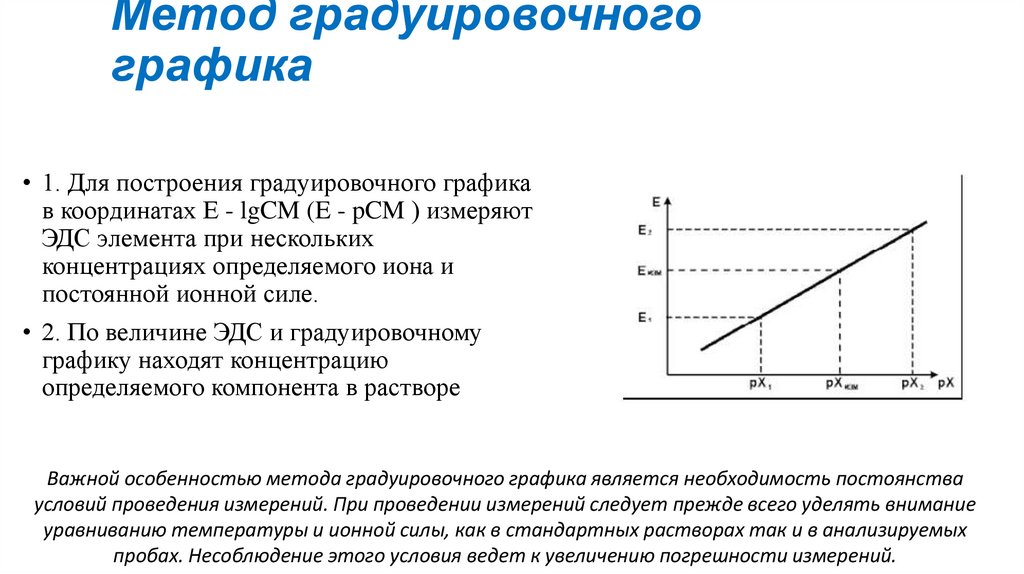
Метод градуировочногографика
• 1. Для построения градуировочного графика
в координатах E - lgCM (E - pCM ) измеряют
ЭДС элемента при нескольких
концентрациях определяемого иона и
постоянной ионной силе.
• 2. По величине ЭДС и градуировочному
графику находят концентрацию
определяемого компонента в растворе
Важной особенностью метода градуировочного графика является необходимость постоянства
условий проведения измерений. При проведении измерений следует прежде всего уделять внимание
уравниванию температуры и ионной силы, как в стандартных растворах так и в анализируемых
пробах. Несоблюдение этого условия ведет к увеличению погрешности измерений.
18.
Достоинстваметода• 1. Простота аппаратурного оформления.
• 2. Быстрота проведения измерений.
• 3. Высокая чувствительность.
• 4. Возможность работы с малыми объемами.
• 5. Большой диапазон концентраций.
• 6. Универсальность. Метод позволяет
использовать реакции
• нейтрализации, осаждения,
комплексообразования,
окислениявосстановления.
• 7. Для анализа можно использовать мутные и
окрашенные растворы.
Недостатки –
• сравнительно невысокая точность .
• необходимость иметь большой набор ионселективных электродов
Применение –
• при исследовании состава природных и сточных
вод, почв, технологических растворов;
• -в анализе пищевых продуктов, биологических
жидкостей и т. п. –
• для определения растворенного в воде
кислорода, -фторидов и цианидов в сточных
водах, • нитратов в почвах и пищевых продуктах,
• -Для определения некоторых органических
веществ.
19.
Потенциометрическое титрованиеСущность метода – измерение потенциала
индикаторного электрода (ЭДС) в ходе титрования
для последующего определения конечной точки
титрования (КТТ).
Для этого необходимо:
• Построить кривую титрования.
• Определить на кривой скачок потенциала.
• По скачку определить объем титранта в точке
эквивалентности.
• Рассчитать концентрацию определяемого иона по
закону эквивалентов.
19
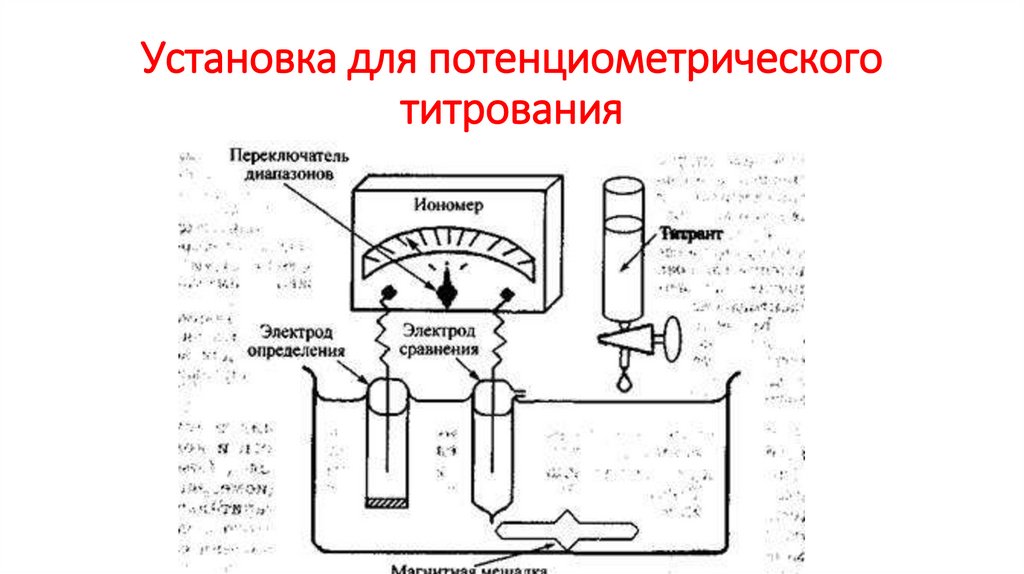
20.
Установка для потенциометрическоготитрования
21.
Автотитраторы(современные
установки)
МККОС. Л.К. № 9. Попова Людмила Федоровна
21
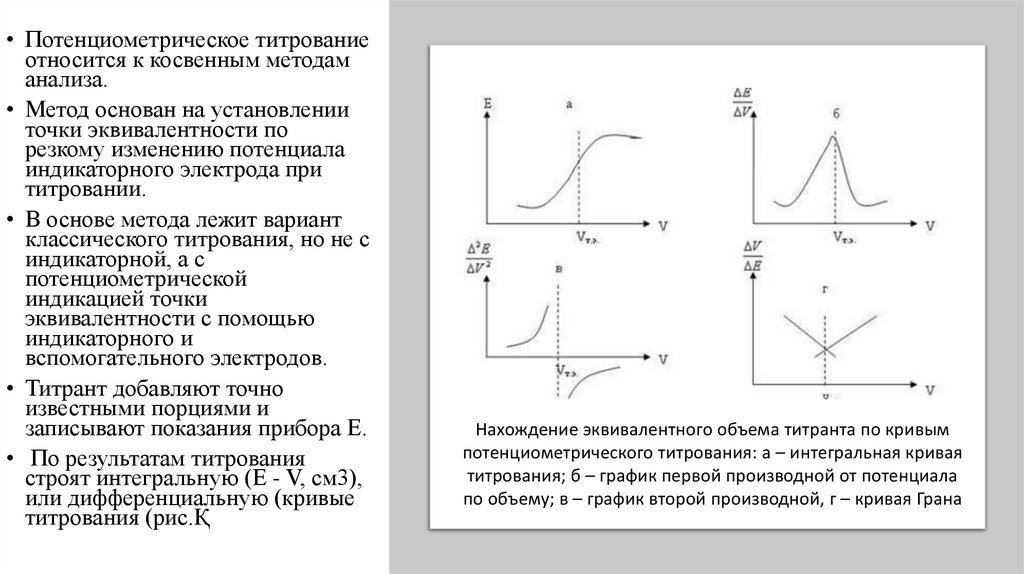
22.
• Потенциометрическое титрованиеотносится к косвенным методам
анализа.
• Метод основан на установлении
точки эквивалентности по
резкому изменению потенциала
индикаторного электрода при
титровании.
• В основе метода лежит вариант
классического титрования, но не с
индикаторной, а с
потенциометрической
индикацией точки
эквивалентности с помощью
индикаторного и
вспомогательного электродов.
• Титрант добавляют точно
известными порциями и
записывают показания прибора Е.
• По результатам титрования
строят интегральную (Е - V, см3),
или дифференциальную (кривые
титрования (рис.Қ
Нахождение эквивалентного объема титранта по кривым
потенциометрического титрования: а – интегральная кривая
титрования; б – график первой производной от потенциала
по объему; в – график второй производной, г – кривая Грана
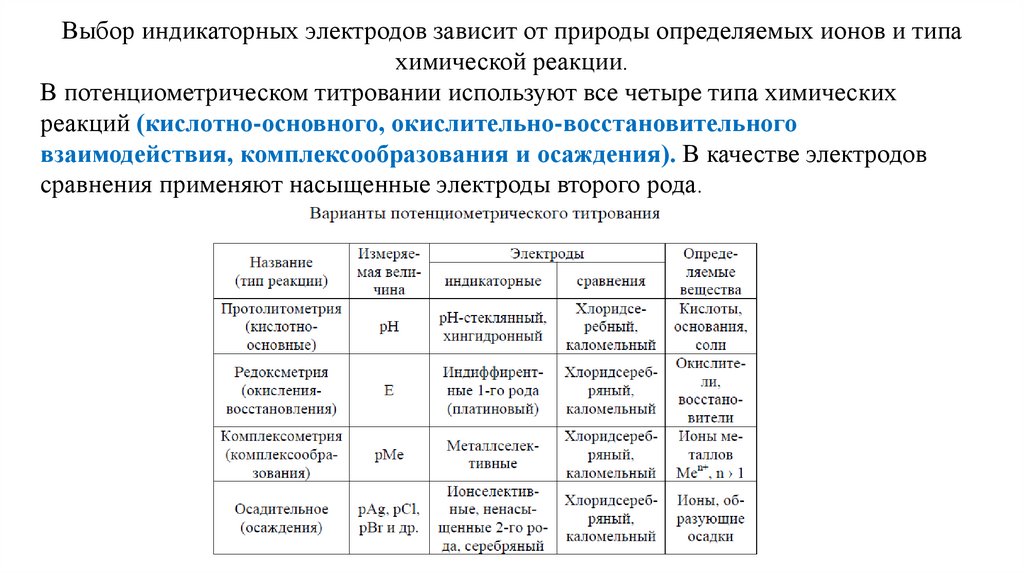
23.
Выбор индикаторных электродов зависит от природы определяемых ионов и типахимической реакции.
В потенциометрическом титровании используют все четыре типа химических
реакций (кислотно-основного, окислительно-восстановительного
взаимодействия, комплексообразования и осаждения). В качестве электродов
сравнения применяют насыщенные электроды второго рода.
















 Химия
Химия








