Похожие презентации:
Электрохимические методы анализа: потенциометрия. Потенциометрическое титрование
1. Тема: Электрохимические методы анализа: потенциометрия. Потенциометрическое титрование
Южно-Казахстанская государственная фармацевтическая академияКафедра фармацевтической и токсикологической химии
Тема: Электрохимические методы анализа:
потенциометрия. Потенциометрическое титрование
Выполнил: Толеш Н
Группа: 302 ТФПК
Приняла: Махова Е. Г.
Шымкент, 2017 г
2. План
І. ВведениеІІ. Оснавная часть
а) Потенциометрия
б) Потенциометрическое титрование
ІІІ. Заключение
IV.Литература
3. Потенциометрия
Основана на измерении потенциала ячейки , т.е.разности потенциалов между двумя электродами
(индикаторным электродом и электродом сравнения)
в отсутствие тока (I = 0) во внешней цепи.
Подразделяется на методы:
1.Прямые ( напр. рН-метрия);
2.Косвенные (потенциометрическое титрование)
4.
5.
Ме0 ↔ Меn + neEx = E0 + RT/nF ln cMe (1)
Уравнение Нернста
аМе = f сМе (2)
(1) Ех – потенциал металлического
электрода при данной концентрации
ионов металла (Ме) в растворе;
Е0 – стандартный (нормальный)
электродный потенциал или потенциал
этого же электрода в растворе с
концентрацией ионов, равной 1 моль/л,;
сМе – концентрация ионов металла в
растворе, моль/л;
R – универсальная газовая постоянная, R
= 8,314 Дж/моль·К;
Т – абсолютная температура, К
F- число Фарадея, F= 9,65·104 n – заряд
ионов металла.
(2) f – коэффициент активности
иона (справочные данные).
6.
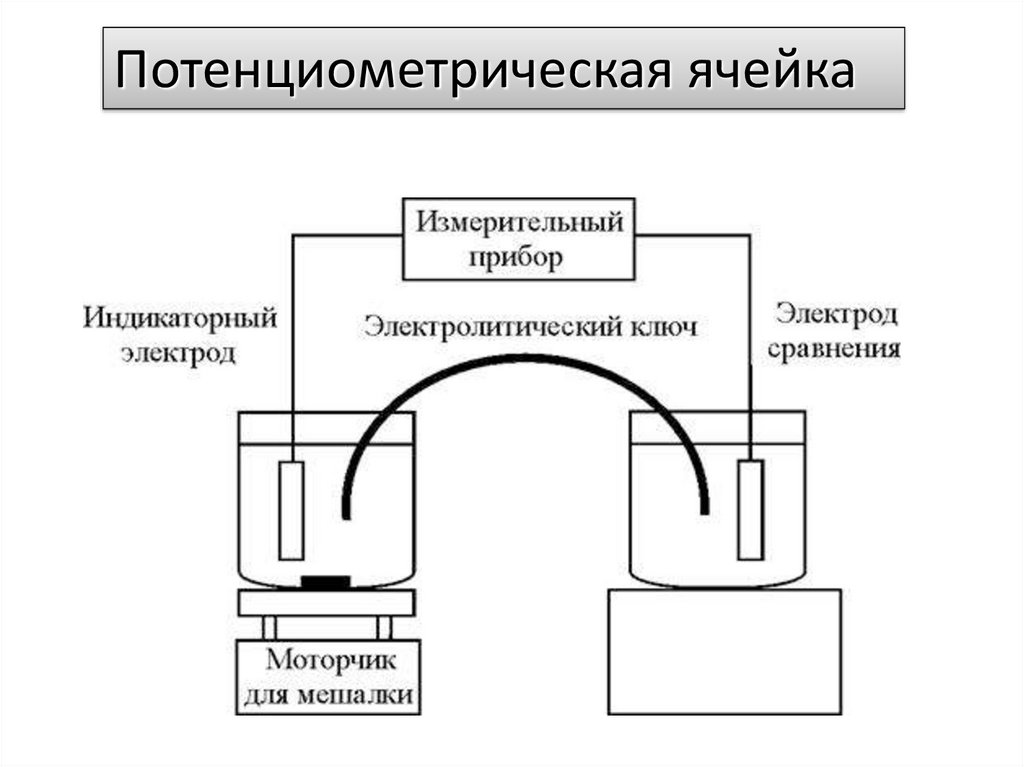
Потенциометрическая ячейка7.
Е = (Еинд - Еср) + Еjправый
левый
где Еинд – потенциал индикаторного электрода; Еср –
потенциал электрода сравнения; Еj – потенциал
жидкостного соединения.
8.
Электроды потенциометрического метода анализаЭлектрод первого рода – металл, погруженный в раствор
соли этого же металла;
Электрод второго рода – металл, покрытый слоем его
труднорастворимой соли.
В потенциометрическом анализе из
электродов составляется гальванический
элемент, э.д.с. которого контролируется в
ходе анализа.
Гальванический элемент образуют два
электрода: индикаторный электрод и
электрод сравнения.
9.
Индикаторный электрод1) Классические электроды:
Класс 0. Инертные металлы;
Класс 1. Обратимые: металл /ион металла;
Класс 2. Обратимые: металл в равновесии с насыщенным
раствором соли иона металла и избытком аниона Х+;
Класс 3. Обратимые: металл в равновесии с двумя
малорастворимыми солями с общим анионом (или растворимым
комплексом иона второго металла) и избытком второго катиона;
2) Мембранные (ион-селективные)
электроды.
10.
Должны удовлетворятьследующим требованиям:
В качестве индикаторных
электродов используют:
равновесный потенциал
электрода должен быть
o
воспроизводимым и
устанавливаться быстро, иначе o
анализ потребует много времени; o
обратимость: потенциал должен
изменяться с изменением
o
концентрации иона;
o
химическая устойчивость: не
должен реагировать с другими
компонентами, находящимися в
растворе.
водородный электрод;
хингидронный электрод;
ионоселективные
мембранные электроды;
стеклянный электрод;
металлические электроды 1-го
и 2-го рода (изготавливают из
Ag, Hg, Cd).
11.
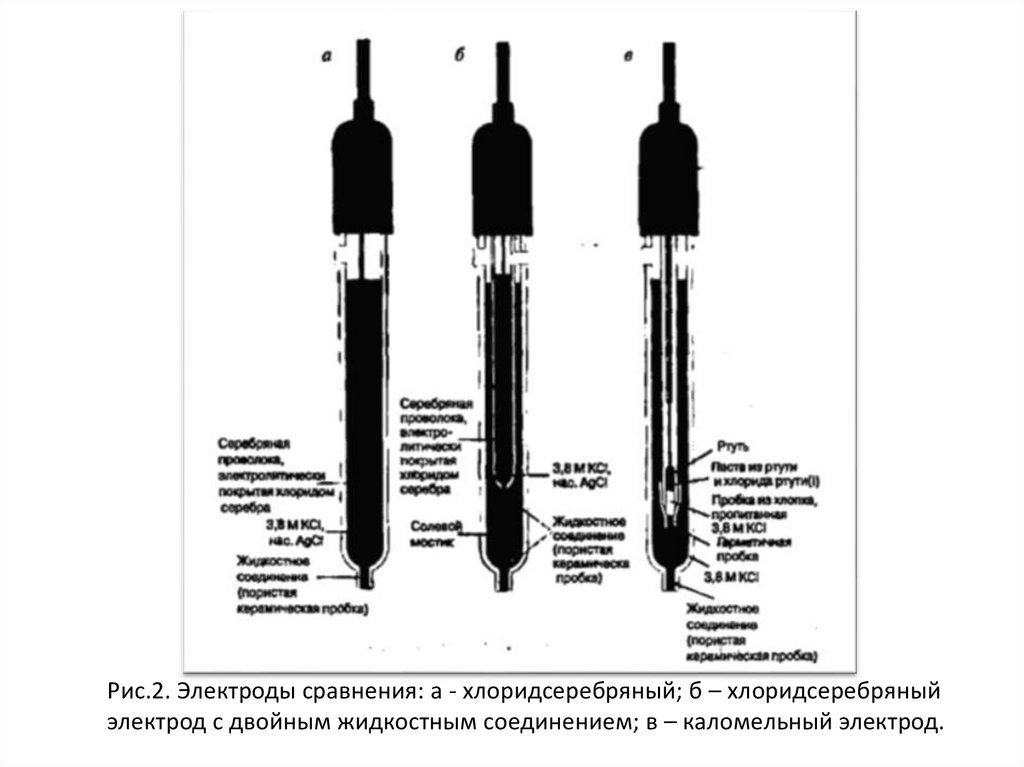
Электроды сравненияХлоридсеребряный электрод (Ag│AgСl, KCl)
AgСl (тв.) + е ↔ Ag(тв.) + Сl Каломельный электрод (Hg│Hg2Cl2, KCl)
Hg2Cl2(тв.) + 2е ↔ 2 Hg(ж.) + 2 Cl-
12.
Рис.2. Электроды сравнения: а - хлоридсеребряный; б – хлоридсеребряныйэлектрод с двойным жидкостным соединением; в – каломельный электрод.
13.
14.
Важными требованиями кэлектроду сравнения являются:
обратимость,
воспроизводимость и стабильность
во времени.
15.
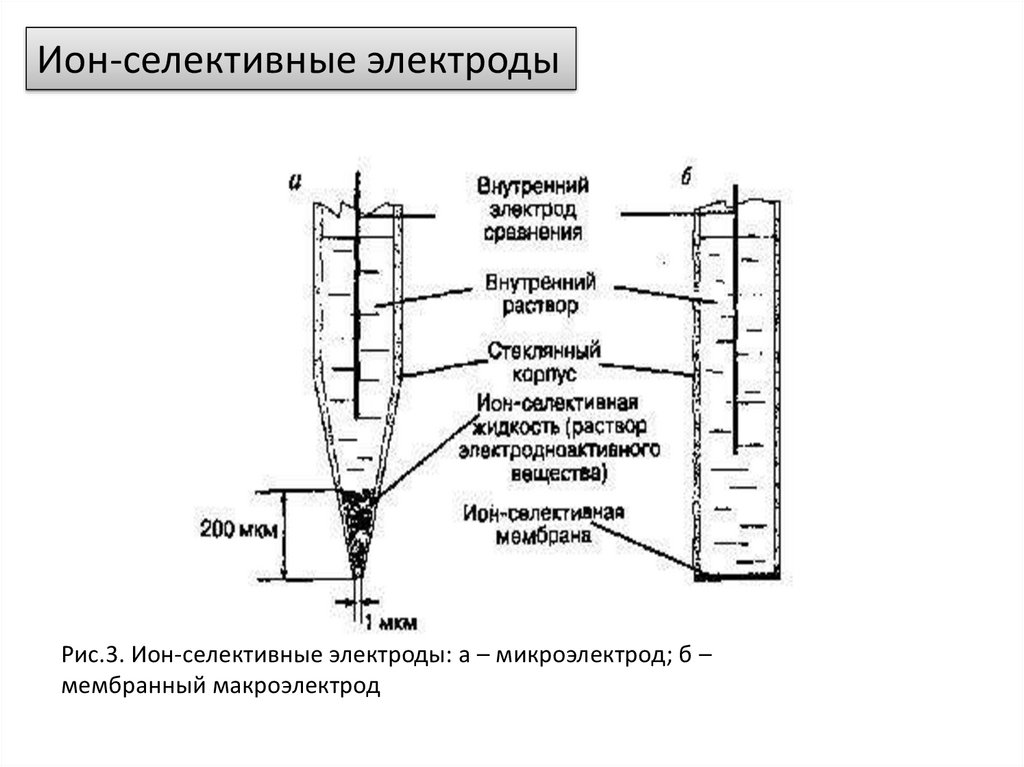
Ион-селективные электродыРис.3. Ион-селективные электроды: а – микроэлектрод; б –
мембранный макроэлектрод
16.
∆φ1 Δφ2 Δφj Ем ∆ φ3 Hg│Hg2Cl2, KCl (насыщ.)║солевой мостик║проба│мембрана│внутр. р-р,AgCl│ Ag
Е = (Δφ1 + Δφ2 + Δφ3) + Δφj + Ем = Δφ0 + Δφj + Ем
где Δφ0 – потенциал электрода сравнения, не зависящий от
концентрации определяемого иона;
Δφj – потенциал жидкостного соединения;
Ем – мембранный потенциал (описывает поведение ионселективного мембранного электрода).
Потенциометрический коэффициент селективности (KпотА,В)
17.
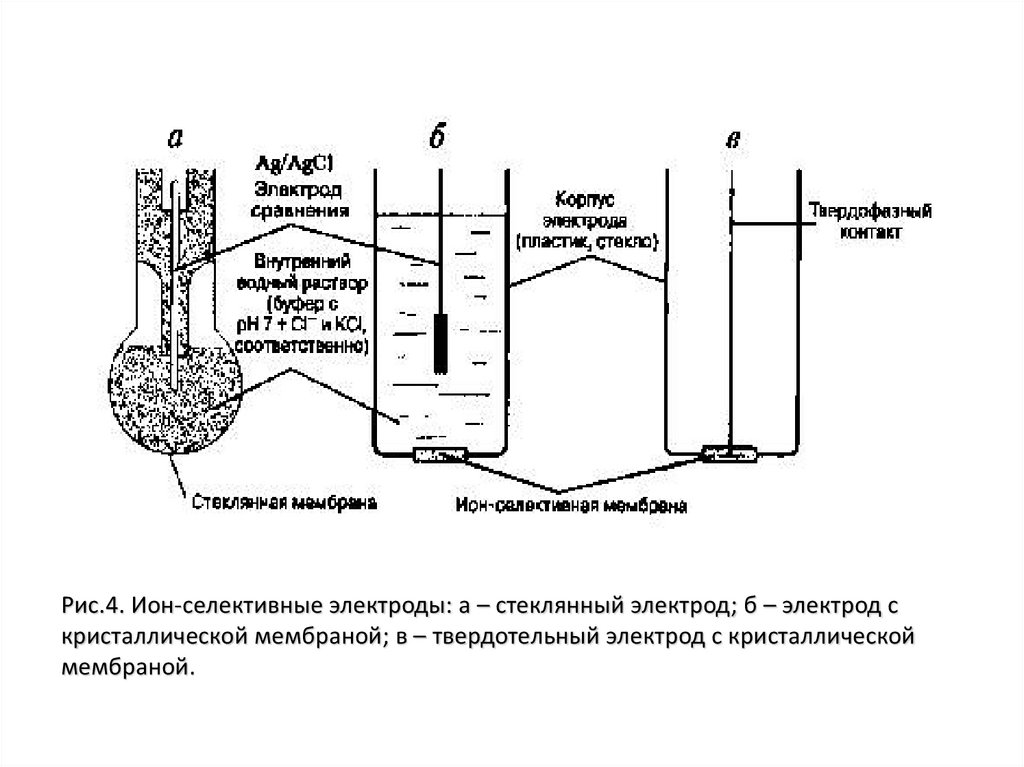
Типы ион-селективных электродов.Первичные ион-селективные электроды:
а) электроды со стеклянной мембраной;
б) кристаллические (твердофазные) мембранные электроды;
в) электроды с жидкой мембраной:
г) жидкие ионообменные мембранные электроды;
д) электроды с жидкой мембраной с нейтральными носителями.
Сложные или многомембранные ион-селективные электроды:
молекулярно-чувствительные устройства, такие, как
газочувствительные или ферментные электроды.
Ион-селективные полевые транзисторы ИСТП:
Эти типы электродов – гибриды ион-селективных электродов и
полевых транзисторов из оксидов металлов.
18.
Рис.4. Ион-селективные электроды: а – стеклянный электрод; б – электрод скристаллической мембраной; в – твердотельный электрод с кристаллической
мембраной.
19.
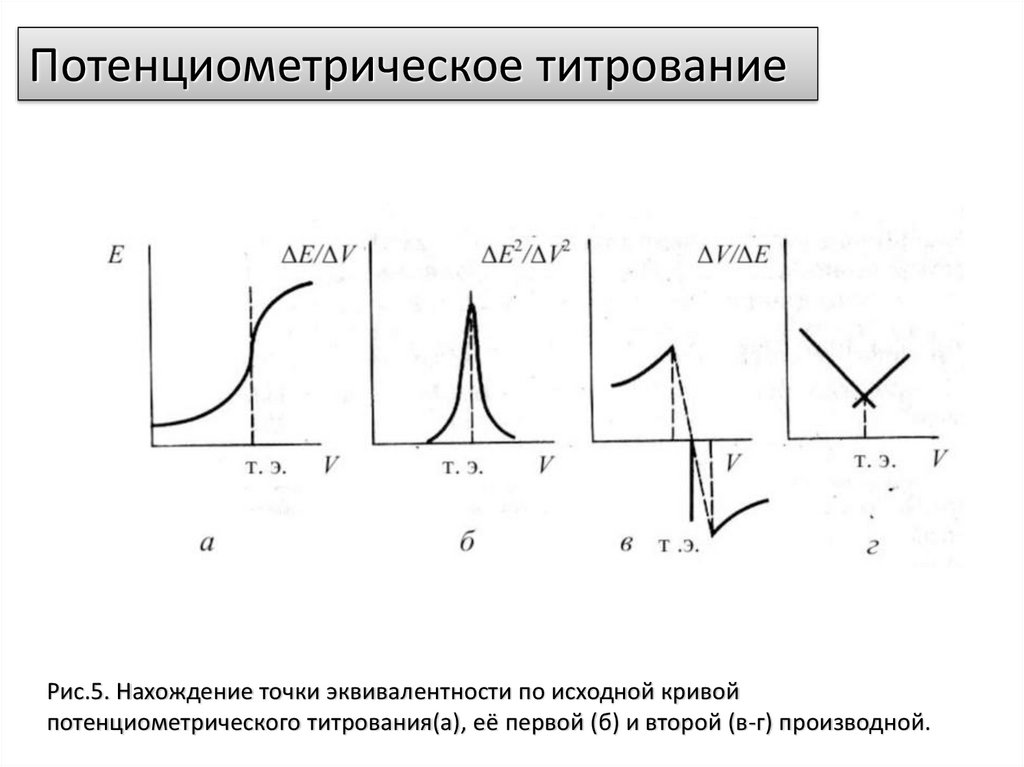
Потенциометрическое титрованиеРис.5. Нахождение точки эквивалентности по исходной кривой
потенциометрического титрования(а), её первой (б) и второй (в-г) производной.
20.
Преимуществами методапотенциометрического титрования по
сравнению с обычным титрованием являются
возможность:
титровать окрашенные растворы, когда цветные
индикаторы неприменимы;
определять нескольких веществ в смеси, не
прибегая к их предварительному разделению.
21.
Приборы в потенциометрии22. Электрохимические методы анализа — группа методов количественного химического анализа, основанные на использовании электролиза.
ЗаключениеЭлектрохимические методы анализа — группа
методов количественного химического анализа, основанные на
использовании
электролиза.
Разновидностями
метода
являются
электрогравиметрический анализ (электроанализ), внутренний
электролиз,
контактный
обмен
металлов
(цементация), полярографический анализ, кулонометрия и др. В
частности, электрогравиметрический анализ основан на
взвешивании вещества, выделяющемся на одном из
электродов. Метод позволяет не только проводить
количественные определения меди, никеля, свинца и др., но и
разделять
смеси
веществ.
23. 1. Арзамасцев А.П. Фармакопейный анализ – М.: Медицина, 1971. 2. Беликов В.Г.Фармацевтическая химия. В 2 частях. Часть 1. 3.
Литература1. Арзамасцев А.П. Фармакопейный анализ – М.: Медицина, 1971.
2. Беликов В.Г.Фармацевтическая химия. В 2 частях. Часть 1.
3. Общая фармацевтическая химия: Учеб. для фармац. ин-тов и
фак. мед. ин-тов. — М.: Высш. шк., 1993. - 432 с.
4. Глущенко Н. Н. Фармацевтическая химия: Учебник для студ.
сред. проф. учеб. заведений / Н. Н. Глущенко, Т. В. Плетенева, В.
А. Попков; Под ред. Т. В. Плетеневой. — М.: Издательский центр
"Академия", 2004. — 384 с
5. Мелентьева Г. А., Антонова Л. А. Фармацевтическая химия. —
М.: Медицина, 1985.— 480 с.
6. Кравченюк Л.П. Полярография лекарственных препаратов. – К.:
Вища школа, 1976. 232 с Фармацевтическая химия: Учеб. пособие
/ Под ред. Л.П.Арзамасцева. – М.: ГЭОТАР-МЕД, 2004. - 640 с.


















 Химия
Химия








