Похожие презентации:
Понятие о кислотах
1.
Что насобъединяет?
2.
ПОНЯТИЕ ОКИСЛОТАХ
3.
ЦЕЛЬ:Сформировать знания о кислотах, их
составе, способах классификации и
названия представителей класса кислот;
умение экспериментально определять
кислоты среди других веществ.
4.
СТРАНА КИСЛОТГород Информаций
5.
Серная кислота6.
Хлороводородная(соляная) кислота
7.
Азотная кислота8.
Борная кислотаH3BO3
9.
Кремниевая кислотаH2SiO3
10.
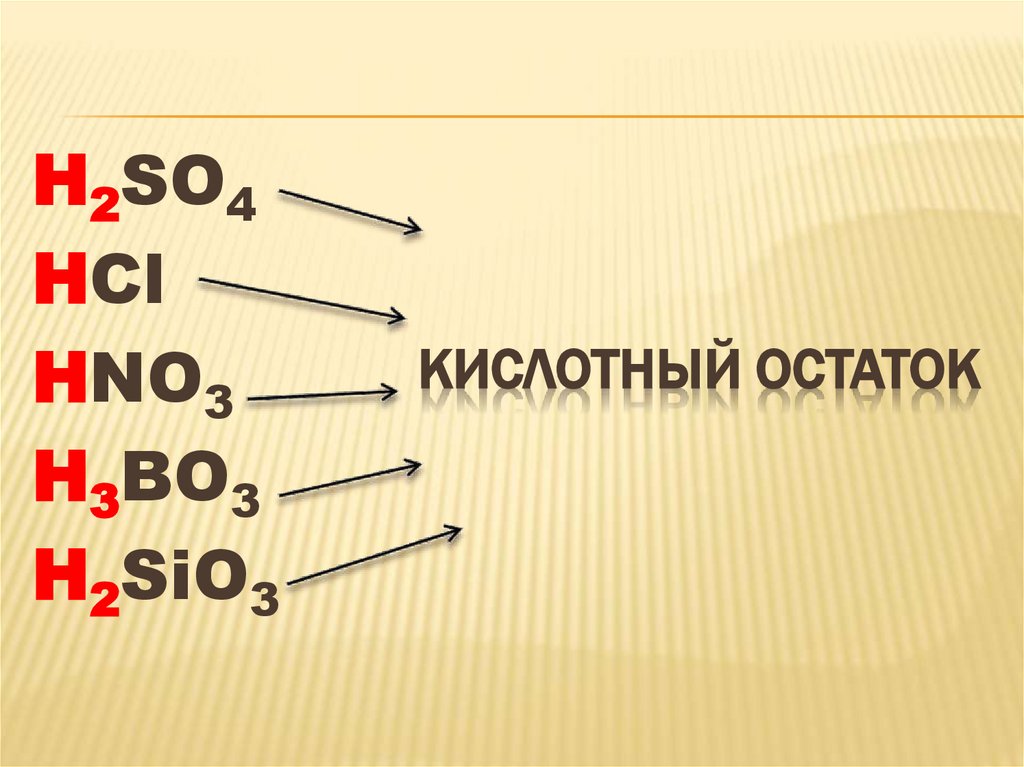
H2SO4HCl
HNO3
H3BO3
H2SiO3
КИСЛОТНЫЙ ОСТАТОК
11.
КИСЛОТЫ - СЛОЖНЫЕВЕЩЕСТВА, МОЛЕКУЛЫ
КОТОРЫХ СОСТОЯТ ИЗ
АТОМОВ ВОДОРОДА И
КИСЛОТНЫХ ОСТАТКОВ.
12.
H2SO4HCl
HNO3
H3BO3
H2SiO3
ВАЛЕНТНОСТЬ
КИСЛОТНОГО ОСТАТКА
РАВНА ЧИСЛУ АТОМОВ
ВОДОРОДА В СОСТАВЕ
КИСЛОТЫ
13.
СТРАНА КИСЛОТГород Классификаций
14.
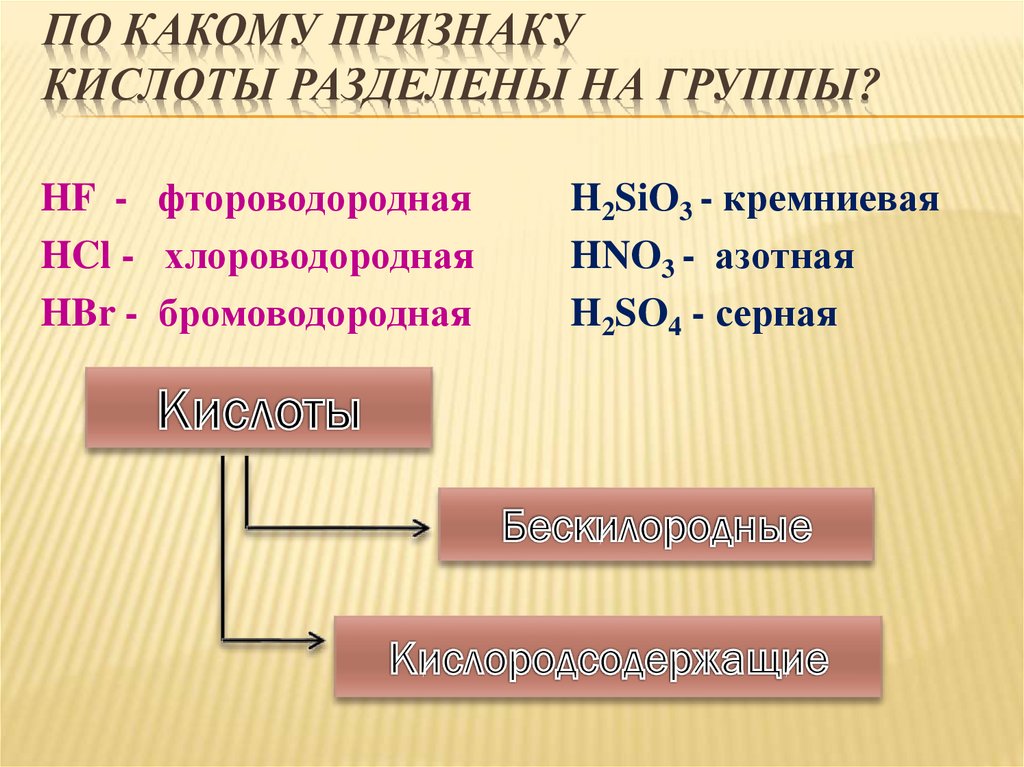
ПО КАКОМУ ПРИЗНАКУКИСЛОТЫ РАЗДЕЛЕНЫ НА ГРУППЫ?
HF - фтороводородная
HCl - хлороводородная
HBr - бромоводородная
H2SiO3 - кремниевая
HNO3 - азотная
H2SO4 - серная
15.
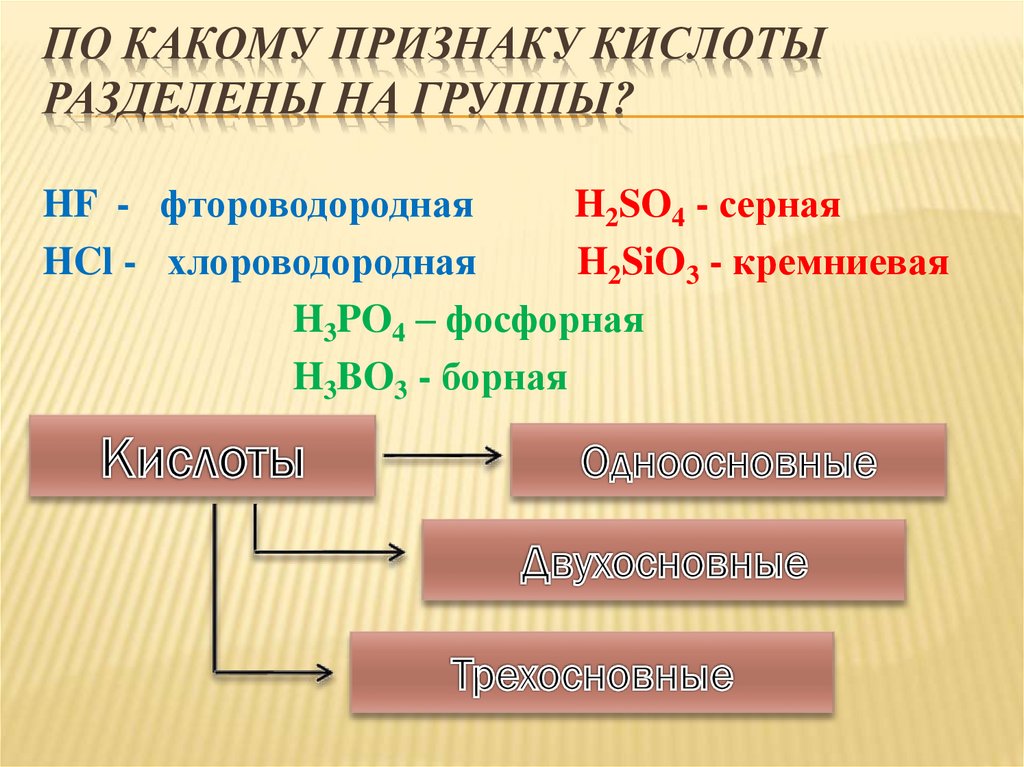
ПО КАКОМУ ПРИЗНАКУ КИСЛОТЫРАЗДЕЛЕНЫ НА ГРУППЫ?
HF - фтороводородная
H2SO4 - серная
HCl - хлороводородная
H2SiO3 - кремниевая
H3PO4 – фосфорная
H3BO3 - борная
16.
H2SO4HCl
HNO3
H3BO3
H2SiO3
17.
КЛАССИФИЦИРУЙТЕ КИСЛОТЫHNO2
H2CO3
H2S
H2SO3
HAlO2
H3PO4
HI
а) бескислородные,
кислородсодержащие
б) одноосновные, двухосновные,
трехосновные
18.
ПРОВЕРЯЕМ:1. Бескислородные: H2S, HI
2. Кислородсодержащие: HNO2, H2CO3,
H2SO3, HAlO2, H3PO4
1. Одноосновные: HNO2, HAlO2, HI
2. Двухосновные: H2CO3, H2S, H2SO3
3. Трехосновные: H3PO4
19.
СТРАНА КИСЛОТГород Номенклатурный
20.
НАЗВАНИЯ КИСЛОТ:HCl – хлороводородная
HBr - бромоводородная
HNO3 – азотная
HNO2 - азотистая
H2SO4 – серная
H2SO3 - сернистая
21.
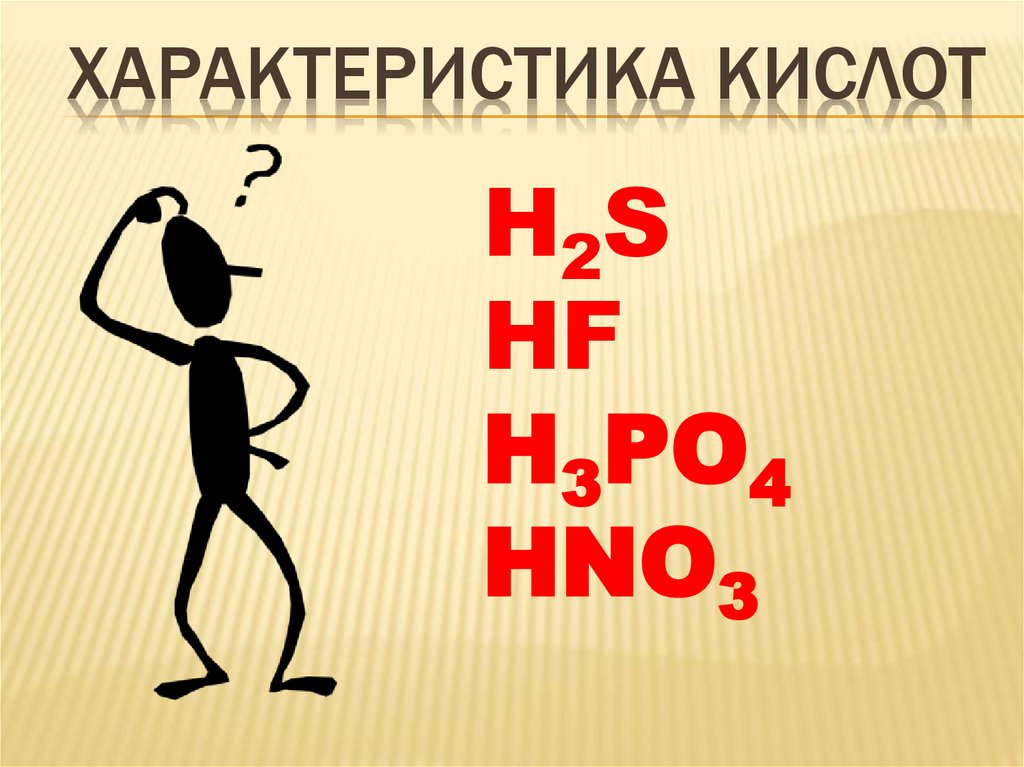
ХАРАКТЕРИСТИКА КИСЛОТH2S
HF
H3PO4
HNO3
22.
ПРОВЕРЯЕМ:HF - фтороводородная,
бескислородная, одноосновная.
H3PO4 - фосфорная,
кислородсодержащая, трехосновная.
HNO3 - азотная,
кислородсодержащая, одноосновная.
23.
СТРАНА КИСЛОТГород Экспериментов
24.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИВнимание! Работать с кислотами необходимо
аккуратно, так как можно получить ожог или
отравление. При попадании кислоты на кожу надо
смыть ее струей воды , а затем обработать
поврежденную поверхность 2%-м раствором питьевой
соды.
25.
Индикаторы – органические вещества,которые изменяют свою окраску в
присутствии кислот и некоторых других
веществ.
26.
ЛАБОРАТОРНЫЙ ОПЫТДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
Задание 1:
проведите опыт, согласно инструкции;
сделайте вывод о распознавании кислот
среди других растворов.
Задание 2:
Определите, в какой из двух предложенных
пробирок находится раствор кислоты.
27.
ИГРА «НАЙДИ КИСЛОТЫ»Среди формул различных соединений
«спрятаны» формулы кислот. Необходимо
отыскать эти формулы.
H2O, SO, HBr, Na2CO3, Mg, Ba,
H2CO3, Ca, NaOH, H3PO4, P2O5,
PH3, NaCl, CO2, HCl, K2O,
H2SiO3, Ag, H2SO4
28.
ИГРА «ТРЕТИЙ ЛИШНИЙ»В каждом ряду найдите лишнюю
формулу, ответ мотивируйте:
H2SO4, SO3, H3PO4.
HCl, H2SO4, H3PO4
H2SO3, H2SiO3, H2SO4
HNO3, H2SO4, H2CO3
























 Химия
Химия