Похожие презентации:
Кислоты. Классификация кислот
1.
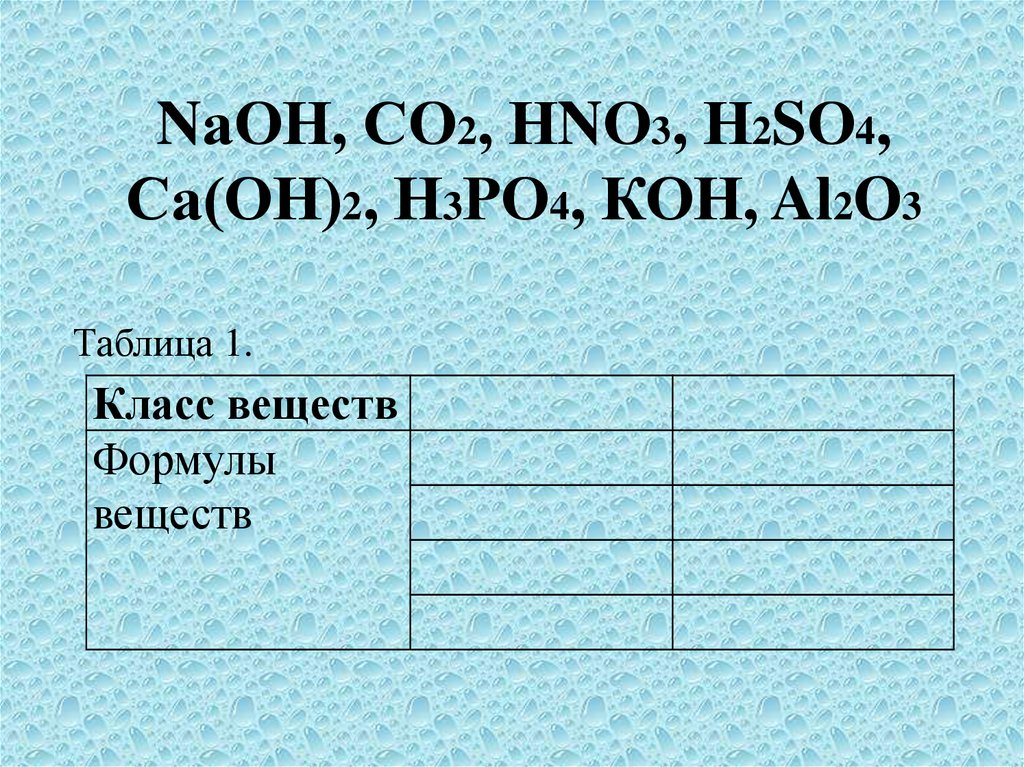
NаОН, СО2, НNО3, Н2SО4,Са(ОН)2, Н3РО4, КОН, Al2O3
Таблица 1.
Класс веществ
Формулы
веществ
2.
НNО3, Н2SО4, Н3РО4Таблица 1.
Класс веществ Оксиды
Формулы
СО2
веществ
Al2O3
Основания
NаОН
Са(ОН)2
КОН
3.
Крапиващавель
4.
Кислоты5.
HCl - хлороводородная(соляная)H2S - сероводородная
HNO3 - азотная
HNO2 - азотистая
H2SO4 - серная
H2SO3 - сернистая
H2CO3 - угольная
H2SiO3- кремниевая
H3PO4 - фосфорная
Кислоты –это сложные вещества, молекулы которых
состоят из атомов водорода и кислотного остатка.
6.
Определение степени окисленияэлементов
H2SO4
7.
Классификация кислотПо какому признаку
кислоты разделены на группы
HF - фтороводородная
HCl - хлороводородная
HBr - бромоводородная
HI - йодоводородная
H2S - сероводородная
HNO3 - азотная
HNO2 - азотистая
HClO4 - хлорная
H2SO4 - серная
H2SO3 - сернистая
H2CO3 - угольная
H2SiO3- кремниевая
H3PO4 - фосфорная
H3BO3 - борная
8.
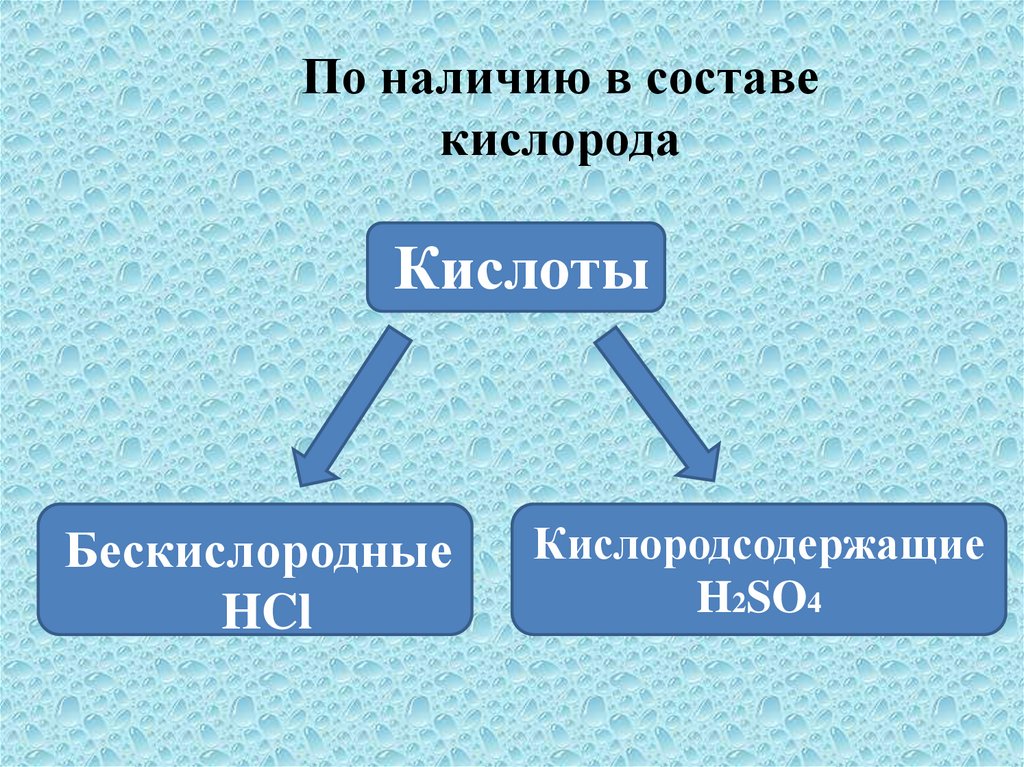
По наличию в составекислорода
Кислоты
Бескислородные
HCl
Кислородсодержащие
H2SO4
9.
По какому признакукислоты разделены на группы
H3PO4 - фосфорная
HF - фтороводородная
H3BO3 - борная
HCl - хлороводородная
HBr - бромоводородная
HI - йодоводородная
HNO3 - азотная
HNO2 - азотистая
H2S - сероводородная
HClO4 - хлорная
H SO - серная
2
4
H2SO3 - сернистая
H2CO3 - угольная
H2SiO3 - кремниевая
10.
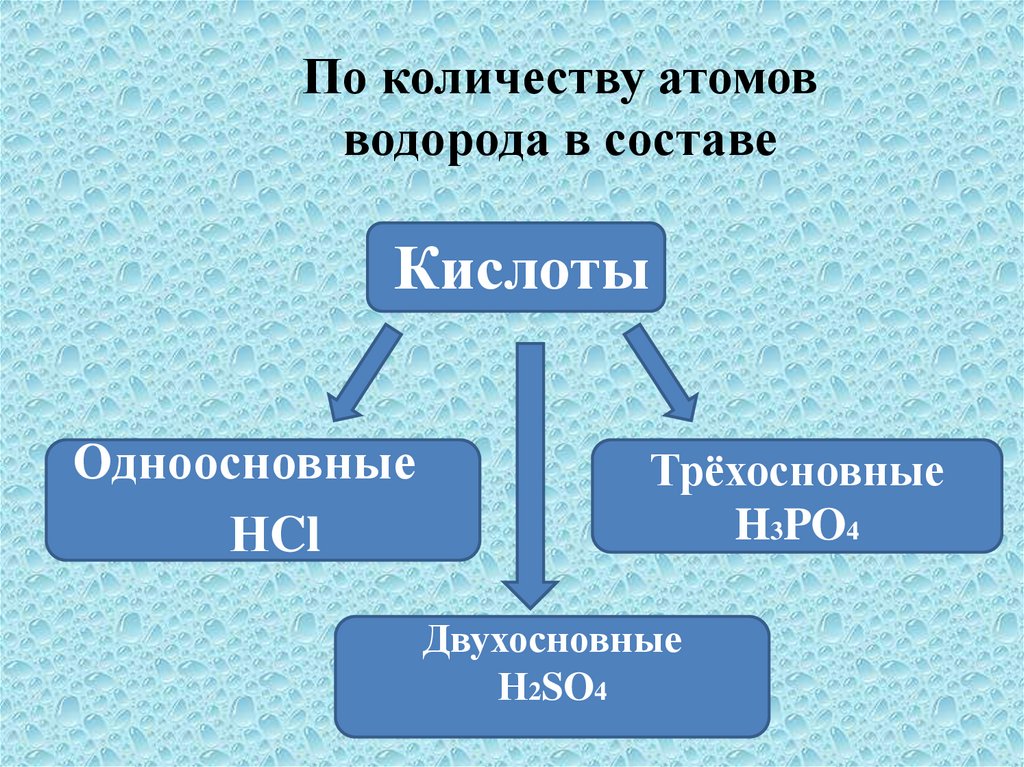
По количеству атомовводорода в составе
Кислоты
Одноосновные
НCl
Трёхосновные
H3PO4
Двухосновные
Н2SO4
11.
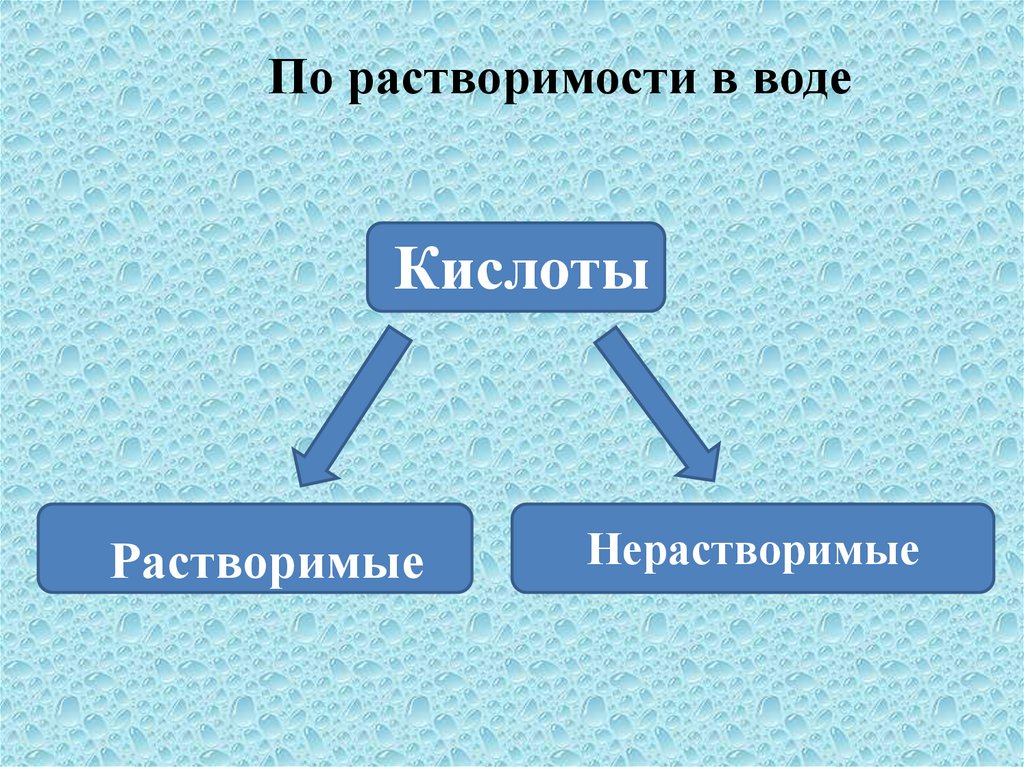
По растворимости в водеКислоты
Растворимые
Нерастворимые
12.
Физические свойства кислот• По агрегатному
состоянию:
- Газообразные (HCl, H2S)
- Жидкие (HNO3, H2SO4)
- Твердые (H3PO4, H2SiO3)
13.
Серная кислотаБесцветная жидкость, вязкая как масло, тяжелее
воды. Растворять кислоту в воде необходимо
очень осторожно, вливать кислоту в воду тонкой
струйкой, а не наоборот, т.к. при смешивании
кислоты и воды выделяется большое количество
теплоты и вода может просто вскипеть и
выплеснуться на руки, лицо, одежду. Серная
кислота обугливает древесину, бумагу, кожу,
ткани.
14.
15.
16.
Угольная и сернистая кислоты - H2CO3 и H2SO3 всвободном виде не существуют, т.к. они разлагаются
на воду и соответствующий оксид.
H2CO3
H2SO3
CO2 + H2O
SO2 + H2O
17.
Правила техники безопасности приработе с кислотами
Не нюхать!
Не пробовать!
Не разливать!
О любых
проблемах
сообщать
учителю!
18.
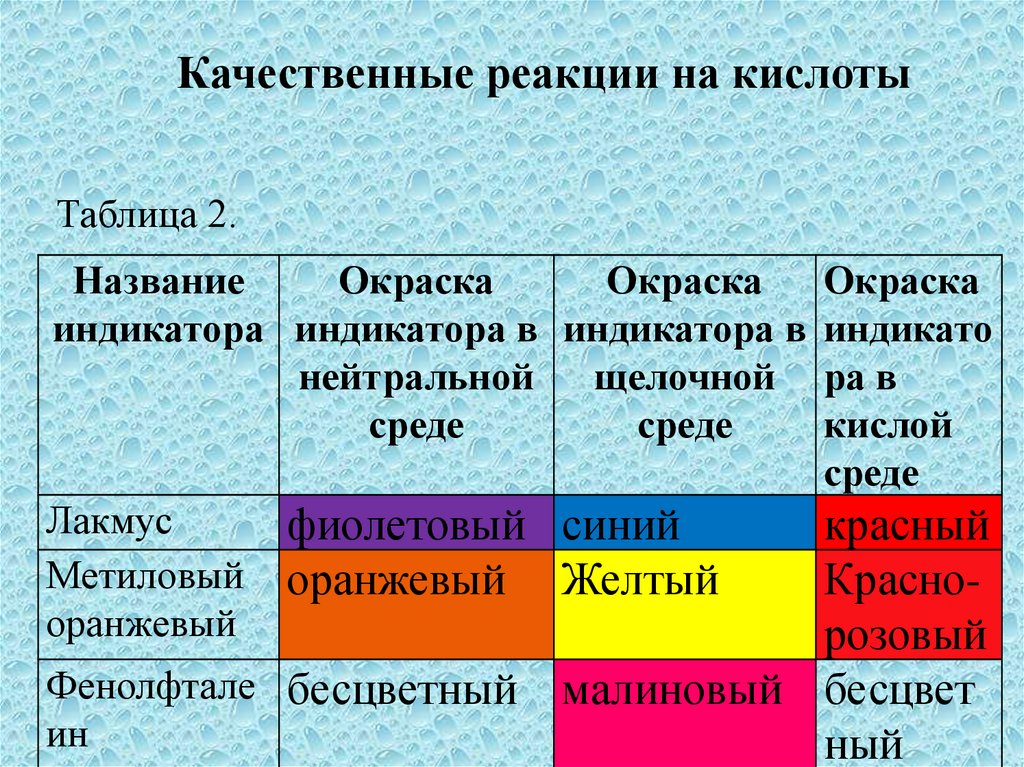
Качественные реакции на кислотыТаблица 2.
Название
Окраска
Окраска
индикатора индикатора в индикатора
нейтральной в щелочной
среде
среде
19.
Качественные реакции на кислотыТаблица 2.
Название
Окраска
Окраска
индикатора индикатора в индикатора
нейтральной в щелочной
среде
среде
Лакмус
фиолетовый синий
Метиловый оранжевый Желтый
оранжевый
Фенолфтале бесцветный малиновый
ин
20.
Качественные реакции на кислотыТаблица 2.
Название
Окраска
Окраска
Окраска
индикатора индикатора в индикатора в индикато
нейтральной
щелочной ра в
среде
среде
кислой
среде
Лакмус
фиолетовый синий
красный
Метиловый оранжевый Желтый
Краснооранжевый
розовый
Фенолфтале бесцветный
ин
малиновый бесцвет
ный
21.
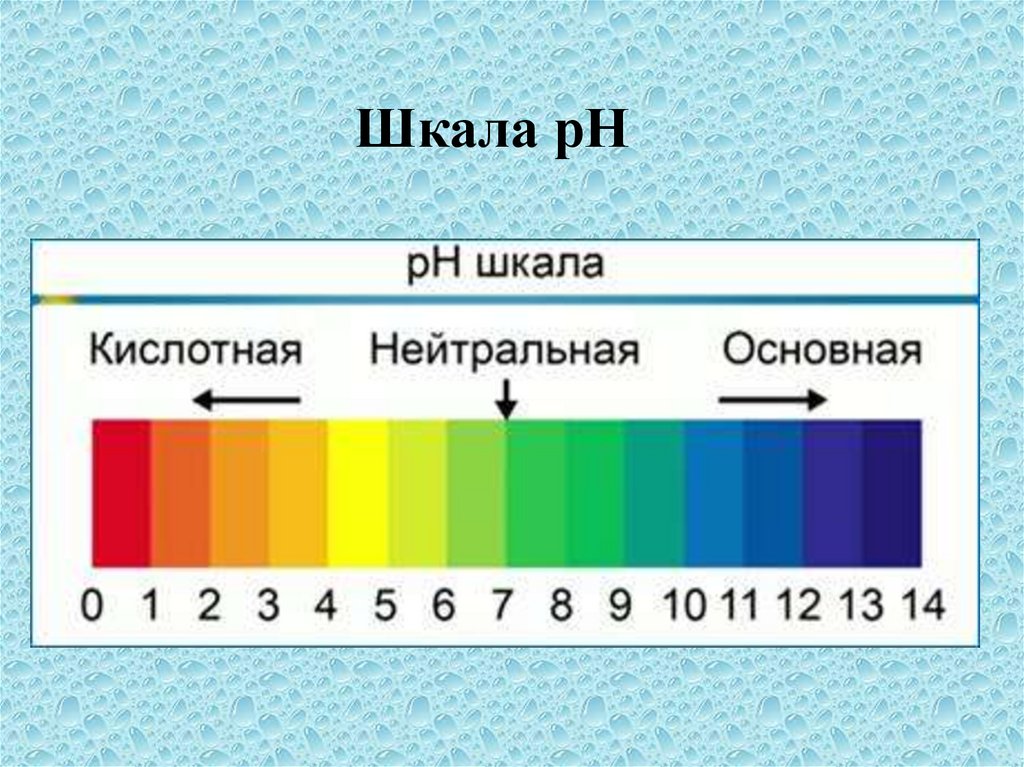
Шкала рН22.
Найти степень окисления всех элементов исоставить формулы соответствующих
оксидов
HNO3 HNO2 H2SO4 H2SO3 H2CO3 H2SiO3H3PO4 -
23.
Домашнее задание§21, выучить формулы и
названия кислот, № 3,4(б)
















 Химия
Химия








