Похожие презентации:
Характеристика химического элемента в свете периодического закона. Урок в 9 классе
1. Характеристика химического элемента в свете периодического закона
Урок в 9 классе2.
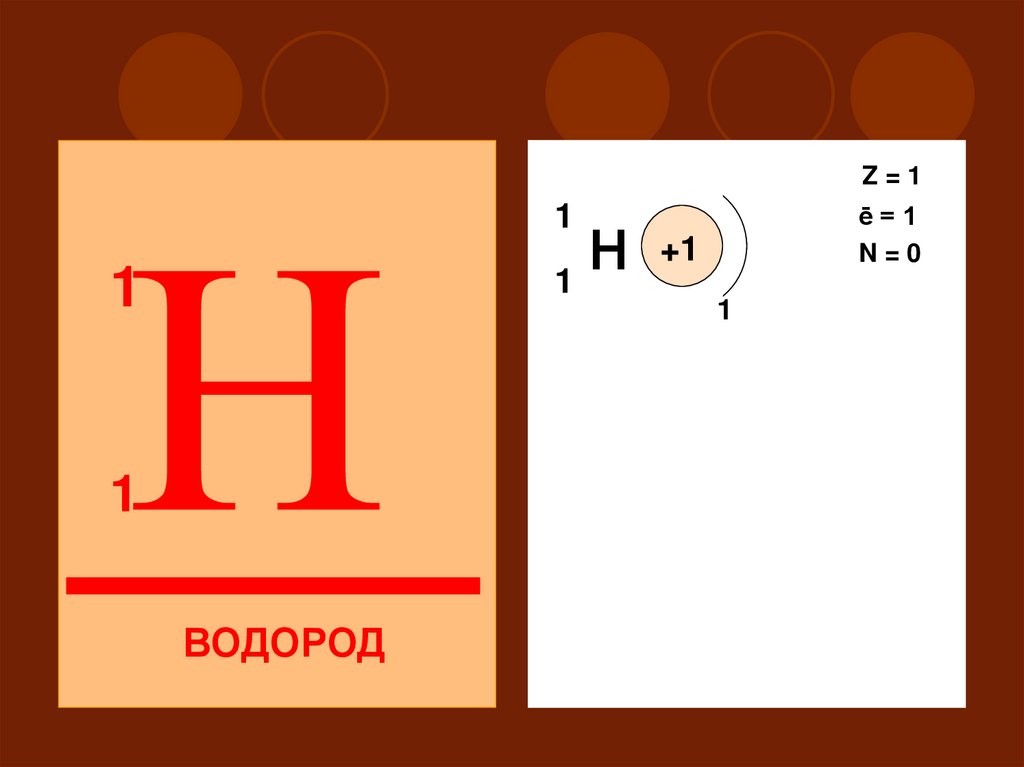
Z=1+1
н
1
ē=1
N=0
1
1
1
1
I
S
1
ВОДОРОД
3.
42
Не
гелий
Z=2
4
Не
2
2
+2
2
1
I
S
ē=2
N=2
4. Периоды
Период – горизонтальный ряд элементов,начинающийся щелочным металлом, и
заканчивающийся инертным газом.
Периоды бывают:
малые ( I – III )
большие ( IV – VII )
Номер периода показывает число
энергетических уровней в атоме,
заполненных электронами
5. Группы и подгруппы
Группа – вертикальный ряд элементовГруппа делится на 2 подгруппы:
главную и побочную
Главная подгруппа включает
S- и Р-элементы
Побочная подгруппа включает
d- и f- элементы
Номер группы показывает число электронов
на внешнем энергетическом уровне (для
элементов главных подгрупп) и высшую
валентность
6.
Радиус атомаПо подгруппе увеличивается
(увеличивается число заполненных
электронами энергетических уровней или
электронных слоёв)
По периоду – уменьшается (становится
плотнее электронная оболочка)
7. Окислительные (неметаллические) свойства
Увеличиваются по периодуУменьшаются по подгруппе
Самый сильный окислитель - F
8. Восстановительные (металлические) свойства
Уменьшаются по периодуУвеличиваются по подгруппе
Самый сильный восстановитель - Fr
9. Степень окисления – условный заряд атома, вычисленный исходя из предположения, что все соединения ионные.
Высшая степень окисленияопределяется по номеру группы
Низшая – считать число элементов до
конца периода
Исключения: F 0, -1 O -2, -1, 0 +2
Металлы имеют только положительную
степень окисления
Самый электроотрицательный элемент - F
10.
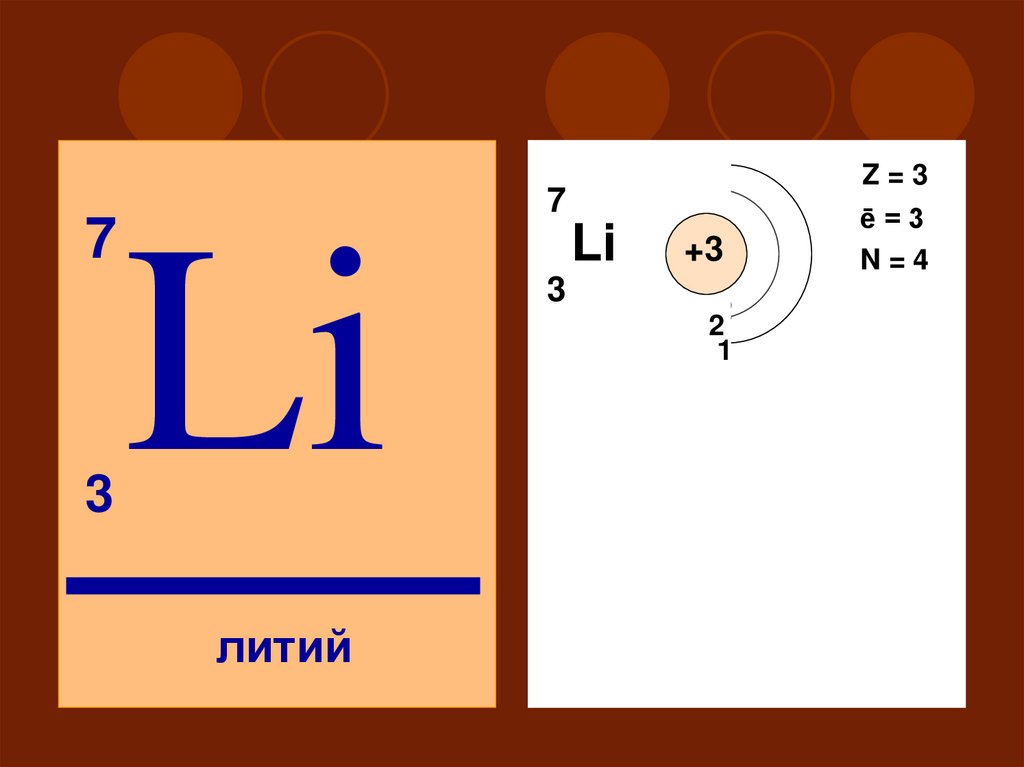
73
Z=3
7
Li
литий
Li
ē=3
N=4
+3
3
2
2
2
11
II
S
P
11.
12. Восстановительные (металлические) свойства: по подгруппе Н < Li < Na по периоду Li > Be Степень окисления от 0 до +1
Восстановительные (металлические)свойства:
по подгруппе Н < Li < Na
по периоду Li > Be
Степень окисления от 0 до +1
Высший оксид – Li2O – основной
Li2O + HCl =
Высший гидроксид – LiOH – oснование
LiOH + HCl =
13.
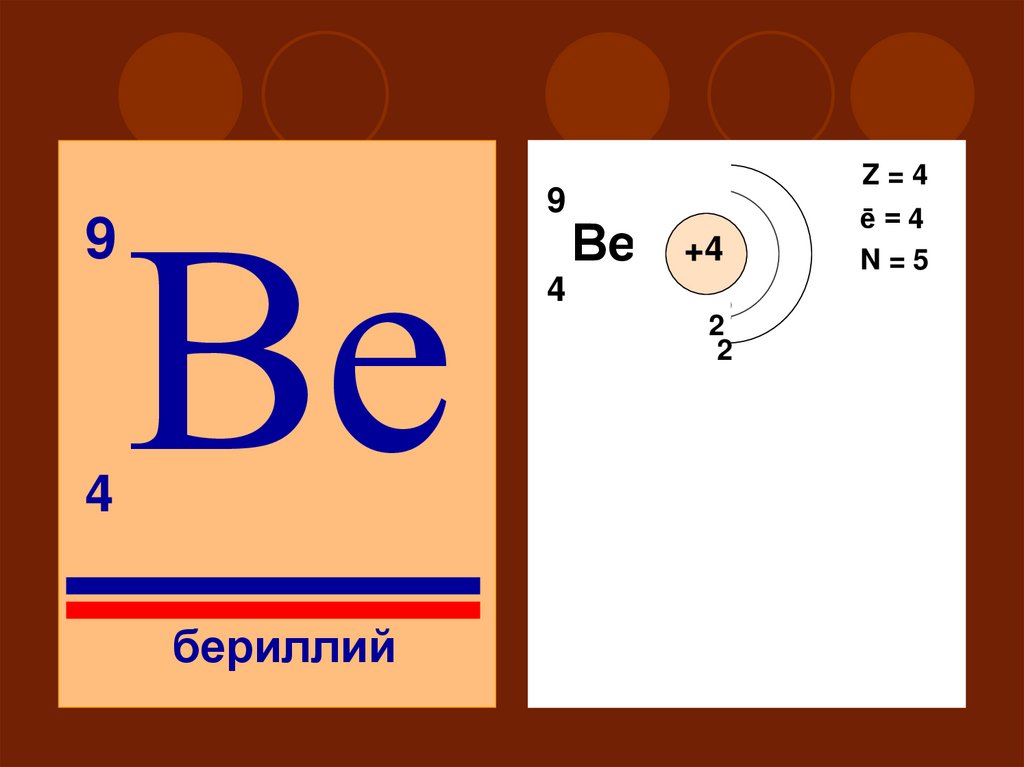
94
Ве
бериллий
9
Z=4
Ве
4
2
ē=4
N=5
+4
2
2
12
II
S
P
14.
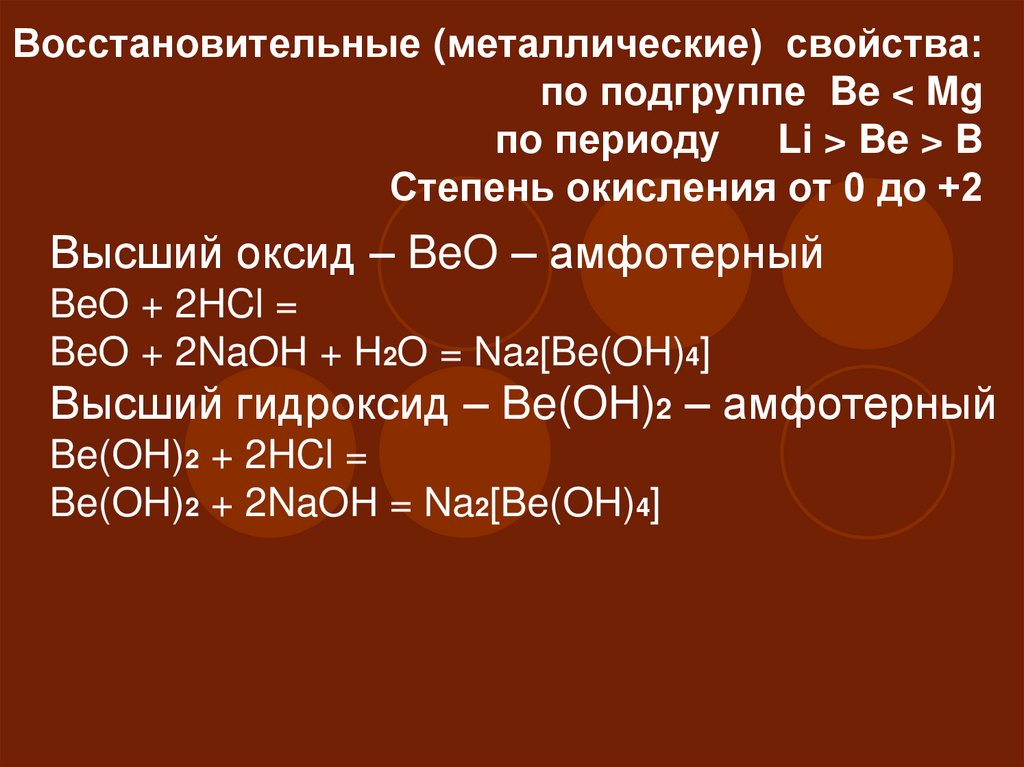
15. Восстановительные (металлические) свойства: по подгруппе Be < Mg по периоду Li > Be > B Степень окисления от 0 до +2
Восстановительные (металлические) свойства:по подгруппе Be < Mg
по периоду Li > Be > B
Степень окисления от 0 до +2
Высший оксид – BeO – амфотерный
BeO + 2HCl =
BeO + 2NaOH + H2O = Na2[Be(OH)4]
Высший гидроксид – Be(OH)2 – амфотерный
Be(OH)2 + 2HCl =
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
16.
115
В
бор
Z=5
11
В
ē=5
N=6
+5
5
2
2
2
13
II
S
P
17.
18. Окислительные (неметаллические) свойства: по подгруппе B > Al по периоду Be < B < C Степень окисления от -3 до +3
Окислительные (неметаллические)свойства:
по подгруппе B > Al
по периоду Be < B < C
Степень окисления от -3 до +3
Высший оксид – B2O3 – кислотный
B2O3 + 6NaOH = 2Na3BO3 + 3H2O
Высший гидроксид – H3BO3 – кислота
H3BO3 + 3NaOH = Na3BO3 + 3H2O
19.
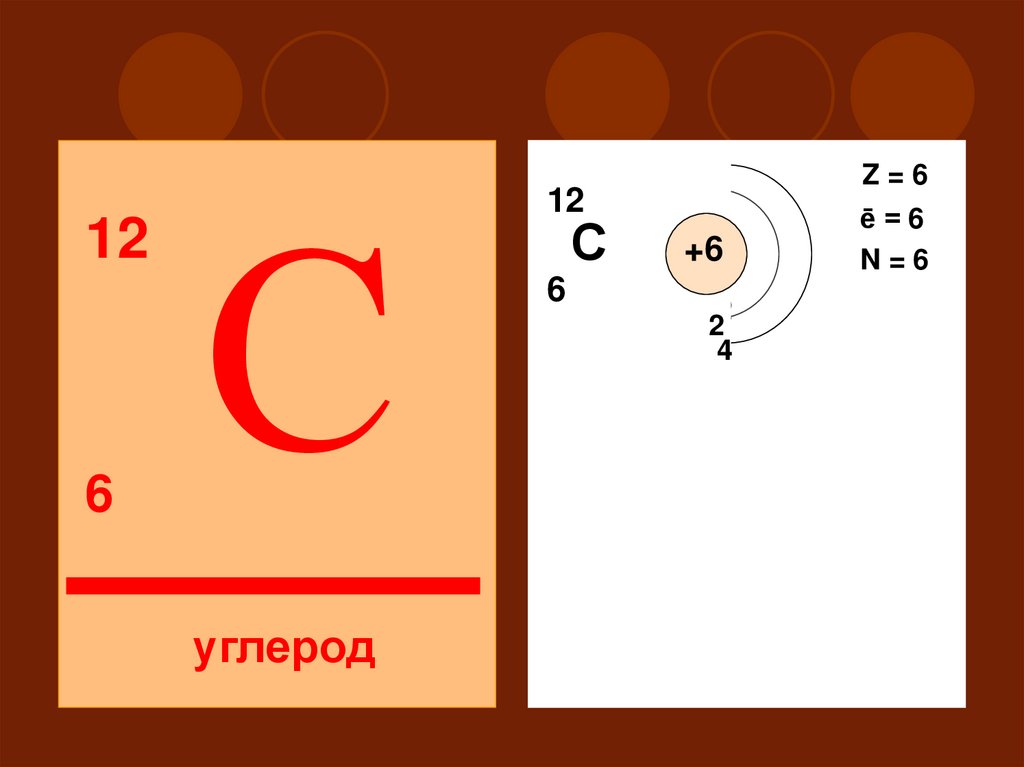
126
С
углерод
Z=6
12
С
ē=6
N=6
+6
6
2
2
2
14
II
S
P
20.
21. Окислительные (неметаллические) свойства: по подгруппе С > Si по периоду B < C < N Степень окисления от - 4 до +4
Окислительные (неметаллические)свойства:
по подгруппе С > Si
по периоду B < C < N
Степень окисления от - 4 до +4
Высший оксид – CO2 – кислотный
CO2 + 2NaOH =
Высший гидроксид – H2CO3 – кислота
Кислота неустойчива, уравнения писать
нельзя.
22.
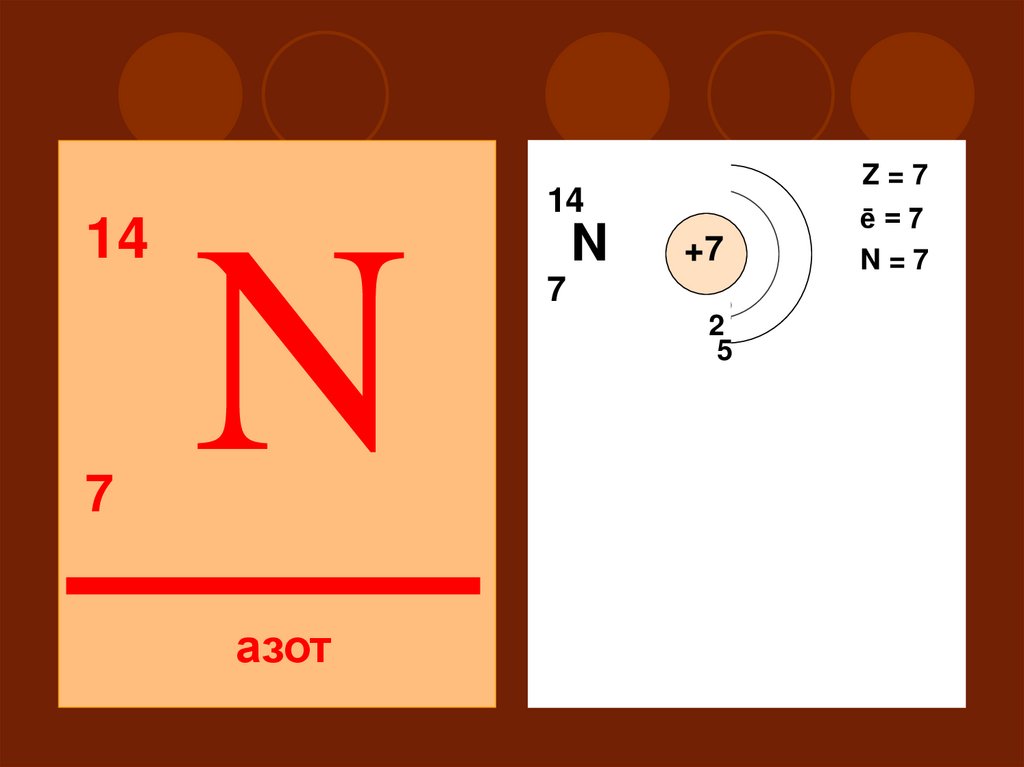
147
Z=7
14
N
азот
N
ē=7
N=7
+7
7
2
2
2
15
II
S
P
23.
24. Окислительные (неметаллические) свойства: по подгруппе N > P по периоду C < N < O Степень окисления от -3 до +5
Окислительные (неметаллические)свойства:
по подгруппе N > P
по периоду C < N < O
Степень окисления от -3 до +5
Высший оксид – N2O5 – кислотный
N2O5 + 2NaOH =
Высший гидроксид – HNO3 – кислота
HNO3 + NaOH =
25.
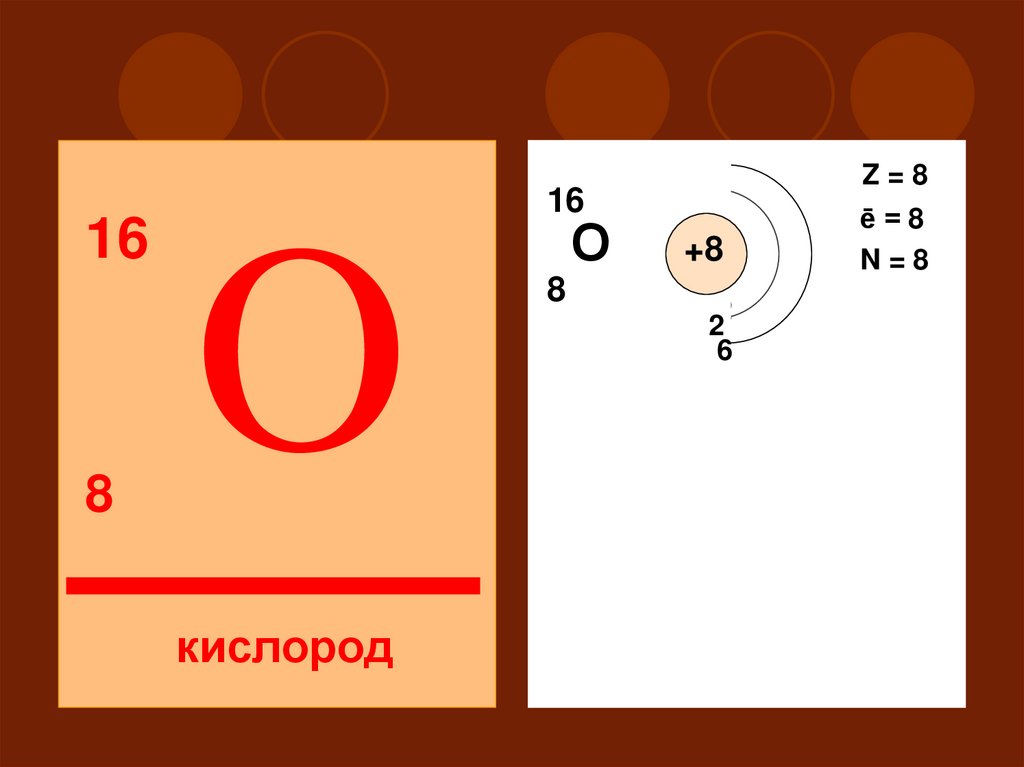
168
Z=8
16
O
кислород
О
ē=8
N=8
+8
8
2
2
2
16
II
S
P
26.
27. Окислительные (неметаллические) свойства: по подгруппе О > S по периоду N < O < F Степень окисления от -2 до +2
Окислительные (неметаллические)свойства:
по подгруппе О > S
по периоду N < O < F
Степень окисления от -2 до +2
Высший оксид и гидроксид – H2O –
амфотерный
Н2O + SO2 =
Н2O + СаO =
28.
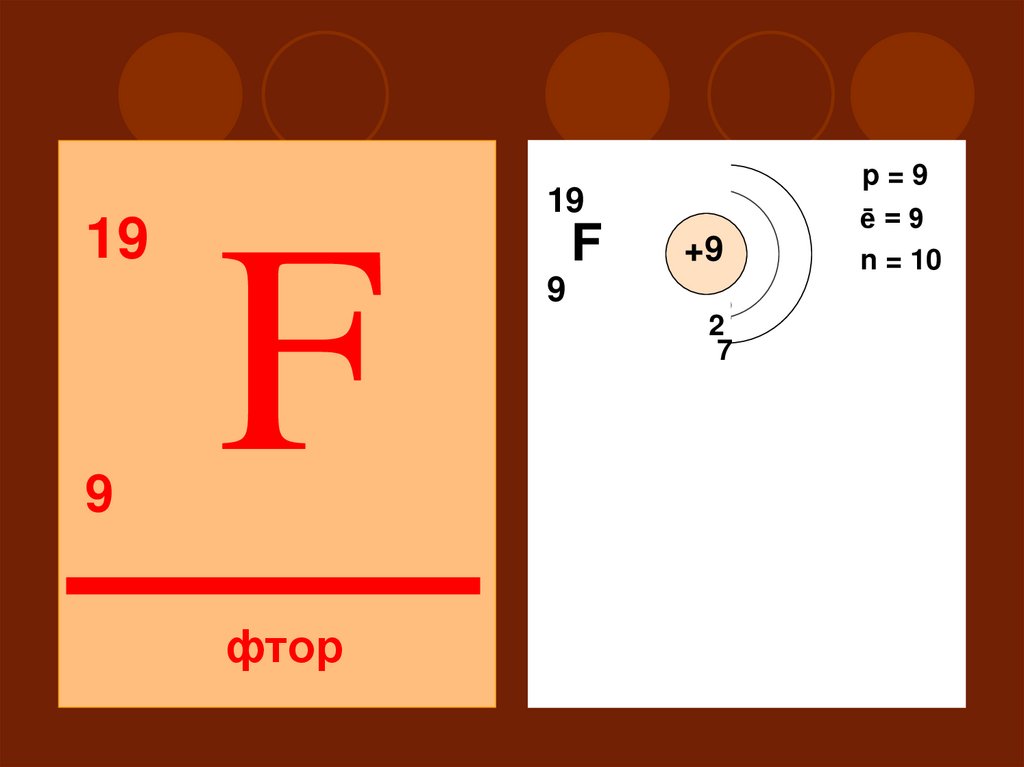
199
p=9
19
F
фтор
F
ē=9
n = 10
+9
9
2
2
2
17
II
S
P
29. Окислительные (неметаллические) свойства: Самый сильный окислитель Степень окисления от -1 до 0
Высшего оксида и гидроксида нет30.
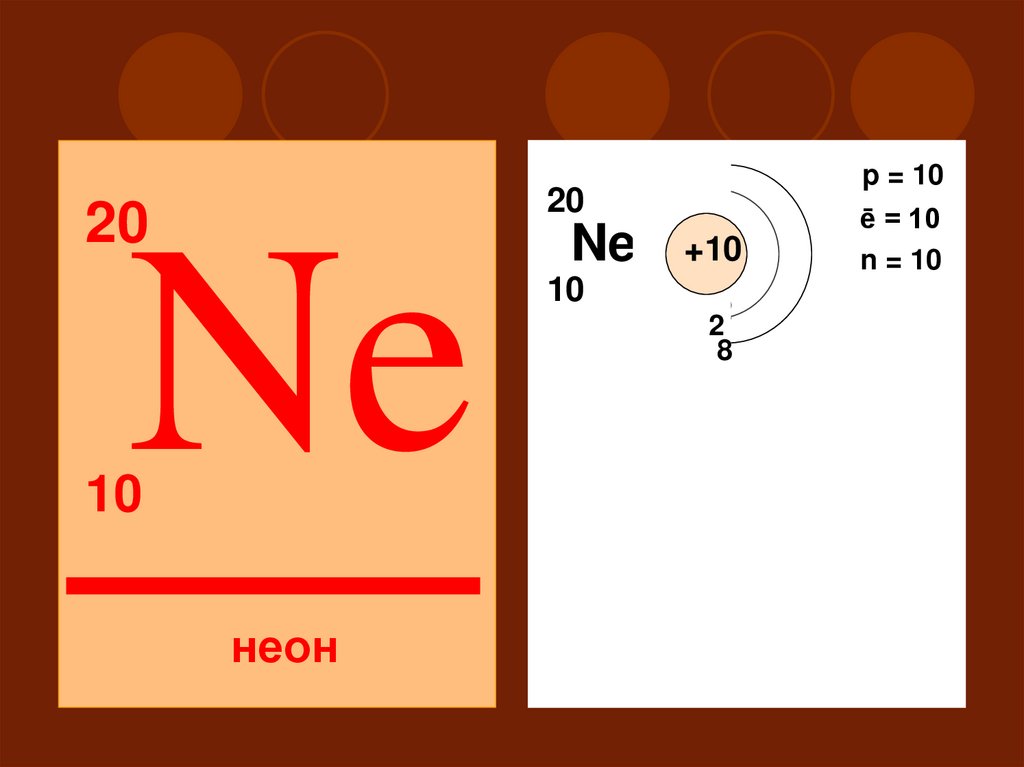
p = 1020
20
Ne
10
неон
Ne
10
2
ē = 10
n = 10
+10
2
2
18
II
S
P
31. Не обладает ни окислительными, ни восстановительными свойствами Степень окисления 0
Высшего оксида и гидроксида нет32.
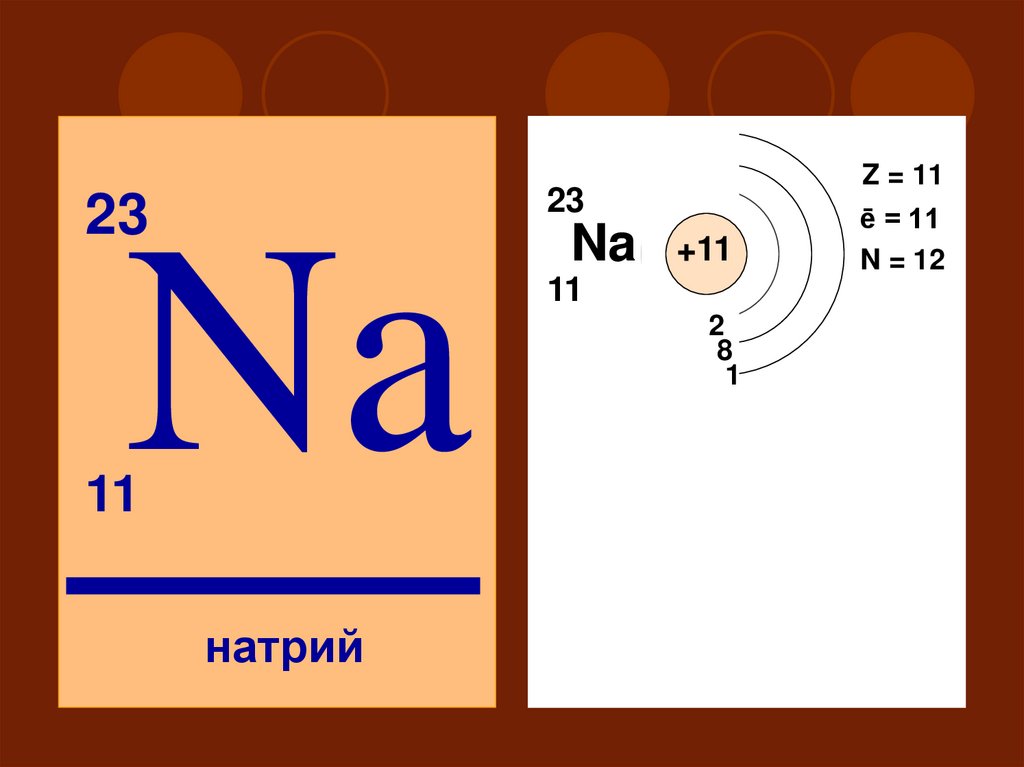
Z = 1123
23
Na
11
Na
+11
11
2
2
2
18
1
III
S
натрий
ē = 11
N = 12
P
d
33. Восстановительные (металлические) свойства: по подгруппе Li < Na < K по периоду Na > Mg Степень окисления от 0 до +1
Восстановительные (металлические)свойства:
по подгруппе Li < Na < K
по периоду Na > Mg
Степень окисления от 0 до +1
Высший оксид – Na2O – основной
Na2O + HCl =
Высший гидроксид – NaOH – oснование
NaOH + HCl =
34.
24p = 12
24
Mg
12
Mg +12
12
2
2
2
18
2
III
S
магний
ē = 12
n = 12
P
d
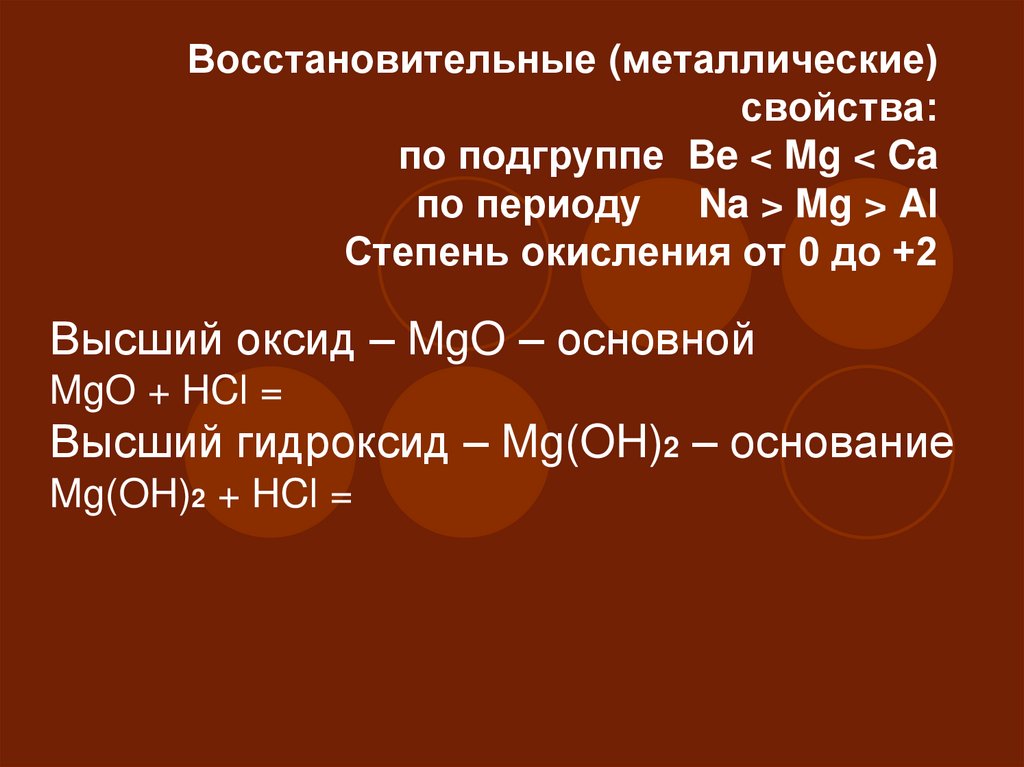
35. Восстановительные (металлические) свойства: по подгруппе Be < Mg < Ca по периоду Na > Mg > Al Степень окисления от 0 до +2
Восстановительные (металлические)свойства:
по подгруппе Be < Mg < Ca
по периоду Na > Mg > Al
Степень окисления от 0 до +2
Высший оксид – MgO – основной
MgO + HCl =
Высший гидроксид – Mg(OH)2 – oснование
Mg(OH)2 + HCl =
36.
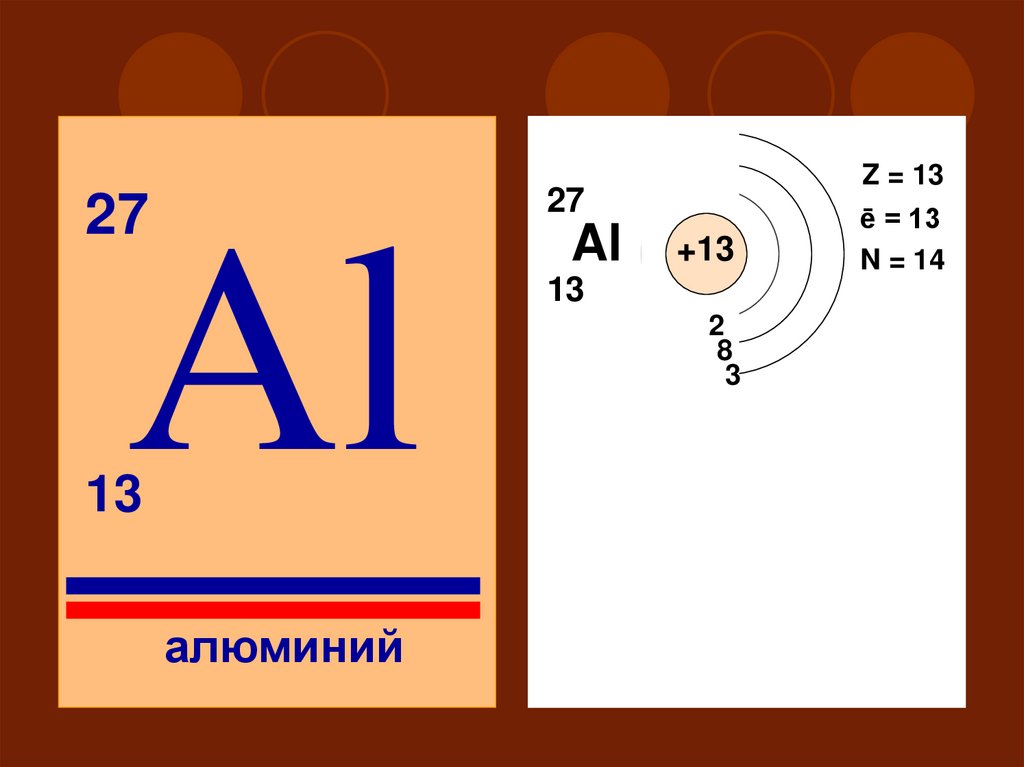
Z = 1327
27
Al
13
Al
+13
13
2
2
2
18
3
III
S
алюминий
ē = 13
N = 14
P
d
37. Восстановительные (металлические) свойства: по подгруппе B < Al < Ga по периоду Mg > Al > Si Степень окисления от 0 до +3
Восстановительные (металлические)свойства:
по подгруппе B < Al < Ga
по периоду Mg > Al > Si
Степень окисления от 0 до +3
Высший оксид – Al2O3 – амфотерный
Al2O3 + HCl =
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Высший гидроксид – Al(OH)3 – амфотерный
Al(OH)3 + HCl =
Al(OH)3 + NaOH = Na[Al(OH)4]
38.
39.
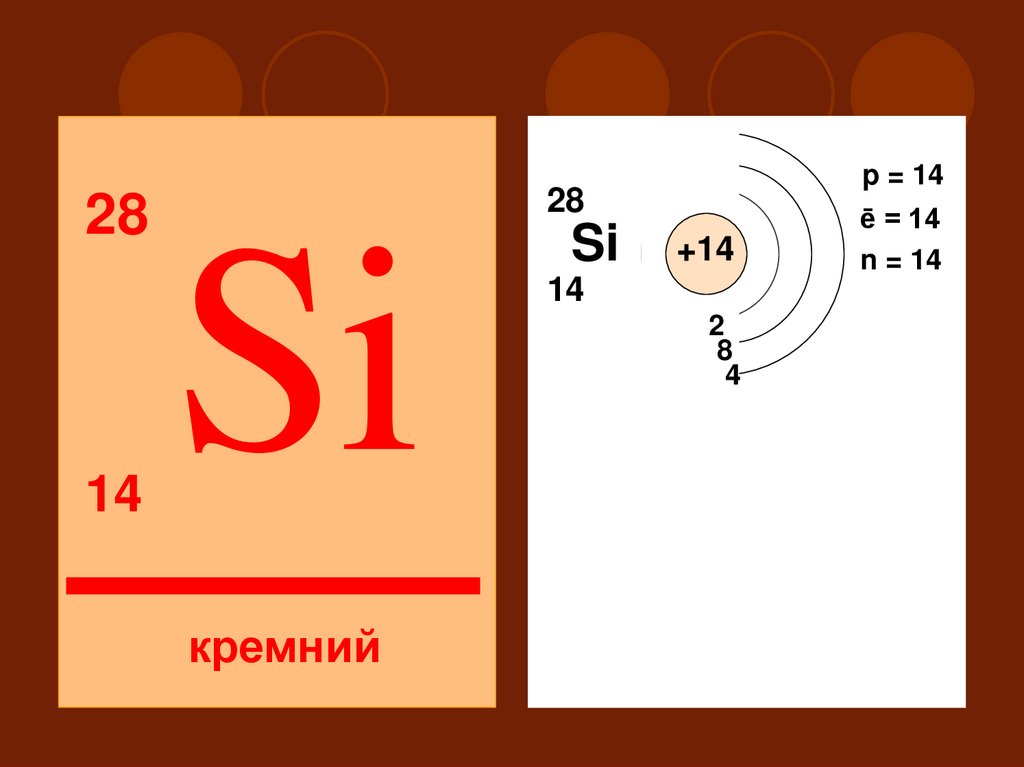
2828
14
p = 14
Si
Si
+14
14
2
2
2
18
4
III
S
кремний
ē = 14
n = 14
P
d
40. Окислительные (неметаллические) свойства: по подгруппе С > Si > Ge по периоду Al < Si < P Степень окисления от -4 до +4
Окислительные (неметаллические)свойства:
по подгруппе С > Si > Ge
по периоду Al < Si < P
Степень окисления от -4 до +4
Высший оксид – SiO2 – кислотный
SiO2 + 2NaOH =
Высший гидроксид – H2SiO3 – кислота
H2SiO3 + 2NaOH =
41.
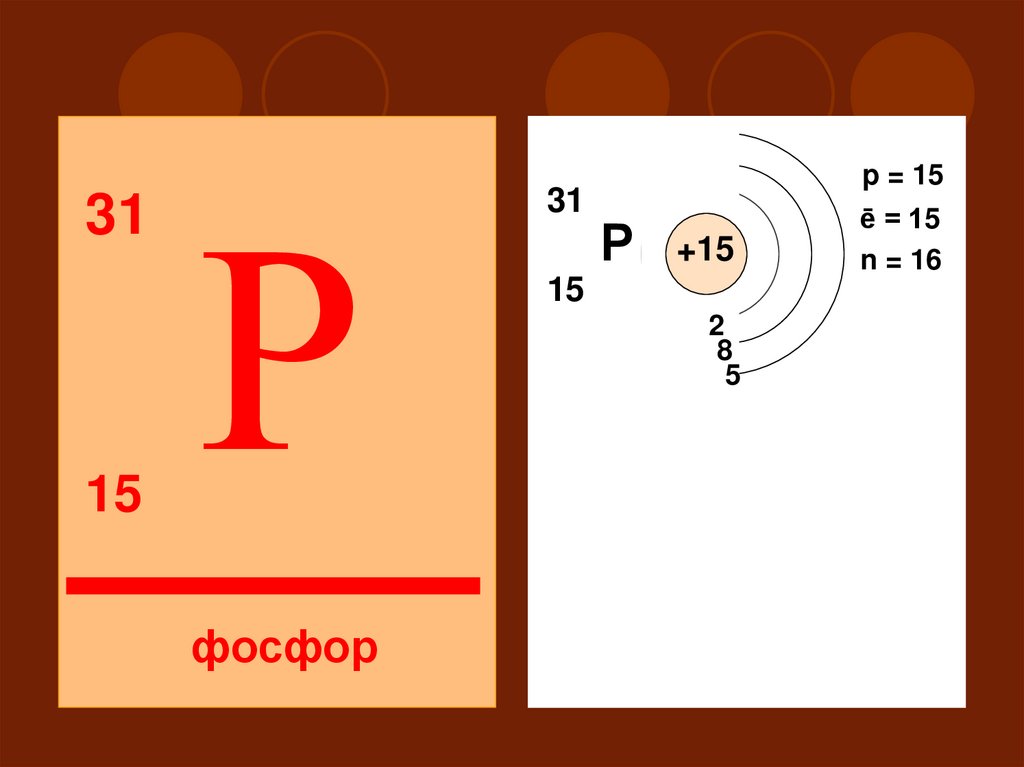
3115
Р
31
p = 15
Р
+15
15
2
2
2
18
5
III
S
фосфор
ē = 15
n = 16
P
d
42. Окислительные (неметаллические) свойства: по подгруппе N > P > As по периоду Si < P < S Степень окисления от -3 до +5
Окислительные (неметаллические)свойства:
по подгруппе N > P > As
по периоду Si < P < S
Степень окисления от -3 до +5
Высший оксид – P2O5 – кислотный
P2O5 + NaOH
Высший гидроксид – H3PO4 – кислота
H3PO4 + NaOH =
43.
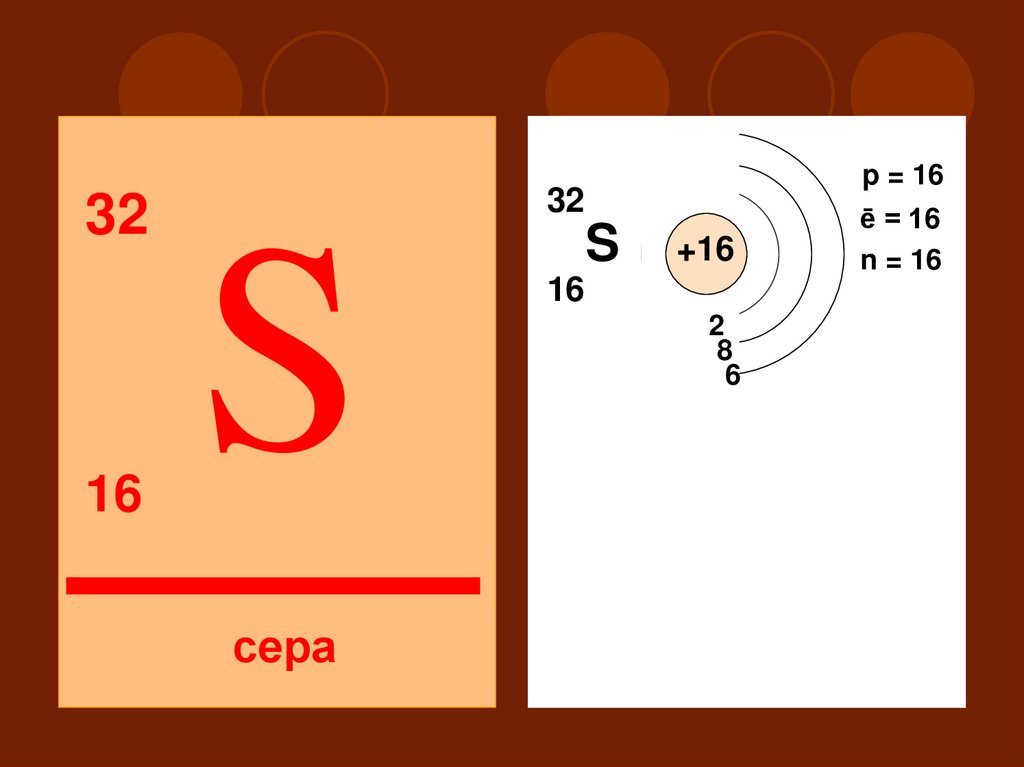
3232
16
p = 16
S
S
+16
16
2
2
2
18
6
III
S
сера
ē = 16
n = 16
P
d
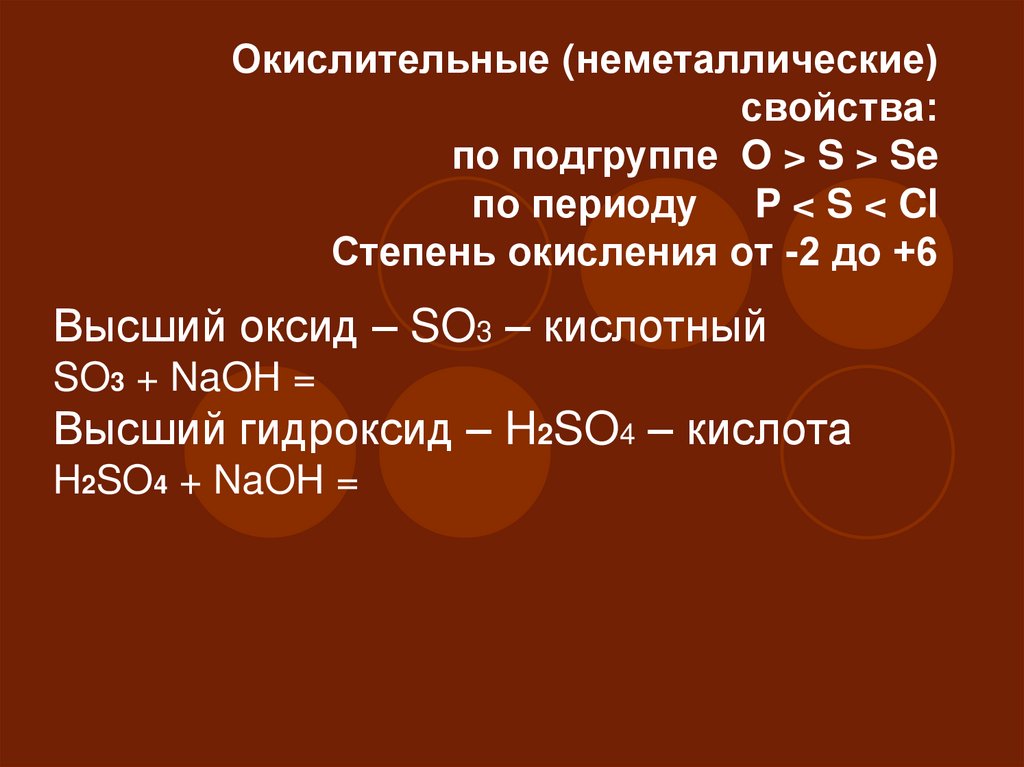
44. Окислительные (неметаллические) свойства: по подгруппе O > S > Se по периоду P < S < Cl Степень окисления от -2 до +6
Окислительные (неметаллические)свойства:
по подгруппе O > S > Se
по периоду P < S < Cl
Степень окисления от -2 до +6
Высший оксид – SO3 – кислотный
SO3 + NaOH =
Высший гидроксид – H2SO4 – кислота
H2SO4 + NaOH =
45.
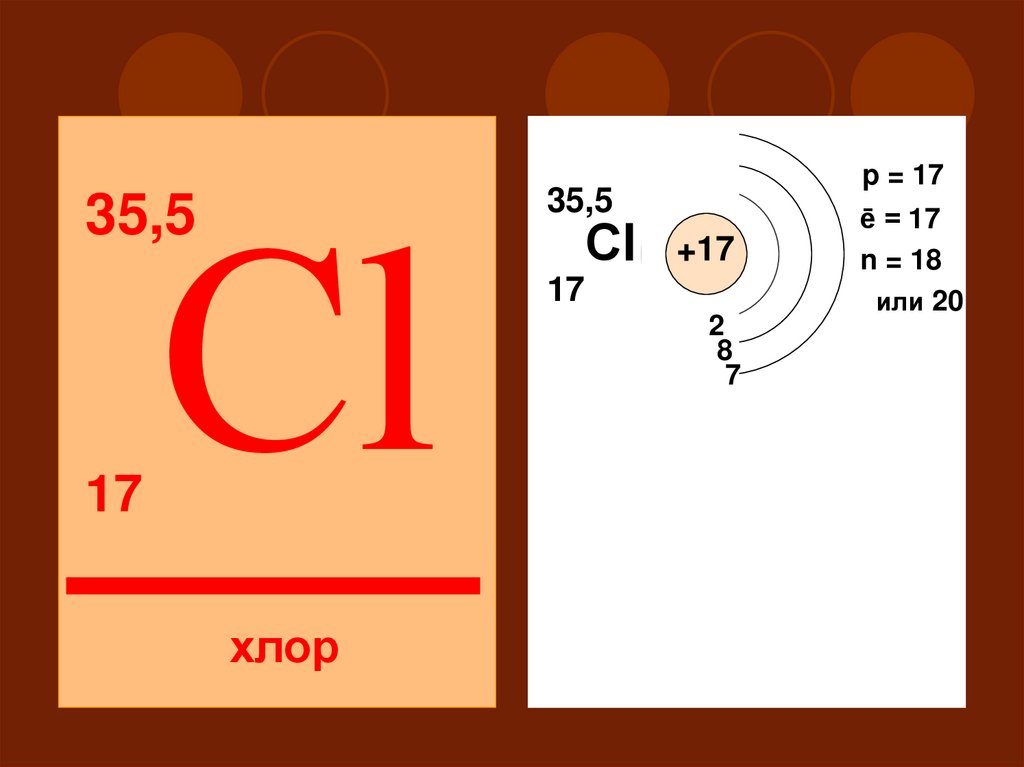
Сl35,5
17
35,5
Сl
ē = 17
n = 18
или 20
+17
17
2
2
2
18
7
III
S
хлор
p = 17
P
d
46. Окислительные (неметаллические) свойства: по периоду S < Cl по подгруппе F > Cl > Br Степень окисления от -1 до +7
Окислительные (неметаллические)свойства:
по периоду S < Cl
по подгруппе F > Cl > Br
Степень окисления от -1 до +7
Высший оксид – Сl2O7 – кислотный
Cl2O7 + 2NaOH = 2NaClO4 + H2O
Высший гидроксид – HClO4 – кислота
HClO4 + NaOH = NaClO4 + H2O
47.
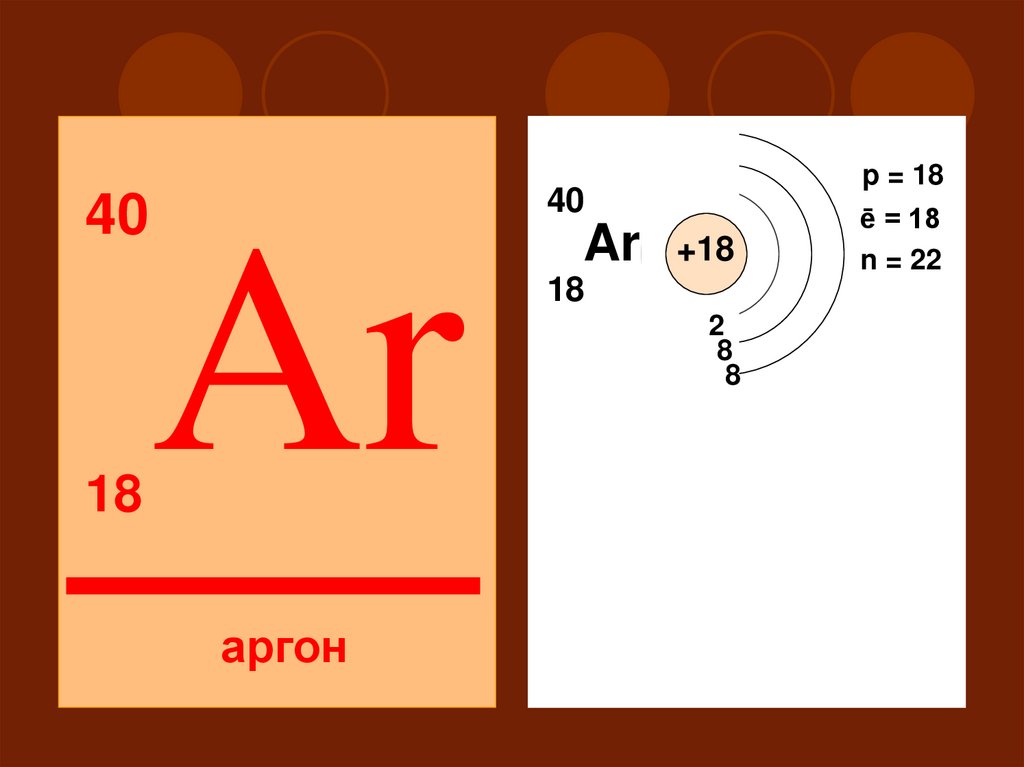
4040
18
p = 18
Ar
Ar +18
18
2
2
2
18
8
III
S
аргон
ē = 18
n = 22
P
d
48. Не обладает ни окислительными, ни восстановительными свойствами Степень окисления 0
Высшего оксида и гидроксида нет49.
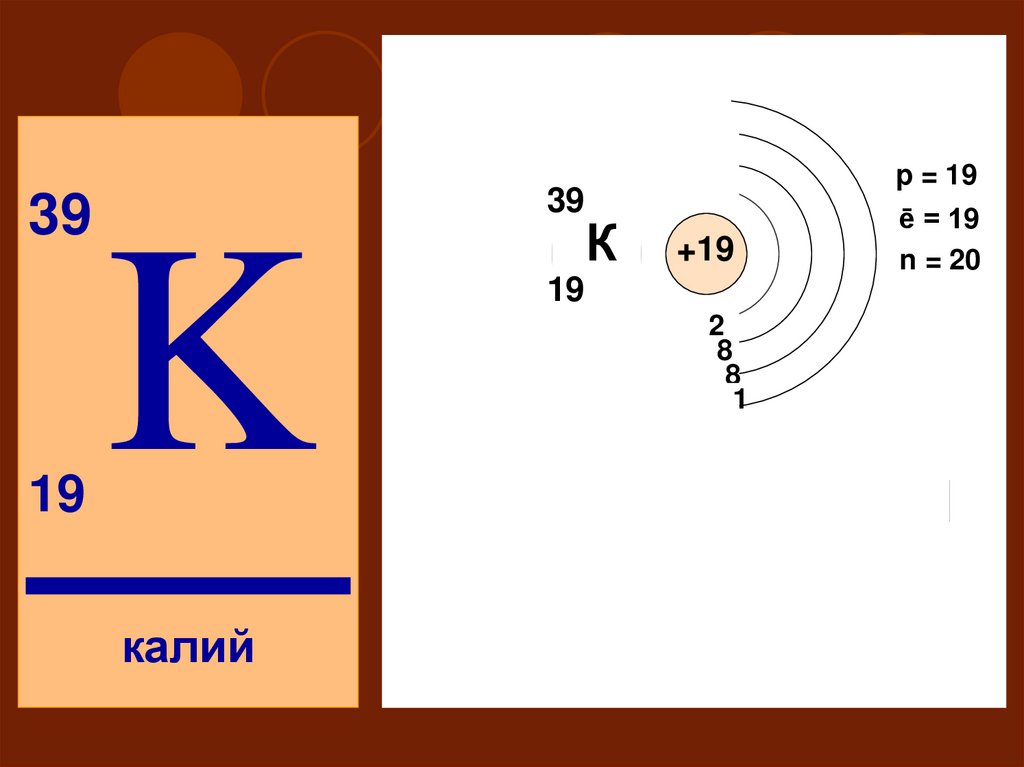
3939
19
K
К
S
P
ē = 19
n = 20
+19
19
2
IV
калий
p = 19
2
2
18
8
1
d
f
50. Восстановительные (металлические) свойства: по подгруппе Na < K < Rb по периоду K > Ca Степень окисления от 0 до +1
Восстановительные (металлические)свойства:
по подгруппе Na < K < Rb
по периоду K > Ca
Степень окисления от 0 до +1
Высший оксид – K2O – основной
K2O + HCl =
Высший гидроксид – KOH – oснование
KOH + HCl = KCl + H2O
51.
4040
Ca
p = 20
Са
ē = 20
n = 20
+19
20
2
2
18
8
2
2
20
IV
кальций
S
P
d
f
52.
53. Восстановительные (металические) свойства: по подгруппе Mg < Ca < Sr по периоду K > Ca > Ga Степень окисления от 0 до +2
Восстановительные (металические)свойства:
по подгруппе Mg < Ca < Sr
по периоду K > Ca > Ga
Степень окисления от 0 до +2
Высший оксид – CaO – основной
CaO + HCl =
Высший гидроксид – Ca(OH)2 – oснование
Ca(OH)2 + HCl =










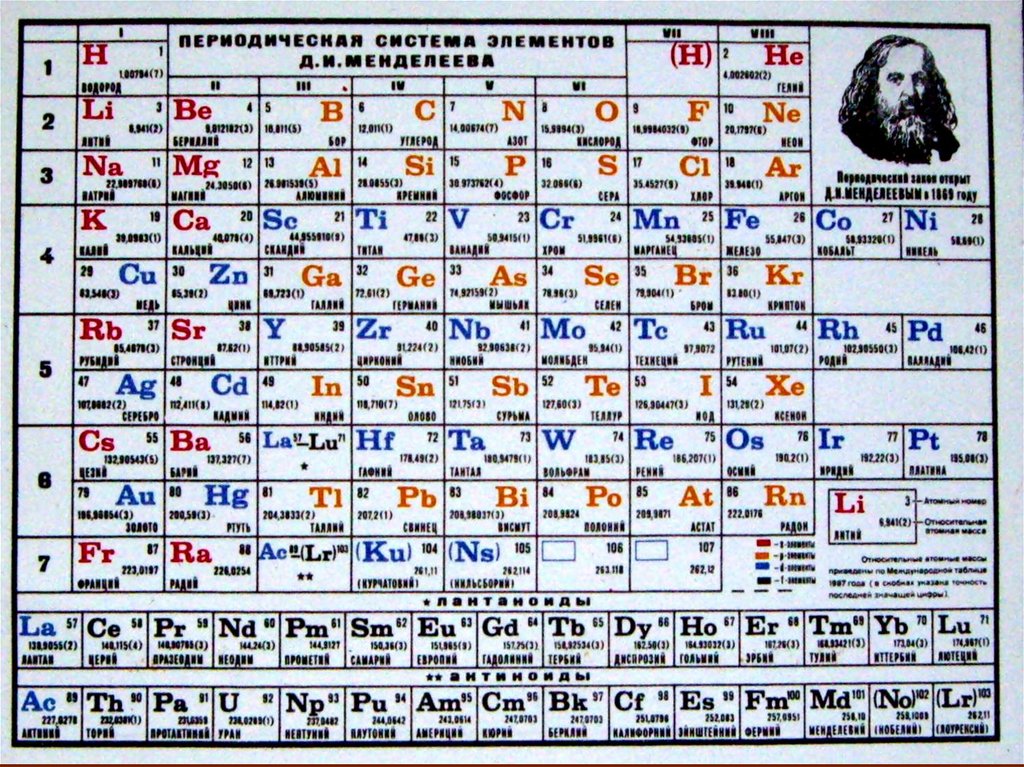



















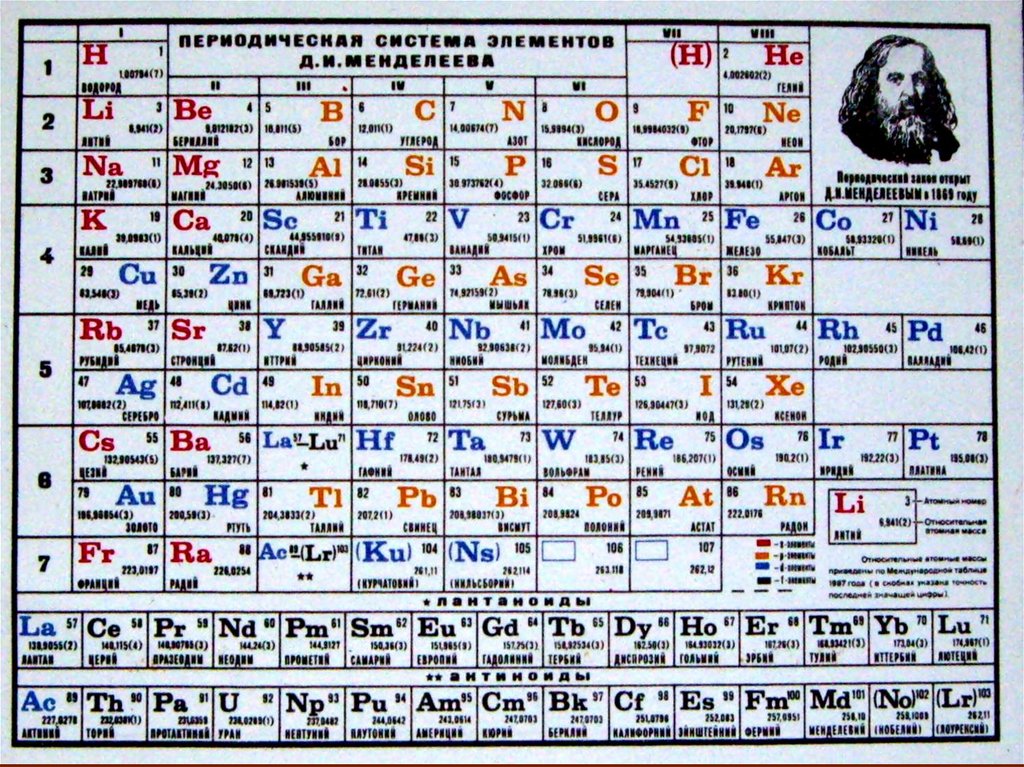


 Химия
Химия








