Похожие презентации:
Строение атома
1. Строение атома
Квантовая теория строения атома© Богданова Ирина Викторовна,
школа №617, г. С-Петербург
2. Модели атома
Модель атома ТомсонаМодель атома Резерфорда
Модель атома Бора
Модель атома Шрёдингера
3. Модель атома Томсона
Джозеф Томсон(1856 -1940),
английский
учёный, в 1897г.
открыл электрон,
предложил
модель атома
«Пудинг с изюмом»
4. Опыт Резерфорда
5. Модель атома Резерфорда
Так должно былопроисходить
рассеяние α-частиц
в атоме Томсона
Такое рассеяние
α-частиц наблюдал
Резерфорд на опыте
6. Трудности модели Резерфорда
Согласно моделиатома Резерфорда
атом
должен
непрерывно
излучать свет всех
длин волн.
Но на опыте были
обнаружены
линейчатые спектры
излучения атомов.
7. Модель атома Бора
1 постулат: В устойчивоматоме электрон может
двигаться лишь по особым
стационарным орбитам, не
излучая при этом
электромагнитной энергии.
2 постулат: Излучение света
атомом происходит при
переходе атома из
стационарного состояния с
большей энергией в
стационарное состояние с
меньшей энергией.
8. Правило квантования орбит
На длине окружности каждойстационарной
орбиты
укладывается целое число n
длин
волн
де
Бройля,
соответствующих
движению
электрона.
2 r
Б
n
h
Б
me
9. Правило квантования орбитального момента импульса
На стационарной орбите моментимпульса
электрона
квантуется
(кратен постоянной Планка)
me r n
10. Радиусы стационарных орбит
Радиусыстационарных
орбит
квантованы (имеют дискретные значения,
пропорциональные квадрату главного
квантового числа).
2
2
rn
n
2
kme e
11. Энергетический спектр атома
Энергия электрона в атоме квантуется2
4
k me e 1
En
2
2
2 n
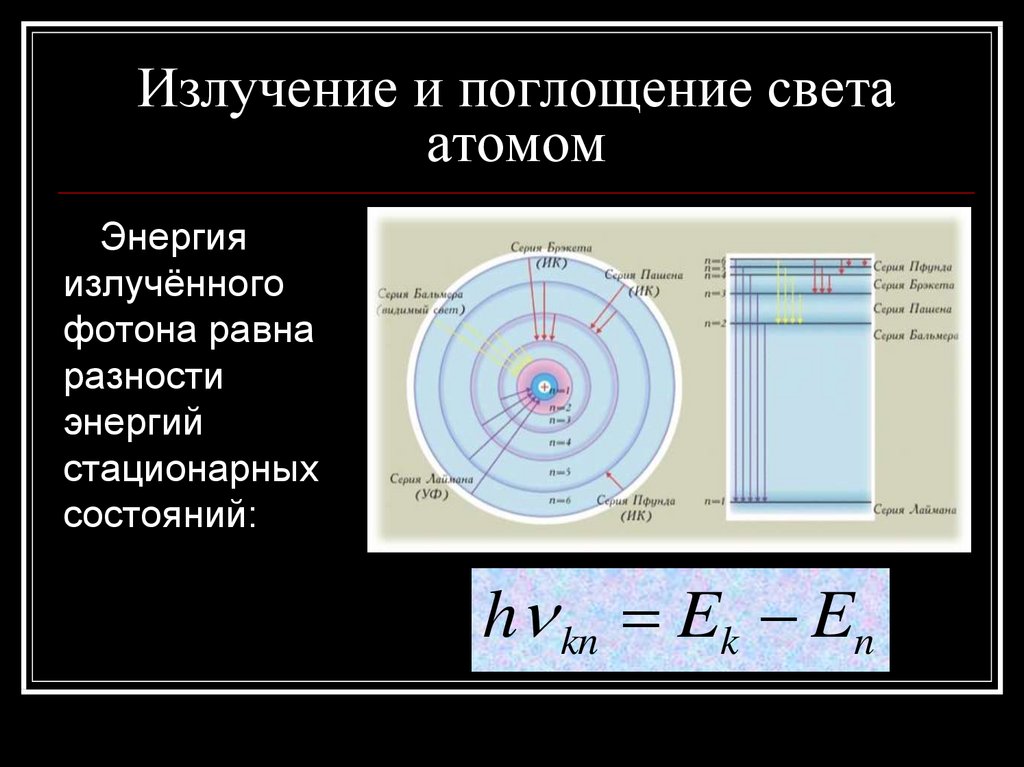
12. Излучение и поглощение света атомом
Энергияизлучённого
фотона равна
разности
энергий
стационарных
состояний:
h kn Ek En
13. Серии излучения атома водорода
Серия Бальмерасостоит из видимых
спектральных
линий фиолетового,
синего, зелёного и
красного цвета.
14. Спектры излучения
Сплошной (непрерывный) спектр излучаюттвердые тела, жидкости и сжатые газы.
15. Спектры излучения
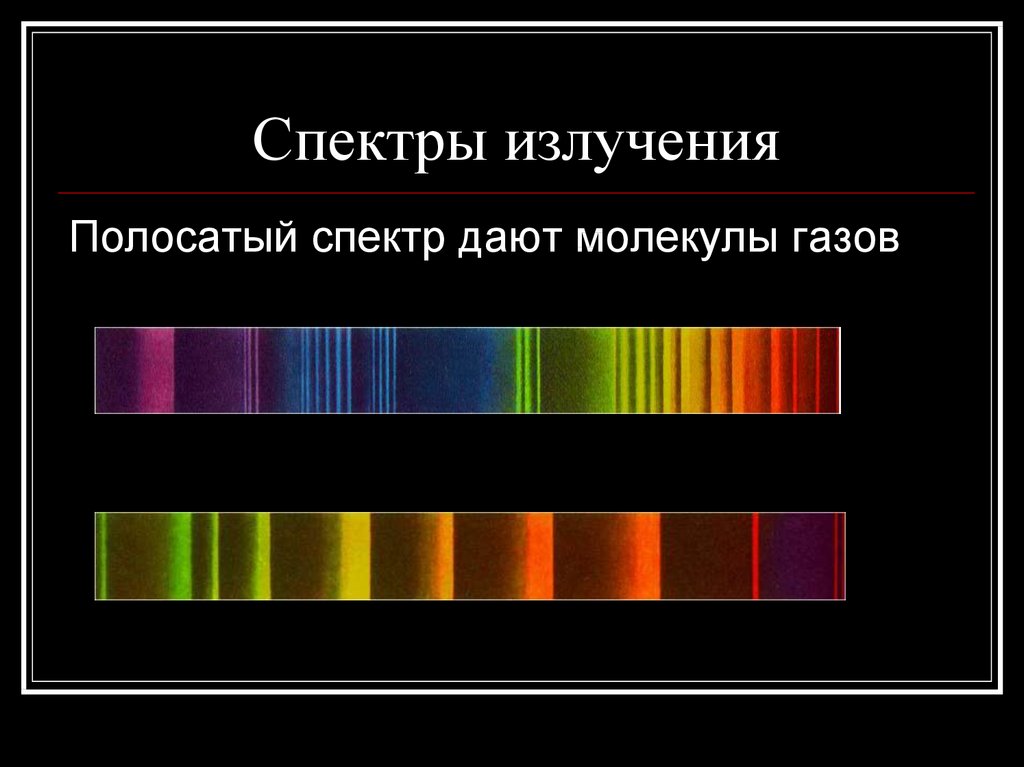
Полосатый спектр дают молекулы газов16. Спектры излучения
Линейчатый спектр создают разреженныегазы в атомарном состоянии
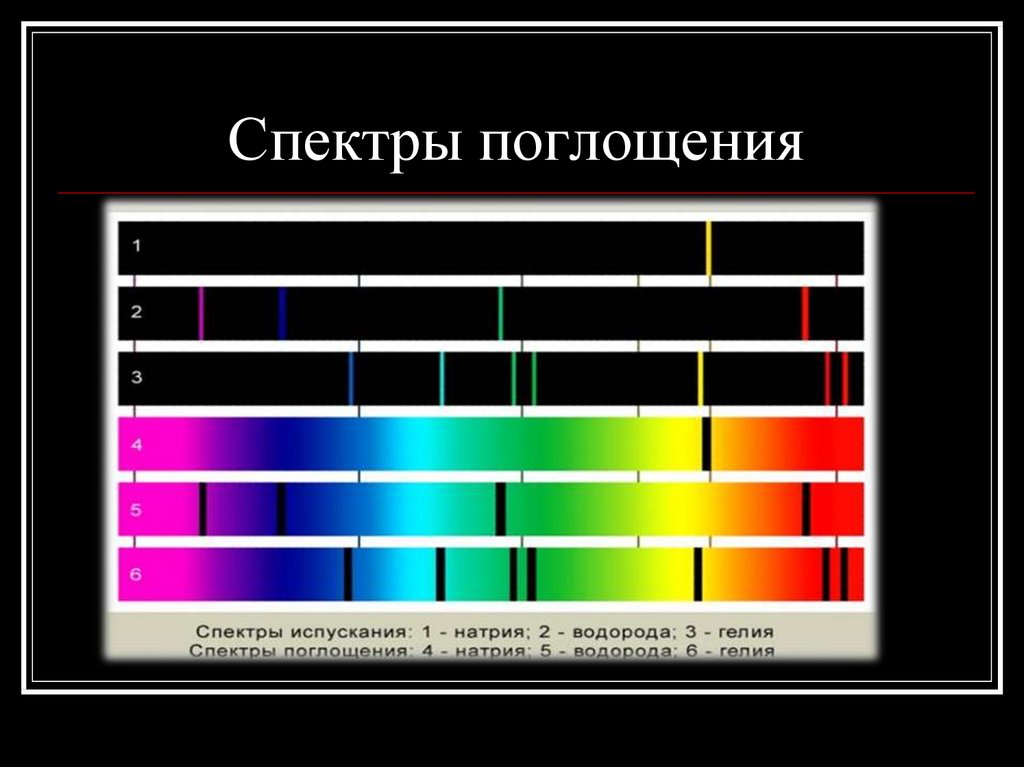
17. Спектры поглощения
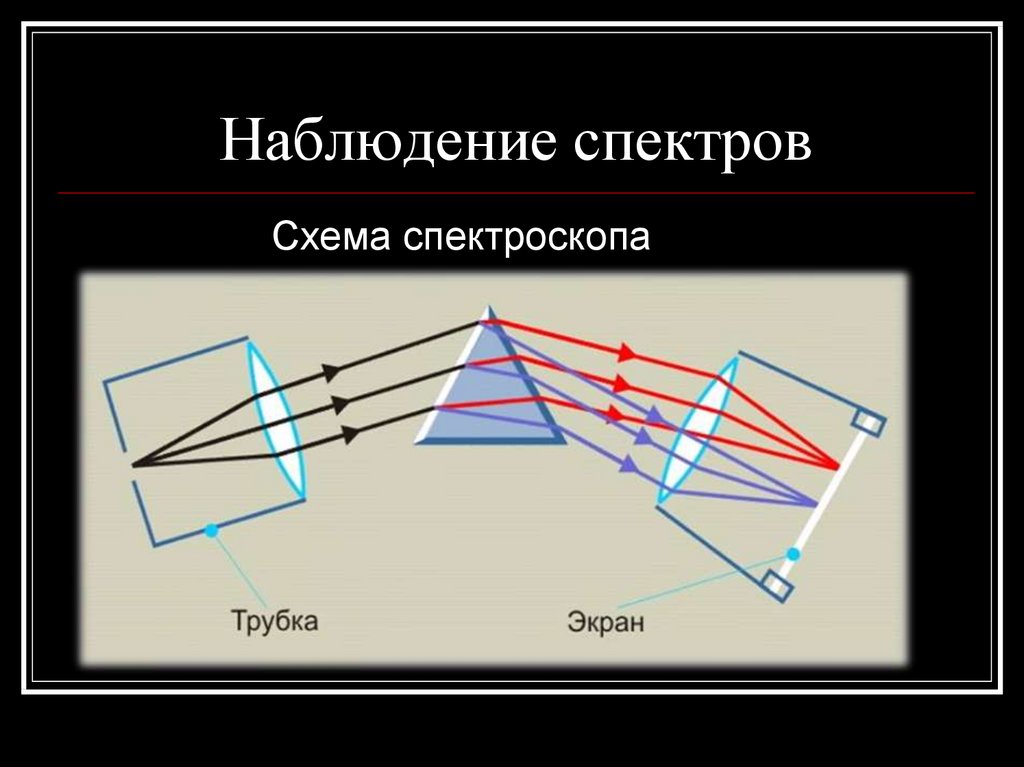
18. Наблюдение спектров
Схема спектроскопа19. Применение спектрального анализа
Определение химического состава сложныхвеществ
В криминалистике
Определение химического состава небесных
объектов
Определение физических характеристик
небесных объектов
В металлургической и горно - добывающей
промышленности
20. Трудности модели атома Бора
Теория Бора моглаописать только атом
водорода и
водородоподобные
системы. Рассчитать
спектр излучения уже
атома гелия эта
теория не могла.
21. Квантово-механическая модель атома
В 1924 г. немецкий физик ЭрвинШрёдингер
предложил
современную модель атома.
В
основе
этой
модели
вероятностный подход.
Положение электрона в атоме
может быть определено лишь с
некоторой долей вероятности
(согласно
соотношению
неопределённостей
Гейзенберга).
Понятие
орбиты
исчезло,
появилось
понятие
об
электронных облаках.
22.
ОсобенностиАтом – равномерно
положительно
заряженная сфера,
электроны - внутри
этой сферы
Недостатки
Атом Томсона
Не выдержал
экспериментально
го подтверждения
опытом
Резерфорда
Атом
Резерфорда
Атом Бора
В центре атома –
положительно
Электрон,
заряженное ядро двигаясь по
малых размеров, стационарной
электроны
орбите, не
вращаются по
излучает
орбитам вокруг
ядра
Невозможно
Необъяснима
описать
устойчивость
строение
атома,
любого
линейчатость
другого
спектров атомов атома, кроме
и других явлений
водорода
Атом
Шрёдингера
Определить
положение
электрона в
атоме можно
только с
некоторой
долей
вероятности
Недостатков
нет
23. Виды излучения
Тепловоеизлучение
Люминесценция
катодолюминесценция
фотолюминесценция
хемилюминесценция
флуоресценция
фосфоресценция
24. Виды излучения
СпонтанноеИндуцированное
25. Лазер
Свойства лазерногоизлучения
Узкая направленность
Высокая
монохроматичность
Пространственная и
временная когерентность
Высокая мощность
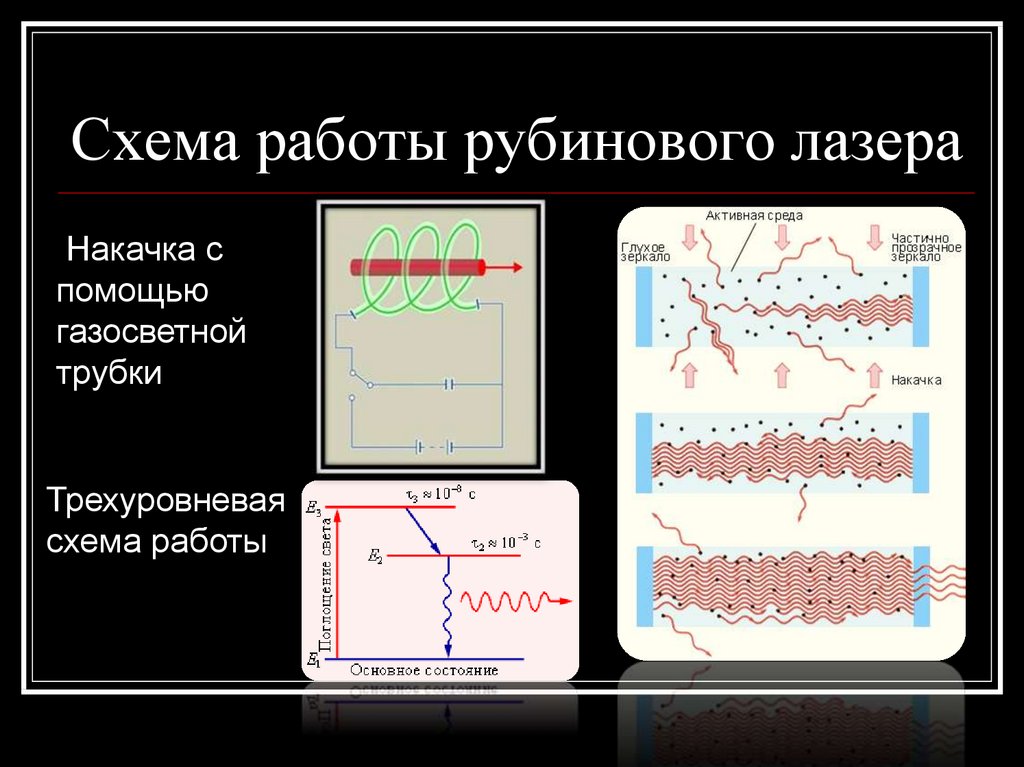
26. Схема работы рубинового лазера
Накачка спомощью
газосветной
трубки
Трехуровневая
схема работы
27. Гелий – неоновый лазер
1 – стеклянная кювета со смесью гелия и неона,в которой создается высоковольтный разряд;
2 – катод; 3 – анод; 4 – глухое сферическое
зеркало с пропусканием менее 0,1 %;
5 – сферическое зеркало с пропусканием 1-2 %.
28. Схема работы гелий-неонового лазера
Активнымгазом,
на
котором
возникает
генерация на длине волны 632,8 нм (яркокрасный свет) в непрерывном режиме, является
неон. Гелий является буферным газом, он
участвует в механизме создания инверсной
населенности одного из верхних уровней неона.
Излучение
He–Ne
лазера
обладает
исключительной,
непревзойденной
монохроматичностью.
Время
когерентности
такого излучения оказывается
порядка
1
2 103
а длина когерентности
с,
c 6 10
т. е. больше диаметра земной орбиты!
11
м,
29.
Подведение итогов урока. Рефлексия учащихсяСпасибо за внимание.
Урок окончен.
Использованные ресурсы:
1. Обучающий диск «Открытая физика», ч.2, Физикон
2. Обучающий диск « Физика 11 класс», Кирилл и Мефодий
3. Энциклопедия Кирилла и Мефодия
























 Физика
Физика