Похожие презентации:
Растворы. Часть 1. Лекция №6
1.
РастворыΔG = - RTlnC
Если С →0, то ΔG →∞
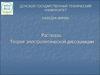
Любой исследуемый вещественный объект
представляет собой многокомпонентную систему
Гомогенная многокомпонентная система называется раствором.
В растворах присутствуют:
1 - растворитель и 2 - растворенные вещества
2.
3.
4.
5.
6.
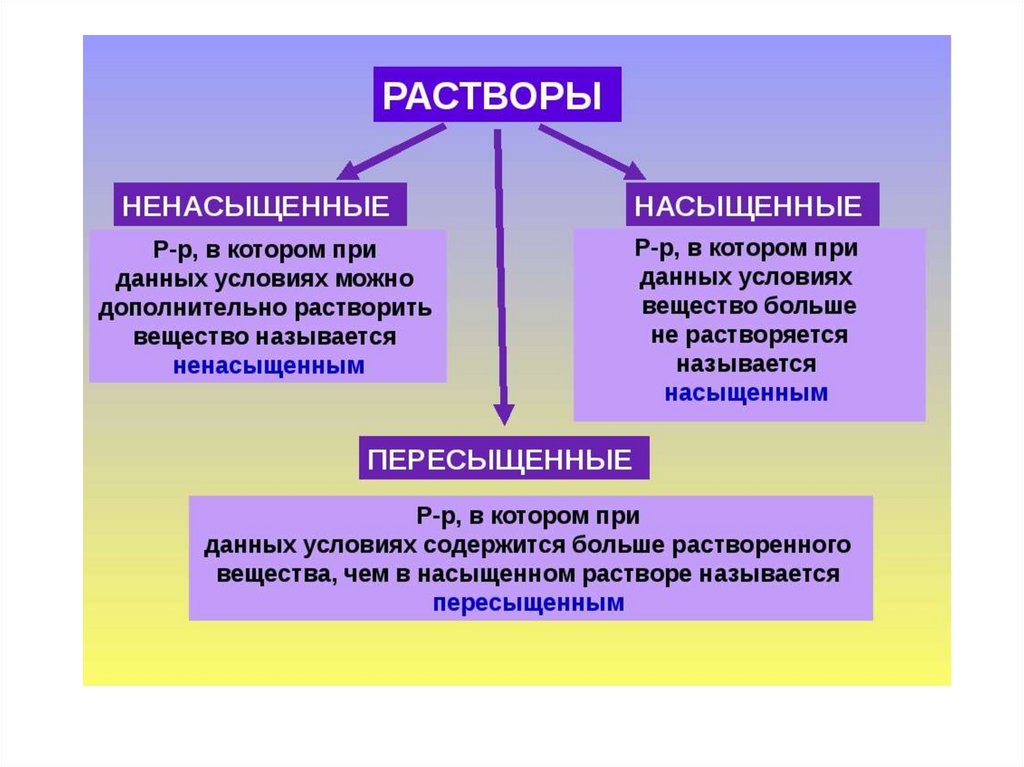
100 г раствора – 4 г NaBr1000г раствора – 40 г
d раствора – 1,03 г/см3
1000 г этого раствора
занимает объем V = m/d
= 1000/1,03 = 970,9 мл =
0,9709 л
С = 40/102,89*0,9709 =
0,4 моль/дм3 (л)
7.
Молярная концентрацияэквивалента.
Эквивалентом называется реальная или условная частица
вещества Х, которая в данной кислотно-основной реакции
эквивалентна одному иону водорода или одному электрону в
окислительно-восстановительной реакции.
HCl +NaOH = NaCl+H2O
f экв – фактор эквивалентности
Для этой реакции fэкв NaOH =1 Эквивалент NaOH = 1
2HCl +Сa(OH)2 = CaCl2 + H2O
f экв Сa(OH)2 = 1/2, эквивалент Сa(OH)2 = ½
3HCl +Al(OH)3 = AlCl3 + H2O
f экв Al(OH)3 = 1/3, эквивалент Al(OH)3 = 1/3
Молярная масса эквивалента вещества Х
Мэкв (Х)= М(х)*fэкв(х)
Мэкв (NaOH) = 40 г/моль*1 = 40 г/моль-экв
M экв Al(OH)3 = 1/3*78 г/моль = 26 г/моль-экв
8.
Количество вещества эквивалента равно отношению массы вещества Х кмолярной массе эквивалента этого вещества
νэквСa(OH)2 = mСa(OH)2/Мэкв Сa(OH)2
Молярная концентрация эквивалента раствора, иначе нормальность
раствора
Это количество вещества эквивалента в 1 дм3 (литре) раствора.
Сэкв(Х) = νэкв(Х)/V
V – объем раствора, дм3.
Пример.
В 1 дм3 воды растворили 150 г серной кислоты. Плотность полученного
раствора (d) = 1,1 г/см3
Найти молярную концентрацию эквивалента этого раствора
Решение
Масса полученного раствора – 1000 г воды + 150 г серной кислоты = 1150 г.
Объем раствора – М = V/d = 1150/1,1 = 1045 см3 = 1,045 дм3
νэквH2SO4 = m (H2SO4)/M(H2SO4)*f = 150/98*1/2 = 3,06 моль-экв
Сэкв(H2SO4) = ν(H2SO4)/V = 3,04/1,045 = 2,93 моль-экв/дм3
Иначе говорят - 2,93 н раствор.
9.
10.
Рассчитать мольные доли глюкозы С6H12O6 и воды в растворе с массовой долей глюкозы 36 %.Решение.
Пусть масса раствора m = 100 г. Тогда масса глюкозы в растворе m1 = 36 г, масса воды m2 = 64 г.
Определим молярные массы глюкозы и воды:
Определим количество глюкозы и воды в растворе:
Определим мольную долю растворенного вещества – глюкозы:
χ
Определим мольную долю растворителя – воды:
χ
χ
χ
11.
12.
.Расcчитать молярность и
моляльность 15-% раствора серной
кислоты (плотность 1,1 г/см3)
Масса 1 л кислоты m = 1000*1,105 = 1105 г.
Кислоты в нем содержится 1105*0,15=165,75 г.
Эквивалентная масса кислоты 98/2=49 г/моль.
Нормальность (молярная концентрация
эквивалента): Сэкв = 165,75/(49*1) = 3,38 н. (мольэкв/дм3)
Молярность (молярная концентрация): С =
165,75/(98*1) = 1,69 М (моль/дм3)
Моляльность: b = 165,75/(98*(1105-165,75)) = 1,8
моль/кг
13.
Задание1,33 г AlCl3 растворили в 200 мл воды.
Плотность полученного раствора - 1,05
г/см3.
Рассчитать:
ω, С, Сэкв, b, χ
14.
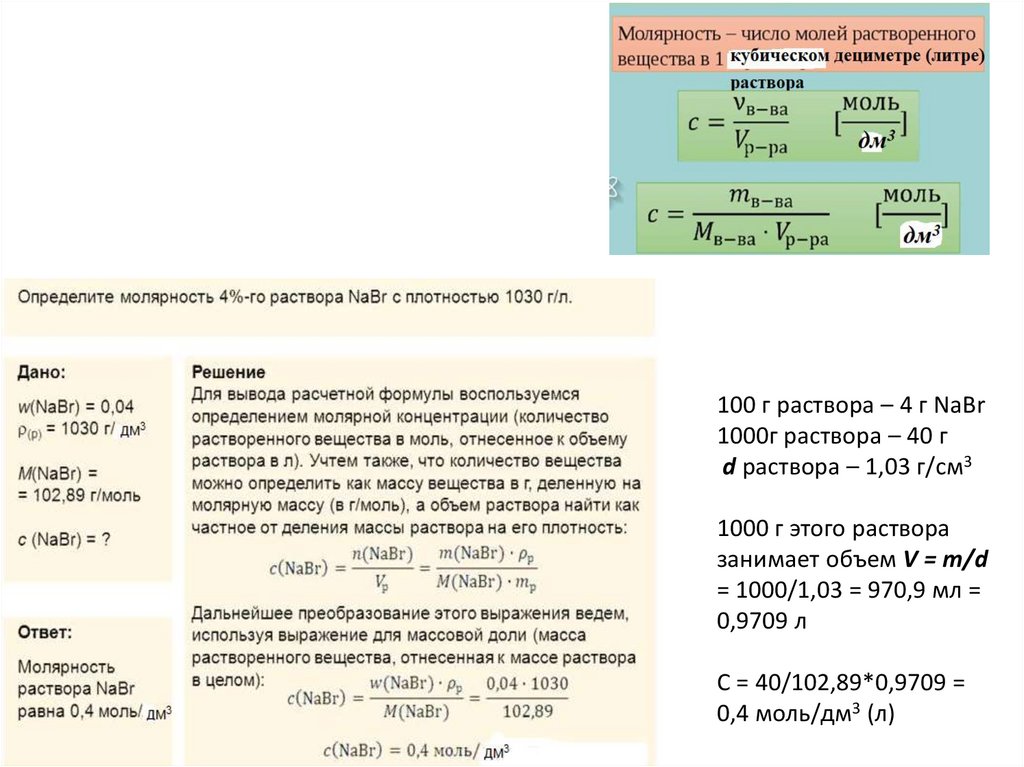
Растворы электролитов инеэлектролитов
15.
ВеществаЭЛЕКТРОЛИТЫ
НЕЭЛЕКТРОЛИТЫ
Электролиты – вещества, растворы и
расплавы которых проводят электрический ток
Неэлектролиты – вещества, растворы и
расплавы которых не проводят электрический
ток.
16.
Почему растворы электролитов проводятэлектрический ток?
Сванте Аррениус
(1859-1927)
Создал теорию
электролитической
диссоциации. За
исследования в
области
электролитов был
удостоен
Нобелевской
премии в 1903 г.
17.
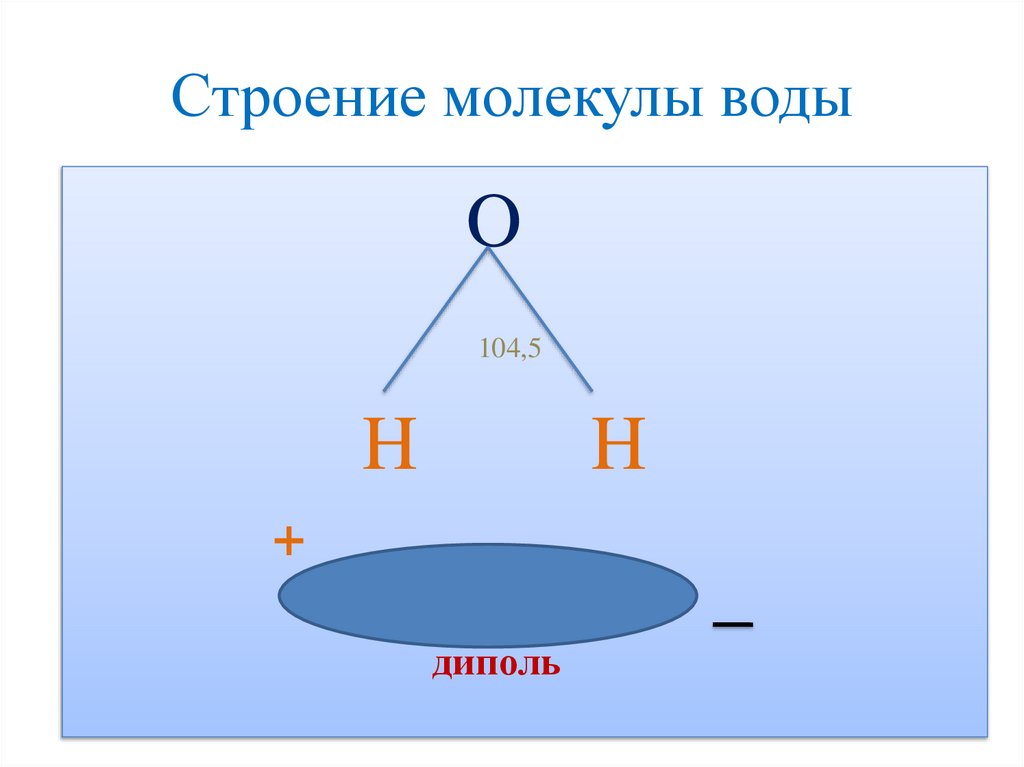
Строение молекулы водыO
104,5
H
H
+
диполь
18.
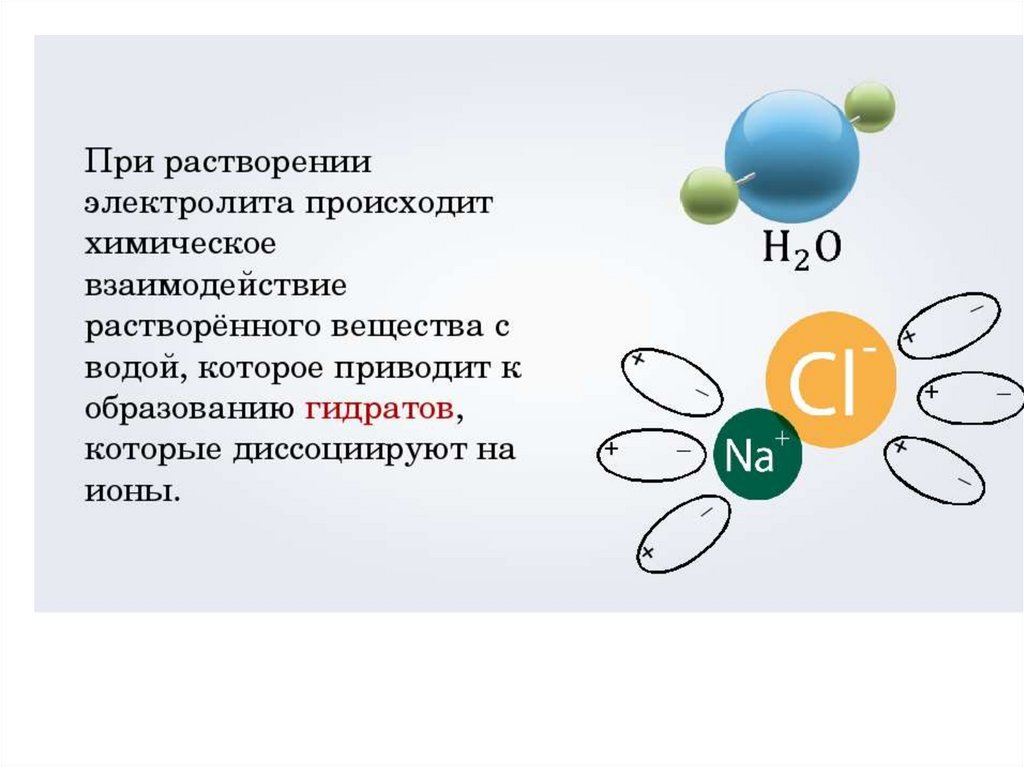
Электролитическая диссоциация –процесс распада электролита на
ионы при растворении его в воде
или расплавлении.
Легче всего диссоциируют вещества с
ионной и ковалентной полярной связью:
Кислоты : HCl, H2SO4, HF, HNO3
Основания: NaOH, Ba(OH)2, KOH
Соли : NaCl, CuSO4, KNO3
19.
20.
21.
22.
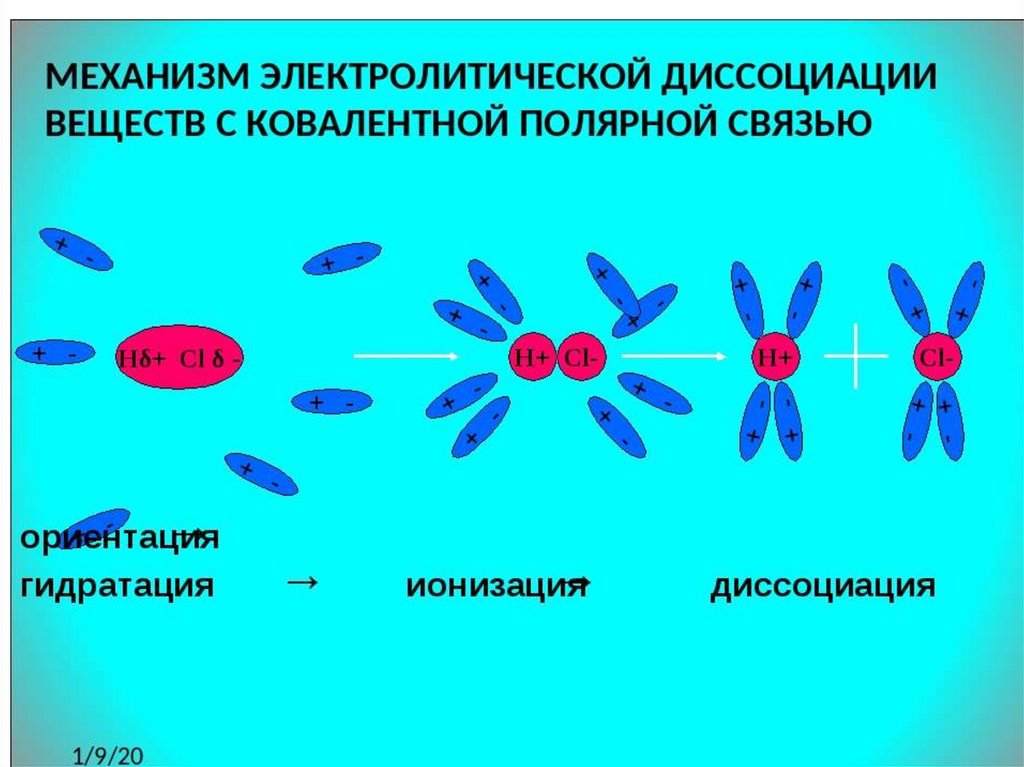
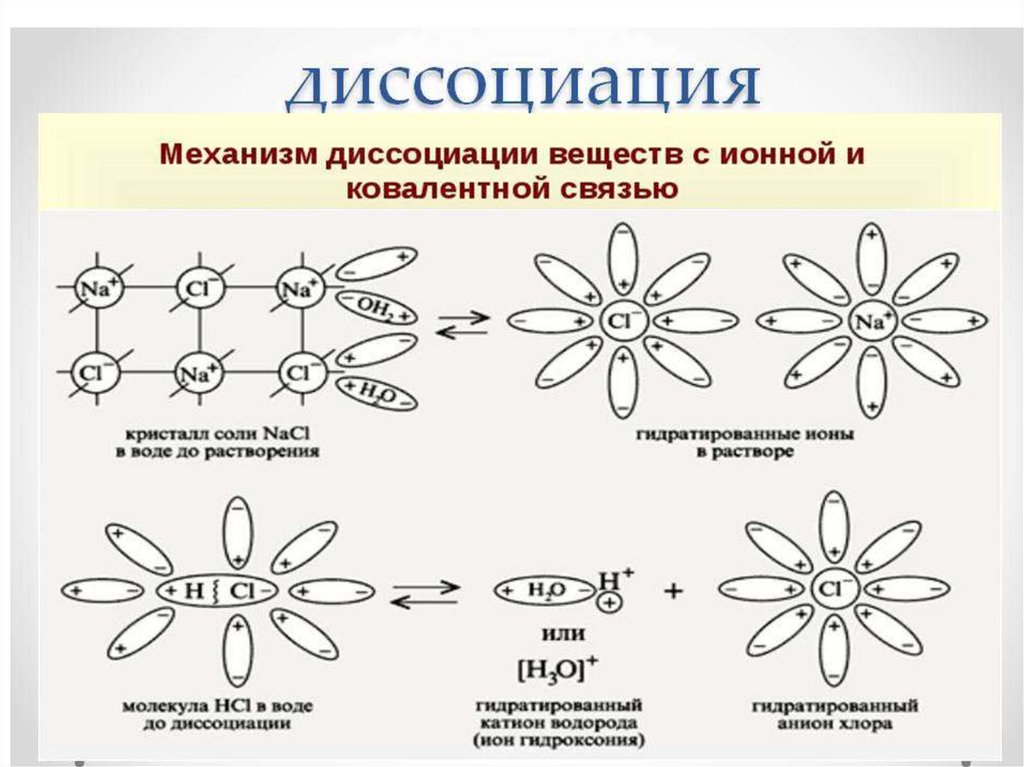
Последовательность процессов, происходящихпри электролитической диссоциации:
Ориентация молекул – диполей воды около
ионов;
Гидратация (взаимодействие) молекул
воды с противоположно заряженными
ионами поверхностного слоя кристалла;
Диссоциация (распад) кристалла
электролита на гидратированные ионы
23.
24.
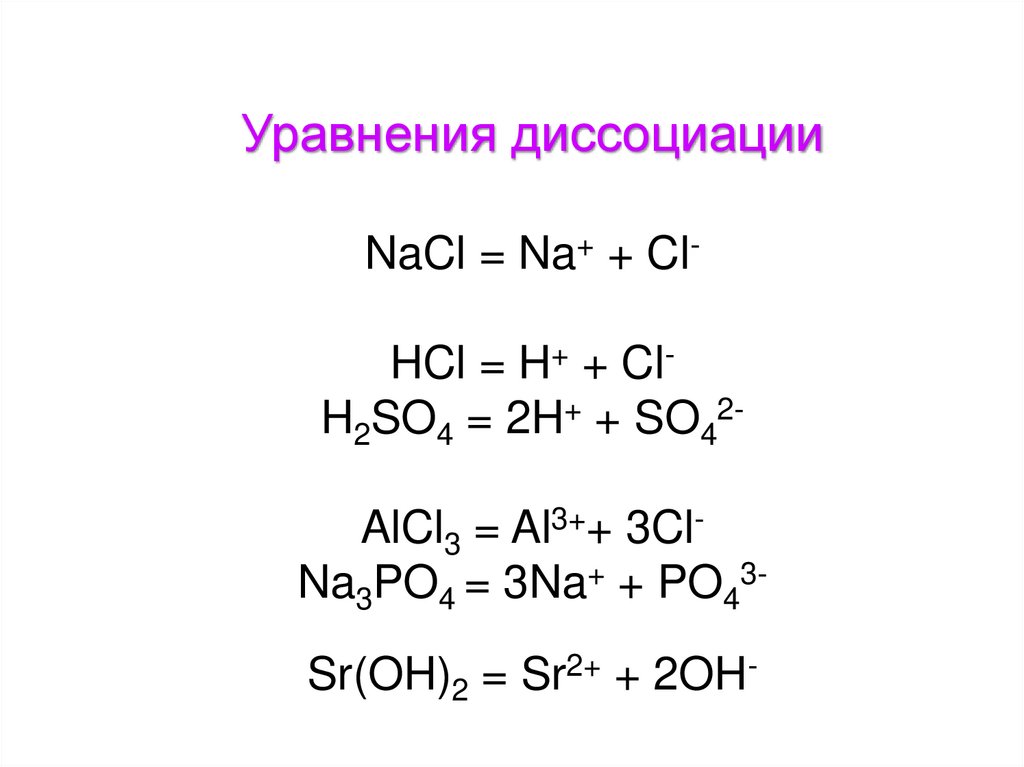
Уравнения диссоциацииNaCl = Na+ + ClHCl = H+ + ClH2SO4 = 2H+ + SO42AlCl3 = Al3++ 3ClNa3PO4 = 3Na+ + PO43Sr(OH)2 = Sr2+ + 2OH-
25.
26.
27.
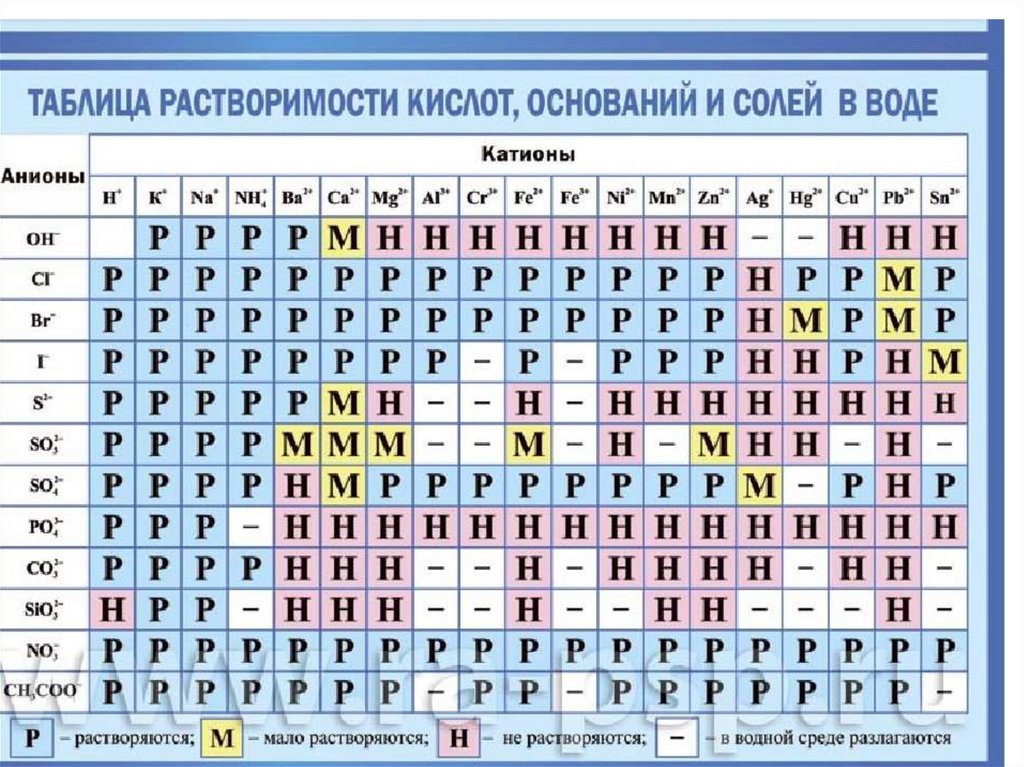
ЭлектролитыСильные
все растворимые соли;
сильные кислоты
H2SO4, H2SeO4, H2TeO4, HCl,
HBr, HI, HNO3, HMnO4,
HReO4, HClO4
все щелочи
NaOH, KOH, LiOH, CsOH и
растворившаяся часть
малорастворимых
оснований группы IIА –
Вa(OH)2, Ca(OH)2, Sr(OH)2
Слабые
слабые кислоты
H2S, H2CO3, HNO2, HF, H3PO4
и т.д.
водный раствор
аммиакаNH3*H2O (NH4OH
= NH4+ + OH-)
органические вещества,
например CH3COOH =
CH3COO- + H+
28.
29.
Степень диссоциации – это отношениечисла частиц, распавшихся на ионы (Nд),
к общему числу растворенных частиц (Nр)
Nд
ά =
Nр
ά – степень диссоциации
Nд - число частиц, распавшихся на ионы
Nр - общее число растворенных частиц
30.
31.
32.
33.
34.
35.
36.
37.
Водородный показатель, рН среды, кислотностьсреды
Если прологарифмировать выражение для ионного
произведения воды
Kв = [H+][OH-] = 10-14, то получим
-lg[H+] + -lg +][OH-] = 14
-lg[H+] = pH это водородный показатель;
-lg +][OH-] =pOH это гидроксидный показатель
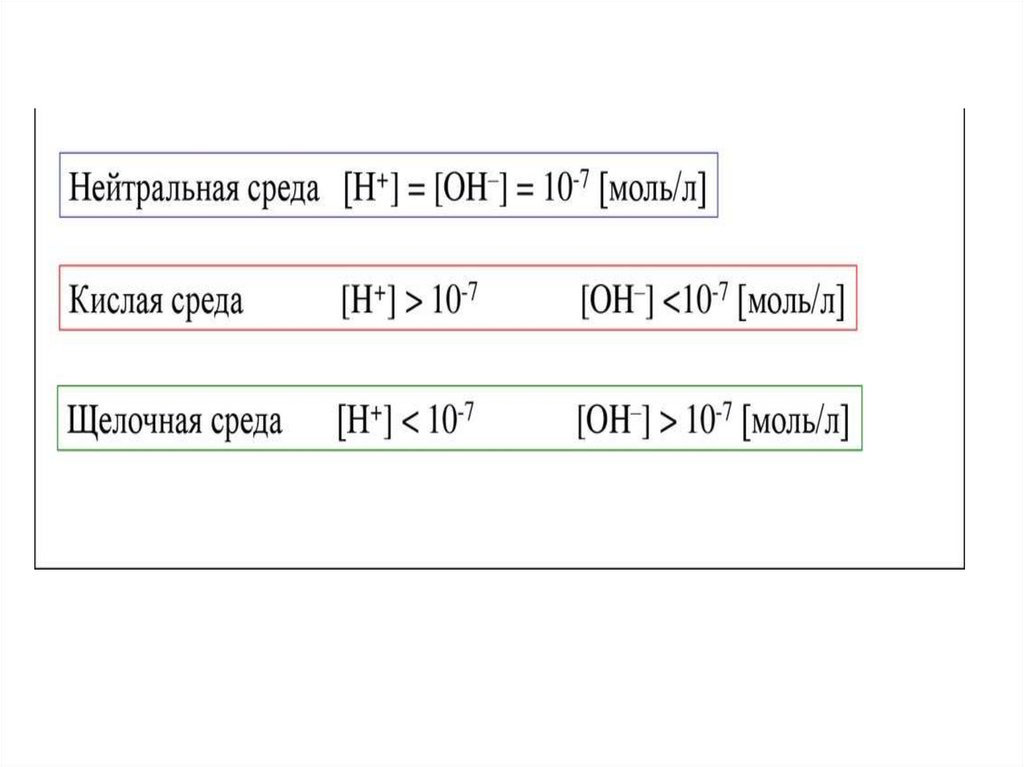
pH+pOH = 14
Кислая среда если рН<7
Щелочная среда если рН>7
Если рН = рОН = 7, то среда нейтральная
рН необходимо контролировать
Приборы – рН-метры
38.
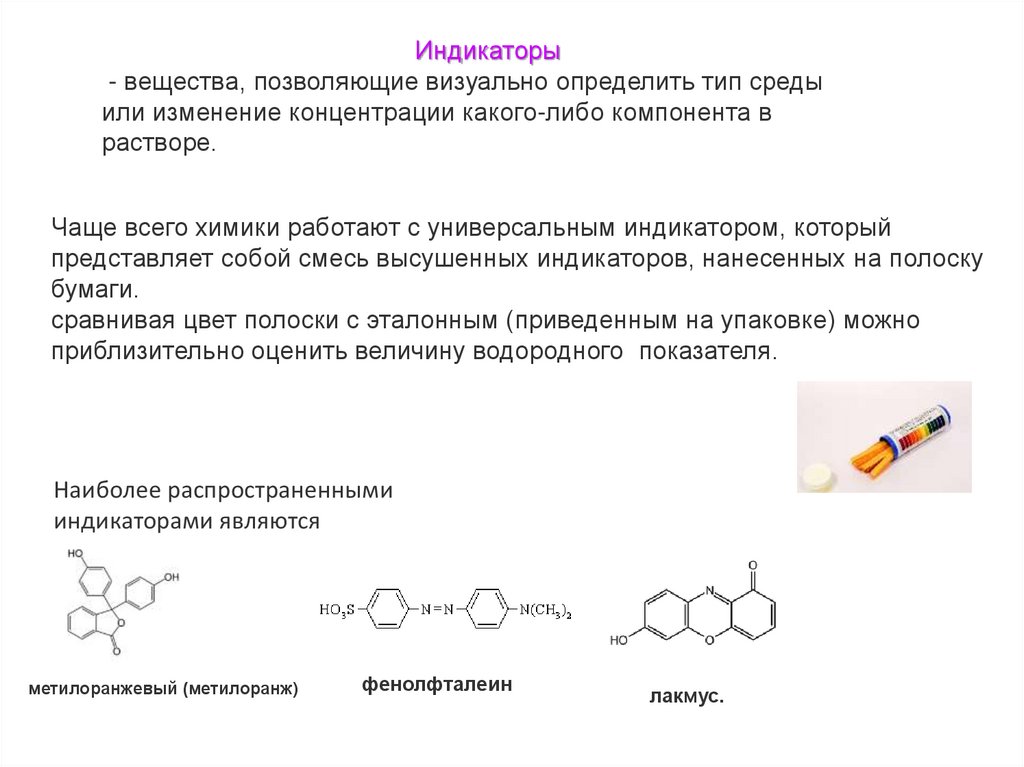
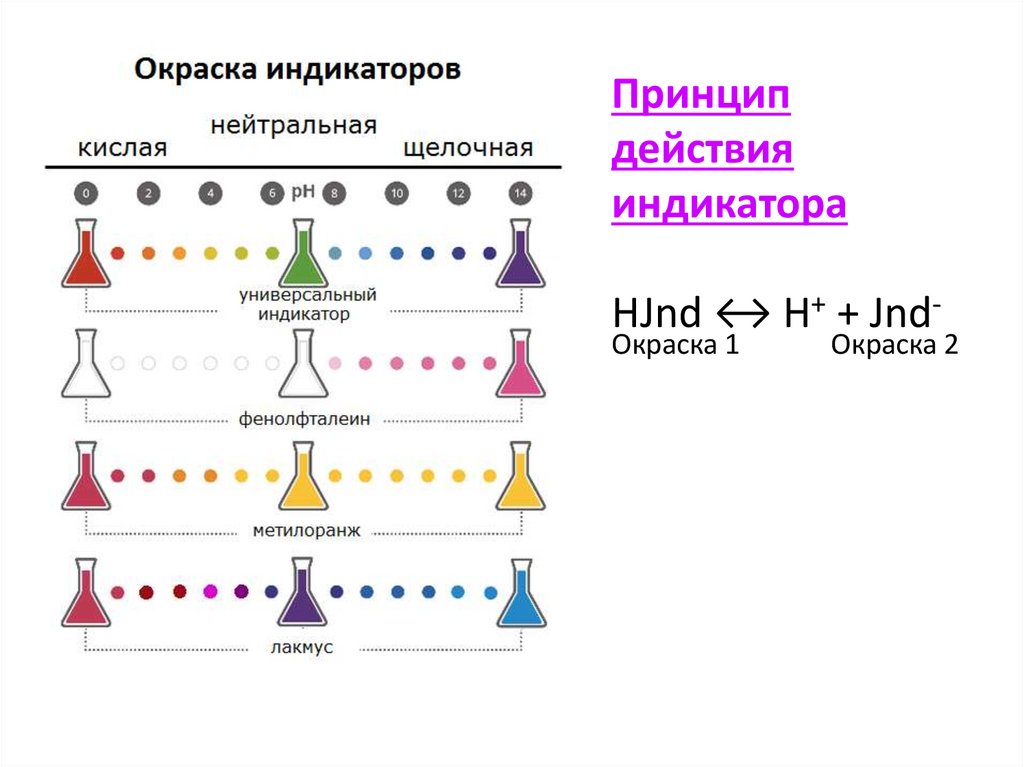
Индикаторы- вещества, позволяющие визуально определить тип среды
или изменение концентрации какого-либо компонента в
растворе.
Чаще всего химики работают с универсальным индикатором, который
представляет собой смесь высушенных индикаторов, нанесенных на полоску
бумаги.
сравнивая цвет полоски с эталонным (приведенным на упаковке) можно
приблизительно оценить величину водородного показателя.
Наиболее распространенными
индикаторами являются
метилоранжевый (метилоранж)
фенолфталеин
лакмус.
39.
Принципдействия
индикатора
HJnd ↔ H+ + JndОкраска 1
Окраска 2
40.
41.
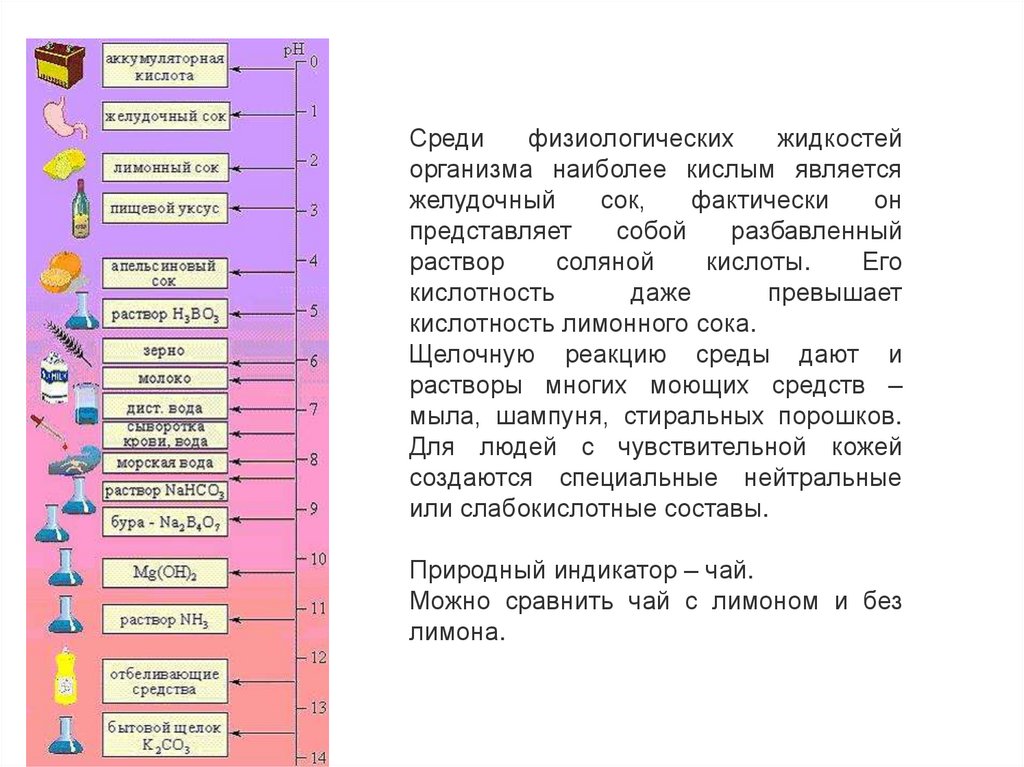
Средифизиологических
жидкостей
организма наиболее кислым является
желудочный
сок,
фактически
он
представляет
собой
разбавленный
раствор
соляной
кислоты.
Его
кислотность
даже
превышает
кислотность лимонного сока.
Щелочную реакцию среды дают и
растворы многих моющих средств –
мыла, шампуня, стиральных порошков.
Для людей с чувствительной кожей
создаются специальные нейтральные
или слабокислотные составы.
Природный индикатор – чай.
Можно сравнить чай с лимоном и без
лимона.




























 Химия
Химия