Похожие презентации:
Теория растворов (лекция 1)
1.
Лекция 1Теория растворов
Рассматриваемые вопросы:
- Введение.
- Смеси. Классификация по размеру частиц растворенного
вещества.
- Раствор как частный случай понятия «смесь». Классификация
растворов.
- Растворимость веществ. Насыщенные и ненасыщенные
растворы. Концентрация растворов.
- Способы выражения концентрации растворов.
- Растворы электролитов. Сильные и слабые электролиты.
- Диссоциация сильных электролитов. Понятие «активности».
- Диссоциация слабых электролитов. Степень и константа
диссоциации. Закон разбавления Оствальда.
- Ионное произведение воды. Водородный и гидроксильный
показатели.
- Расчет рН сильных и слабых кислот и оснований.
- Произведение растворимости.
2.
Курс лекцийпо общей химии
для студентов
ФМХФ
читает Болейко Гелена Михайловна
к.б.н., доцент кафедры Общей химии
МФТИ
3.
Рекомендуемая литература:*дадут на
семинаре...
4.
Рекомендуемая литература:*надо взять в
библиотеке
5.
2. Смеси. Классификация по размеру частицрастворенного вещества.
Чем отличаются смеси от химических соединений?
Химическое
соединение
Смесь веществ
Количествен-ный
состав
постоянный
переменный
Методы
разделения
химические
физические
присутствуют
отсутствуют
Тепловые
эффекты при
6.
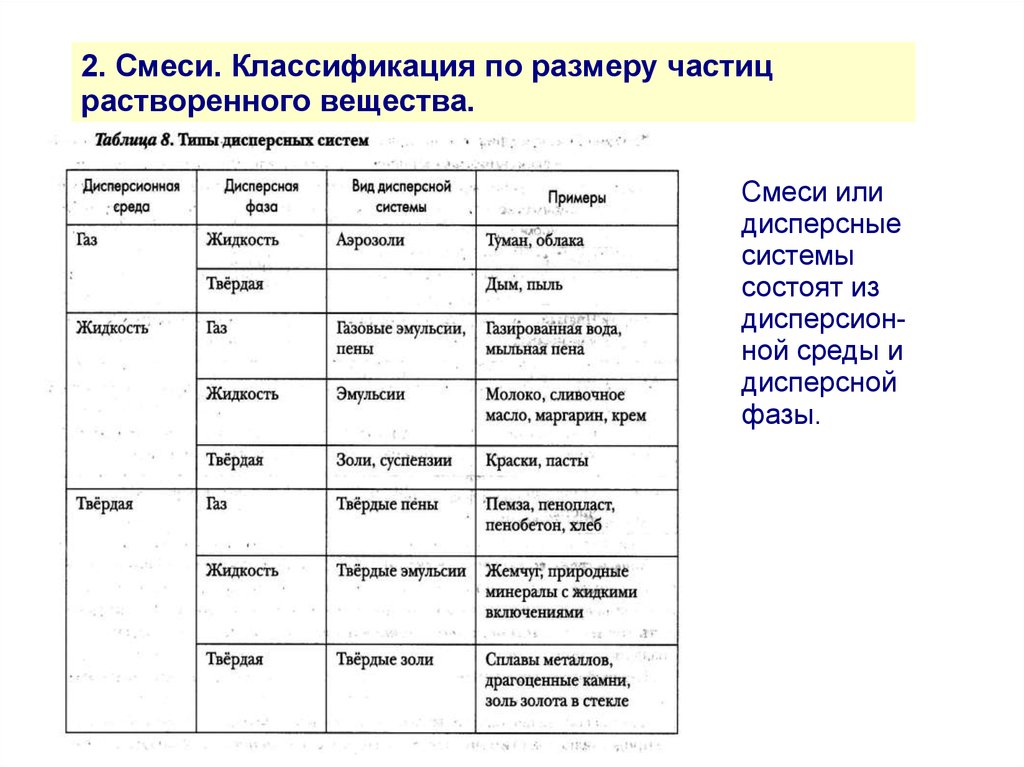
2. Смеси. Классификация по размеру частицрастворенного вещества.
Смеси или
дисперсные
системы
состоят из
дисперсионной среды и
дисперсной
фазы.
7.
2. Смеси. Классификация по размеру частицрастворенного вещества.
По размерам частиц дисперсной фазы смеси можно
разделить на:
- механические
(бетон)
- грубодисперсные d ≥ 1000 нм
(взвесь глины в воде)
- микрогетерогенные 100 > d > 1000 нм
(краски, пасты, молоко)
- коллоидные (неистинные) растворы 1 > d > 100 нм
(чай, большинство жидкостей организма)
- истинные растворы d < 1 нм
(раствор соли в воде)
8.
2. Смеси. Классификация по размеру частицрастворенного вещества.
Эффект Тиндаля
9.
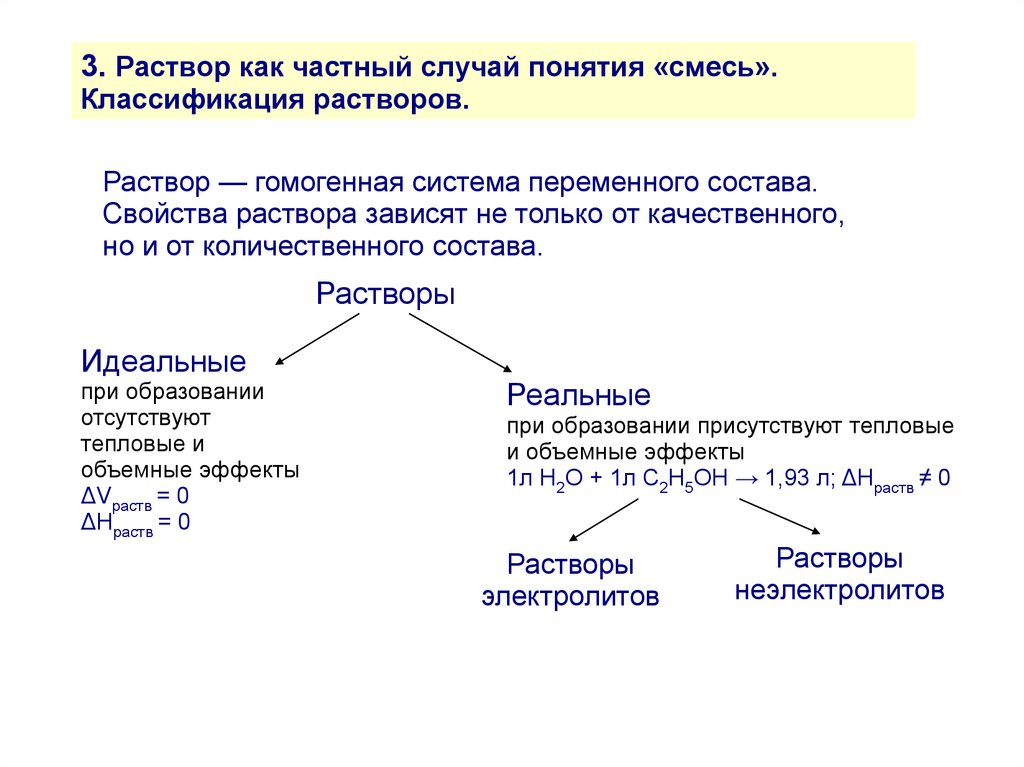
3. Раствор как частный случай понятия «смесь».Классификация растворов.
Раствор — гомогенная система переменного состава.
Свойства раствора зависят не только от качественного,
но и от количественного состава.
Растворы
Идеальные
при образовании
отсутствуют
тепловые и
объемные эффекты
ΔVраств = 0
ΔHраств = 0
Реальные
при образовании присутствуют тепловые
и объемные эффекты
1л Н2О + 1л С2Н5ОН → 1,93 л; ΔHраств ≠ 0
Растворы
электролитов
Растворы
неэлектролитов
10.
4. Растворимость веществ. Насыщенные иненасыщенные растворы. Концентрация растворов.
Растворимость —
способность вещества
(твердого, жидкого или
газообразного)
растворяться в воде
или другом
растворителе.
Выражают в г (соли)/
100 г Н2О.
Зависит от
температуры.
11.
4. Растворимость веществ. Насыщенные иненасыщенные растворы. Концентрация растворов.
Насыщенный раствор —
раствор, находящийся в
контакте (в динамическом
равновесии) со своим осадком
(при данной t°).
Динамическое равновесие:
Vрастворения = Vкристаллизации
Т.о., растворимость — это
концентрация насыщенного
раствора, т.е. максимально
возможная концентрация
данного вещества в данном
растворителе при данной
температуре.
12.
4. Растворимость веществ. Насыщенные иненасыщенные растворы. Концентрация растворов.
Ненасыщенные растворы
Концентрированные
Разбавленные
Концентрация раствора — содержание вещества в единице
объема или массы раствора.
13.
5. Способы выражения концентрации растворов.Безразмерные:
mв− ва
ω=
m р− ра
V в− ва
φ=
V р− ра
Размерные:
Молярная
концентрация
n в− ва
CM =
Vр− ра
Молярная
концентрация
эквивалента
nв− ва экв.
CN =
V р− ра
Моляльная
концентрация
Cm =
Титр
nв− ва
m р− ля
mв− ва
Т=
V р− ра
[моль/л]
[моль/л]
[моль/кг]
[г/мл]
X=
nв− ва
∑ nв− в в р− ре
14.
6. Растворы электролитов. Сильные и слабыеэлектролиты.
Электролиты — это вещества с ионными или полярными
связями, растворы и расплавы которых проводят
электрический ток.
Электролитическая диссоциация — процесс распада
вещества на ионы.
KA → K+ + AИоны — переносчики заряда 2-го рода, электролит —
проводник второго рода.
Справка: переносчики заряда 1-го рода — электроны,
проводники 1-го рода — металлы.
15.
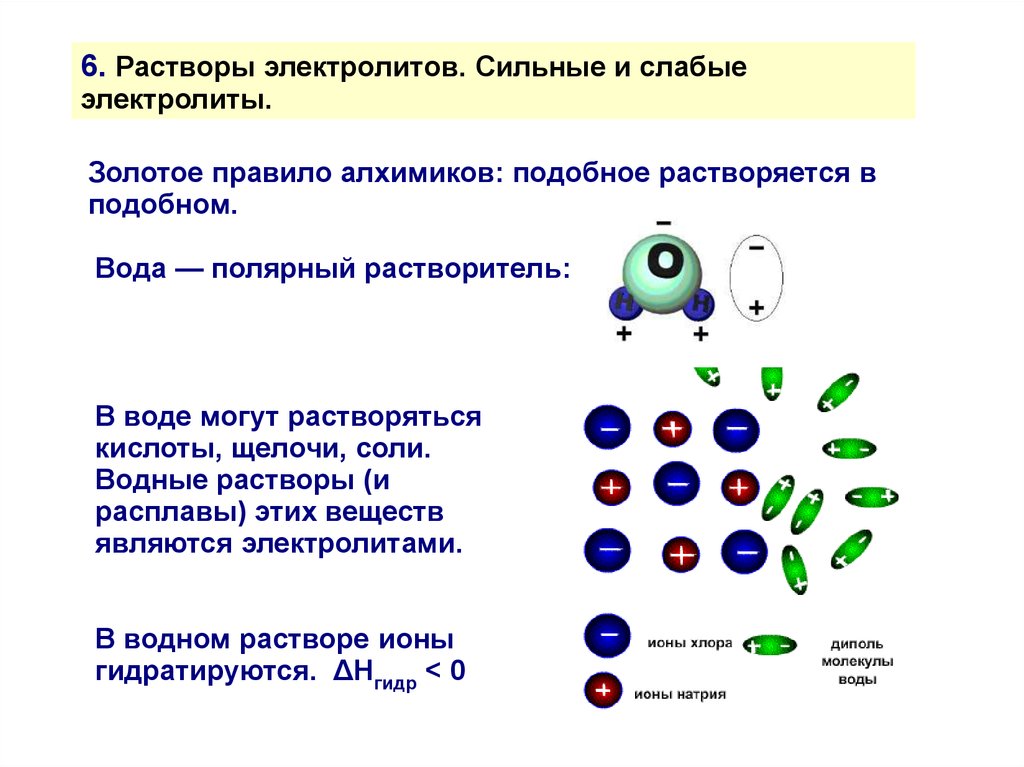
6. Растворы электролитов. Сильные и слабыеэлектролиты.
Золотое правило алхимиков: подобное растворяется в
подобном.
Вода — полярный растворитель:
В воде могут растворяться
кислоты, щелочи, соли.
Водные растворы (и
расплавы) этих веществ
являются электролитами.
В водном растворе ионы
гидратируются. ΔHгидр < 0
16.
6. Растворы электролитов. Сильные и слабыеэлектролиты.
Электролиты
Сильные
Слабые
диссоциируют
полностью
необратимо
KA → K+ + A-
частично
обратимо
KA <=> K+
+ AВ растворе сильного
электролита
присутствуют только
гидратированные
ионы.
В растворе слабого электролита
присутствуют и гидратированные
ионы, и недиссоциирован-ные
молекулы.
При tº = const в растворе слабого
электролита устанавливается
динамическое равновесие:
Vдиссоциации = Vассоциации
17.
6. Растворы электролитов. Сильные и слабыеэлектролиты.
Сильные электролиты:
Слабые электролиты:
1. Практически все соли.
1. Некоторые соли Zn, Cd и
др.
2. Минеральные кислоты:
бескислородные HСl, HBr, HI
2. Минеральные кислоты:
кислородсодержащие:
HnЭOn+2 и HnЭOn+3
HNO3, H2SO4, HClO3, HClO4,
HMnO4
бескислородные H2S, HCN ...
3. Щелочи: гидроксиды
металлов IA и IIA групп (кроме
Be и Mg) — NaOH, Ba(OH)2 и
пр.
кислородсодержащие:
HnЭOn и HnЭOn+1
HNO2, H2SO3, HClO, HClO2,
H3PO4 …
органические кислоты
3. Основания, в т.ч. NH4OH
18.
7. Диссоциация сильных электролитов. Понятие«активности»..
Сильные электролиты диссоциируют полностью и
необратимо =>
- в растворе очень много ионов (гидратированных)
- расстояния между ними малы =>
Подвижность ионов снижается! =>
Снижается активность.
Активность — это эффективная концентрация, в соответствии с
которой вещества проявляют себя в реакциях.
Активность — мера концентрации с учетом электростатических
ионных взаимодействий.
a = fa·CM;
[моль/л]
где а — активность, [моль/л]
СМ — расчетная (аналитическая) концентрация, [моль/л]
fa — фактор активности (определяется
экспериментально либо рассчитывается через ионную
силу раствора)
19.
7. Диссоциация сильных электролитов. Понятие«активности»..
Уравнения диссоциации сильных электролитов:
HNO3 → H+ + NO3Ba(OH)2 → Ba2+ + 2OHAl2 (SO4)3 → 2Al3+ + 3SO42Na3PO4 → 3Na+ + PO43Na2HPO4 → 2Na+ + HPO42AlOHCl2 → AlOH2+ + 2Cl-
20.
8. Диссоциация слабых электролитов. Степень иконстанта диссоциации. Закон разбавления Оствальда.
Уравнения диссоциации слабых электролитов:
HNO2 ↔ H+ + NO2-
НЕВЕРНО! HNO2 = H+ + NO2-
многоосновные кислоты диссоциируют ступенчато:
1) H3PO4 ↔ H+ + H2PO4- , КI = 7,1∙10-3
2) H2PO4- ↔ H+ + HPO42- , КII = 6,2∙10-8
3) HPO42- ↔ H+ + PO43- , КIII= 5,0∙10-13
при 25ºС
Каждая ступень диссоциации характеризуется константой
равновесия.
Как правило, каждая последующая константа отличается от
предыдущей на 5 порядков в меньшую сторону.
21.
8. Диссоциация слабых электролитов. Степень иконстанта диссоциации. Закон разбавления Оствальда.
Константа диссоциации
HNO2 ↔ H+ + NO2Прямой процесс — диссоциация HNO2 → H+ + NO2Обратный процесс — ассоциация H+ + NO2- → HNO2
при tº = const
V пр= k пр⋅ C ( HNO 2 )
V обр = k обр⋅ С ( H + .)⋅ C ( NO−2 . )
В состоянии равновесия обе скорости равны, тогда
k пр [ H + . ]⋅ [ NO−2 . ]
K д=
=
k обр
[ HNO 2 ]
Равновесная концентрация
недиссоциированных молекул
Равновесные
концентрации
ионов
22.
8. Диссоциация слабых электролитов. Степень иконстанта диссоциации. Закон разбавления Оствальда.
Степень диссоциации
HNO2 ↔ H+ + NO2-
при tº = const
C дисс
α=
С общ
Степень диссоциации зависит:
- от природы растворенного вещества и растворителя;
- от концентрации;
- от температуры.
При бесконечном разбавлении α→1 (к 100%)
Электролиты:
- сильные
α > 30%
- средней силы 3% < α < 30%
- слабые
α < 3%
для 0,1 М р-ров при 25ºС
23.
8. Диссоциация слабых электролитов. Степень иконстанта диссоциации. Закон разбавления Оствальда.
Закон разбавления Оствальда
связывает между собой обе характеристики слабого
электролита — степень и константу диссоциации.
HNO2 ↔ H+ + NO2-
при tº = const
[ H + . ]⋅ [NO −2 . ]
K д=
[ HNO 2]
C дисс
α=
С общ
Сдисс = α·Собщ = [H+] = [NO2-]
Cнедисс = Собщ — Сдисс = Собщ — α·Собщ = Собщ ·(1-α) =
[HNO2]
α 2⋅ С общ
K д=
1− α
При α << 1
Кд
≈ α2·Собщ
24.
9. Ионное произведение воды. Водородный игидроксильный показатели.
Вода — слабый амфотерный электролит.
H2O ↔ H+ + OН-
при tº = 25ºС
[ H + . ]⋅ [OH − . ]
K д=
= 1,8⋅ 10− 16
[ H 2 O]
Практически все молекулы воды находятся в
недиссоциированном состоянии,
т.е. [Н2О] = СМ (Н2О) = const при данной tº
СМ (Н2О) = m(H2O) / M(H2O)·V(H2O) = 1000г/18(г/моль)·1л = 55,56 моль
Тогда [H+]·[ОН-] = Кд·[Н2О] = 10-14
Кw = [H+]·[ОН-] = 10-14
Ионное произведение воды
25.
9. Ионное произведение воды. Водородный игидроксильный показатели.
H2O ↔ H+ + OНКw = [H+]·[ОН-] = 10-14
справедливо для любого водного раствора
В чистой дист. воде [H+] = [ОН-] = √10-14 = 10-7 моль/л
В растворе щелочи [H+] < [ОН-], т.е. [H+] < 10-7 моль/л
В растворе кислоты [H+] > [ОН-], т.е. [H+] > 10-7 моль/л
[H+] и [ОН-] - средообразующие ионы!
При увеличении в растворе [H+] или [ОН-] концентрация
противоионов уменьшается вследствие смещения равновесия
системы в сторону образования молекул Н2О.
Т.о., в кислом или щелочном растворе абсолютные значения
ионов [H+] и [ОН-] изменяются, но их произведение остается
постоянным!
26.
9. Ионное произведение воды. Водородный игидроксильный показатели.
H2O ↔ H+ + OНКw = [H+]·[ОН-] = 10-14
Вопрос: как изменится Кw при увеличении температуры?
Кw = 55·10-14 при tº = 100ºC
27.
9. Ионное произведение воды. Водородный игидроксильный показатели.
H2O ↔ H+ + OНКw = [H+]·[ОН-] = 10-14
Водородный показатель:
рН = -lg (aH+) или рН = -lg [H+]
Гидроксильный показатель:
рОН = -lg (a ОH-) или рОН = -lg [ОH-]
следовательно,
рН + рОН = 14
для любого водного раствора
28.
9. Ионное произведение воды. Водородный игидроксильный показатели.
В чистой дист. воде рH = рОН = 7
В растворе щелочи рH > рОН, т.е. рH > 7
В растворе кислоты рH < рОН, т.е. рH < 7
ФЕНОЛФТАЛЕИН
МЕТИЛОВЫЙ
ОРАНЖЕВЫЙ
ЛАКМУС
УНИВЕРСАЛЬНЫЙ
ИНДИКАТОР
Кислая среда
Нейтральная
Щелочная
29.
Произведение растворимости:Произведение растворимости (ПР) — это произведение
равновесных концентраций ионов электролита в
НАСЫЩЕННОМ растворе, взятых в степенях их
стехиометрических коэффициентов.
PbI2 (тв) ↔ Pb2+ (раств) + 2I- (раств)
[ Pb2+ . ]⋅ [I− . ]2
K р=
[PbI2 ]
при tº = const
ПР (PbI2 )= K р⋅ [PbI2 ]= [Pb2+ . ]⋅ [ I− . ]2
В насыщенном растворе электролита произведение
концентраций его ионов, взятых в степенях их
стехиометрических коэффициентов, есть величина
постоянная при данной температуре.
30.
Произведение растворимости:Как определить РАСТВОРИМОСТЬ труднорастворимого
электролита, зная его ПР?
PbI2 (тв) ↔ Pb2+ (раств) + 2I- (раств)
х моль
х моль
2х моль
ПР ( PbI 2 )= [ Pb 2+ . ]⋅ [ I − .]2 = 8,6⋅ 10− 9 (из таблицы)
или
2
3
−9
ПР
x⋅
(2x)
=
4x
=
8,6⋅
10
х =( PbI
[PbI22)=
]
=
S
(PbI
)
(раств)
2
S — растворимость вещества при данной tº.
S=
√ √
3
ПР 3 8,6⋅ 10− 9
−3
=
= 1,3⋅ 10 моль/ л
4
4
31.
Условия выпадения и растворения осадков:Если в некотором произвольном растворе произведение
концентраций (ПК) ионов меньше, чем произведение
растворимости (ПР) при данной tº, осадок не образуется. Если
больше или равно — образуется.
Например, образуется ли осадок при сливании равных объемов 0,002 М
растворов Pb(NO3)2 и KI?
Pb(NO3)2 + 2KI → PbI2 ↓ + 2KNO3
0,002 моль 0,002 моль
После разбавления в 2 раза 0,001 моль 0,001 моль
Определяем ПК: ПК = [Pb2+]∙[I-]2 = 10-3∙(10-3)2 = 10-9
10-9 < 8,6·10-9
ПК < ПР
Следовательно, осадок не образуется.
32.
Определение рН сильных электролитов:Для сильных электролитов активность средообразующих ионов
равна активности самого электролита.
1. Записываем диссоциацию электролита.
2. Определяем средообразующие ионы.
3. Для сильных кислот
ан+ = fa·CM(кислоты)
Для сильных оснований (щелочей)
аОн- = fa·CM(основания)
4. Берем -lg от этой величины и находим соответствующий
показатель: рН или рОН.
5. Для определения рН щелочи производим еще одно действие:
рН = 14 - рОН
33.
9. Ионное произведение воды. Водородный игидроксильный показатели.
ЗАДАЧИ:
1. Определите рН 0,05М раствора HCl.
2. Определите рН 0,05М раствора NaOH.
3. Определите рН 0,05М раствора HNO2.
4. рН 0,05М раствора NH4OH.
Вариации:
- при известном рН или рОН определить [H+] или [ОН-] в
растворе;
- сравнить содержание [H+] в разных растворах: кислоты и
щелочи, слабой и сильной кислоты, кислоты или щелочи до и
после разбавления.
Задача для подумать:
рН в растворе NaOH равен 8. Каким будет рН раствора после
разбавления в 100 раз?
34.
В лекции использованы материалы профессорахимического факультета МГУ им. Ломоносова
Еремина Вадима Владимировича
Спасибо
за внимание!































 Химия
Химия








