Похожие презентации:
Растворы. Растворимость
1. РАСТВОРЫ
2.
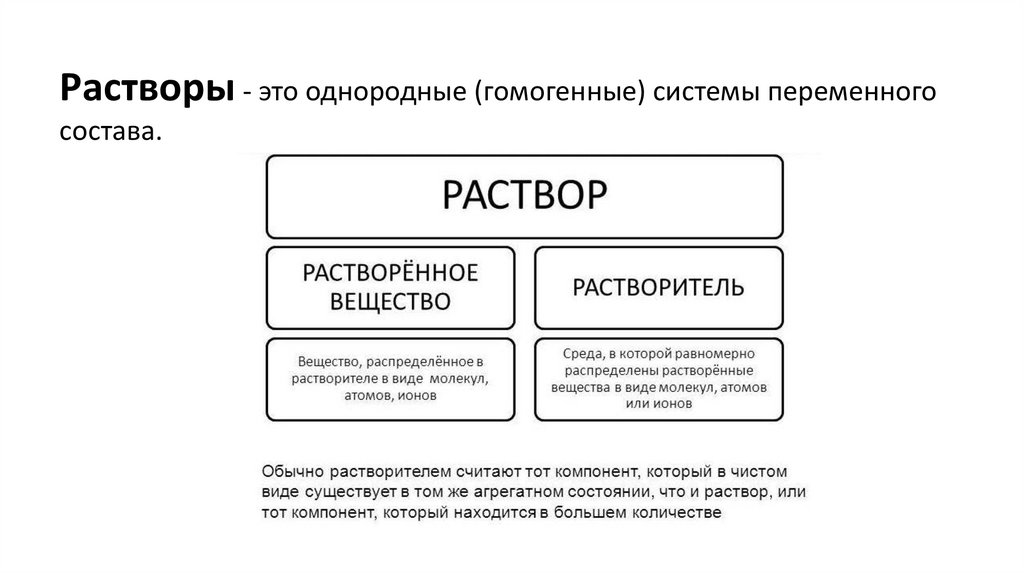
Растворы - это однородные (гомогенные) системы переменногосостава.
3.
Количество (масса) растворенного вещества в единице массы или объема раствора называютконцентрацией раствора.
Способы выражения концентрации растворов:
Массовая доля – это масса вещества в 100 г раствора:
Молярная концентрация – это количество вещества в 1 л раствора:
Молярная концентрация эквивалента (нормальная концентрация)
– это число эквивалентов вещества в 1 л раствора:
4.
Задача. Вычислите массы соли и воды, необходимые дляприготовления 750 г 20%-ного раствора NH4Cl.
Решение. Масса растворенной соли составляет 20% от
массы раствора:
750 20
m(NH4Cl) =
= 150 (г)
100
масса растворителя – 80% от массы раствора:
750 80
m(растворителя) =
= 600 (г).
100
5.
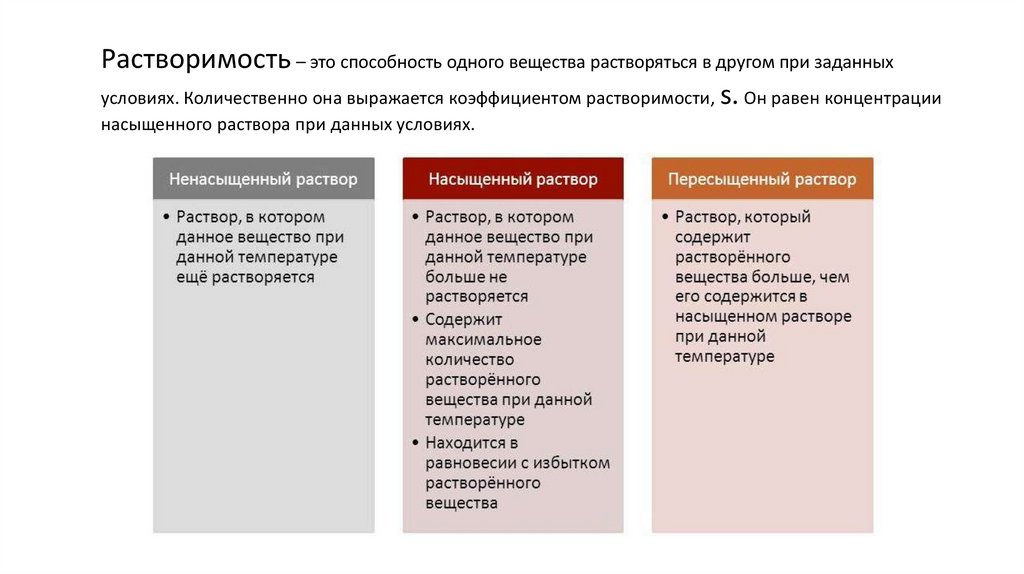
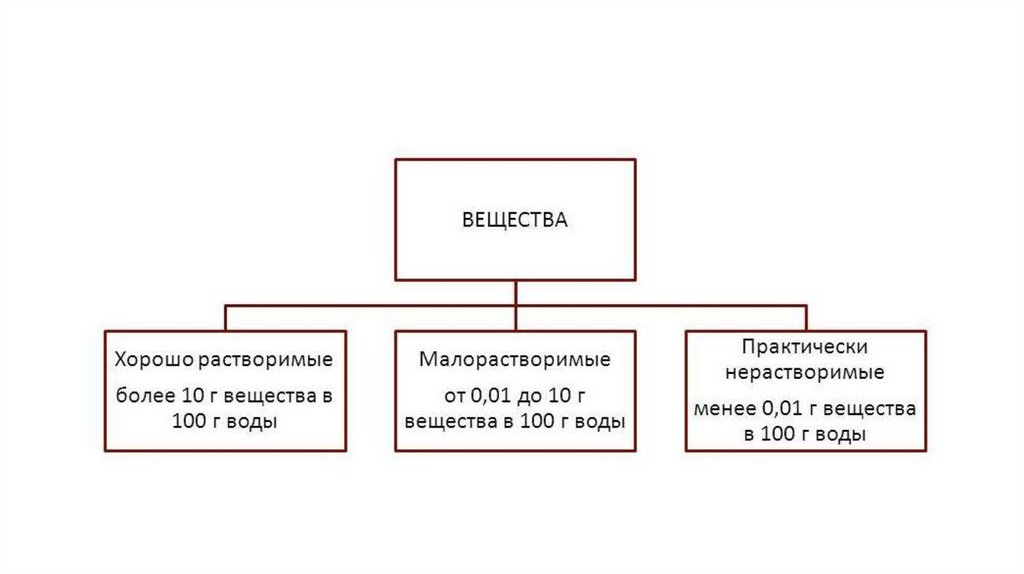
Растворимость – это способность одного вещества растворяться в другом при заданныхусловиях. Количественно она выражается коэффициентом растворимости, s. Он равен концентрации
насыщенного раствора при данных условиях.
6.
7.
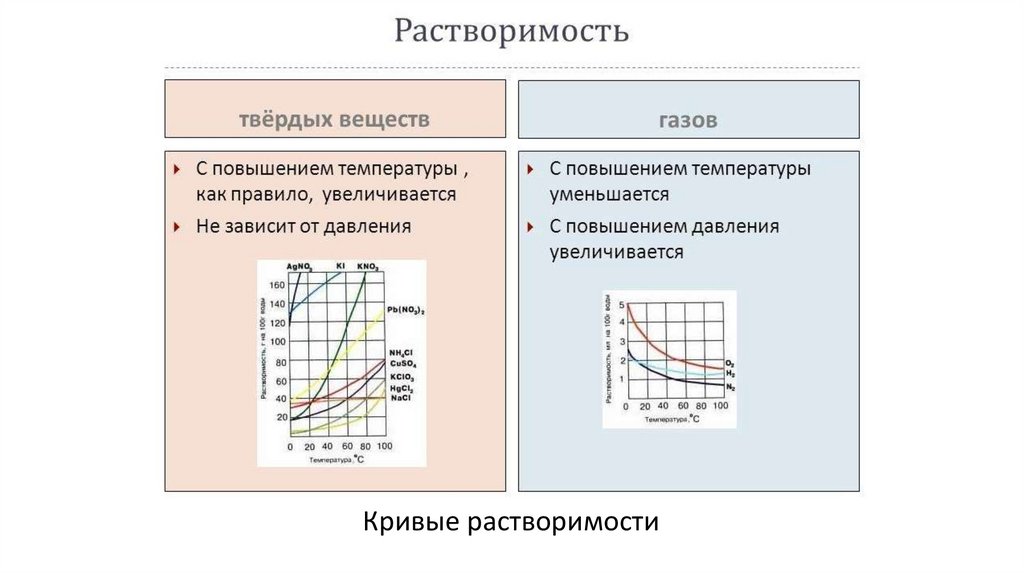
Кривые растворимости8.
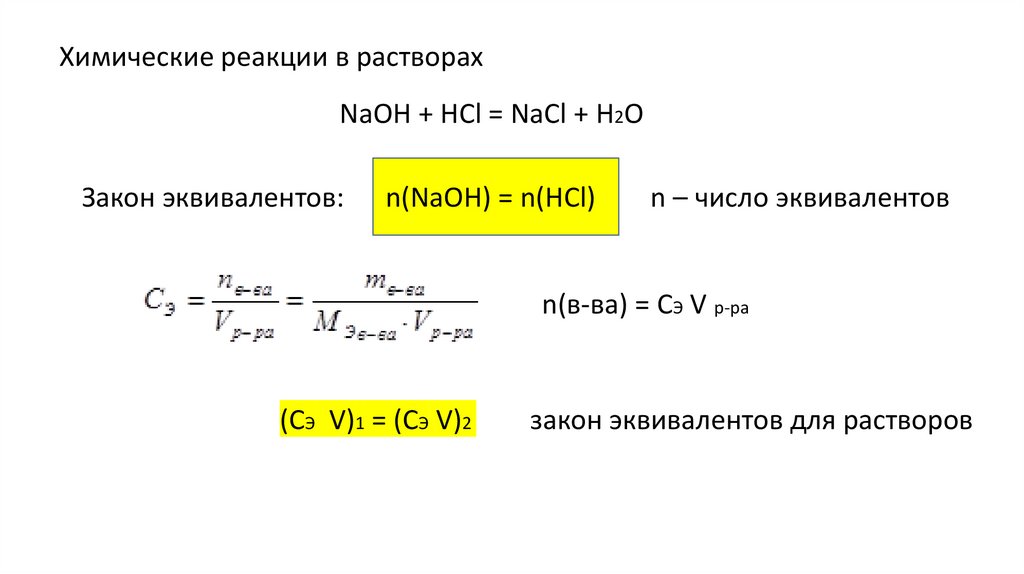
Химические реакции в растворахNaOH + HCl = NaCl + H2O
Закон эквивалентов:
n(NaOH) = n(HCl)
n – число эквивалентов
n(в-ва) = СЭ V р-ра
(СЭ V)1 = (СЭ V)2
закон эквивалентов для растворов
9.
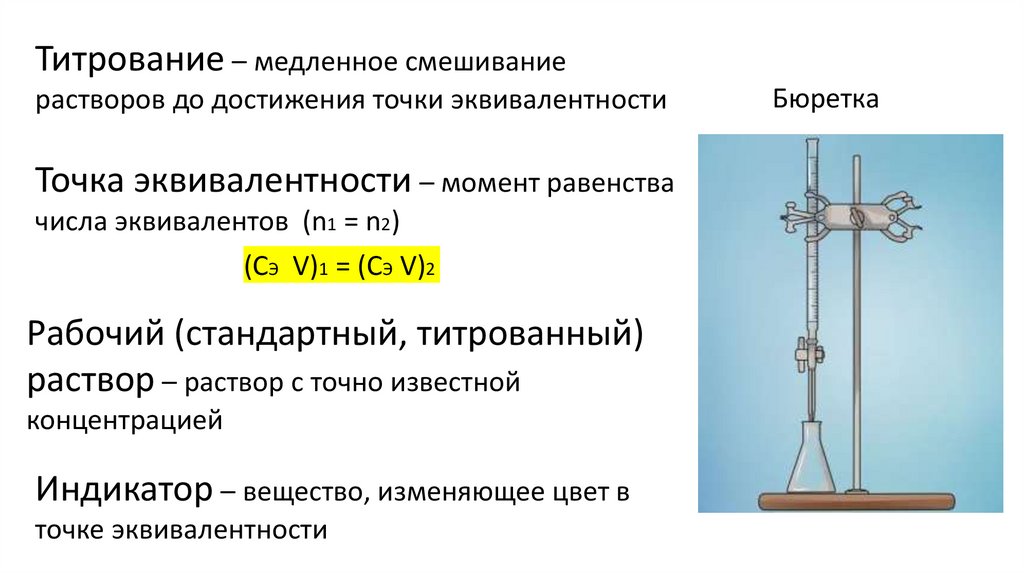
Титрование – медленное смешиваниерастворов до достижения точки эквивалентности
Точка эквивалентности – момент равенства
числа эквивалентов (n1 = n2)
(СЭ V)1 = (СЭ V)2
Рабочий (стандартный, титрованный)
раствор – раствор с точно известной
концентрацией
Индикатор – вещество, изменяющее цвет в
точке эквивалентности
Бюретка
10.
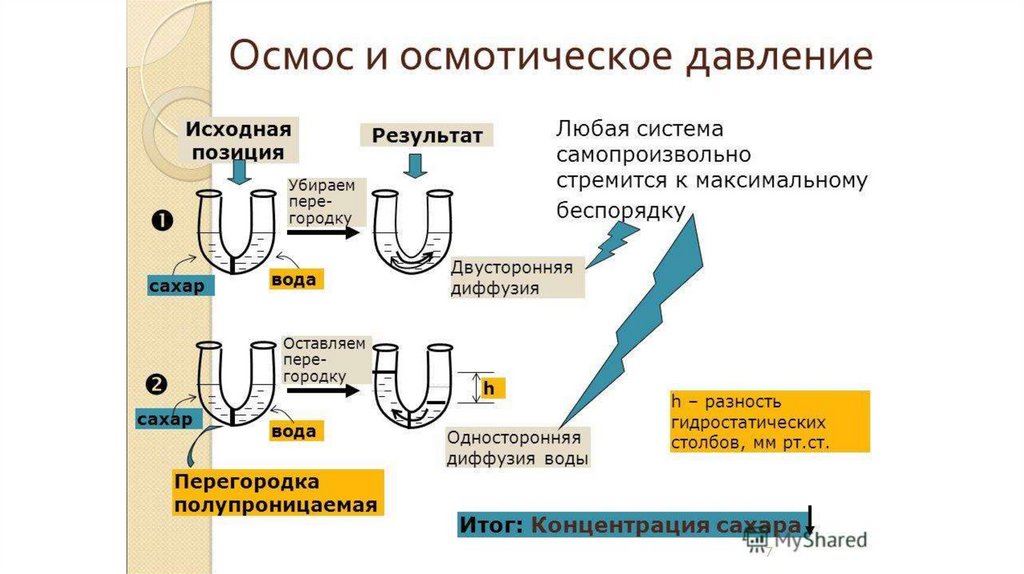
11. Свойства растворов
• Общие (коллигативные) свойства – зависят толькоот концентрации растворов и не зависят от природы
растворенного вещества
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
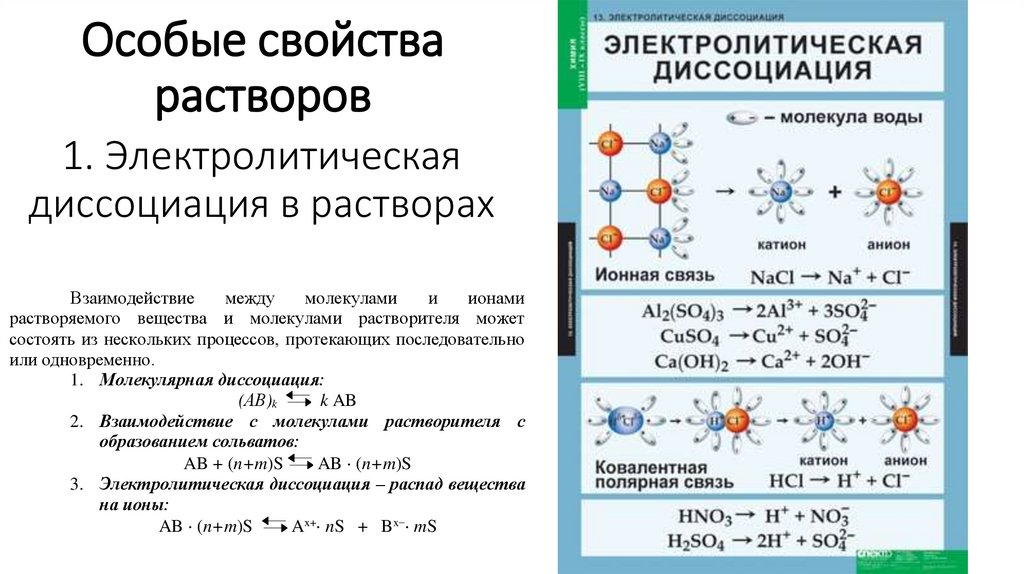
22. Особые свойства растворов
1. Электролитическаядиссоциация в растворах
Взаимодействие
между
молекулами
и
ионами
растворяемого вещества и молекулами растворителя может
состоять из нескольких процессов, протекающих последовательно
или одновременно.
1. Молекулярная диссоциация:
(АВ)k
k AB
2. Взаимодействие с молекулами растворителя с
образованием сольватов:
AB + (n+m)S
AB (n+m)S
3. Электролитическая диссоциация – распад вещества
на ионы:
AB (n+m)S
Ax+ nS + Bx mS
23.
Степень диссоциации:= Nдис / Nобщ = Сдис / Собщ,
где N – число молекул; С – концентрация электролита
в растворе.
Электролиты
Слабые (α<0,03)
Сильные (α>0,3)
• некоторые кислоты (HCl, H2SO4, HNO3, HClO4, HBr, HI),
• щелочи (NaOH, KOH, Ca(OH)2, Ba(OH)2 и др.)
• практически все соли.
В растворах сильные электролиты практически полностью
распадаются на ионы (диссоциация сильных электролитов
необратимая и одноступенчатая):
Al2(SO4)3 2 Al3+ + 3 SO4 2
• слабые кислоты (все остальные),
• NH4OH
• H2O
Диссоциация слабых электролитов - процесс
обратимый и ступенчатый, в растворах находятся
молекулы
H3PO4
3H+ + PO4 3
24. Реакции обмена в растворах
Равновесие реакций обмена в растворах смещено в сторонуобразования осадков, газов, молекул слабых электролитов.
В ионном виде реакции обмена записывают следующим
образом:
- сильные растворимые в воде электролиты пишут в виде ионов;
- слабые электролиты, осадки и газы записывают в виде молекул:
H2SO4
Na2SO4 + 2HNO2
сильная
растворимая
слабая
кислота
в воде соль
кислота
(реакция в молекулярном виде)
2Na+ + 2NO2 + 2H+ + SO42
2Na+ + SO42 + 2HNO2
(полное ионное уравнение реакции)
2NaNO2
растворимая
в воде соль
+
2NO2 + 2H+
2HNO2
(сокращенное ионное уравнение реакции)
25.
Свойствахимических
соединений
в
растворах
определяются характером их диссоциации:
+
HCl H + Cl (кислоты при диссоциации дают ионы Н+);
NaOH Na+ + OH (основания при диссоциации дают ионы ОН );
NaCl Na+ + Cl (cоли при диссоциации дают катионы
металлов и анионы кислотных остатков).
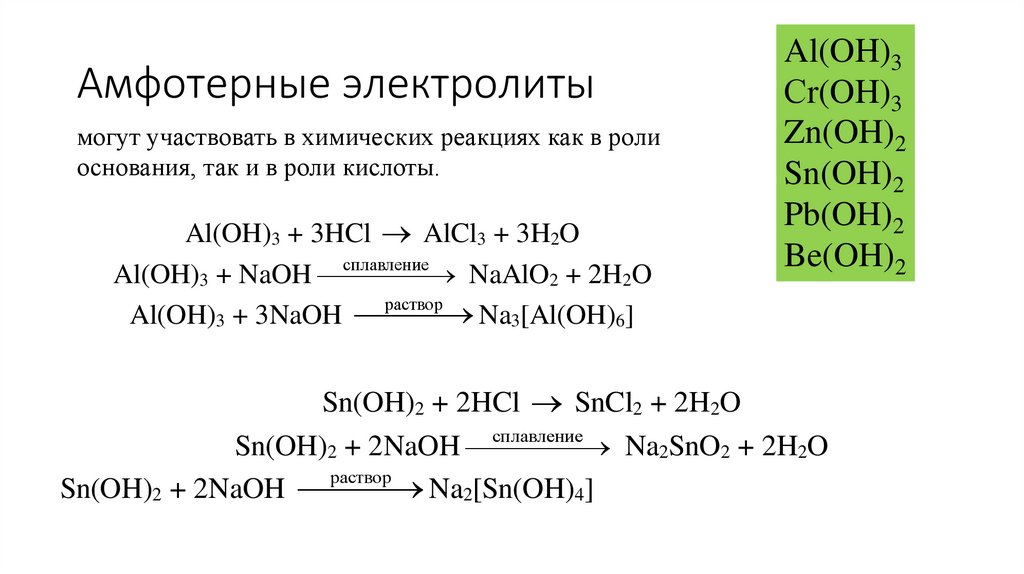
26. Амфотерные электролиты
могут участвовать в химических реакциях как в ролиоснования, так и в роли кислоты.
Al(OH)3 + 3HCl AlCl3 + 3H2O
NaAlO2 + 2H2O
Al(OH)3 + NaOH сплавление
раствор
Na3[Al(OH)6]
Al(OH)3 + 3NaOH
Al(OH)3
Сr(OH)3
Zn(OH)2
Sn(OH)2
Pb(OH)2
Be(OH)2
Sn(OH)2 + 2HCl SnCl2 + 2H2O
Na2SnO2 + 2H2O
Sn(OH)2 + 2NaOH сплавление
раствор
Sn(OH)2 + 2NaOH Na2[Sn(OH)4]
27. Теория сильных электролитов
Активность – кажущаяся концентрация ионов,проявляющаяся в их взаимодействии:
a = f C ( f – коэффициент активности).
Чем меньше коэффициент активности, тем больше взаимодействие между ионами.
Коэффициент активности зависит
от общей концентрации ионов в
растворе (ионной силы раствора):
= ½ Ci Zi2,
уравнение Дебая-Хюккеля:
- ионная сила раствора;
Ci – концентрации ионов в растворе;
Zi – заряды ионов.
28.
Задача. Рассчитайте ионную силу раствора, содержащего0.02 моль/л CaCl2 и 0.05 моль/л Na2SO4.
Решение. Так как растворимые соли представляют собой
сильные электролиты, то в растворе они полностью
диссоциированы на ионы:
CaCl2 Ca2+ + 2Cl–
Na2SO4 2Na+ + SO42–
[Ca2+] = C(CaCl2) = 0.02 моль/л;
[Cl–] = 2C(CaCl2) = 0.04 мольт/л;
[Na+] = 2C(Na2SO4) = 0.1 моль/л;
[SO42–] = C(Na2SO4) = 0.05 моль/л.
=1/2{[Ca2+] Z2(Ca2+)+[Cl–] Z2(Cl–)+[Na+] Z2(Na+)+[SO42–] Z2(SO42–)}
1
= (0,02 22 + 0,04 12 + 0,1 12 + 0,05 22) = 0,21 моль/л.
2
29. Теория слабых электролитов
Диссоциация слабыхэлектролитов процесс обратимый и
ступенчатый, для него
устанавливается
состояние
химического
равновесия, которое
характеризуется
константой
равновесия константой
диссоциации.
1 ступень: H3PO4
2 ступень: H2PO4
3 ступень: HPO4 2
H+ + H2PO4 ; K1 =
[H ] [H2 PO4 ]
[H3 PO4 ]
H + HPO4 2 ; K2 =
[H ] [H PO4
H + PO4 3 ; K3 =
[H ] [ PO4
+
+
2
[H2 PO4 ]
3
2
[HPO4 ]
=8 10 3
]
]
=6 10 8
=2 10 12
Суммарный процесс:
H3PO4
3H + PO4 3 ; K =
+
[H ]3 [ PO4
3
]
= К1 К2 К3=1 10 21
[H3 PO4 ]
[H+], [H2PO4 ], [HPO4 2 ], [PO4 3 ], [H3PO4] - равновесные
концентрации ионов;
К1, К2, К3 - ступенчатые константы диссоциации;
К - общая константа диссоциации.
30.
Диссоциация слабого бинарного электролитаCH3COO + H+
CH3COOH
Если начальная концентрация электролита равна С, а степень диссоциации ,
Cдис
Сдис Собщ С
Собщ
[CH3COO-] = [H+] = C
[CH3COO-] = C - C
H CH COO
K
3
CH 3COOH
для 1
C 2 2
C 2 2
C 2
C C C 1 1
2
K=C
и
K
C
Закон разбавления Оствальда
31.
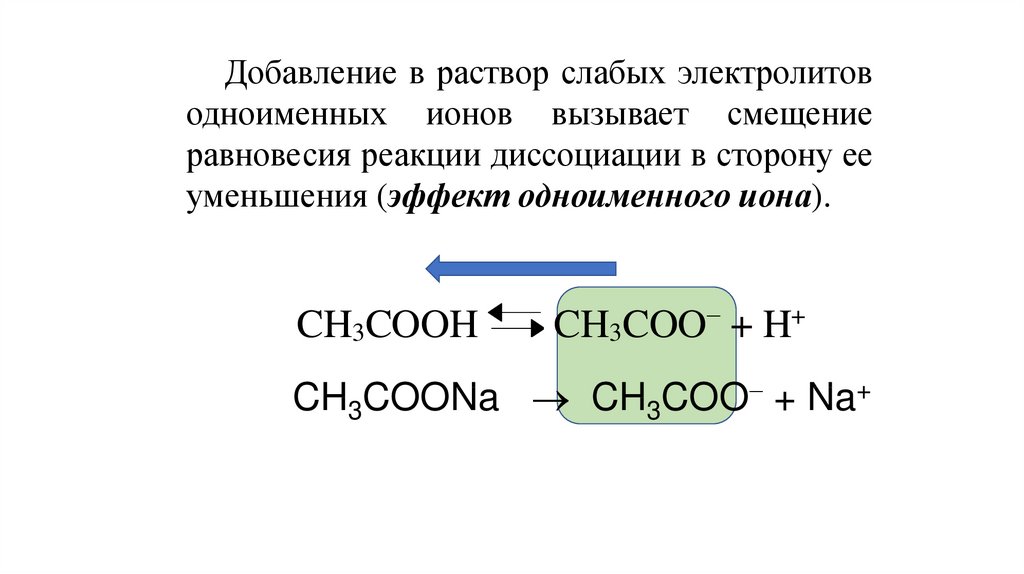
Добавление в раствор слабых электролитоводноименных ионов вызывает смещение
равновесия реакции диссоциации в сторону ее
уменьшения (эффект одноименного иона).
CH3COOH
CH3COO + H+
CH3COONa CH3COO + Na+
32. Электролитическая диссоциация воды
Н2О-
Н + ОН + 55,90 кДж/моль
+
[H2O]= n(H2O)/1л = 1000/18 = 55,5 моль/л
K[H2O] = 1,8 10 16 55,5 = 10 14 = [H+] [OH ] = KH2O
(ионное произведение воды)
33.
t, CKH2O
10
22
30
100
0,4 10 14 1,0 10 14 1,9 10 14 74 10 14
В нейтральном растворе концентрации ионов водорода и
гидроксид-ионов равны: [H+] = [OH-] = 10 14 = 10 7 моль/л.
В кислом растворе [Н+] > [OH-]; [H+] >10 7 моль/л.
В щелочном растворе [H+] < [OH-]; [H+]< 10 7 моль/л.
Водородный показатель, рН:
рН = –lg[H+]
Гидроксильный показатель, рОН: рОН = –lg[ОH-]
рН + рОН = 14
В нейтральном растворе рН = рОН = 7.
В кислом растворе рН < 7.
В щелочном растворе рН > 7.
34. Кислотно-основные индикаторы
вещества, меняющее окраску в определенной области значения pH раствора.Цвет
Индикатор
кислотная
щелочная
форма
форма
Метилоранж
красный
желтый
Фенолфталеин бесцветный.
красный
Лакмус
красный
синий
Область
перехода
окраски,
рН
3,2 – 4,5
8,2 – 10,0
6,0 –9,0
35.
Задача. Рассчитайте pH 0.01 M раствора NaOH.Решение. Так как NaOH является сильным электролитом,
то он полностью диссоциирует в растворах:
NaOH Na+ + OH
[OH ] = C(NaOH) = 10 2 моль/л.
[H+] = 10 [OH ] = 10 2 моль/л.
pH = –lg [H+] = 12.
36.
Задача. Рассчитайте pH 0.01 M раствора of CH3COOH.Решение. Уксусная кислота – слабый электролит,
диссоциирующий обратимо: CH3COOH
CH3COO + H+
[H+] = C(CH3COOH)
Согласно закону разбавления Оствальда,
[H ]
K dis (CH 3COOH )
,
C (CH 3COOH )
поэтому
K (CH 3COOH )
C (CH 3COOH ) K (CH 3COOH ) C (CH 3COOH )
C (CH 3COOH )
Константа диссоциации уксусной кислоты– табличная
величина, которая равна K(CH3COOH) = 1.75 10 5, поэтому
[ H ] 1.75 10 5 0.01 4.18 10 4 моль/л
pH = –lg [H+] = –lg (4.18 10 ) = 4 – lg(4.18) = 3.38.
37. Гетерогенные равновесия растворов с осадком
2+CaCO3(т.)
Ca +
2
CO3
[Ca 2 ][CO3 2 ]
К=
[CaCO3 ]
[Ca2+], [CO32 ] - равновесные концентрации ионов в растворе;
[CaCO3] - концентрация вещества в осадке (в твердой фазе), она постоянна.
К [CaCO3] = Ksp = [Ca ]
2+
2
[CO3 ]
Произведение растворимости – это произведение концентраций ионов
малорастворимого вещества в его насыщенном растворе в степенях их
стехиометрических коэффициентов
.
38.
Связь между произведением растворимости ирастворимостью осадка
y+
KxAy
xK
y+ x
x
+ yA
x y
Ksp = [K ] [A ]
Обозначим молярную растворимость вещества через “S” . Тогда раствор
будет содержать катионов [Ky+]=xS (моль/л), анионов - [Ax ]=yS (моль/л).
Ksp = [xS]x [yS]y
39.
В присутствии одноименных ионовравновесие смещается в сторону образования
осадка (эффект одноименного иона).
В присутствии сильных электролитов, не содержащих
общих ионов, подвижность ионов в растворе
уменьшается и равновесие смещается в сторону
большего растворения осадка (солевой эффект).
40.
Условие образования осадка: произведение концентраций ионов врастворе должно быть больше, чем величина произведения
растворимости данного соединения. Например,
[Ca2+] [CO32 ] > Ksp (CaCO3).
Условие растворения осадка: произведение концентраций ионов в
растворе (Pi) меньше, чем величина произведения растворимости
данного соединения ([Ca2+] [CO32 ] < Ksp(CaCO3) ).
41.
Задача. Выведите формулу зависимости произведениярастворимости Ksp от растворимости S для Ag2S.
Решение.
Ag2S
2 Ag + + S2
Согласно уравнению диссоциации соли,
[Ag +] = 2S (моль/л), [S2 ] = S (моль/л).
Ksp = (2S)2 (S) = 4S3,
K sp
3
s 4
или
42.
Задача. Вычислите растворимость AgCl в присутствии 0.01 Mраствора HCl.
Решение.
AgCl
s
Ag+ + Cl
(s+0.01 моль/л 0.01 моль/л)
s
KSp (AgCl) = [Ag+] [Cl ] = s 0.01 = 1,6 10 10, s = 1,6 10 моль/л
43.
Задача. Выпадет ли осадок PbCl2 при смешивании равныхобъемов 0.01M раствора Pb(NO3)2 и 0.02M раствора of HCl?
Решение.
Pb(NO3)2 + 2HCl PbCl2 + 2HNO3
Pb 2+ + 2Cl PbCl2
При смешивании равных объемов рстворов концентрации
реагирующих веществ уменьшаются в 2 раза. Концентрации ионов
в растворе составляют:
[Pb2+] = C(Pb(NO3)2) = 0.01 / 2 = 0.005 моль/л
[Cl ] = C(HCl) = 0.02 / 2 = 0.01 моль/л
Произведение концентраций ионов в растворе:
Pi = [Pb2+] [Cl ]2 = 0.005 (0.01)2 = 5 10
Из таблицы находим, что KSp(PbCl2) = 1.6 10 5.
Так как Pi < Ksp, то осадок PbCl2 не образуется.

































 Химия
Химия








