Похожие презентации:
Внепечная обработка стали. Лекция №8
1.
Российский государственный университет нефти и газа(национальный исследовательский университет) имени И.М.
Губкина
Кафедра трибологии и технологий ремонта нефтегазового оборудования
УЧЕБНАЯ ДИСЦИПЛИНА
ТЕХНОЛОГИЯ КОНСТРУКЦИОННЫХ МАТЕРИАЛОВ
Лекции № 8
Преподаватель:
Доцент кафедры ТиТРНГО, к.т.н. Буклаков Андрей Геннадьевич
Москва 2020 год
2.
ВНЕПЕЧНАЯОБРАБОТКА СТАЛИ
3.
Способы внепечнойобработки
обработка металла вакуумом;
продувка инертным газом;
обработка стали синтетическим шлаком в ковше;
введение реагентов в глубь металла;
продувка порошкообразными материалами.
4.
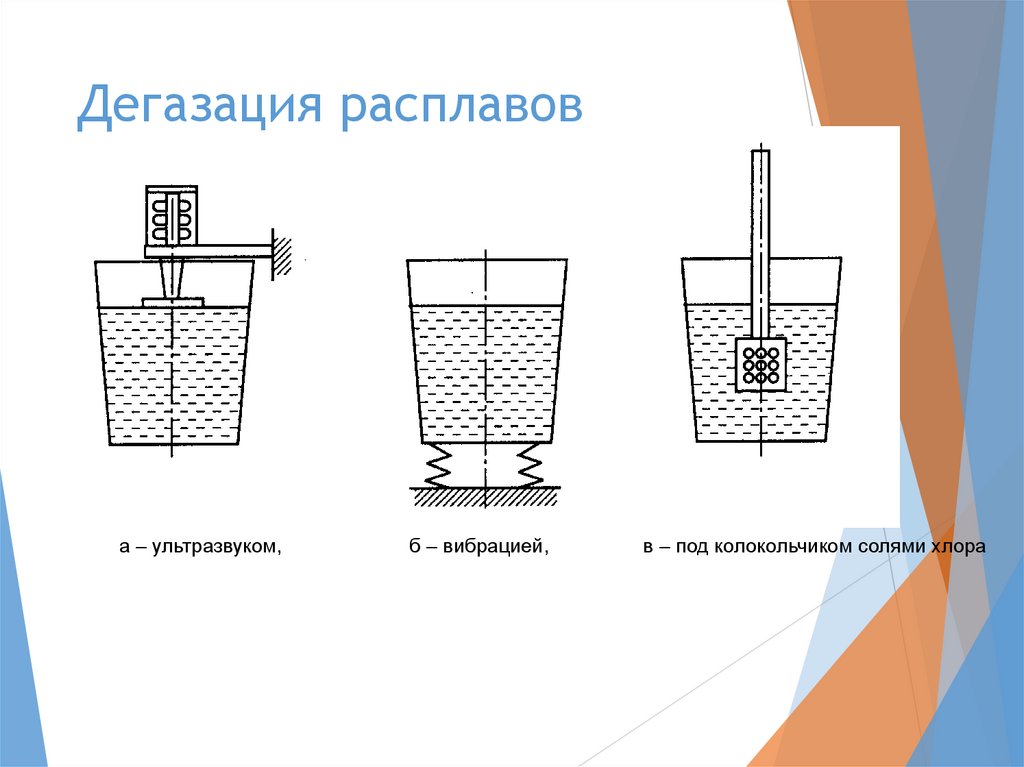
Дегазация расплавова – ультразвуком,
б – вибрацией,
в – под колокольчиком солями хлора
5.
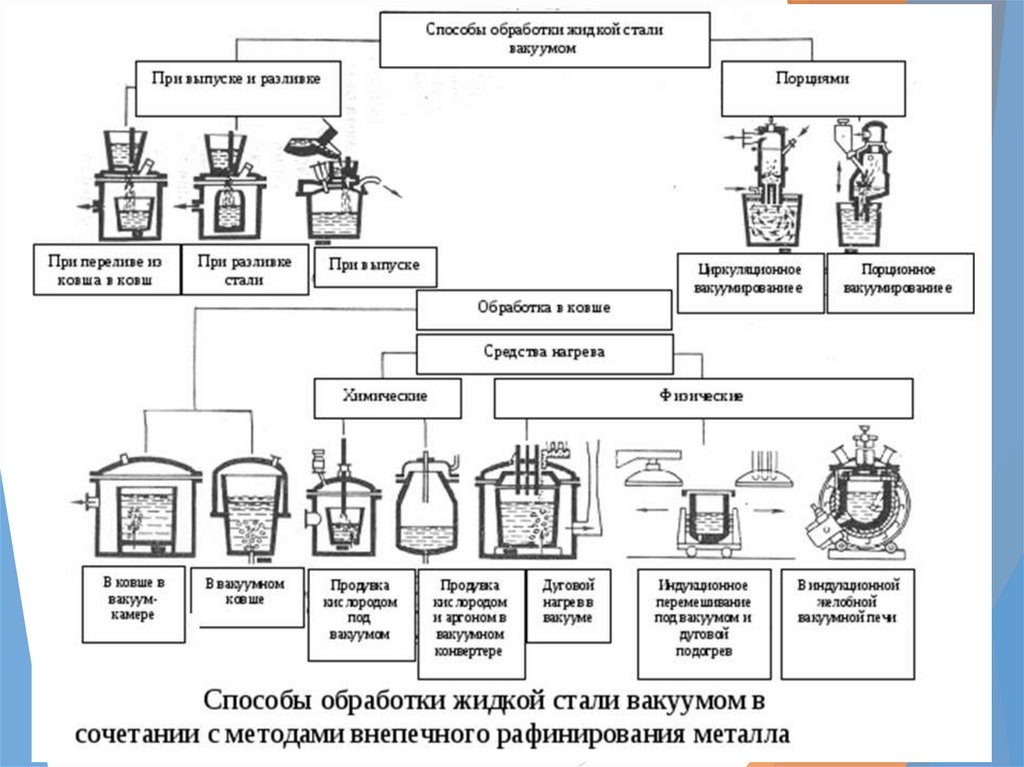
Вакуумирование6.
Электрошлаковый переплав1 – электрод
2 – кристаллизатор
3 – поддон
4 – расплавленный
шлак
5 – жидкий металл
6 – слиток
7 - трансформатор
7.
Установка для вакуумного переплава8.
Особенностипроизводства
цветных
металлов
9.
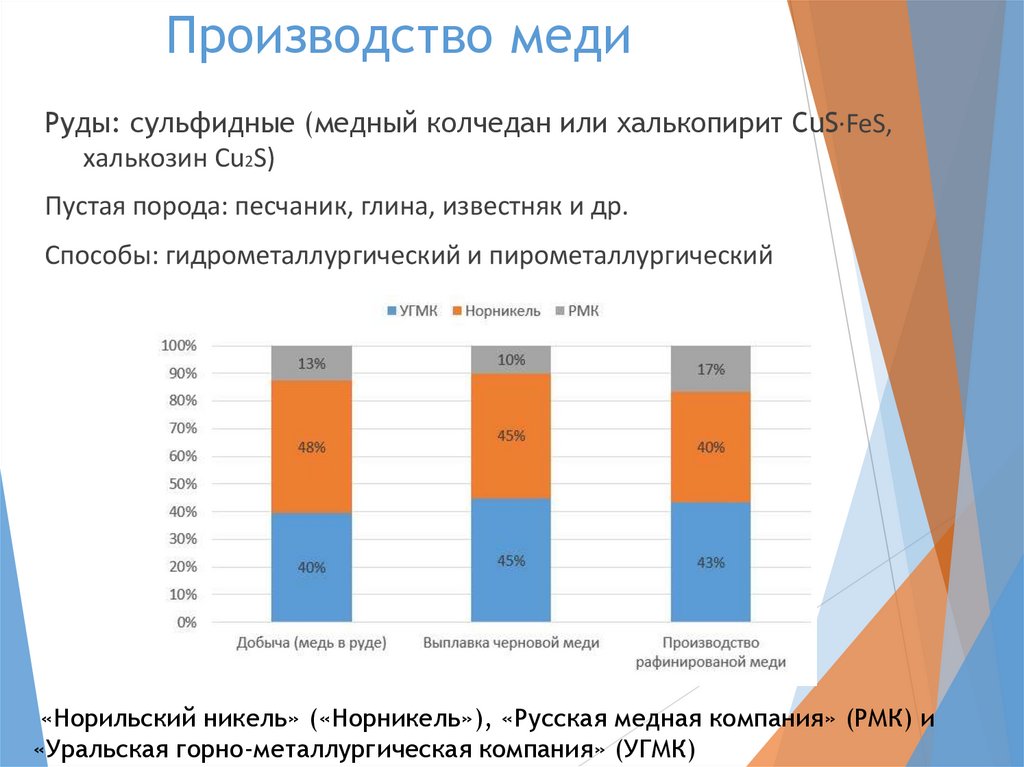
Производство медиРуды: сульфидные (медный колчедан или халькопирит CuS·FeS,
халькозин Cu2S)
Пустая порода: песчаник, глина, известняк и др.
Способы: гидрометаллургический и пирометаллургический
«Норильский никель» («Норникель»), «Русская медная компания» (РМК) и
«Уральская горно-металлургическая компания» (УГМК)
10.
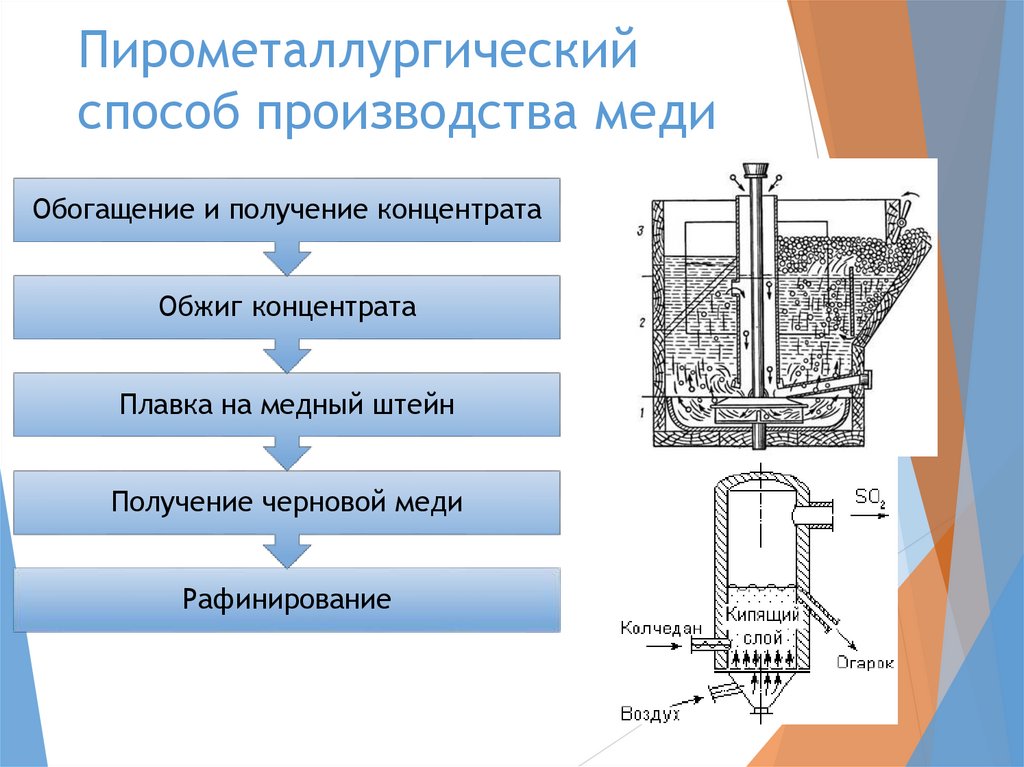
Пирометаллургическийспособ производства меди
Обогащение и получение концентрата
Обжиг концентрата
Плавка на медный штейн
Получение черновой меди
Рафинирование
11.
Плавка на медный штейнСхема устройства отражательной
1 – загрузка шихты, 2 –
печи для плавки медных руд: 1 теплоизлучение от факела, 3 –
бункер; 2 — воронки; 3 — летка; 4
стекающая плавящаяся шихта,
— руда; 5 — под
шихтовый откос
FeS+3Fe3O4 + 5SiO2 = 5 (2FeO* SiO2) + SO2.
2FeS + 2Cu2O +SiO2 = 2FeO* SiO2 (в шлак) + 2Сu2S (в штейн).
Штейны содержат 23 — 28 % S, 16 — 60 % CU и 50 — 15 % Fe
12.
1 стадия (конвертированиемедного штейна):
2FeS + 3О2→2FeO + 2SО2.
2FeO + SiО2→(FeO)2×SiО2.
слив шлака
1-аппарат для подачи песка; 2привод; 3-горловина; 4футеровка; 5-трубы; 6-муфты;
7-ролик
2 стадия (получение черновой
меди):
Cu2S+ 1,5О2 →Сu2O+ SO2 + 92 760
кал.
Cu2S + 2Cu2O→6Cu + SO2 - 38 640
кал.
13.
Огневое рафинированиеЗагрузка
Расплавление
Окисление примесей (Al, Fe, Zn, Sn, Sb, Bi, As, Ni и немного меди до Cu2O)
Удаление растворенных газов
Раскисление меди
Разливка
4 [Cu]+ О2 = 2 (Сu2О
[Me] + (Сu2О) = (Ме2О) + 2Cu
(Сu2О) + Н2 = Н2,О + 2[Сu];
[О]Cu + СО = СО2.
14.
Электролитическоерафинирование меди
1 – металл, подлежащий растворению;
2 – катод;
3 – электролит;
4 – осадок
Электролит - раствор CuSO4 и H2SO4
Напряжение - 0,3—0,4 В.
Осадок Au, Ag, Se, Те, Pb, Sn, Pt
Диссоциация: CuSO4 = Cu2+ + SO42Катод: Cu + e = Cu
Анод: Сu – 2e = Cu2+
15.
Производство титанаТитановые руды: рутил TiO2, ильменит FeTiO3, титаномагнетит
FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiOSiO5
Коренные руды титана — ильменит-титаномагнетитовые и
россыпные — рутил-ильменит-цирконовые
16.
Производство титана изильменитовых руд
1.
Получение титанового шлака восстановительной плавкой
FeO·TiO2 + С = Fe + TiO2 + CO
2. Получение тетрахлорида титана хлорированием титановых шлаков
TiO2 + 2Cl2 + 2С = TiCl4↑ + 2СО, температура процесса 700-1000 °C.
Хлоратор – шахтная или шахтная электрическая печь
1 конденсатор: вход 500-600 °C, выход 300-350 °C, конденсируется MgCl2, CaCl2, MnCl4, FeCl2.
2 конденсатор: вход 120-180 °C, конденсируется FeCl3, AlCl3.
3 оросительный конденсатор – здесь проводится охлаждение газа жидким распыленным TiCl4.
3. Металлотермическое восстановление титана из тетрахлорида
TiCl4 (магние- или натриетермия) и TiO2 (алюмотермическое или кальциетермическое восстановление)
4. Рафинирование титана
йодидный способ: Ti + 2I2 = Til4
99,9—99,99 % Ti.
электролиз хлоридов титана в электролите, состоящем из NaCl, KCl или смесей хлоридов с невысокой
температурой плавления
17.
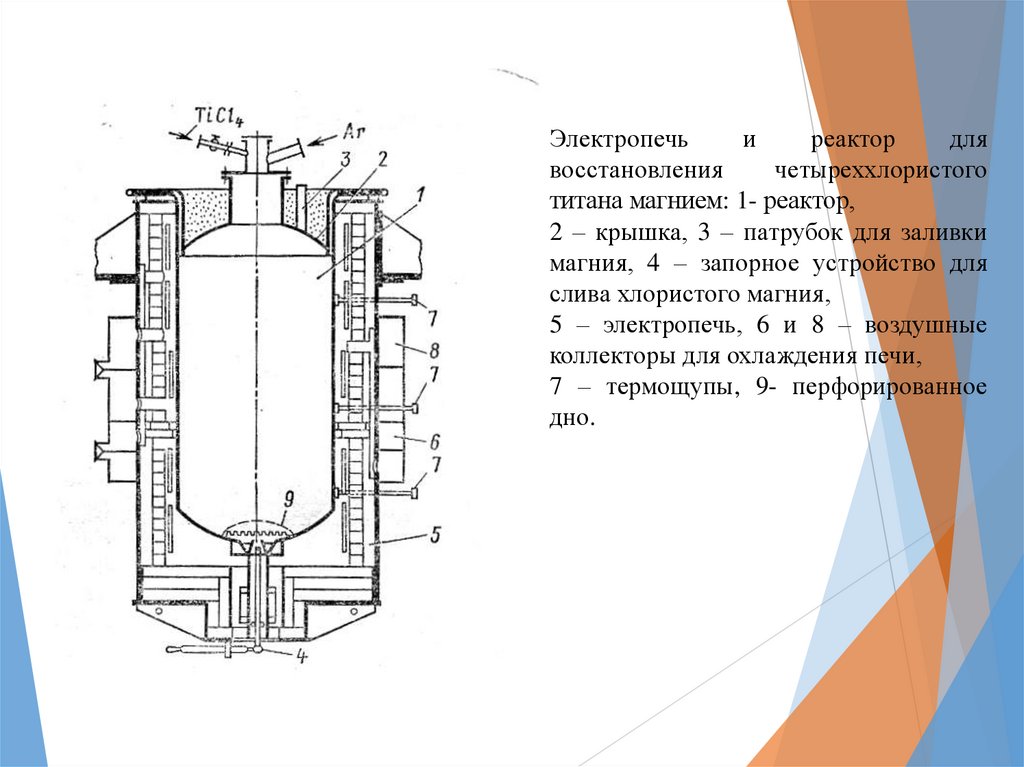
Электропечьи
реактор
для
восстановления
четыреххлористого
титана магнием: 1- реактор,
2 – крышка, 3 – патрубок для заливки
магния, 4 – запорное устройство для
слива хлористого магния,
5 – электропечь, 6 и 8 – воздушные
коллекторы для охлаждения печи,
7 – термощупы, 9- перфорированное
дно.
18.
Производство магнияМагнезит — углекислый магний МgCO3.
Доломит — горная порода, представляющая собой двойной карбонат кальция и
магния МgCO3*СаСО3. Доломиты обычно содержат примеси кварца, кальцита, гипса
и др. Доломит, так же как и магнезит, применяемый магниевой промышленностью,
предварительно обжигают до получения смеси окислов МgO и СаО.
Карналлит КС1*MgC12* 6Н2О — природный хлорид магния и калия — очень
гигроскопичное кристаллическое вещество, обычно окрашенное примесями в
розовый, желтый или серый цвет.
Электролизер для получения магния:
1 — анод; 2 — катоды; 3 — диафрагма,
отделяющая анодное и катодное
постравнство, 4 – труба для отвода хлора из
анодного пространства, 5 – катодные шины
19.
Производство алюминияБокситы — сложная горная порода, которая содержит алюминий в виде гидроокисей.
Na2СО3 + А12О3 = Na2О* Аl2O3+СО2;
2SiO2 + 2СаО = 2СаО* SiО2 ,.
Na2О*Аl2O3 + СО2 + 3Н2 О = Nа2СО3 + А13O3* 3Н2О
Nа3А1F6 = 3Na+ + А1F63+.
А12О3 = 2А13+ + 3О2-.
Схема электролизной ванны для получения
алюминия














 Промышленность
Промышленность








