Похожие презентации:
Строение вещества. Поляризация вещества. Молярная рефракция
1.
СТРОЕНИЕ ВЕЩЕСТВА.Поляризация вещества. Молярная рефракция
1. Полярные и неполярные молекулы. Дипольный момент
2. Поляризация вещества
3. Преломление света. Молярная рефракция
4. Рефрактометрия
1
2.
СТРОЕНИЕ ВЕЩЕСТВА.1. Полярные и неполярные молекулы. Дипольный момент
Физическое определение молекулы
Молекула (новолат. molecula, уменьшит от лат. moles – масса) – система атомов, связанных друг с
другом различными связями.
Химическое определение
Молекула – наименьшее частица вещества, определяющая его свойства и способная к
самостоятельному существованию.
Ковалентная связь (лат. co – «совместно» и vales – «имеющий силу») – это химическая связь между
двумя атомами при обобществлении принадлежащих им валентных электронных облаков.
Гомонуклеарными двухатомными называют молекулы, содержащие ядра атомов одного элемента
(H2, N2, O2 и др.). В гомонуклеарных молекулах в отсутствие внешнего электрического поля центры
тяжести положительных и отрицательных зарядов совпадают. Химическую связь называют
ковалентной неполярной (чисто ковалентной), а сами молекулы неполярными.
Гетеронуклеарными двухатомными называют молекулы, содержащие ядра атомов двух разных
элементов (CO, HF, NO и др.). В гетеронуклеарных молекулах электронная плотность распределена
несимметрично относительно обоих ядер. Химическую связь называют ковалентной полярной, а
сами молекулы – полярными.
Ионная связь – это связь с высокой полярностью, при которой электронный заряд на связывающей
орбитали уже не распределён между двумя ядрами, а практически сосредоточен в области одного
ядра. Характерна для молекул галогенов щелочных металлов (NaCl, KF и т.д.)
2
3.
СТРОЕНИЕ ВЕЩЕСТВА.1. Полярные и неполярные молекулы. Дипольный момент
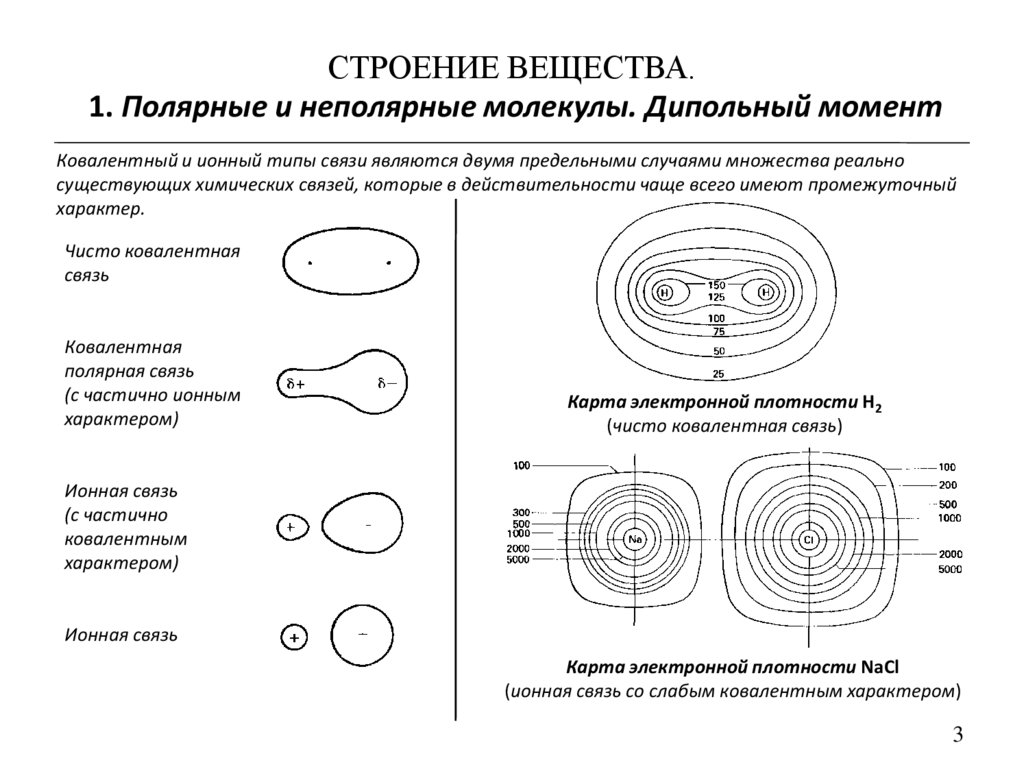
Ковалентный и ионный типы связи являются двумя предельными случаями множества реально
существующих химических связей, которые в действительности чаще всего имеют промежуточный
характер.
Чисто ковалентная
связь
Ковалентная
полярная связь
(с частично ионным
характером)
Карта электронной плотности H2
(чисто ковалентная связь)
Ионная связь
(с частично
ковалентным
характером)
Ионная связь
Карта электронной плотности NaCl
(ионная связь со слабым ковалентным характером)
3
4.
СТРОЕНИЕ ВЕЩЕСТВА.1. Полярные и неполярные молекулы. Дипольный момент
В полярных молекулах электрические центры тяжести положительных зарядов ядер и отрицательных
зарядов электронов не совпадают, в молекуле возникает постоянный электрический диполь (ПЭД).
Электрический диполь (греч. di – дважды, двойной + poloς – полюс) – совокупность двух равных по
абсолютной величине разноимённых точечных зарядов +q и –q, находящихся на некотором расстоянии
друг от друга l (длина или плечо диполя).
Электрический дипольный момент μ – векторная величина, характеризующая асимметрию
распределения положительных и отрицательных зарядов в электрически нейтральной системе
(молекуле):
μ ql 0
Дипольный момент измеряется в дебаях (D). 1D = 3.336·10–30 Кл·м.
Постоянный (перманентный, собственный) дипольный момент – дипольный момент полярной
молекулы в отсутствии внешнего электрического поля. Постоянный дипольный момент имеют
гетеронуклеарные молекулы с полярной ковалентной связью (CO, HF, NO и др.).
Гомонуклеарные неполярные молекулы (H2, N2, O2 и др.) ПЭД не обладают.
4
5.
СТРОЕНИЕ ВЕЩЕСТВА.1. Полярные и неполярные молекулы. Дипольный момент
Дипольный момент многоатомной гетеронуклеарной молекулы с полярными связями определяют
путём суммирования дипольных моментов отдельных связей по правилу параллелограмма:
μ μ1 μ 2
105
105
105
μ μ1 cos
μ 2 cos
2 μ1 cos
2
2
2
2 5.03 10 30 Кл м 0.61 6.14 10 30 Кл м 1.84 D
Несимметричная молекула H2O
В симметричных многоатомных гетеронуклеарных молекулах (CO2, CS2 и др.) происходит полная
компенсация дипольных моментов отдельных связей:
μ μ1 μ 2
μ μ1 cos90 μ 2 cos90 0
Симметричная молекула CO2
Компенсация дипольных моментов связей широко распространена среди углеводородов. Связь C–H
является слабополярной (m 0.3 D). Метильная группа –CH3 в целом обладает таким же m, поэтому во
всех предельных углеводородах эти дипольные моменты полностью взаимно компенсируются:
m(CnH2n+2) = 0
5
6.
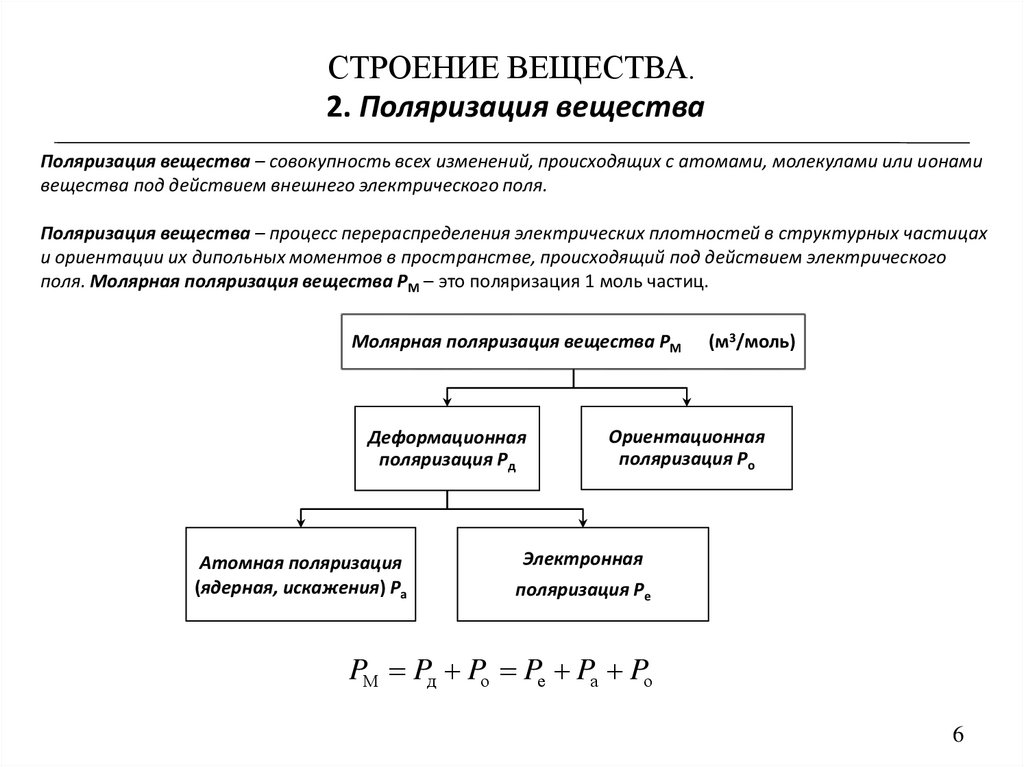
СТРОЕНИЕ ВЕЩЕСТВА.2. Поляризация вещества
Поляризация вещества – совокупность всех изменений, происходящих с атомами, молекулами или ионами
вещества под действием внешнего электрического поля.
Поляризация вещества – процесс перераспределения электрических плотностей в структурных частицах
и ориентации их дипольных моментов в пространстве, происходящий под действием электрического
поля. Молярная поляризация вещества РМ – это поляризация 1 моль частиц.
Молярная поляризация вещества РM
Деформационная
поляризация Рд
Атомная поляризация
(ядерная, искажения) Ра
(м3/моль)
Ориентационная
поляризация Ро
Электронная
поляризация Ре
PM Pд Pо Pе Pа Pо
6
7.
СТРОЕНИЕ ВЕЩЕСТВА.2. Поляризация вещества
1. Ориентационная поляризация Ро – отражает стремление полярных молекул под действием внешнего
электрического поля ориентироваться вдоль его направления:
4
m2
Pо pN A
3
3kT
Ро происходит только в веществах, молекулы которых полярны.
Тепловое движение приводит к беспорядочному расположению молекул в пространстве.
Поэтому с повышением температуры Ро всегда уменьшается (в отличие от Рд).
Ро стремится к нулю при увеличении частоты внешнего поля до 1010 Гц, когда ориентация диполей не
успевает за изменением внешнего электрического поля.
7
8.
СТРОЕНИЕ ВЕЩЕСТВА.2. Поляризация вещества
2. Деформационная поляризация Рд = Pa + Pе – может возникать как в полярных, так и в неполярных
молекулах. При наложении на неполярную молекулу внешнего электрического поля возникает
индуцированный (наведённый) диполь, характеризующийся индуцированным дипольным моментом μ инд .
3. Атомная поляризация (ядерная, искажения) Pa – возникает в результате смещения ядер атомов или
атомных групп в направлении отрицательного полюса внешнего электрического поля.
Pa происходит только в молекулах или сложных ионах.
Молекулярное искажение, вследствие которого возникает индуцированный диполь, является
геометрическим искажением положения ядер – в приложенном поле молекула изгибается и
растягивается. Отсюда и название Pa – поляризация искажения.
μ инд ql1
4
Pа pN A а
3
При увеличении частоты внешнего поля до 1013 Гц Pa стремится к нулю, так как изменение формы
молекулы не успевает за изменением внешнего электрического поля (10–13 с – время, необходимое для
одного колебания молекулы).
8
9.
СТРОЕНИЕ ВЕЩЕСТВА.2. Поляризация вещества
4. Электронная поляризация Ре – возникает в результате упругого смещения и деформации электронных
облаков относительно поля ядер в направлении положительного полюса внешнего электрического поля.
Происходит в любом атоме, ядре, молекуле:
μ инд ql1
4
pN A е
3
е r 3
Pе
Электронная поляризация атома H2 в постоянном электрическом поле
Ре соответствует объёму смещённых электронных облаков. Частица вещества условно считается
проводящей сферой радиусом r.
Видимый свет – это электромагнитное излучение с большой частотой (оптические частоты 1015 Гц).
При такой частоте Pо = 0 и Pa = 0. На колебания видимого света реагируют электроны, как частицы,
обладающие массой, намного меньшей массы протона (mp 1837mе ). В частице возникает только Ре.
9
10.
СТРОЕНИЕ ВЕЩЕСТВА.2. Поляризация вещества
Поляризуемость атомов, ионов и молекул – величина, характеризующая способность этих частиц к
деформационной поляризации (способность приобретать индуцированный дипольный момент µинд ),
отнесённая к единице напряжённости внешнего электрического поля E0.
μ инд е a E0 е E0
1
1
1 E02 2 E03 е E0
2!
3!
i – сверхполяризуемость (гиперполяризуемость) молекул i-го порядка. Актуальна при очень высоких
напряжённостях внешнего поля (в лазерных пучках).
Для поляризации вещества видимым светом вполне справедливо:
μинд е E0
P 0 E0
1
Диэлектрическая восприимчивость – это величина, характеризующая способность диэлектриков к
поляризации под действием внешнего электрического поля E0.
Диэлектрическая проницаемость – это величина, характеризующая диэлектрические свойства
вещества – его реакцию на электрическое поле E0.
показывает, во сколько раз уменьшится кулоновское взаимодействие зарядов, при переносе их из вакуума
в данную среду (в соответствии с законом Кулона):
Fe
1
1 22
4 πεε 0 r
10
11.
СТРОЕНИЕ ВЕЩЕСТВА.3. Преломление света. Молярная рефракция
Абсолютный показатель преломления среды n (коэффициент рефракции, лат. refractus – преломлённый)
– это отношение скорости света в вакууме к скорости света в данной среде.
Относительный показатель преломления двух сред n21 – это отношение скоростей распространения
света в первой v1 и во второй v2 средах:
n1
8
c 2.9979·10 м с
v1
v1
Преломление (рефракция) луча
света на границе раздела
прозрачных однородных сред
c 2.9979·108 м с
n2
v2
v2
n21
v1 n2
v 2 n1
Виллеброрд ван Снелль
Ван Ройен, Snellius
(1580–1626)
Законы преломления света:
1. Падающий, отражённый и преломлённый лучи и нормаль к
границе раздела в точке падения лежат в одной плоскости
(плоскость падения).
2. Закон преломления Снелля
(ван Снелль – 1621, Декарт – 1627):
при любом угле падения отношение синусов углов падения
и преломления является величиной постоянной:
n21
sin
sin
Рене Декарт,
Renatus Cartesius
(1596–1650)
11
12.
СТРОЕНИЕ ВЕЩЕСТВА.3. Преломление света. Молярная рефракция
Показатель преломления зависит от поляризации вещества светом!
При распространении в веществе световой волны молекулы вещества
подвергаются электронной поляризации Ре , возникает индуцированный
дипольный момент μ инд. При этом молекулы искажаются, что влияет
на скорость распространения световой волны в веществе, а значит – на
показатель преломления n.
Молярная рефракция вещества RM – это электрооптическая характеристика вещества, связывающая
электронную поляризуемость вещества е с его показателем преломления n.
Молярная рефракция RM – это молярная поляризация на оптических частотах ( 1015 Гц), при которых из
всех видов поляризации остаётся одна – электронная Ре .
RM , как и n, характеризует способность вещества преломлять свет, но в отличие от него практически
не зависит от плотности, температуры и агрегатного состояния вещества.
12
13.
СТРОЕНИЕ ВЕЩЕСТВА.3. Преломление света. Молярная рефракция
Формула Лоренц–Лоренца (1880)
4
n2 1 M
RM Pe pN A е 2
3
n 2
Справедлива для изотропных сред
(газы, неполярные жидкости, кубические кристаллы).
Является частным случаем формулы Клаузиуса–Мосотти
при частоте внешнего поля >1013 Гц.
Хендрик Антон Лоренц
Людвиг Валентин Лоренц
(1853–1928)
(1829–1891)
Нобелевская премия по физике 1902 г.
«в знак признания выдающегося вклада,
который он внёс своими исследованиями
влияния магнетизма на излучение»
Формула Клаузиуса (1879) – Мосотти (1850)
4
1 M
Pe Pа pN A е а
3
2
При оптических частотах ( 1015 Гц) = n2
Является частным случаем формулы Ланжевена–Дебая
при частоте внешнего поля >1010 Гц.
Рудольф Юлиус Эмануэль
Клаузиус (Готтлиб)
(1822–1888)
Оттавиаио Фабрицио
Мосотти
(1791–1863)
13
14.
СТРОЕНИЕ ВЕЩЕСТВА.3. Преломление света. Молярная рефракция
Формула Ланжевена (1905) – Дебая (1912)
4
m2 1 M
Pe Pа Pо pN A е а
3
3kT 2
Является обобщением формулы Клаузиуса–Мосотти на
случай полярного диэлектрика.
Справедлива для газов и паров из полярных молекул,
разбавленных растворов полярных жидкостей в
неполярных растворителях.
Поль Ланжевен
(1872–1946)
Петер Йозеф Вильгельм Дебай
(1884–1966)
Нобелевская премия по физике 1936 г.
«за вклад в наше понимание
молекулярной структуры в ходе
исследований дипольных явлений и
дифракции рентгеновских лучей и
электронов в газах»
14
15.
СТРОЕНИЕ ВЕЩЕСТВА.4. Рефрактометрия
Рефрактометрия – совокупность методов анализа и исследования вещества, основанных на измерении
его показателя преломления. Один из методов структурной химии.
Рефрактометрические измерения обычно проводят в видимой (оптической) части спектра, определяя n
по отношению к воздуху.
Основа рефрактометрии – формула Лоренц–Лоренца.
Для химически чистых веществ:
Для растворённых веществ:
n2 1 M
RM 2
n 2
n22 1 100 n12 1 100 С M
RM 2
2
n
2
n
2
1 С
2
1
2
Сравнивая экспериментальную рефракцию RM (формула Лоренц–Лоренца) с RM , определённой по правилу
аддитивности, судят о строении молекулы исследуемого вещества.
Аддитивность (лат. additivus – прибавляемый) – свойство, заключающееся в том, что величина,
соответствующая физическому объекту, равна сумме величин, соответствующих его частям.
Отклонения от аддитивности связаны с взаимодействием частей молекул, образующих целое.
15
16.
СТРОЕНИЕ ВЕЩЕСТВА.4. Рефрактометрия
Правило аддитивности:
n
RM g i RDi
i 1
С учётом инкрементов связей и циклов:
n
m
RM g i RDi Ri
i 1
i 1
При наличии сопряжённых связей в открытых цепях органических молекул наблюдается заметное
повышение RM – экзальтация рефракции:
n
m
RM g i RDi Ri ER
i 1
i 1
Используя правило аддитивности, можно:
исследовать структуру соединений,
определять дипольные моменты молекул,
изучать водородные связи,
определять состав смесей.
16
17.
СТРОЕНИЕ ВЕЩЕСТВА.4. Рефрактометрия
Устройство и принцип работы рефрактометра:
n21
n2 sin
; 90 sin 1
n1 sin
n2
1
n1 n2sin
n1 sin
A. Оптическая схема рефрактометра УРЛ
B. Схема измерения предельного угла
17















 Физика
Физика








