Похожие презентации:
Основные классы веществ (часть 2)
1.
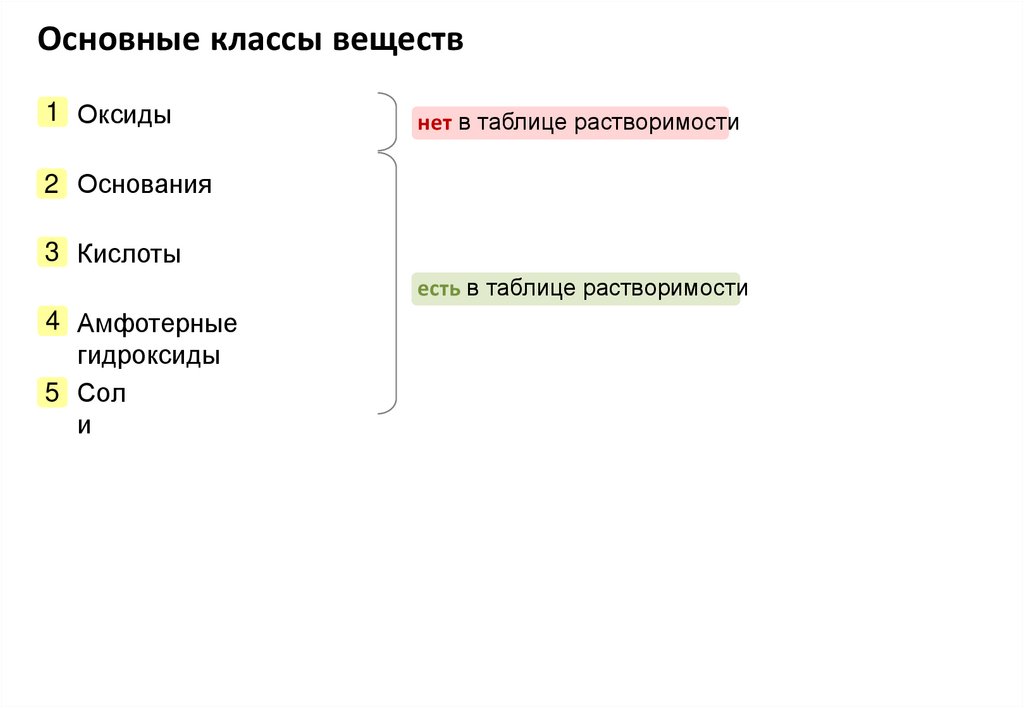
Основные классы веществ1 Оксиды
нет в таблице растворимости
2 Основания
3 Кислоты
есть в таблице растворимости
4 Амфотерные
гидроксиды
5 Сол
и
2.
Таблица растворимостикатионы
анионы
SO32− ≡
SO3II
Fe3+ ≡ Fe III
3.
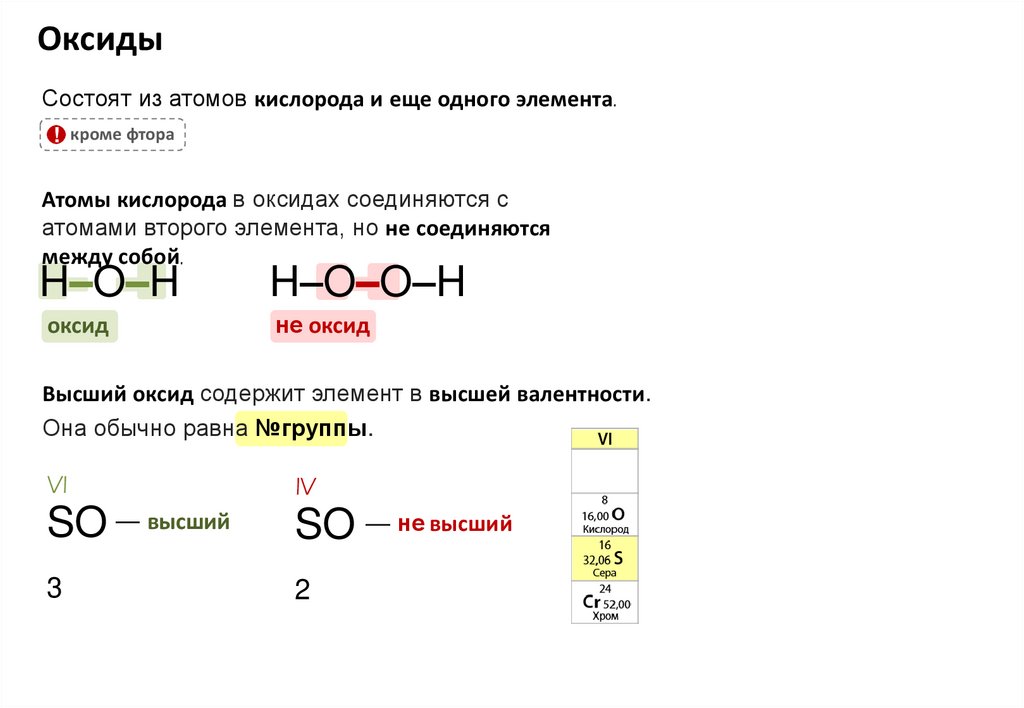
ОксидыСостоят из атомов кислорода и еще одного элемента.
! кроме фтора
Атомы кислорода в оксидах соединяются с
атомами второго элемента, но не соединяются
между собой.
H–O–H
H–O–O–H
оксид
не оксид
Высший оксид содержит элемент в высшей валентности.
Она обычно равна №группы.
VI
IV
SO –– высший
SO –– не высший
3
2
4.
ОксидыСостоят из атомов кислорода и еще одного элемента.
! кроме фтора
Атомы кислорода в оксидах соединяются с
атомами второго элемента, но не соединяются
между собой.
H–O–H
H–O–O–H
оксид
не оксид
Оксиды называют так:
оксид +
какого
элемента
+ ! валентность
элемента
Для
элементов с переменной
валентностью
5.
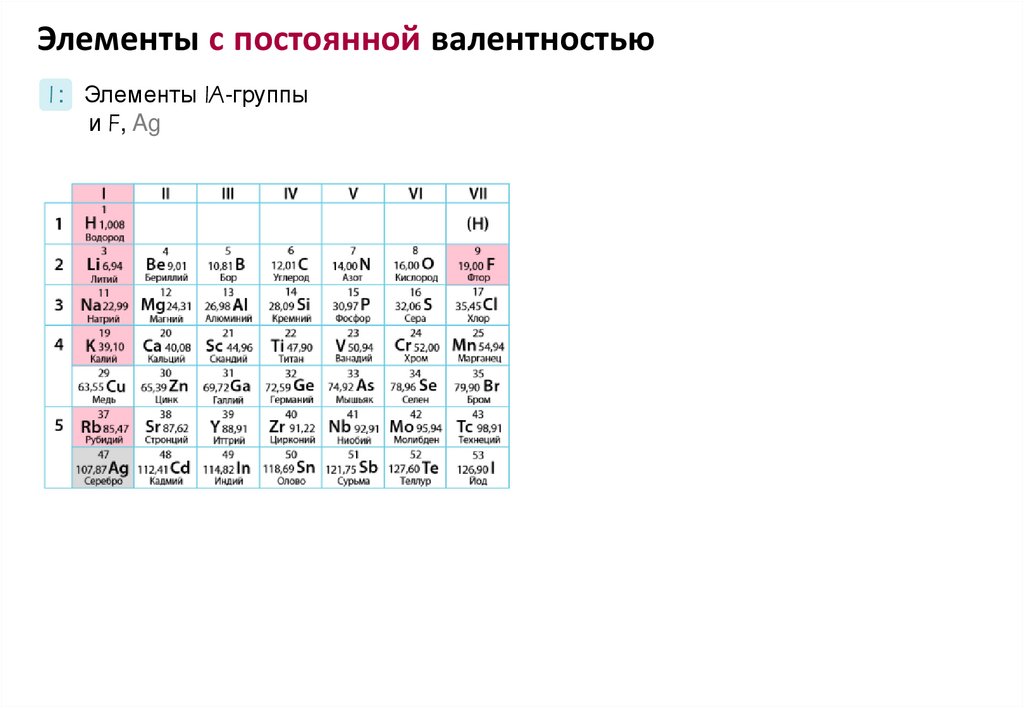
Элементы с постоянной валентностьюI : Элементы IA-группы
и F, Ag
6.
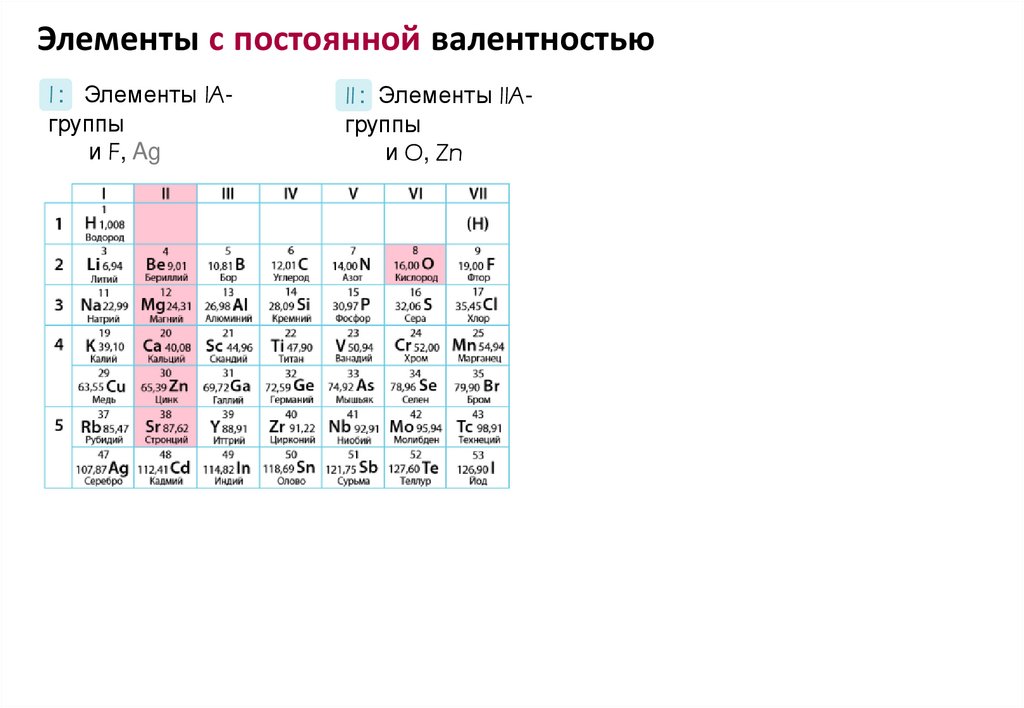
Элементы с постоянной валентностьюI : Элементы IAгруппы
и F, Ag
II : Элементы IIAгруппы
и O, Zn
7.
Элементы с постоянной валентностьюI : Элементы IAгруппы
и F, Ag
II : Элементы IIAгруппы
и O, Zn
III : Al, B
8.
Оксиды называют так:оксид +
I
H2O
какого
элемента
постоянная
валентность
оксид водорода
вод
а
+ ! валентность
элемента
Для
элементов с переменной валентностью
НОК: 4
IV II
SO2
переменная
валентность
оксид серы (IV)
НОК: 6
III
Al2O
постоянная
3 валентность
оксид алюминия
III II
N2O
переменная
3 валентность
оксид азота (III)
9.
ОксидыII
II
Оксид магния: MgO
VI II
Оксид серы(VI
(VI): SO3
)
V II
Оксид фосфора(V(V):P2O5
)
I
II
Оксид лития: Li2O
10.
Тривиальные названия оксидовCО
оксид углерода (II)
угарный газ
без
запаха
CО2 оксид углерода (IV)
без запаха
твердый: сухой лед
оксид серы
сернистый газ
(IV)
резкий запах
(зажженной
спички, жженой серы)
N2
O
оксид азота
веселящий газ
(I)
сладкий
запах
NO
оксид азота (IV)
бурый газ
углекислый газ
SО
2
2
SiO2 оксид кремния (IV)
песок/кремнезём/кварц
CaO оксид кальция
негашеная известь
11.
ОснованияСостоят из атома металла с валентностью I или II и гидроксогрупп OH.
! кроме Zn(OH)2, Be(OH)2
Основания называют так:
гидрокси +
д
+ ! валентность
Дляметалла
элементов с переменной
какого
металла
валентностью
I
I
LiOH
постоянная
валентность
II
I
постоянная
Сa(OH)2 валентность
гидроксид лития
гидроксид кальция
II
II
I
переменная
Fe(OH)2 валентность
гидроксид железа (III)
I
переменная
Mn(OH)2 валентность
гидроксид марганца (II)
12.
ОснованияСостоят из атома металла с валентностью I или II и гидроксогрупп OH.
! кроме Zn(OH)2, Be(OH)2
Основания называют так:
гидрокси +
д
какого
металла
+ ! валентность
Дляметалла
элементов с переменной
валентностью
Гидроксид кальция:Ca(OH)2
Гидроксид марганца (II):Mn(OH)2
Тривиальные названия оснований
гидроксид натрия
NaO
едкий натр
H
известковая вода
Ca(OH) гидроксид кальция раствор:
взвесь: известковое молоко
гашёная известь
2
13.
ОснованияKOH
Mg(OH)2
14.
КислотыСостоят из атомов водорода и кислотного остатка.
В химических реакциях эти атомы водорода
способны заменяться на атомы металлов.
2HCl + Zn → H2 + ZnCl2
HCl + NaOH → H2O +
HO
NaCl
H
В лаборатории обычно используют водные растворы
кислот.
! кроме H2SiO3 – она нерастворима
15.
Приходите к нам на химию,у нас есть:
H2SO4
HCl
HNO3
KOH
NaOH
LiOH
Ведь все эти вещества -- прозрачные
растворы
16.
Названия бескислородныхкислотных остатков и кислот
Кислотный остаток, его название
Элемент + ид
F
I
Cl
I
Br
I
I
Фторид
I
S
Хлорид
Бромид
Иодид
II
Галогены,
сера,
селен,
теллур
Сульфи
sulfur
– сера
д
Ее тривиальное название
Соответствующая кислота
Элементоводородная
Фтороводородная
I I
HF
I
Хлороводородная
Бромоводородная
Иодоводородная
Сероводородная
I
HCl
I
I
HBr
I I
HI
I
II
H2S
Плавикова
я
Соляная
17.
Названия кислородосодержащихкислотных остатков и кислот
Кислотный остаток, его название
Элемент + ит
IV
II
SO3
III
I
NO
2
Соответствующая кислота
!
-истая
I
Сульфи
т
Сернистая
Нитрит
Азотиста
я
nitrogenium – азот
II
H2SO3
I
I
HNO
2
У элемента
не высшая
валентность
Кислорода
меньше
18.
Валентность элементав кислородсодержащем кислотном остатке
Валентность элемента
кислотном остатке
X
II
=
число атомов
∙ II -кислорода
X
валентность
кислотного остатка
или число атомов
водорода в кислоте
I
SO3
NO2
X = 3 ∙ II − II =
IV
X = 2 ∙ II − I = III
19.
Названия кислородосодержащихкислотных остатков и кислот
Кислотный остаток, его название
Соответствующая кислота
Элемент + ат
-ная или –овая/евая
II
SO4
I
NO
I
Сульфа
т
Серная
Нитрат
Азотная
PO4
II
CO3
Фосфат
Карбонат
carboneum – углерод
SiO3
Силикат
silicium – кремний
I
HNO3
I
III
I
II
Фосфорна
я
H3PO4
Угольная
H2CO
3
II
II
H2SO4
I
3
III
!
I
II
Кремниевая H2SiO3
У элемента
высшая
валентность
Кислорода
больше
20.
СравнитеII
SO3
II
SO4
I
NO
2 I
NO
Сульфи
т
Сульфа
т
Сернистая
Нитрит
Нитрат
Азотиста
я
Азотная
Гипохлорит
Хлорноватистая
Хлорит
Хлористая
Хлорат
Хлорновата
я
Хлорная
Серная
3
I
I
ClO
III
I
ClO2
V
I
ClO3
VII
I
ClO4
Перхлорат
но не срочно
21.
Амфотерные гидроксидыСостоят из атома металла с валентностью III или IV и гидроксогрупп OH,
а также: Zn(OH)2, Be(OH)2.
Амфотерные гидроксиды называют так:
гидрокси +
д
какого
металла
+ ! валентность
Дляметалла
элементов с переменной
валентностью
III
I
переменная
Cr(OH)3 валентность
гидроксид хрома (III)
III
I
постоянная
Al(OH)3 валентность
гидроксид алюминия
22.
Амфотерные гидроксидыСостоят из атома металла с валентностью III или IV и гидроксогрупп OH,
а также: Zn(OH)2, Be(OH)2.
Амфотерные гидроксиды называют так:
гидрокси +
д
какого
металла
+ ! валентность
Дляметалла
элементов с переменной
валентностью
Cr(OH)3
Zn(OH)2
Fe(OH)3
23.
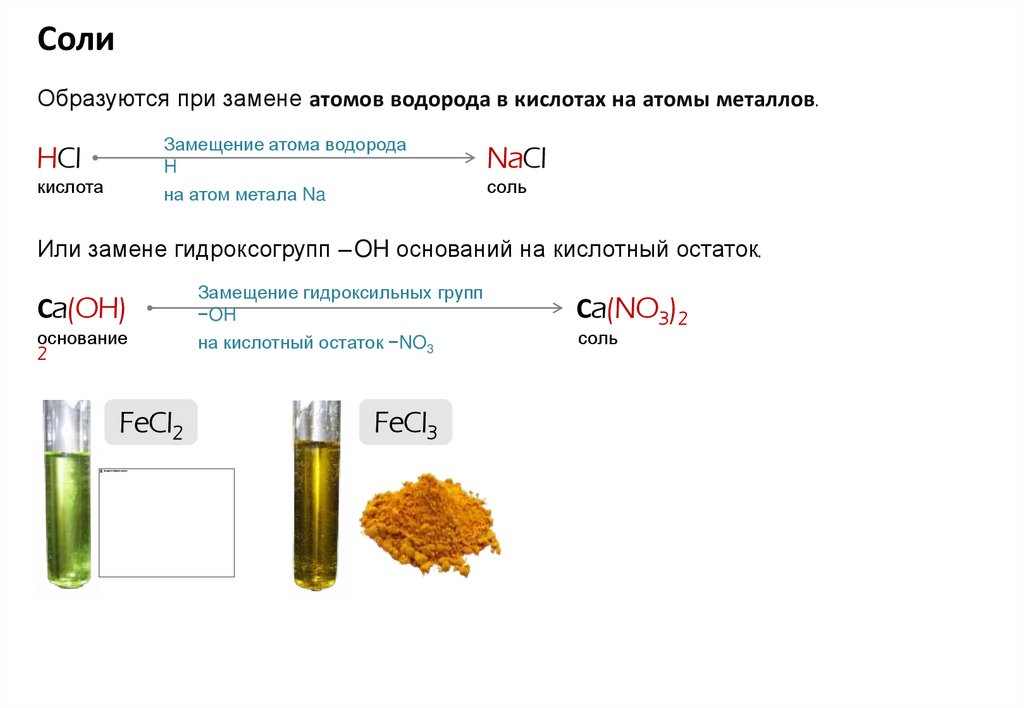
СолиОбразуются при замене атомов водорода в кислотах на атомы металлов.
Замещение атома водорода
H
на атом метала Na
HCl
кислота
NaCl
соль
Или замене гидроксогрупп – OH оснований на кислотный остаток.
Сa(OH)
основание
2
FeCl2
Замещение гидроксильных групп
−OH
на кислотный остаток −NO3
FeCl3
Сa(NO3)2
соль
24.
СолиОбразуются при замене атомов водорода в кислотах на атомы металлов.
HCl
кислота
Замещение атома водорода
H
на атом метала Na
NaCl
соль
Или замене гидроксогрупп – OH оснований на кислотный остаток.
Сa(OH)
основание
2
PbI2
Замещение гидроксильных групп
−OH
на кислотный остаток −NO3
NaCl
Сa(NO3)2
соль
25.
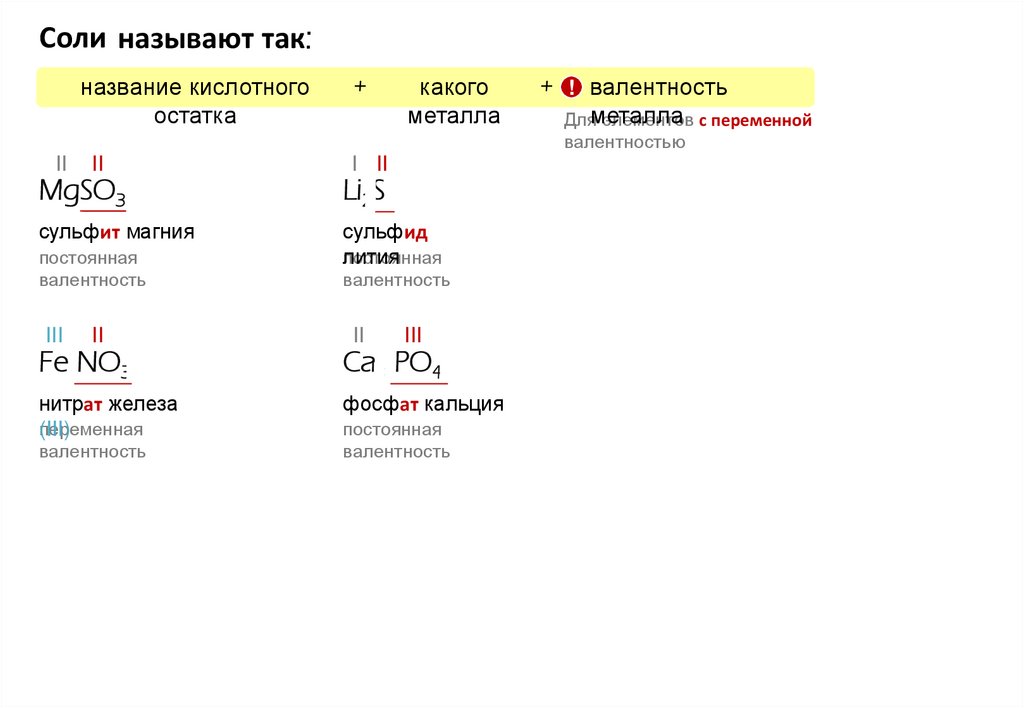
Соли называют так:название кислотного
остатка
+
какого
металла
+ ! валентность
Дляметалла
элементов с переменной
валентностью
II
I
III
II
Ca(NO2)
Al2(SO4)3
нитрит
кальция
2
сульфаталюмини
постоянная
я
постоянная
валентность
III I
валентность
I
II
FeCl3
K2CO3
хлорид железа (III)
карбонат калия
переменная
валентность
постоянная
валентность
26.
Соли называют так:название кислотного
остатка
+
какого
металла
+ ! валентность
Дляметалла
элементов с переменной
валентностью
II
II
I II
MgSO3
Li2S
сульфит магния
сульфид
постоянная
лития
постоянная
валентность
III
II
валентность
II
III
Fe(NO3)3
Ca3(PO4)2
нитрат железа
переменная
(III)
фосфат кальция
валентность
постоянная
валентность
27.
Тривиальные названия оксидовТривиальное название
Название по номенклатуре
NaCl
поваренная соль
хлорид натрия
NaHCO3
пищевая/питьевая
сода
кальцинированная
сода
поташ
гидрокарбонат
натрия
карбонат
натрия
карбонат калия
мел/мрамор/известняк
карбонат кальция
Na2CO3
К2CO3
CaC
O3
Некоторые нитраты = селитры
NaNO3
натриевая селитра
нитрат натрия
КNO3
калиевая
селитра
аммиачная
селитра
нитрат калия
NH4NO3
нитрат
аммония
28.
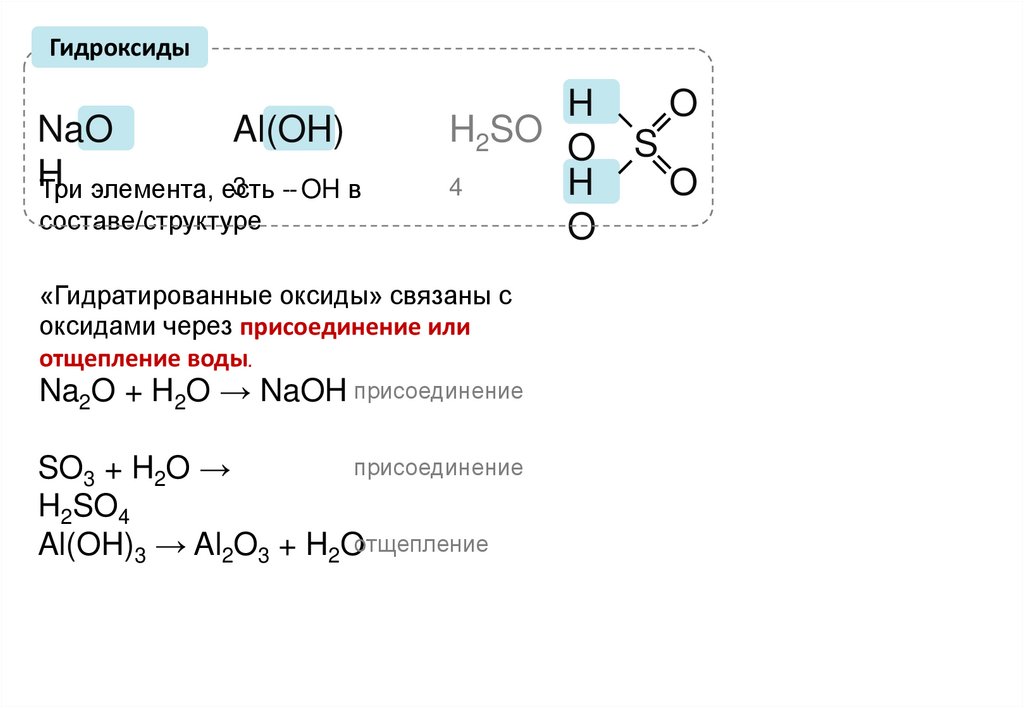
ГидроксидыAl(OH)
NaO
H
3 -- OH в
Три элемента, есть
составе/структуре
H
H2SO O
H
4
O
«Гидратированные оксиды» связаны с
оксидами через присоединение или
отщепление воды.
Na2O + H2O → NaOH присоединение
присоединение
SO3 + H2O →
H2SO4
Al(OH)3 → Al2O3 + H2Oотщепление
O
S
O
29.
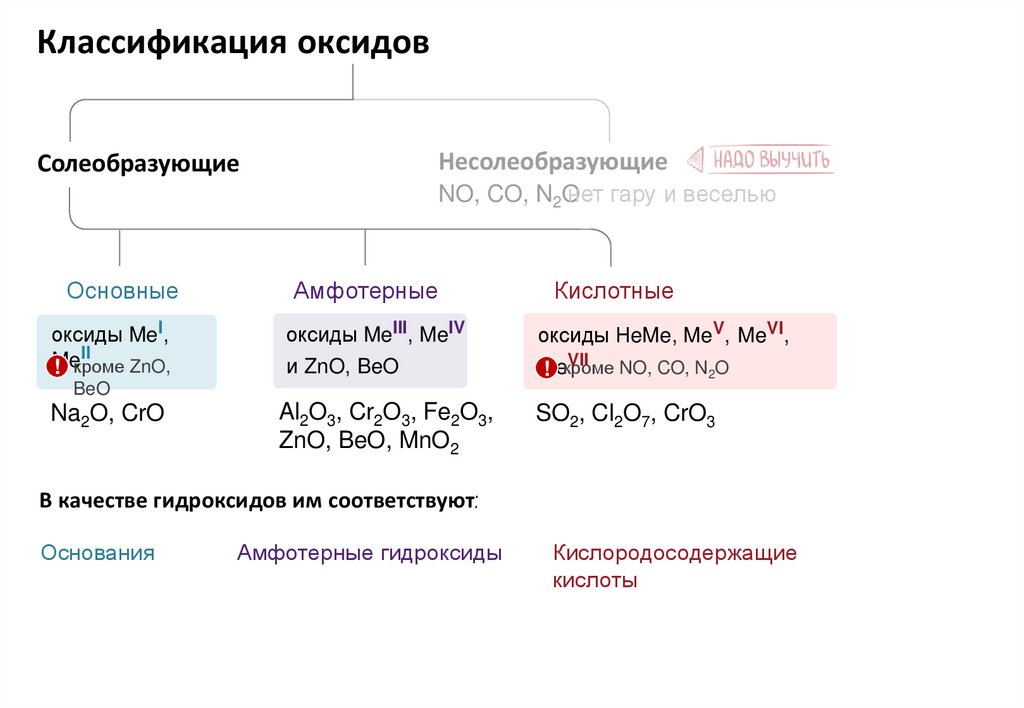
Классификация оксидовf
Несолеобразующие
Солеобразующие
NO, CO, N2O
нет гару и веселью
Основные
Амфотерные
Кислотные
оксиды MeI,
II
Me
! кроме ZnO,
оксиды MeIII, MeIV
оксиды НeMe, MeV, MeVI,
и ZnO, BeO
VII
Me
NO, CO, N2O
! кроме
Al2O3, Cr2O3, Fe2O3,
ZnO, BeO, MnO2
SO2, Cl2O7, CrO3
BeO
Na2O, CrO
В качестве гидроксидов им соответствуют:
Основания
Амфотерные гидроксиды
Кислородосодержащие
кислоты
30.
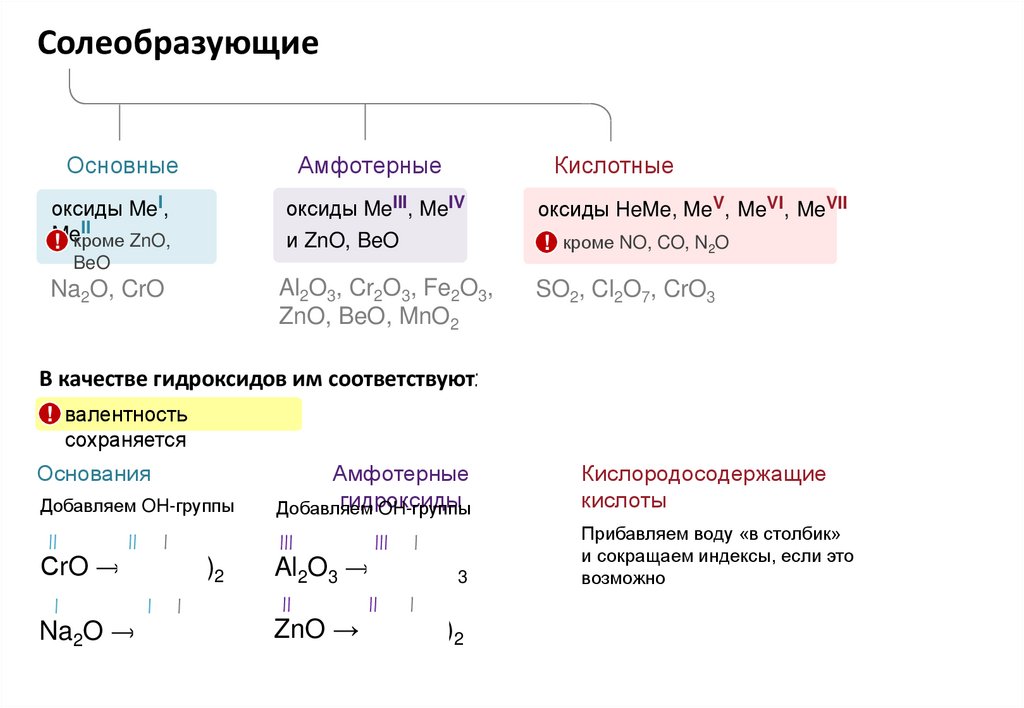
СолеобразующиеОсновные
Амфотерные
Кислотные
оксиды MeI,
II
Me
! кроме ZnO,
оксиды MeIII, MeIV
оксиды НeMe, MeV, MeVI, MeVII
и ZnO, BeO
! кроме NO, CO, N2O
Al2O3, Cr2O3, Fe2O3,
ZnO, BeO, MnO2
SO2, Cl2O7, CrO3
BeO
Na2O, CrO
В качестве гидроксидов им соответствуют:
! валентность
сохраняется
Основания
Добавляем OH-группы
Амфотерные
гидроксиды
Добавляем
OH-группы
Кислородосодержащие
кислоты
II
СrO → Cr(OH)2
III
III
I
Al2O3 → Al(OH)3
Прибавляем воду «в столбик»
и сокращаем индексы, если это
возможно
I
II
II
I
II
I
I
I
Na2O → NaOH
ZnO → Zn(OH)2
31.
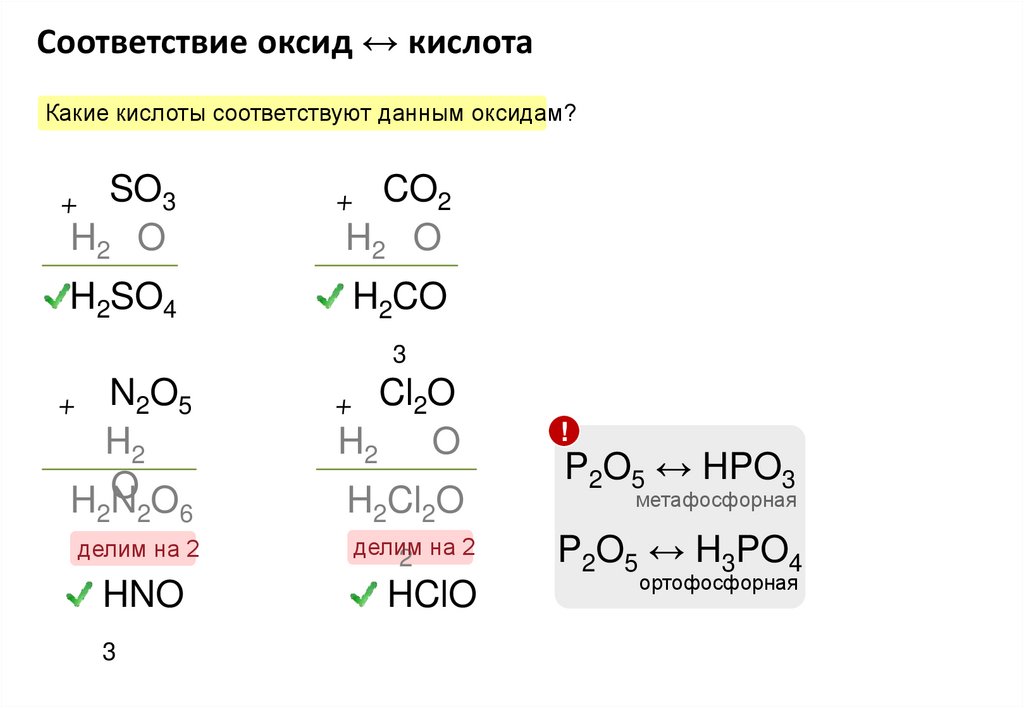
Соответствие оксид ↔ кислотаКакие кислоты соответствуют данным оксидам?
+ SO3
+ CO2
H2 O
H2 O
H2SO4
H2CO
3
N2O5
H2
OO
HN
+
2 2 6
делим на 2
HNO
3
+ Cl2O
H2
O
H2Cl2O
делим
2 на 2
HClO
!
P2O5 ↔ HPO3
метафосфорная
P2O5 ↔ H3PO4
ортофосфорная
32.
Соответствие оксид ↔ кислотаКакой оксид соответствует данной кислоте? H SO
2
4
1 Считаем валентность элемента
Сумма валентностей кислорода в кислоте
равна сумме валентностей элемента и
водорода.
I
X II
H2SO4
2 · I + X = 4 · II
X=6
2 Составляем оксид элемента с этой валентностью
VI
VI
H2SO4 ↔ SO3
Примечание: для HMnO4, H2SiO3 так же
33.
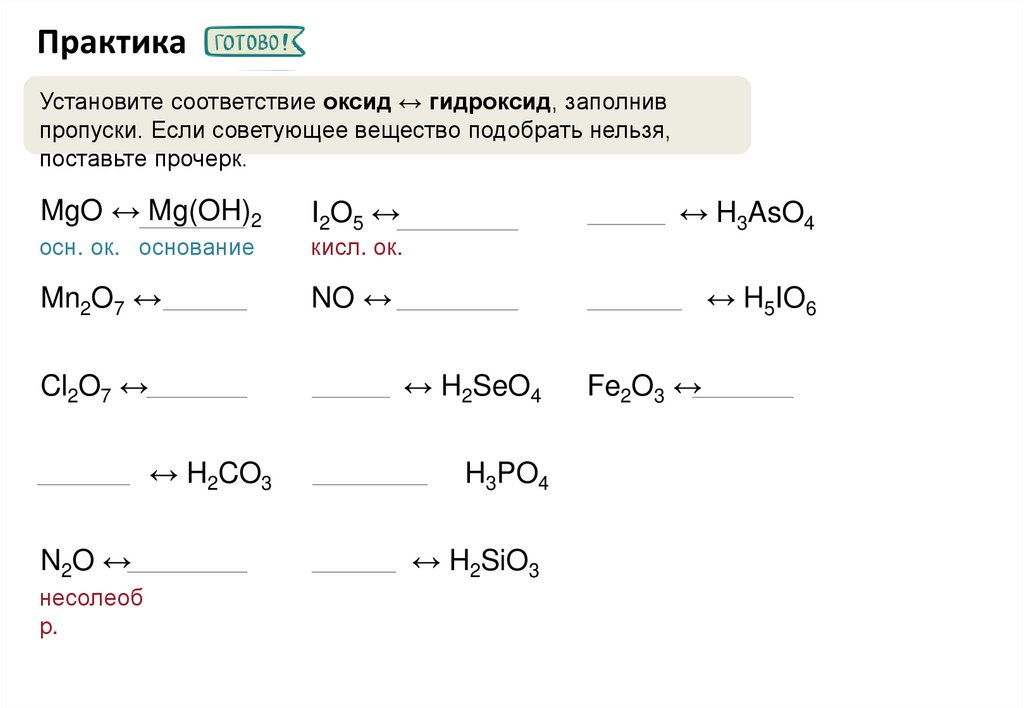
ПрактикаУстановите соответствие оксид ↔ гидроксид, заполнив
пропуски. Если советующее вещество подобрать нельзя,
поставьте прочерк.
MgO ↔ Mg(OH)2
I2O5 ↔
осн. ок. основание
кисл. ок.
Mn2O7 ↔
NO ↔
Mn2O7
Cl2O7 ↔
Mn2O7 ↔ H2SeO4
Fe2O3 ↔
H2CO3 ↔ H2CO3
H2CO3
N2O ↔
Mn2O7 ↔ H2SiO3
несолеоб
р.
Mn2O7 ↔ H3AsO4
H3PO4
↔ H5IO6





















 Химия
Химия








