Похожие презентации:
Электролиз
1.
Электролиз1
2.
1. Определение сущности процесса электролиза2. Электролиз в расплавах:
а) процессы на катоде
б) процессы на аноде
в) примеры электролиза в расплавах электролитов
3. Электролиз в растворах:
а) процессы на катоде
б) процессы на аноде
в) примеры электролиза в растворах электролитов
4. Области использования электролиза:
а) получение чистых металлов
б) очистка металлов , получение щелочей, галогенов, водорода
в) гальваностегия
г) гальванопластика
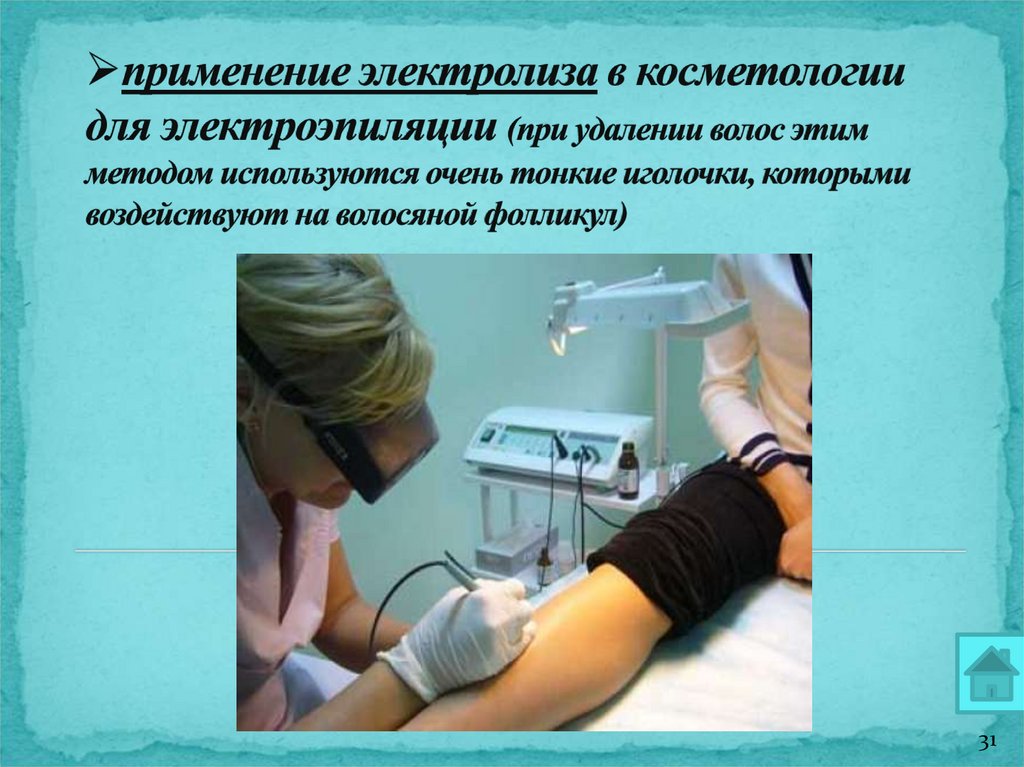
д) косметология
5. Тест по теме «Электролиз»
6. Домашнее задание
7.Список использованной литературы и Интернет-ресурсов
2
3.
34.
• В расплавах катионы металлавосстанавливаются до свободного
металла:
Мn+ + nē = М 0
4
5.
• В расплавах анионы бескислородных кислот(кроме фторидов) окисляются до
соответствующего простого вещества, например:
2Cl – – 2ē = Cl 2 0
• Кислородсодержащие анионы выделяют кислород
и превращаются в один из оксидов:
SO 4 2– – 2ē = SO 2 0 + O 2 0 .
5
6.
ЭЛЕКТРОЛИЗ – окислительно-восстановительный процесс,протекающий на электродах
при прохождении электрического тока
через расплав или раствор электролита
электроды
катод
анод
+ē
-ē
ПРОЦЕСС
ПРОЦЕСС
ВОССТАНОВЛЕНИЯ
ОКИСЛЕНИЯ
-Что называется
электролизом?
-Какой электрод
называют катодом,
какой – анодом?
-Какие процессы
протекают на
катоде, на аноде?
-Чем отличается
электролиз
расплавов от
электролиза водных
растворов?
7.
АНОДКАТОД
Cl
Na
Na
Cl2
8.
NaClА(+)
↓
← Na + + Cl- →
Na + + 1ē = Na 0
2Cl - - 2ē = Cl 2
К(-)
электролиз
2NaCl
2Na + Cl 2
8
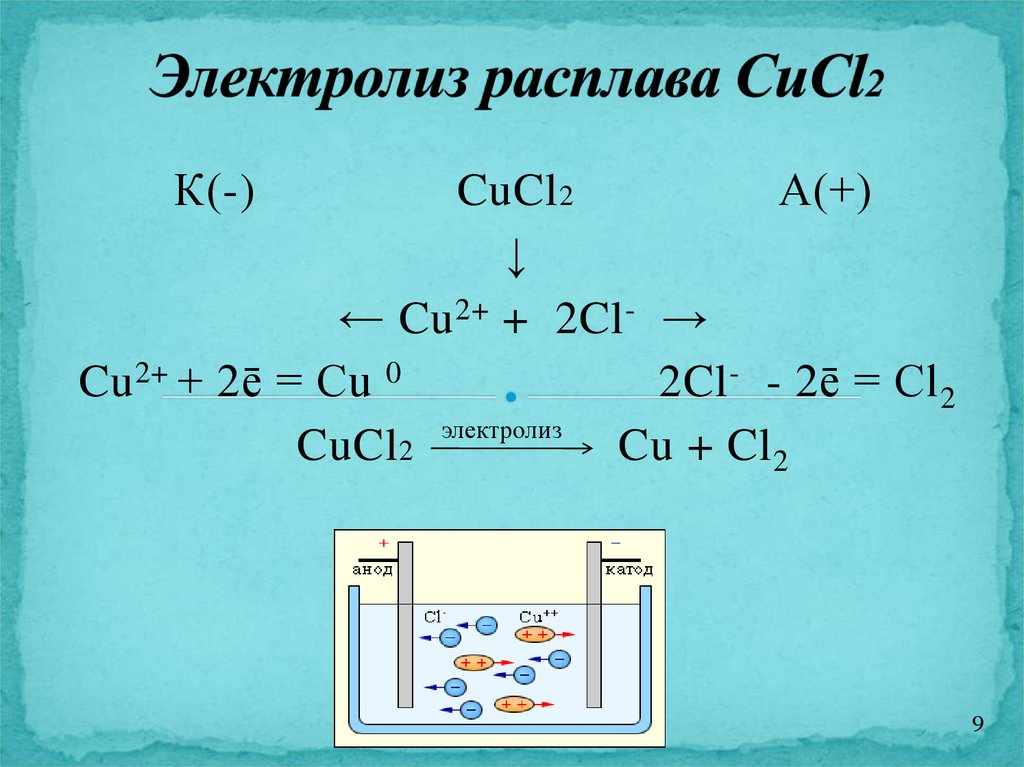
9.
К(-)CuCl 2
А(+)
↓
← Cu 2+ + 2Cl - →
Cu 2+ + 2ē = Cu 0
2Cl - - 2ē = Cl 2
CuCl 2 электролиз Cu + Cl 2
9
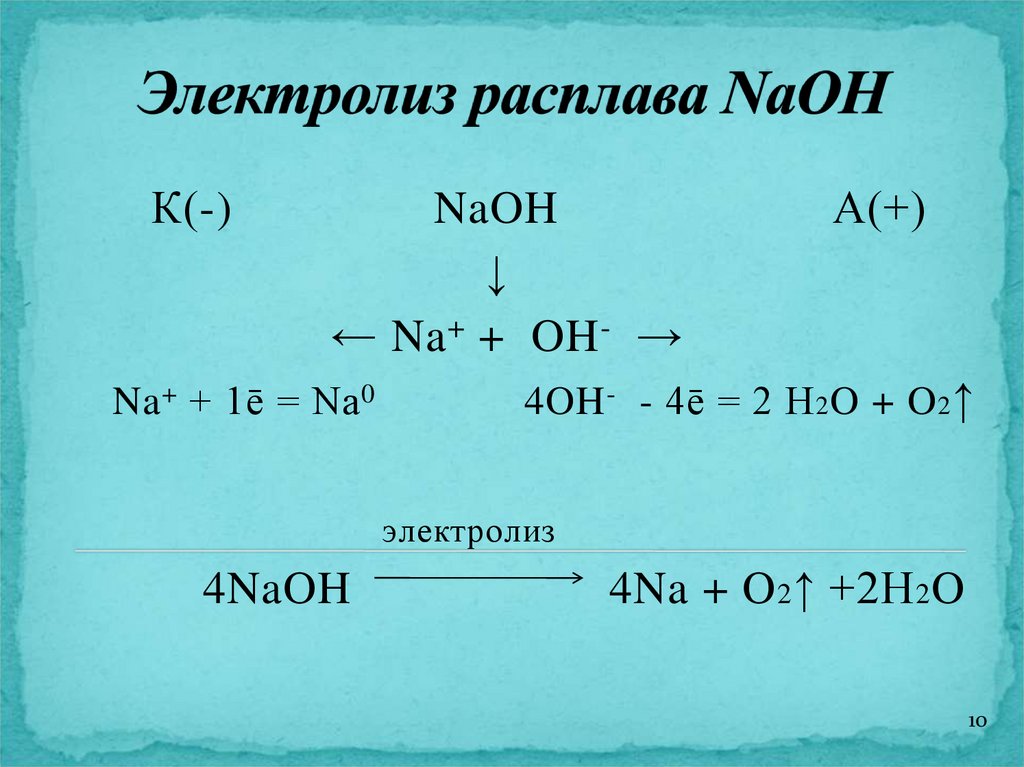
10.
К(-)NaOH
↓
← Na + + OH - →
Na + + 1ē = Na 0
А(+)
4OH - - 4ē = 2 H 2 O + O 2 ↑
электролиз
4NaOH
4Na + O 2 ↑ +2H 2 O
10
11.
• В растворах процесс на катоде не зависит отматериала катода, а зависит от активности
восстанавливаемого металла.
а) Если металл расположен в ряду напряжений
от Li до Al включительно, то на катоде идет
процесс восстановления воды:
2Н 2О + 2ē = H 20 + 2OH –
11
12.
б) Если металл расположен в ряду напряжений между Alи H 2 , то на катоде идут одновременно процессы
восстановления воды и катионов металла:
2Н 2 О + 2ē = H 2 0 + 2OH –
М n+ + nē = М 0
в) Если металл расположен в ряду напряжений после Н 2,
то на катоде идет процесс восстановления катионов
металла:
М n+ + nē = М 0
При электролизе растворов кислот идет процесс
восстановления ионов водорода:
2Н + + 2ē = H 2 0
12
13.
Процессы на КАТОДЕКатионы активных
металлов
Катионы менее
активных металлов
Катионы неактивных
металлов
Li+, Cs+, Rb+, K+, Mn2+, Cr3+, Zn2+,
3+, Cu2+, Ag+,
Bi
Ba2+, Sr2+, Ca2+,
Ga3+, Fe2+, Cd2+,
2+, Pd3+, Pt2+,
Hg
Na+, Mg2+, Be2+, In3+, Tl+, Co2+, Ni2+,
3+
Au
Al3+
Mo4+, Sn2+, Pb2+
Легко
Тяжело разряжаются В водном растворе
(только из расплавов), восстанавливаются
разряжаются и
металл (при малой восстанавливается
в водном растворе
концентрации
электролизу
только металл
катионов в
подвергается вода с
выделением водорода растворе — металл и
водород)
Н2
Н2, Металл Металл
14.
Процессы на АНОДЕАнионы
Гидроксид-ионы; анионы
кислородсодержащих
бескислородных кислот
кислот
(кроме F−)
PO43−, CO32−, SO42−, NO3−,
−, Cl−, Br−, I−, S2−
OH
NO2−, ClO4−
Тяжело разряжаются
(только из расплавов), в
Легко разряжаются
водном растворе
электролизу подвергается
вода с выделением
кислорода
О2
Неметаллы
15.
В растворах процесс на аноде зависит отматериала анода и от природы аниона. Аноды
могут быть двух видов – растворимые (железо,
медь, цинк, серебро и все металлы, которые
окисляются в процессе электролиза) и
нерастворимые, или инертные (уголь, графит,
платина, золото)
а) Если анод растворимый, то независимо от
природы аниона всегда идет окисление металла
анода, например:
Cu 0 – 2ē = Cu 2+
15
16.
б) Если анод инертный, то в случае бескислородныханионов (кроме фторидов) идет окисление анионов:
2Cl – – 2ē = Cl 2 0
В случае кислородсодержащих анионов и фторидов идет
процесс окисления воды, анион при этом не окисляется и
остается в растворе:
2H 2 O – 4ē = O 2 0 + 4H +
При электролизе растворов щелочей идет окисление
гидроксид-ионов:
4OH – – 4ē = O 2 0 + 2H 2 O
16
17.
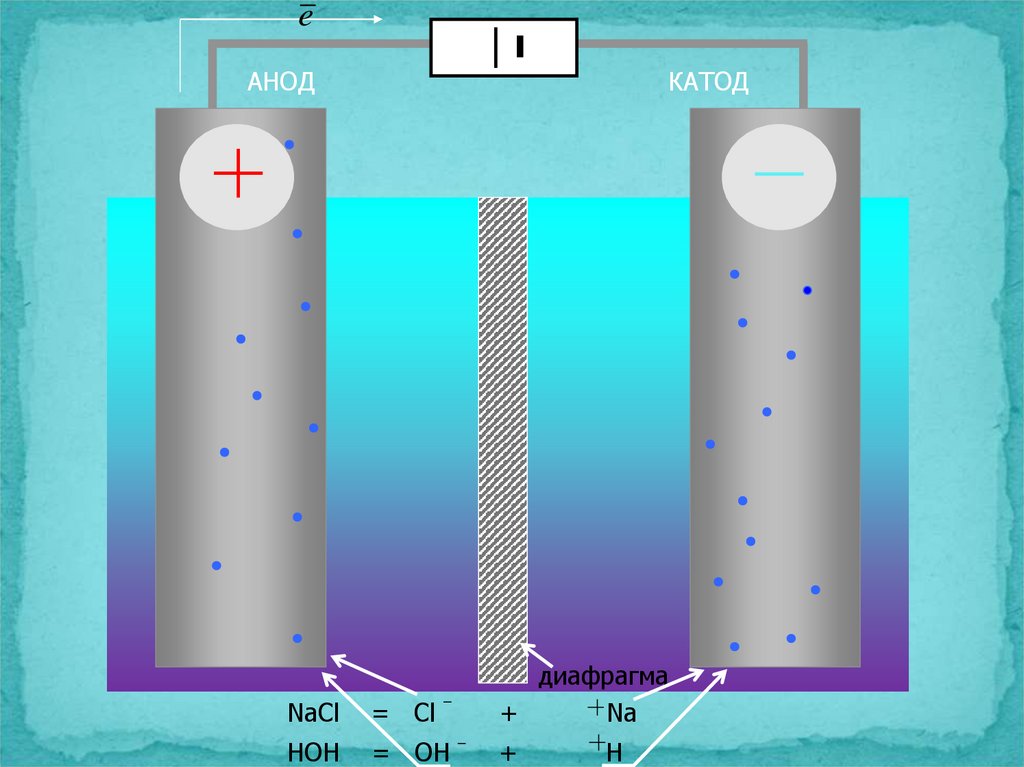
18.
eАНОД
КАТОД
NaCl
= Cl
диафрагма
+
Na
HOH
= OH
+
H
19.
АНОДКАТОД
H 2O
H
Cl
OH
Cl
OH
Cl
H 2O
H2
H
Cl2
20.
К(-)NaCl
↓
← Na + + Cl- →
2Н 2 О + 2ē = H 2 + 2OH -
А(+)
2Cl - - 2ē = Cl 2 ↑
электролиз
2NaCl + 2H 2 O
H 2 + Cl 2 +2NaOH
20
21.
22.
АНОДКАТОД
OH
H 2O
H
OH
H 2O
H
O2
H 2O
H 2O
Cu 2
H 2O
Cu
2
Cu
Cu
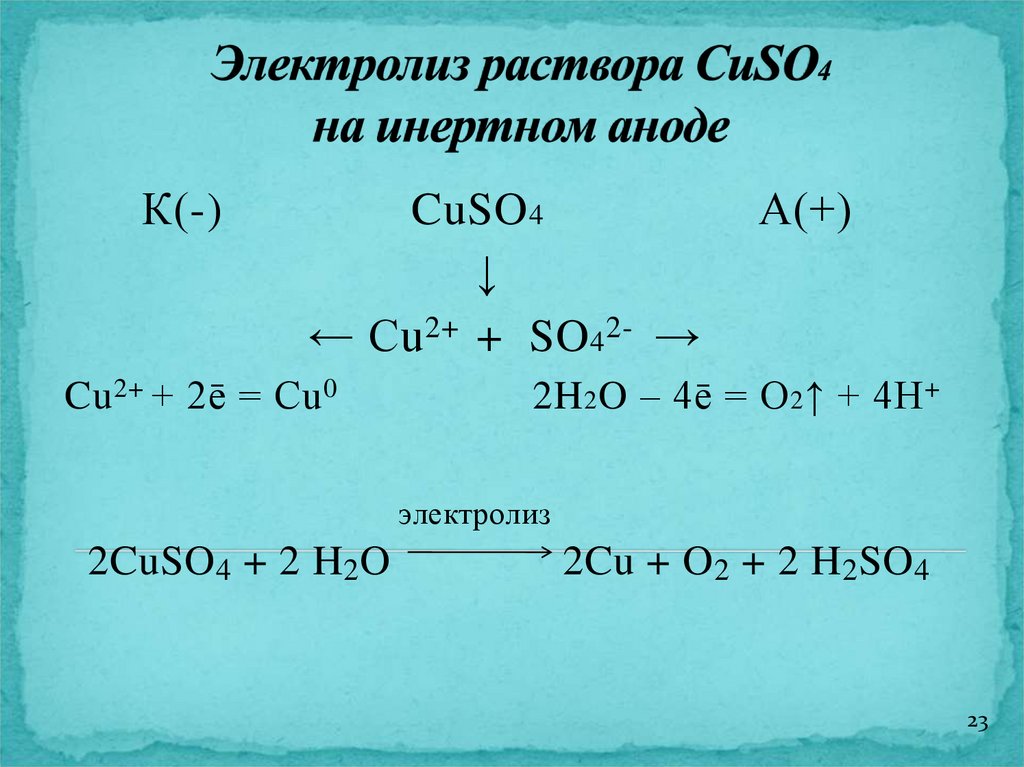
23.
К(-)CuSO 4
↓
← Cu 2+ + SO 4 2- →
Cu 2+ + 2ē = Cu 0
А(+)
2H 2 O – 4ē = O 2 ↑ + 4H +
электролиз
2CuSO4 + 2 H2O
2Cu + O 2 + 2 H2SO4
23
24.
К(-)NaCl
↓
← Na + + Cl- →
Cu 2+ + 2ē = Cu 0
А(+)
(Cu)
Cu 0 – 2ē =Cu 2+
(т.к. Cu 2+ в ряду напряжений
стоят после H + )
Происходит переход ионов меди с анода на катод.
Концентрация NaCl в растворе не меняется.
24
25.
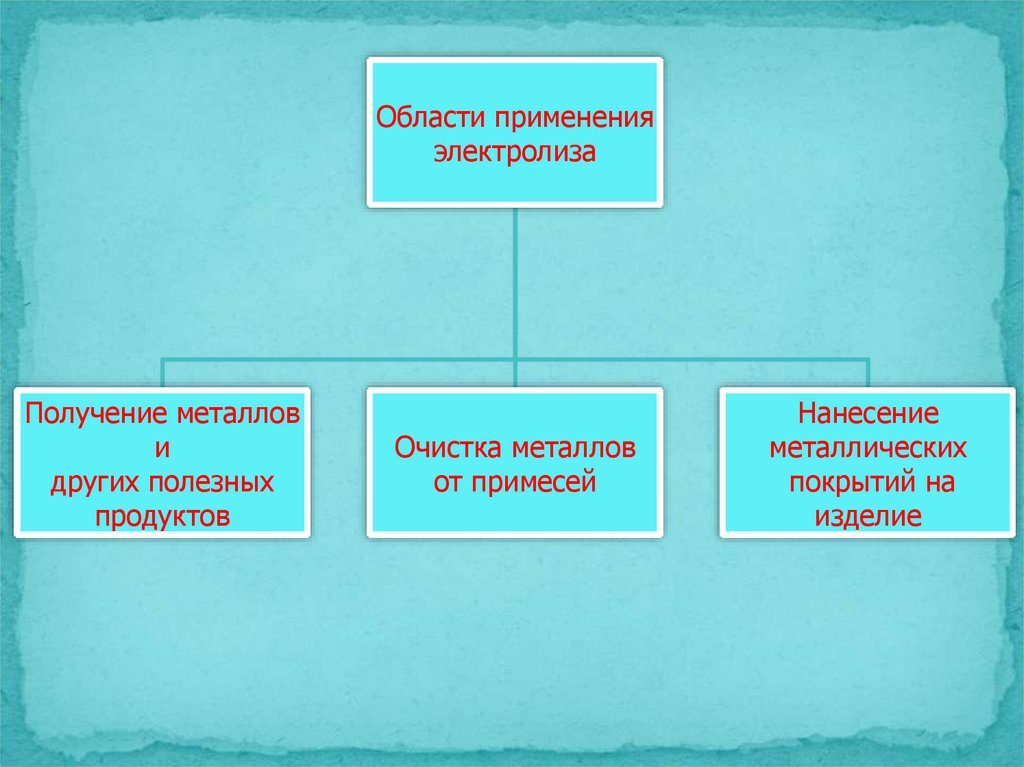
Области примененияэлектролиза
Получение металлов
и
других полезных
продуктов
Очистка металлов
от примесей
Нанесение
металлических
покрытий на
изделие
26.
В основной химической промышленности – получение H2, O2, S,галогенов, щелочей и др.
Электрометаллургия – получают металлы, в том числе щелочные и
щелочно-земельные электролизом расплавов солей
Металлообрабатывающая промышленность – гальваностегия –
нанесение металлических покрытий на изделия в декоративных целях,
в целях защиты от коррозии (хромирование, никелирование,
золочение, серебрение и т.д.)
Гальванопластика – снятие копий с изделий (скульптуры,
грампластинки, рельефные рисунки). Внедрил Б. С. Якоби, под
руководством которого таким образом изготовили украшения
фронтона Большого театра, Исаакиевского Собора, Эрмитажа
Очистка металлов – рафинирование (очистку Ni, Pb, Cu проводят
электрохимическим методом)
27.
получение чистых металлов(Алюминий,
магний, натрий, кадмий получают только электролизом)
27
28.
получение щелочей, хлора, водорода,кислорода
28
29.
2930.
3031.
3132.
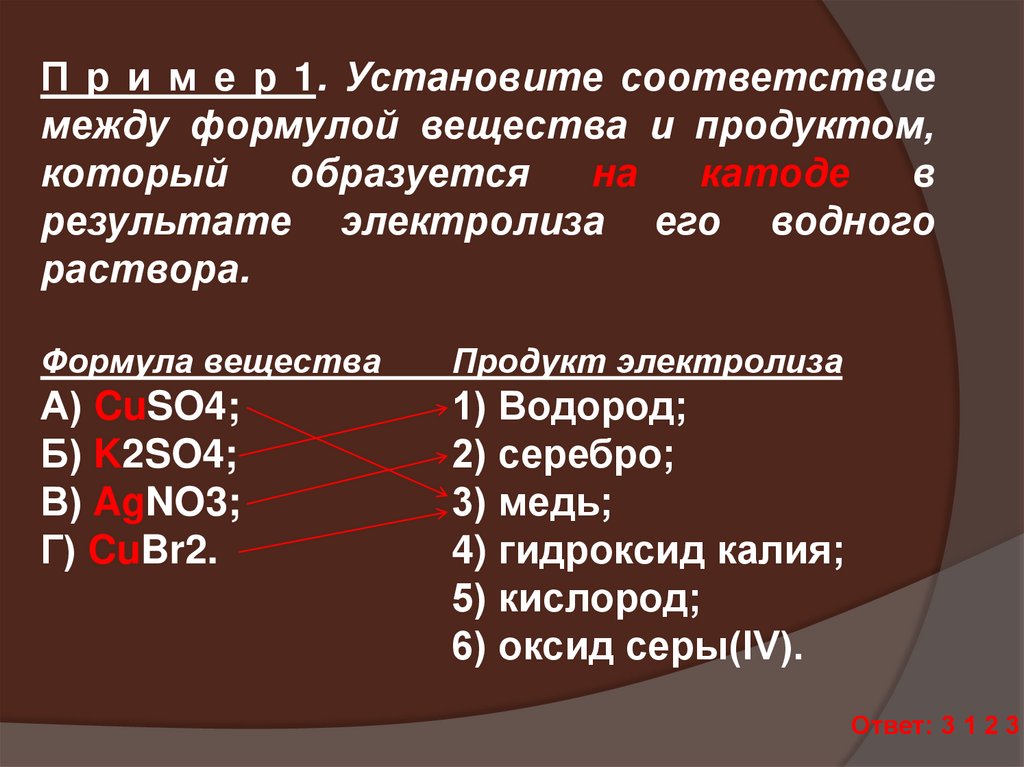
П р и м е р 1. Установите соответствиемежду формулой вещества и продуктом,
который
образуется
на
катоде
в
результате электролиза его водного
раствора.
Формула вещества
Продукт электролиза
А) CuSO4;
Б) K2SO4;
В) AgNO3;
Г) CuBr2.
1) Водород;
2) серебро;
3) медь;
4) гидроксид калия;
5) кислород;
6) оксид серы(IV).
Ответ: 3 1 2 3
33.
П р и м е р 2. Установите соответствиемежду формулой вещества и продуктом,
образующимся на аноде в результате
электролиза его водного раствора.
Формула вещества
Продукт электролиза
А) CuSO4;
Б) KCl;
В) AgF;
Г) CuBr2.
1) Фтор;
2) бром;
3) хлор;
4) хлороводород;
5) кислород;
6) оксид серы(IV).
Ответ: 5 3 5 2
34.
П р и м е р 8. Установите соответствие междуназванием вещества и продуктами электролиза на
инертных электродах.
Название вещества
Продукты электролиза
А) Хлорид меди(II) (раствор);
Б) хлорид меди(II) (расплав);
В) хлорид натрия (раствор);
водород;
Г) хлорид натрия (расплав).
1) Водород, хлор;
2) натрий, хлор;
3) гидроксид меди(II),
4) медь, хлор;
5) водород, кислород;
6) гидроксид натрия, хлор,
водород.
Ответ: 4 4 6 2
35.
П р и м е р 3. Установите соответствие междуформулой вещества и итоговым уравнением
электролиза его водного раствора.
Формула вещества
А) CuSO4;
Б) KCl;
В) AgF;
Г) NaNO3.
Уравнение электролиза
1) 2AgF = 2Ag + F2;
2) 4AgF + 2H2O = 4Ag + 4HF + O2;
3) 2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2;
4) 2KCl + 2H2O = H2 + 2KOH + Cl2;
5) NaNO3 + H2O = NaOH + HNO3;
6) 2H2O = 2H2 + O2.
Ответ: 3 4 2 6
36.
П р и м е р 4. Установите соответствие междуформулой соли и схемой процесса, протекающего
на катоде в результате электролиза ее водного
раствора.
Формула соли
Процесс, протекающий на катоде
А) Cu(NO3)2;
Б) MgBr2;
В) NaCl;
Г) HgCl2.
1) 2Н2О + 2е → Н2 + 2ОН–;
2) Cu 2+ + 2е → Cu 0;
3) 2Br – – 2е → Br2 0;
4) Mg 2+ + 2е → Mg 0;
5) Hg 2+ + 2е → Hg 0;
6) Na + + е → Na 0.
Ответ: 2 1 1 5
37.
1. При электролизе раствора сульфата цинка синертными электродами на аноде выделяется:
а) цинк;
б) кислород;
в) водород;
г) сера.
2. При электролизе раствора хлорида натрия
образуются:
а) натрий и хлор;
б) гидроксид натрия, хлор и водород;
в) кислород и хлор;
г) натрий, хлор и соляная кислота.
37
38.
4. Платиновый электрод:а) инертный;
б) растворимый;
в) расходуется в процессе электролиза;
г) не расходуется в процессе электролиза.
38
39.
6. При электролизе раствора нитрата меди(II) смедными электродами на аноде будет
происходить:
а) выделение диоксида азота;
б) выделение монооксида азота;
в) растворение анода;
г) выделение кислорода.
39
40.
4041.
1-б2-б
3-в, г
4-а, г
5-б
6- в
7- в
8-б
41
42.
Список использованной литературы:1. О.С.Габриелян Учебник химии для 11 класса, М., Дрофа, 2004г.
2. Г.П.Хомченко, К.И.Севастьянова «Окислительновосстановительные реакции» М., Просвещение, 1980.
Интернет – ресурсы:
1. http://www.nontoxicprint.com/electroetching.htm
2. http://dic.academic.ru/dic.nsf/enc_colier/3192/ХИМИЧЕСКИЕ
3. http://atecom.ru/ru/hydrogen/
4. http://festival.1september.ru/articles/564677/
5. http://www.nickelca.ru/professions/metallurgy/
6. http://t-coins.narod.ru/Hidro.htm
7. http://medicini.info/raznoe/165-udalenie-volos-metodomelektroliza.html
8. http://www.bayertechnology.com/ru/produkty/khlor-ehlektroliz.html
9. http://www.interfax.by/article/4066
42




































 Химия
Химия








