Похожие презентации:
Электролиз. Области использования электролиза
1.
Электролиз1
2.
1. Определение сущности процесса электролиза2. Электролиз в расплавах:
а) процессы на катоде
б) процессы на аноде
в) примеры электролиза в расплавах электролитов
3. Электролиз в растворах:
а) процессы на катоде
б) процессы на аноде
в) примеры электролиза в растворах электролитов
4. Области использования электролиза:
а) получение чистых металлов
б) очистка металлов
в) получение щелочей, галогенов, водорода
г) гальваностегия
в) гальванопластика
г) косметология
5. Тест по теме «Электролиз»
6. Домашнее задание
7.Список использованной литературы и Интернет-ресурсов
2
3.
34.
• В расплавах катионы металлавосстанавливаются до свободного
металла:
Мn+ + nē = М 0
4
5.
• В расплавах анионы бескислородных кислот(кроме фторидов) окисляются до
соответствующего простого вещества, например:
2Cl – – 2ē = Cl 2 0
• Кислородсодержащие анионы выделяют кислород
и превращаются в один из оксидов:
SO 4 2– – 2ē = SO 2 0 + O 2 0 .
5
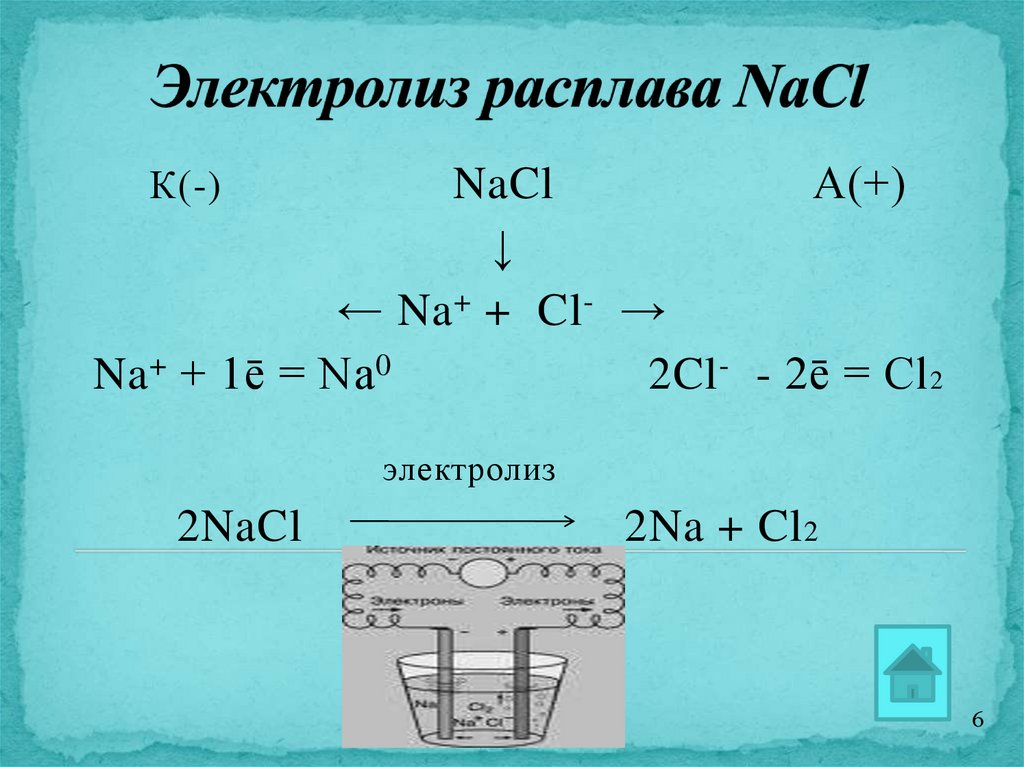
6.
NaClА(+)
↓
← Na + + Cl- →
Na + + 1ē = Na 0
2Cl - - 2ē = Cl 2
К(-)
электролиз
2NaCl
2Na + Cl 2
6
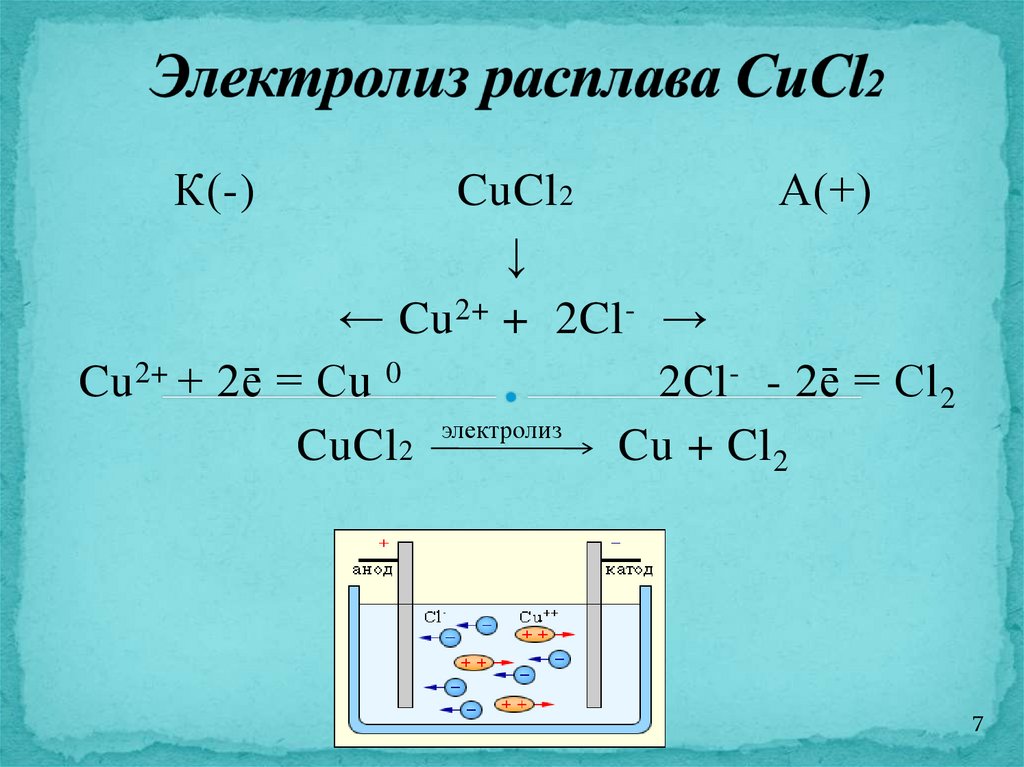
7.
К(-)CuCl 2
А(+)
↓
← Cu 2+ + 2Cl - →
Cu 2+ + 2ē = Cu 0
2Cl - - 2ē = Cl 2
CuCl 2 электролиз Cu + Cl 2
7
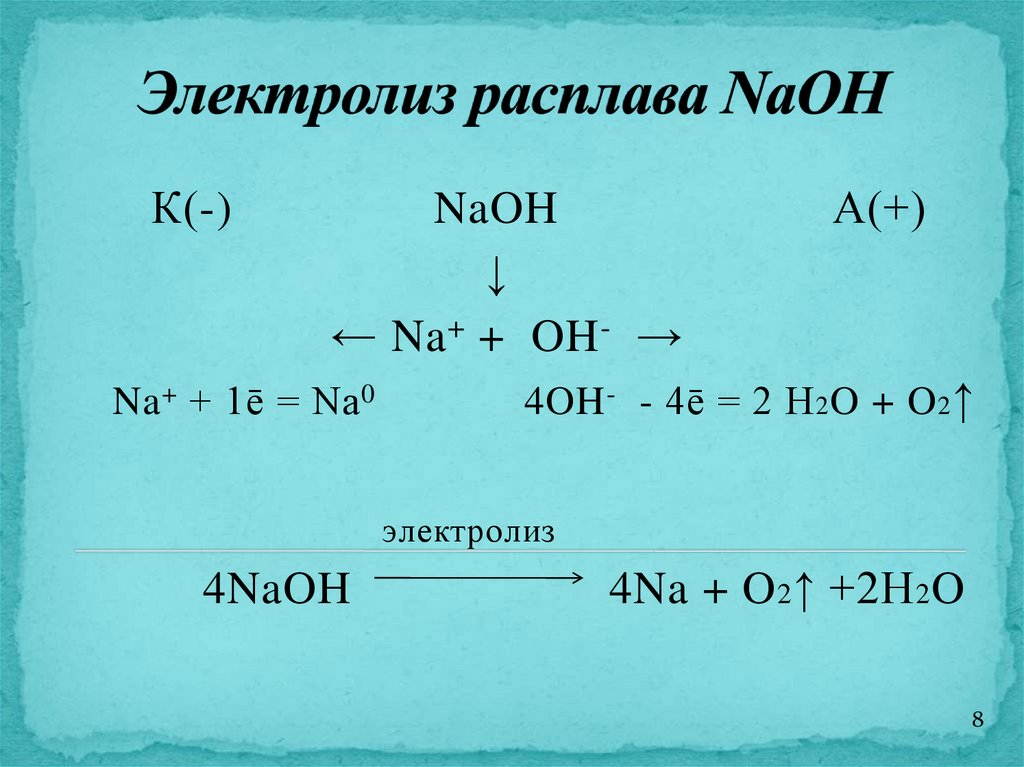
8.
К(-)NaOH
↓
← Na + + OH - →
Na + + 1ē = Na 0
А(+)
4OH - - 4ē = 2 H 2 O + O 2 ↑
электролиз
4NaOH
4Na + O 2 ↑ +2H 2 O
8
9.
• В растворах процесс на катоде не зависит отматериала катода, а зависит от активности
восстанавливаемого металла.
а) Если металл расположен в ряду напряжений
от Li до Al включительно, то на катоде идет
процесс восстановления воды:
2Н 2О + 2ē = H 20 + 2OH –
9
10.
б) Если металл расположен в ряду напряжений междуAl и H 2 , то на катоде идут одновременно процессы
восстановления воды и катионов металла:
2Н 2 О + 2ē = H 2 0 + 2OH –
М n+ + nē = М 0
в) Если металл расположен в ряду напряжений после
Н 2, то на катоде идет процесс восстановления
катионов металла:
М n+ + nē = М 0
При электролизе растворов кислот идет процесс
восстановления ионов водорода:
2Н + + 2ē = H 2 0
10
11.
В растворах процесс на аноде зависит отматериала анода и от природы аниона. Аноды
могут быть двух видов – растворимые (железо,
медь, цинк, серебро и все металлы, которые
окисляются в процессе электролиза) и
нерастворимые, или инертные (уголь, графит,
платина, золото)
а) Если анод растворимый, то независимо от
природы аниона всегда идет окисление металла
анода, например:
Cu 0 – 2ē = Cu 2+
11
12.
б) Если анод инертный, то в случае бескислородныханионов (кроме фторидов) идет окисление анионов:
2Cl – – 2ē = Cl 2 0
В случае кислородсодержащих анионов и фторидов
идет процесс окисления воды, анион при этом не
окисляется и остается в растворе:
2H 2 O – 4ē = O 2 0 + 4H +
При электролизе растворов щелочей идет окисление
гидроксид-ионов:
4OH – – 4ē = O 2 0 + 2H 2 O
12
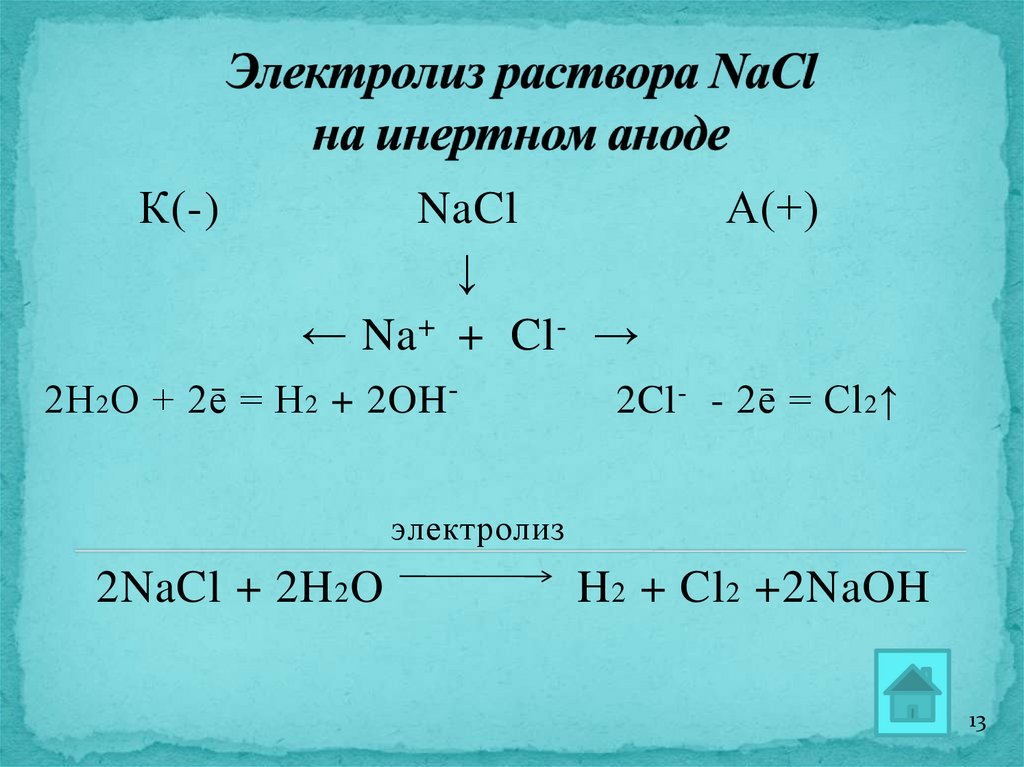
13.
К(-)NaCl
↓
← Na + + Cl- →
2Н 2 О + 2ē = H 2 + 2OH -
А(+)
2Cl - - 2ē = Cl 2 ↑
электролиз
2NaCl + 2H 2 O
H 2 + Cl 2 +2NaOH
13
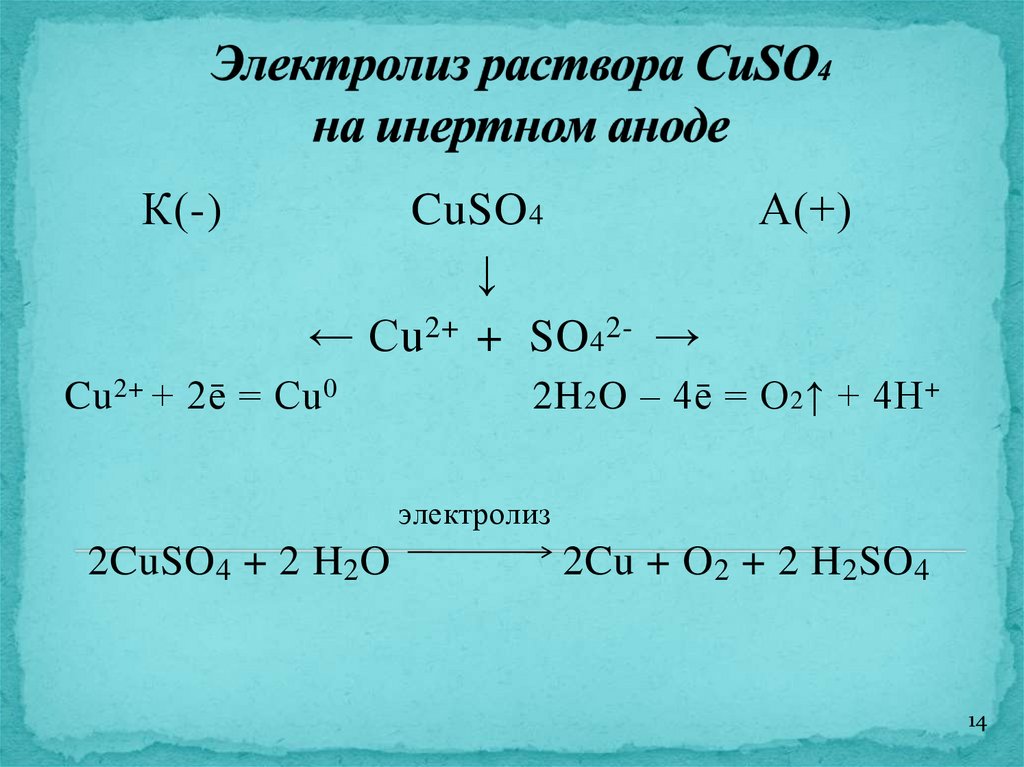
14.
К(-)CuSO 4
↓
← Cu 2+ + SO 4 2- →
Cu 2+ + 2ē = Cu 0
А(+)
2H 2 O – 4ē = O 2 ↑ + 4H +
электролиз
2CuSO4 + 2 H2O
2Cu + O 2 + 2 H2SO4
14
15.
К(-)NaCl
↓
← Na + + Cl- →
Cu 2+ + 2ē = Cu 0
А(+)
(Cu)
Cu 0 – 2ē =Cu 2+
(т.к. Cu 2+ в ряду напряжений
стоят после H + )
Происходит переход ионов меди с анода на катод.
Концентрация NaCl в растворе не меняется.
15
16.
получение чистых металлов(Алюминий,
магний, натрий, кадмий получают только электролизом)
16
17.
1718.
1819.
1920.
2021.
2122.
1. При электролизе раствора сульфата цинка синертными электродами на аноде выделяется:
а) цинк;
б) кислород;
в) водород;
г) сера.
2. При электролизе раствора хлорида натрия
образуются:
а) натрий и хлор;
б) гидроксид натрия, хлор и водород;
в) кислород и хлор;
г) натрий, хлор и соляная кислота.
22
23.
4. Платиновый электрод:а) инертный;
б) растворимый;
в) расходуется в процессе электролиза;
г) не расходуется в процессе электролиза.
23
24.
6. При электролизе раствора нитрата меди(II) смедными электродами на аноде будет
происходить:
а) выделение диоксида азота;
б) выделение монооксида азота;
в) растворение анода;
г) выделение кислорода.
24
25.
2526.
1-б2-б
3-в, г
4-а, г
5-б
6- в
7- в
8-б
26
27.
Учебник О.С.ГабриелянаХимия 11 класс
§ 18 (стр.217 - 222),
упр. 22,23,25.
27























 Химия
Химия








