Похожие презентации:
Электролиз
1.
Электролиз- окислительно-восстановительные процессы
на электродах
под действием внешнего источника тока
• Раствор или расплав электролита помещают
специальную емкость — электролитическую ванну.
в
Отрицательно заряженный электрод - катод притягивает
положительно заряженные ионы — катионы.
• Положительно заряженный электрод - анод притягивает
отрицательно заряженные частицы анионы.
• Катод выступает в качестве восстановителя, а анод — в
качестве окислителя.
• Катод – катионы – восстановление ( +е)
• Анод – анионы – окисление (-е)
2.
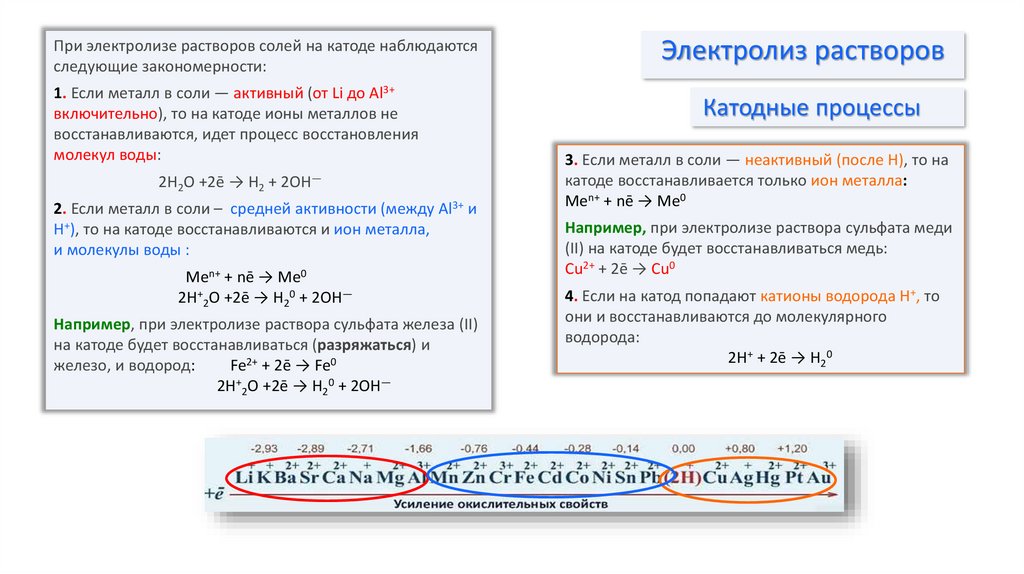
При электролизе растворов солей на катоде наблюдаютсяследующие закономерности:
1. Если металл в соли — активный (от Li до Al3+
включительно), то на катоде ионы металлов не
восстанавливаются, идет процесс восстановления
молекул воды:
2H2O +2ē → H2 + 2OH—
2. Если металл в соли – средней активности (между Al3+ и
Н+), то на катоде восстанавливаются и ион металла,
и молекулы воды :
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH—
Например, при электролизе раствора сульфата железа (II)
на катоде будет восстанавливаться (разряжаться) и
железо, и водород:
Fe2+ + 2ē → Fe0
2H+2O +2ē → H20 + 2OH—
Электролиз растворов
Катодные процессы
3. Если металл в соли — неактивный (после H), то на
катоде восстанавливается только ион металла:
Men+ + nē → Me0
Например, при электролизе раствора сульфата меди
(II) на катоде будет восстанавливаться медь:
Cu2+ + 2ē → Cu0
4. Если на катод попадают катионы водорода H+, то
они и восстанавливаются до молекулярного
водорода:
2H+ + 2ē → H20
3. Анодные процессы
Электролиз растворовПри электролизе растворов солей на аноде
наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный
остаток, то он окисляется до свободного состояния (до
степени окисления 0):
неМеn- – nē = неМе0
Например: при электролизе раствора хлорида натрия на
аноде окисляются хлорид-ионы:
2Cl— – 2ē = Cl20
Исключение: при электролизе растворов фторидов
окисляются молекулы воды, а не фторид-ионы:
2H2O-2 – 4ē → O20+ 4H+
2. Если на анод попадает кислородсодержащий
кислотный остаток, либо фторид-ион, то окислению
подвергается вода с выделением молекулярного
кислорода:
2H2O-2 – 4ē → O20 + 4H+
Анодные процессы
3. Если на анод попадает гидроксид-ион, то он
окисляется и происходит выделение молекулярного
кислорода:
4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых
кислот окислению подвергается атом углерода
карбоксильной группы, выделяется углекислый газ и
соответствующий алкан.
Например, при электролизе растворов ацетатов
выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
4.
5. Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.Например, электролиз раствора сульфата меди.
CuSO4 → Cu2+ + SO42Катод (–): Cu2+, Н2О Cu2+ + 2ē → Cu
2
Анод (+): SO42-, Н2О
2H2O – 4ē → O2 + 4H+ 1
2Cu2+ + 2H2O → 2Cu + 4H+ + O2
+2SO42+2SO42-
Электролиз водного раствора K2CO3.
K2CO3 → 2K+ + CO32Катод (–): К+, Н2О
2H2O +2ē → H2 + 2OH– 2
Анод (+): СO32-, Н2О 2H2O – 4ē → O2 + 4H+ 1
4H2O +2H2O → 2H2 + O2 + 4ОН- + 4Н+
2H2O → 2H2 + O2
(K2CO3) + 2H2
O-2
ϟ
→ 2H2 + O2 + (K2CO3)
ϟ
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Электролиз раствора хлорида натрия выглядит так:
NaCl→ Na+ + ClКатод (–): Na+, H2O
2H2O +2ē → H2 + 2OH– 1
Анод (+): Cl-, H2O
2Cl– – 2ē → Cl2
1
2H2O +2Cl- → H2 + 2OH- + Cl2
+2Na+
+2Na+
ϟ
2H2O +2NaCl → H2 + 2NaOH + Cl2
Электролиз водного раствора CuCl2.
Катод (–): Cu2+ , Н2О Cu2+ + 2ē → Cu0 1
Анод (+): Cl– , Н2О
2Cl– – 2ē → Cl20 1
Cu2++ 2Cl– → Cu0 + Cl20
ϟ
CuCl2 → Cu + Cl2
Электролиз раствора NaOH
Катод (–): Na+, Н2О 2H+2O +2ē → H2 + 2OH– 2
Анод (+): Н2О, ОН4OH– – 4ē → O2 + 2H2O 1
4Н2О + 4ОН- → 2 Н2 + О2 + 4ОН- +Н+
(NaOH) + 2H2
O2
ϟ
→ 2H2 + O2 + (NaOH)
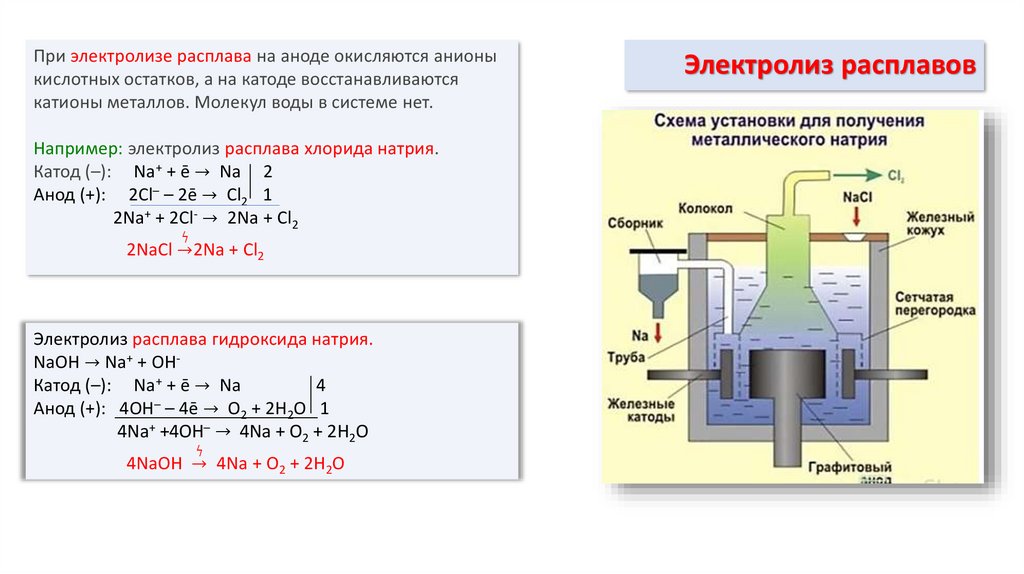
6. Электролиз расплавов
При электролизе расплава на аноде окисляются анионыкислотных остатков, а на катоде восстанавливаются
катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия.
Катод (–): Na+ + ē → Na 2
Анод (+): 2Cl– – 2ē → Cl2 1
2Na+ + 2Cl- → 2Na + Cl2
ϟ
2NaCl →2Na + Cl2
Электролиз расплава гидроксида натрия.
NaOH → Na+ + OHКатод (–): Na+ + ē → Na
4
Анод (+): 4OH– – 4ē → O2 + 2H2O 1
4Na+ +4OH– → 4Na + O2 + 2H2O
ϟ
4NaOH → 4Na + O2 + 2H2O
Электролиз расплавов
7.
Многие металлы получают в промышленности электролизом расплавов.Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита.
Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС).
А оксид алюминия отлично растворяется в расплавленном криолите и диссоциирует на ионы:
Al2O3 → Al3+ + AlO33Катод (–): Al3+ + 3ē → Al
Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O2
Общее уравнение электролиза раствора
оксида алюминия в расплаве криолита:
2Al2О3 = 4Al + 3О2
В промышленности при электролизе оксида
алюминия в качестве электродов используют
графитовые стержни.
При этом электроды частично окисляются
в выделяющемся кислороде:
C + О2 = CO2
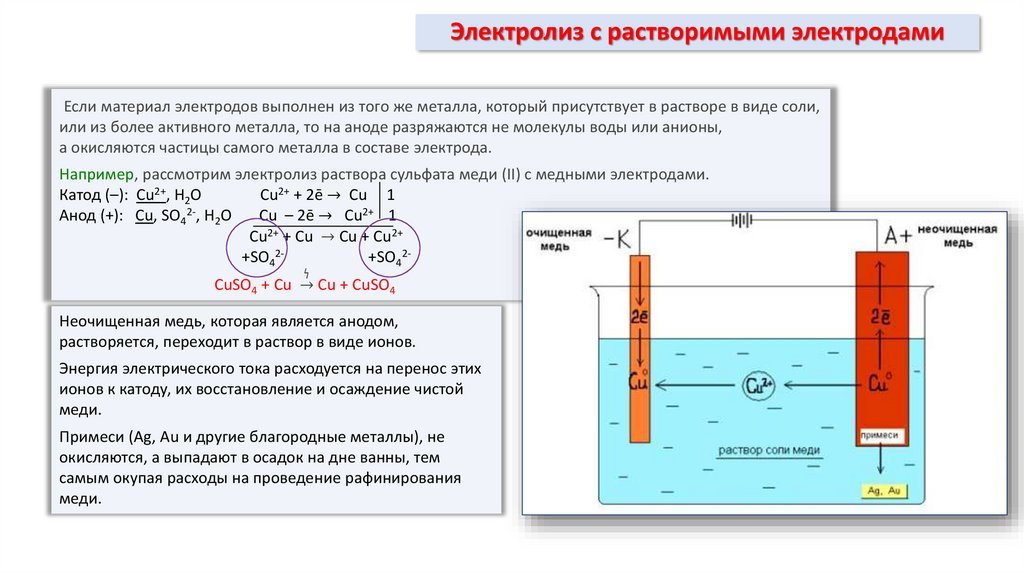
8. Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли,или из более активного металла, то на аноде разряжаются не молекулы воды или анионы,
а окисляются частицы самого металла в составе электрода.
Например, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
Катод (–): Cu2+, Н2О
Cu2+ + 2ē → Cu 1
Анод (+): Cu, SO42-, Н2О
Cu – 2ē → Cu2+ 1
Cu2+ + Cu → Cu + Cu2+
+SO42+SO42ϟ
CuSO4 + Cu → Cu + CuSO4
Неочищенная медь, которая является анодом,
растворяется, переходит в раствор в виде ионов.
Энергия электрического тока расходуется на перенос этих
ионов к катоду, их восстановление и осаждение чистой
меди.
Примеси (Ag, Au и другие благородные металлы), не
окисляются, а выпадают в осадок на дне ванны, тем
самым окупая расходы на проведение рафинирования
меди.





 Химия
Химия








