Похожие презентации:
Основы гистологии и гистологической техники. Гистохимия
1.
НОО «Фонд поддержки талантливых детей и молодежи «Золотое сечение»ФГБОУ ВО «Уральский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
Основы гистологии и
гистологической техники
Гистохимия
Прощенко Дарья Александровна
А ССИСТЕНТ КАФЕДРЫ МИКРОБИОЛОГИИ , ВИРУСОЛОГИИ И
ИММУНОЛОГИИ
2.
3.
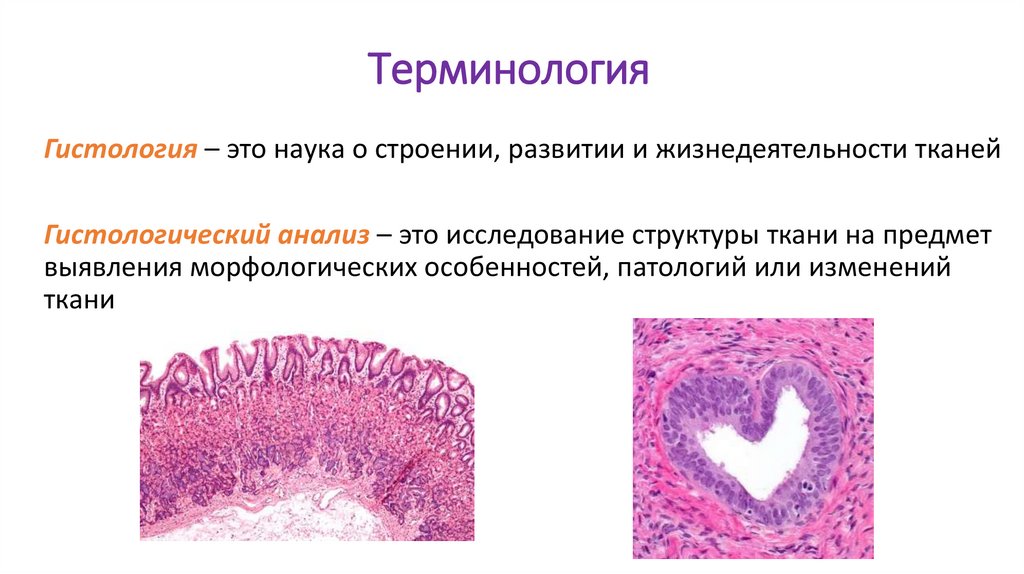
ТерминологияГистология – это наука о строении, развитии и жизнедеятельности тканей
Гистологический анализ – это исследование структуры ткани на предмет
выявления морфологических особенностей, патологий или изменений
ткани
4.
Для чего нужен гистологический анализ?Выявление патологических изменений в ткани при различных
заболеваниях - Патологическая анатомия, Онкология
Установление причины смерти человека - Судебная медицинская
экспертиза
Где проводится гистологический анализ?
Патологоанатомические отделения
Бюро судебно-медицинской экспертизы
Онкологические диспансеры
НИИ онкологии
Гистологические лаборатории больниц
Гистологические лаборатории медицинских университетов
5.
Что является объектом гистологическогоанализа?
Гистологический препарат
6.
Как проводится гистологическийанализ?
1. Забор материала для исследования
2. Обработка материала и получение гистологического препарата
3. Микроскопическое исследование препарата врачом-гистологом
и постановка диагноза
7.
Забор материала длягистологического анализа
1. Аутопсия (некропсия)– посмертное вскрытие и исследование тела, в том числе
внутренних органов.
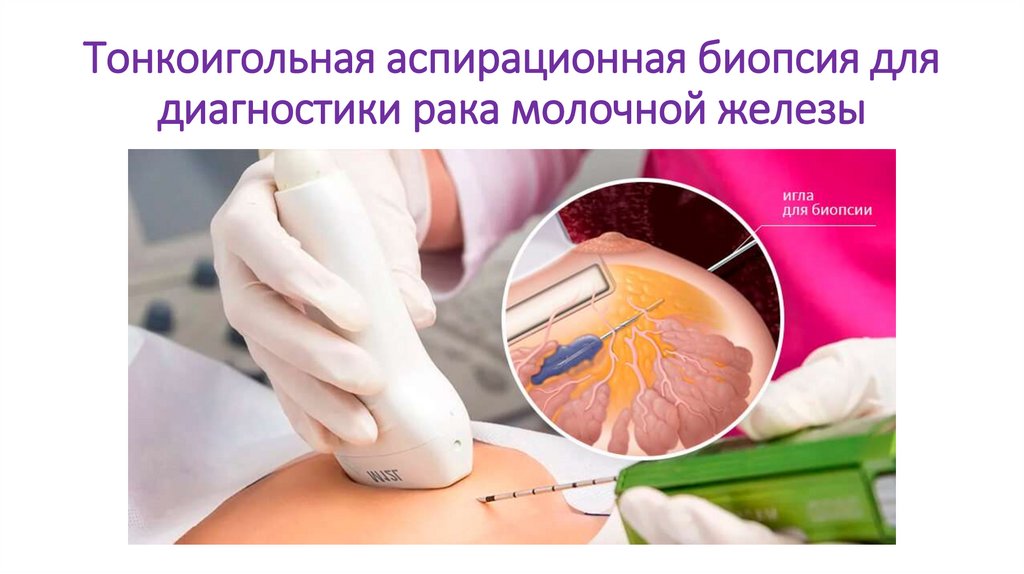
2. Биопсия (эксцизионная, инцизионная, тонкоигольная аспирационная)–
прижизненный забор клеток или тканей для микроскопических исследований с
диагностической целью.
-эксцизионная – изъятие всего органа во время операции
-инцизионная – изъятие части образования или органа
-тонкоигольная аспирационная – забор столбика ткани при помощи прокола полой
иглой
8.
Эксцизионная биопсия длядиагностики меланомы
Иссекается вся опухоль!
9.
Инцизионная биопсия дляИнцизионная биопсия для
диагностики меланомы диагностики рака молочной железы
Иссекается часть опухоли!
10.
Тонкоигольная аспирационная биопсия длядиагностики рака молочной железы
11.
Этапы гистологического исследования• приготовление тонкого среза тканей (или других типов
цитологических и гистологических препаратов: мазки,
отпечатки и др.)
• проведение гистохимической реакции в соответствии с
поставленной задачей и анализ полученных препаратов
12.
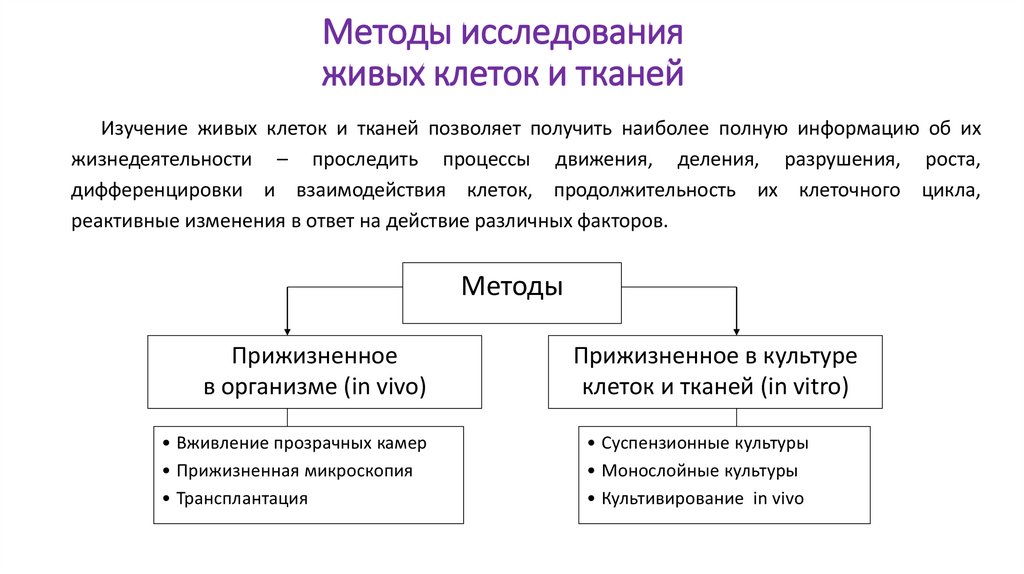
Методы исследованияживых клеток и тканей
Изучение живых клеток и тканей позволяет получить наиболее полную информацию об их
жизнедеятельности – проследить процессы движения, деления, разрушения, роста,
дифференцировки и взаимодействия клеток, продолжительность их клеточного цикла,
реактивные изменения в ответ на действие различных факторов.
Методы
Прижизненное
в организме (in vivo)
• Вживление прозрачных камер
• Прижизненная микроскопия
• Трансплантация
Прижизненное в культуре
клеток и тканей (in vitro)
• Суспензионные культуры
• Монослойные культуры
• Культивирование in vivo
13.
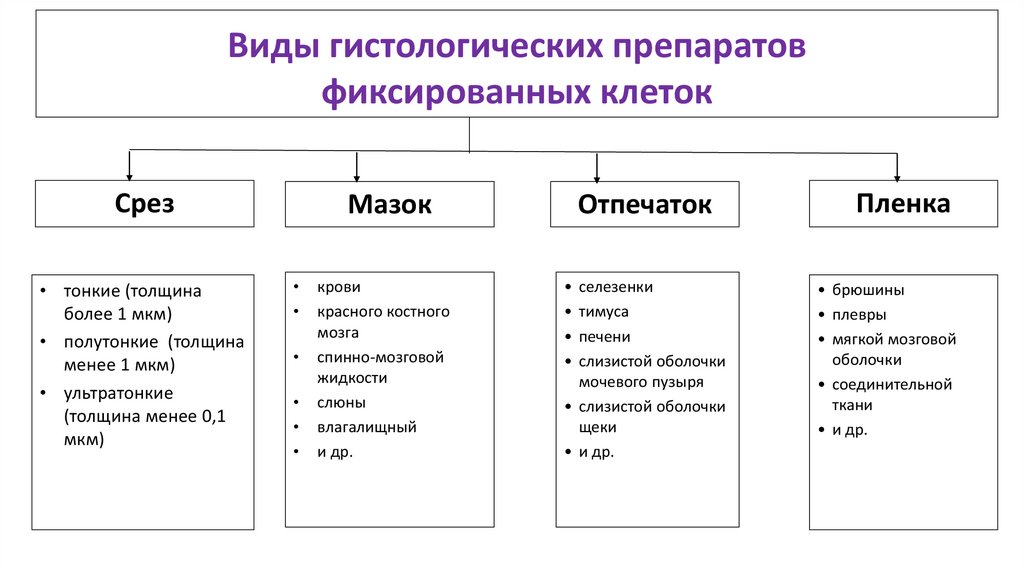
Виды гистологических препаратовфиксированных клеток
Срез
• тонкие (толщина
более 1 мкм)
• полутонкие (толщина
менее 1 мкм)
• ультратонкие
(толщина менее 0,1
мкм)
Мазок
крови
красного костного
мозга
спинно-мозговой
жидкости
слюны
влагалищный
и др.
Отпечаток
селезенки
тимуса
печени
слизистой оболочки
мочевого пузыря
• слизистой оболочки
щеки
• и др.
Пленка
• брюшины
• плевры
• мягкой мозговой
оболочки
• соединительной
ткани
• и др.
14.
Какие могут быть проблемы?Ткани животных (и растений) содержат около 80-90% воды и обладают
такими вязко-эластичными свойствами, которые не позволяют без
специальной дополнительной обработки, непосредственно из живой
ткани, сделать тонкие срезы ткани, годные для проведения
гистохимической реакции и последующего микроскопического анализа
Тонкие срезы – срезы толщиной 2-5 мкм для цитологических
исследований; для гистологических исследований и проведения
гистохимических реакций - 5 - 25 мкм
15.
Какие могут быть проблемы?После умерщвления животных и
извлечения ткани из организма в ткани
продолжаются различные биохимические
процессы, приводящие к нарушению
морфологической и биохимической
структуры, характерные для нативного
состояния
Эти постмортальные изменения приводят
к необратимым артефактам
Артефакт - признаки или структуры,
возникающие на препаратах случайно или
вследствие плохой обработки
16.
Задача гистолога на этом этапе• осуществить максимально быструю остановку биохимических
процессов для уменьшения постмортальных изменений и
изменения вязко-упругих свойств ткани таким образом, чтобы
было возможно изготовить тонкие срезы
17.
Для изготовления срезов используютсяспециальные операции:
• ФИКСАЦИЯ (химическая фиксация и фиксация с использованием
физических методов - криометоды, вакуумная сублимационная
сушка и др.)
• ЗАЛИВКА фиксированного материала в твердые материалы
(парафин, полимерные смолы)
18.
Зачем нужна фиксация материала?Фиксация обеспечивает стабилизацию тканевых структур и их уплотнение
Химическая фиксация
Использование специальных химических фиксаторов - соединений, приводящих к
быстрой остановке биохимических процессов в тканях и клетках, после извлечения
их из организмов и органов
19.
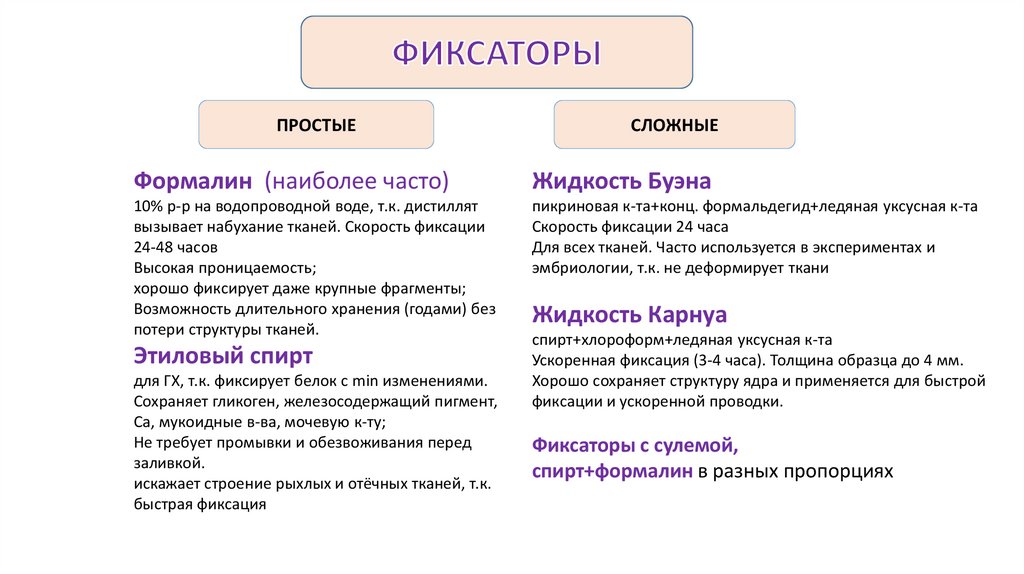
ПРОСТЫЕСЛОЖНЫЕ
Формалин (наиболее часто)
Жидкость Буэна
10% р-р на водопроводной воде, т.к. дистиллят
вызывает набухание тканей. Скорость фиксации
24-48 часов
Высокая проницаемость;
хорошо фиксирует даже крупные фрагменты;
Возможность длительного хранения (годами) без
потери структуры тканей.
пикриновая к-та+конц. формальдегид+ледяная уксусная к-та
Скорость фиксации 24 часа
Для всех тканей. Часто используется в экспериментах и
эмбриологии, т.к. не деформирует ткани
Этиловый спирт
для ГХ, т.к. фиксирует белок с min изменениями.
Сохраняет гликоген, железосодержащий пигмент,
Ca, мукоидные в-ва, мочевую к-ту;
Не требует промывки и обезвоживания перед
заливкой.
искажает строение рыхлых и отёчных тканей, т.к.
быстрая фиксация
Жидкость Карнуа
спирт+хлороформ+ледяная уксусная к-та
Ускоренная фиксация (3-4 часа). Толщина образца до 4 мм.
Хорошо сохраняет структуру ядра и применяется для быстрой
фиксации и ускоренной проводки.
Фиксаторы с сулемой,
спирт+формалин в разных пропорциях
20.
К химическим фиксаторам предъявляютсятри основные требования:
• Не должны разрушать морфологическое строение клеток и тканей;
• Должны быстро проникать в ткань за счет диффузии и иметь высокую
скорость взаимодействия с внутриклеточными и внутритканевыми
соединениями;
• Должны приводить к обратимым химическим изменениям
внутриклеточных и внутритканевых эндогенных соединений, или к
необратимым изменениям, которые, однако, не влияют на
качественные и количественные параметры последующей
гистохимической реакции.
• В качестве химических фиксаторов используются альдегиды, кислоты,
соли неорганических кислот, спирты и другие соединения.
21.
22.
Обработка материала и получение гистологического препаратаМАРКИРОВКА
ВЫРЕЗКА
ПРОВОДКА
ОКРАСКА
МИКРОТОМИРОВА
НИЕ
ЗАЛИВКА
ЗАКЛЮЧЕНИЕ
ДИАГНОСТИКА
АРХИВИРОВАНИЕ
23.
Маркировка - присвоение материалу определенногопорядкового номера
Маркеры устойчивые к реагентам
«Алмазный» карандаш
Краска для маркировки тканей
Принтеры для маркировки кассет и стекол
24.
ВырезкаС помощью традиционных инструментов – скальпелей и ножей
получение образцов ткани стандартной толщины
труднодостижимо
25.
Процесс вырезкиВАЖНО!
Толщина образца ткани для исследования должна быть
не более 2-7 мм
(часто определяется фиксатором, типом ткани
и вариантом последующей окраски)
В противном случае качество последующей обработки ткани будет
варьировать
26.
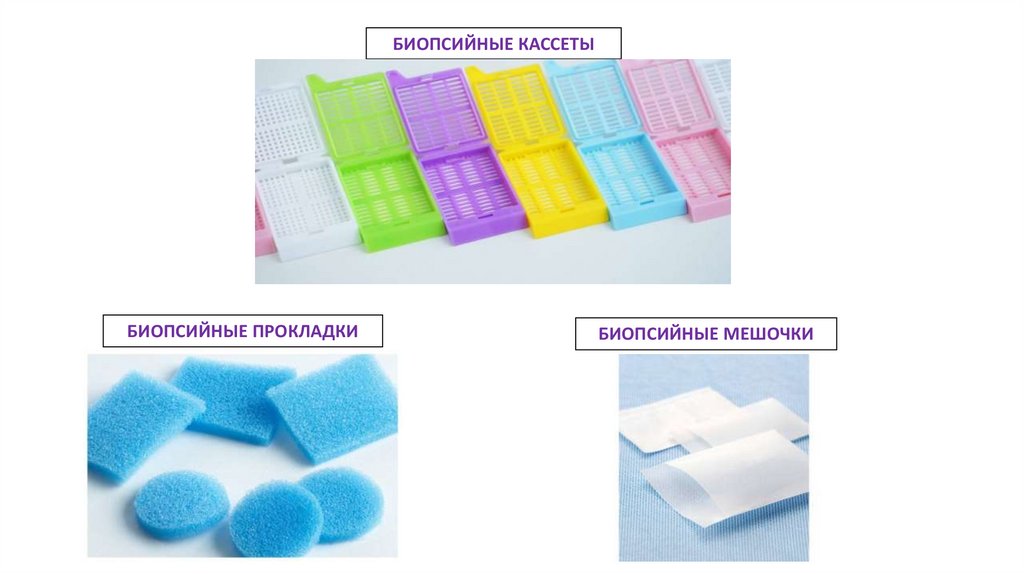
БИОПСИЙНЫЕ КАССЕТЫБИОПСИЙНЫЕ ПРОКЛАДКИ
БИОПСИЙНЫЕ МЕШОЧКИ
27.
ПроводкаГистологическая проводка - это процесс последовательного
замещения воды и жиров ткани на парафин.
Результат проводки: получение фиксированного и обезвоженного
образца ткани, который в дальнейшем может быть залит в
парафиновый блок и подвержен микротомированию.
28.
Этапы гистологической проводки1. Фиксация тканей. Обычно в формалине.
2. Обезвоживание тканей в спиртах восходящей крепости и ксилоле.
3. Пропитка тканей парафином
400
700
960
спирт
абс1
абс2
кс1
ксилол
кс2
Hist
Hist
Парафин Histomix
29.
Проводка вручнуюТрадиционно используют марлю и банки с притертой крышкой!
30.
Недостатки проводки вручнуюДлительный процесс проводки
Требует постоянного внимания лаборанта
Нестабильное, часто низкое качество проводки
Испарение реагентов загрязняет атмосферу в лаборатории
Очень трудоемкий процесс
Возможна потеря образцов
31.
Проводка автоматическаяКарусельного типа
Вакуумные
процессоры
Гистоконвейеры
32.
ЗаливкаЗаливка – это процесс заключения проведенного образца в парафин
(редко целлоидин).
Результат заливки – это парафиновый блок, в который заключен
образец ткани. Этот блок далее поступает на этап микротомии.
33.
Парафиновые средыПриготовленные вручную
Парафин
Готовые
Воск
(пчелиный или зуботехнический)
34.
Как приготовить парафин для заливки вручную?Расплавление парафина и воска
Охлаждение полученной смеси холодной водой
Тщательное перемешивание полученной смеси руками
И ТАК 5-10 РАЗ ДО ПОЛУЧЕНИЯ ГОМОГЕНЕЗИРОВАННОЙ ПАРАФИНОВОЙ СМЕСИ
Недостатки:
• Процесс очень трудоемкий;
• Лаборант тратит на приготовление среды для заливки до 30% своего рабочего
времени;
• Лаборант подвергает свое здоровье опасности
• Качество воска и парафина варьирует, а следовательно, варьирует и качество
среды
35.
Как традиционно заливают ткани в лаборатории?Помещение объекта в формочку
Заливка парафином, разогретым до температуры 58°-65°
Ориентация кусочка ткани с помощью подогретой препаровальной иглы
Охлаждение залитых объектов с целью получения лучшей консистенции парафинового блока.
Для этого формы опускают в холодную воду или помещают на охлажденную поверхность
Вырезка блоков из затвердевшего парафина
Приклеивание приготовленных блоков с помощью подогретого
шпателя к деревянному блоку
Маркировка блока
36.
Заливка вручную37.
Недостатки• Занимает много времени
• Требует постоянного внимания лаборантов
• Трудно выполнять одному
• Нестабильное качество заливки
• Очень трудоемкий процесс
38.
Заливка автоматическая39.
МикротомияМикротомия – это получение тонких срезов из парафинового блока, в
котором заключен образец ткани.
Криотомия – это получение тонких срезов из замороженного кусочка
ткани при необходимости постановки срочного диагноза (срочная
биопсия).
Полученный срез (срезы) наносится на предметное стекло для
дальнейшего окрашивания и получения гистологического препарата.
40.
Микротомия тканейМикротомия тканей - комплекс методик и соответствующих
приборов для изготовления срезов тканей толщиной от 2-3 мкм до
100-150 мкм.
Микротомия тканей, фиксированных химическими фиксаторами и
залитых в пропитывающие среды,
Микротомия замороженных тканей (без предварительной
фиксации, после фиксации, без заливки в пропитывающие среды).
Микротомия нативных образцов тканей или образцов
фиксированной, не залитой в пропитывающие среды
41.
МикротомияМикротомы – это приборы, с помощью которых получают срезы тканей, залитых в
парафиновые среды, а также замороженных и нефиксированных.
По принципу действия различают санные, ротационные микротомы, а также
криотомы.
42.
Как традиционно проводитсямикротомия в лаборатории?
Традиционно лаборанты-гистологи
работают на санных микротомах МС-2
43.
Как традиционно проводитсямикротомия в лаборатории?
Для работы на санном микротоме используют
МНОГОРАЗОВЫЕ микротомные ножи, которые
периодически необходимо затачивать
44.
Недостатки работы на санноммикротоме
1. ОЧЕНЬ трудоемкий процесс микротомирования
2. Необходимость постоянной оптимизации механизма микротома
3. Невозможно получить серию срезов, что зачастую необходимо
для анализа структуры ткани
45.
Недостатки работы сМНОГОРАЗОВЫМИ ножами
1. Невозможно получить качественные срезы мягких тканей
2. Трудности в получении тонких (до 1 мм толщиной) срезов
3. Проблематичность организации процесса заточки ножа
4. Дороговизна абразивных материалов, необходимых для заточки
5. Необходимость закупки дополнительного оборудования для
заточки ножей
46.
Одноразовые микротомные ножи47.
Преимущества работы с одноразовымимикротомными ножами
1. Отсутствует необходимость постоянной заточки
2. Отсутствует необходимость закупки дорогостоящего оборудования и
абразивных материалов для заточки
3. Возможность получения высококачественных тонких срезов
4. Для различных типов тканей существуют особые типы одноразовых
ножей
5. Каждый нож покрыт специальным покрытием, предотвращающим
его от повреждений и коррозии
48.
ОкраскаОкраска препаратов позволяет оценить :
•морфологию ткани
•наличие патологических изменений в ткани или клетке
•наличие патогенных микроорганизмов
•активность некоторых белков, ответственных за внутриклеточные процессы
49.
Подготовка препарата к окраске• Большинство красителей не проникают в срезы, пропитанные
парафином, поскольку являются водо- или спирторастворимыми
веществами
• Парафин перед окраской препаратов должен быть удален
• Для этого препарат подвергается процедурам депарафинизации и
регидратации
50.
Депарафинизация срезовПрепарат последовательно проводят через ксилол и батарею спиртов
для удаления парафина
кс1
ксилол
кс2
абс
960
700
спирт
400
H2O
вода
51.
Сухие красителиНедостатки:
Огромные временные затраты на приготовление
красителей
Зависимость качества приготовленного красителя от
мастерства лаборанта
Сложности с закупками отдельных сухих красителей
Необходимость закупать дополнительные реактивы
– кислоты, щелочи, соли
Низкий уровень стандартизации результатов
52.
Готовые красителиНаборы красителей
Растворы красителей
53.
ОКРАСКА54.
Окраскавручную
автоматическая
55.
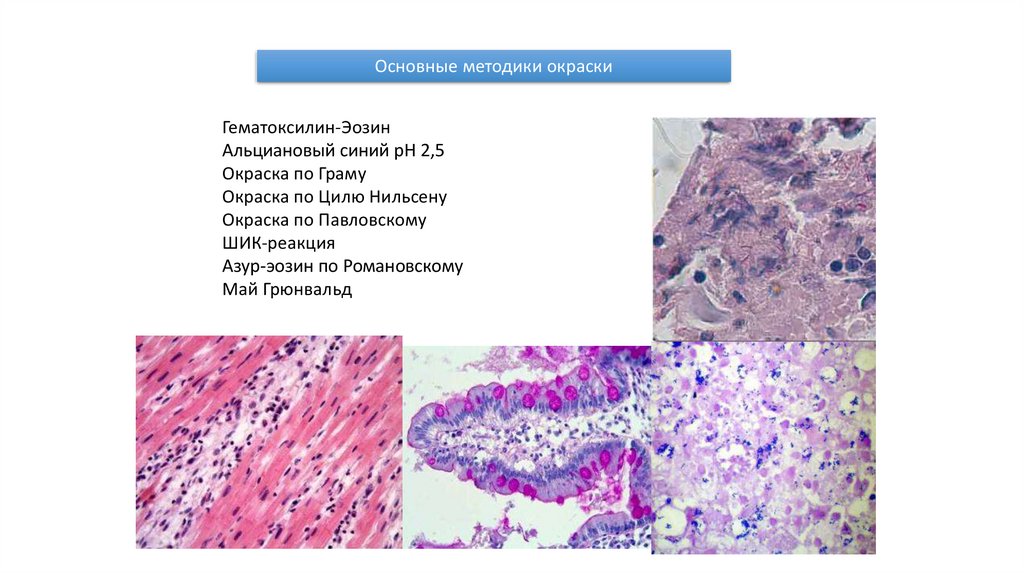
Основные методики окраскиГематоксилин-Эозин
Альциановый синий рН 2,5
Окраска по Граму
Окраска по Цилю Нильсену
Окраска по Павловскому
ШИК-реакция
Азур-эозин по Романовскому
Май Грюнвальд
56.
Методы окрашиванияОбщегистологические
Специальные
Гистохимические
Импрегнация
выявление общего плана
строения клеток, тканей,
органов
выявление
специализированн
ых структур в
клетках и тканях
анализ химического
состава клеток и
межклеточного
вещества
выявление
специализированных
структур в клетках и
тканях
57.
ИмпрегнацияМетод выявления тканевых структур путем пропитывания объектов гистологического исследования растворами
солей тяжелых и драгоценных металлов (например, азотнокислое серебро (серебрение), кобальт, хлористое золото
(золочение), кадмий, осмиевым ангидрид и др. ).
Участки ткани, в которых происходит осаждение солей металлов на гистологических структурах, приобретают
черный или бурый цвет в зависимости от количества и свойств восстановленного металла.
Периферический нерв (поперечный срез)
Импрегнация оксидом осмия
Мультиполярный нейрон
Импрегнация нитратом серебра
Мультиполярные нейроны
Импрегнация нитратом серебра
58.
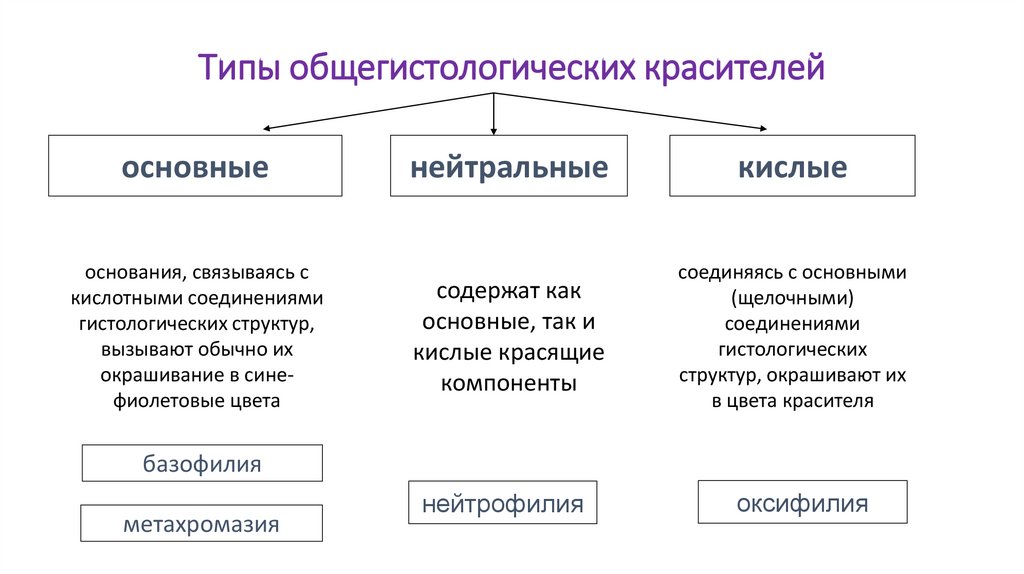
Типы общегистологических красителейосновные
основания, связываясь с
кислотными соединениями
гистологических структур,
вызывают обычно их
окрашивание в синефиолетовые цвета
нейтральные
кислые
содержат как
основные, так и
кислые красящие
компоненты
соединяясь с основными
(щелочными)
соединениями
гистологических
структур, окрашивают их
в цвета красителя
базофилия
метахромазия
нейтрофилия
оксифилия
59.
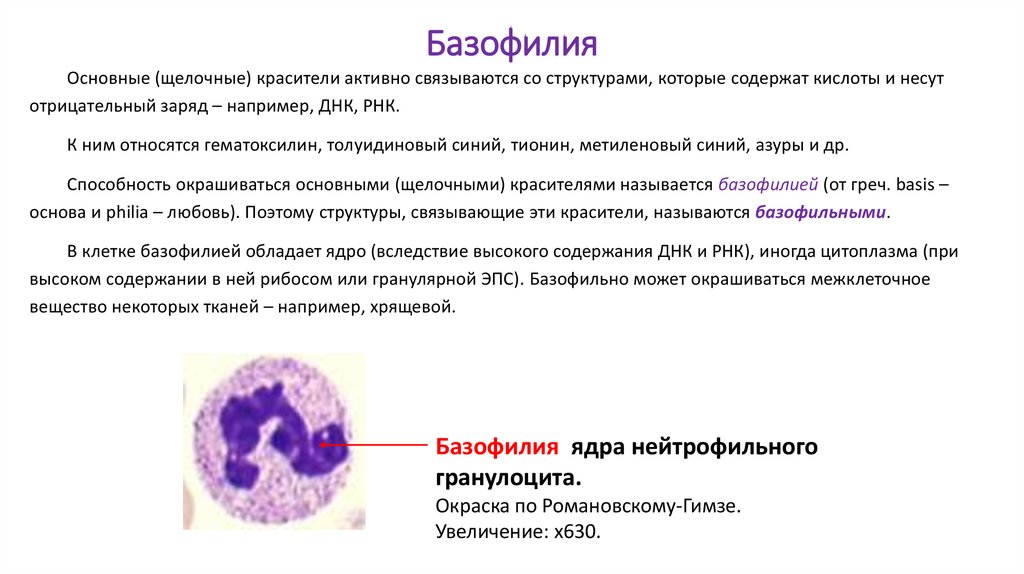
БазофилияОсновные (щелочные) красители активно связываются со структурами, которые содержат кислоты и несут
отрицательный заряд – например, ДНК, РНК.
К ним относятся гематоксилин, толуидиновый синий, тионин, метиленовый синий, азуры и др.
Способность окрашиваться основными (щелочными) красителями называется базофилией (от греч. basis –
основа и philia – любовь). Поэтому структуры, связывающие эти красители, называются базофильными.
В клетке базофилией обладает ядро (вследствие высокого содержания ДНК и РНК), иногда цитоплазма (при
высоком содержании в ней рибосом или гранулярной ЭПС). Базофильно может окрашиваться межклеточное
вещество некоторых тканей – например, хрящевой.
Базофилия ядра нейтрофильного
гранулоцита.
Окраска по Романовскому-Гимзе.
Увеличение: х630.
60.
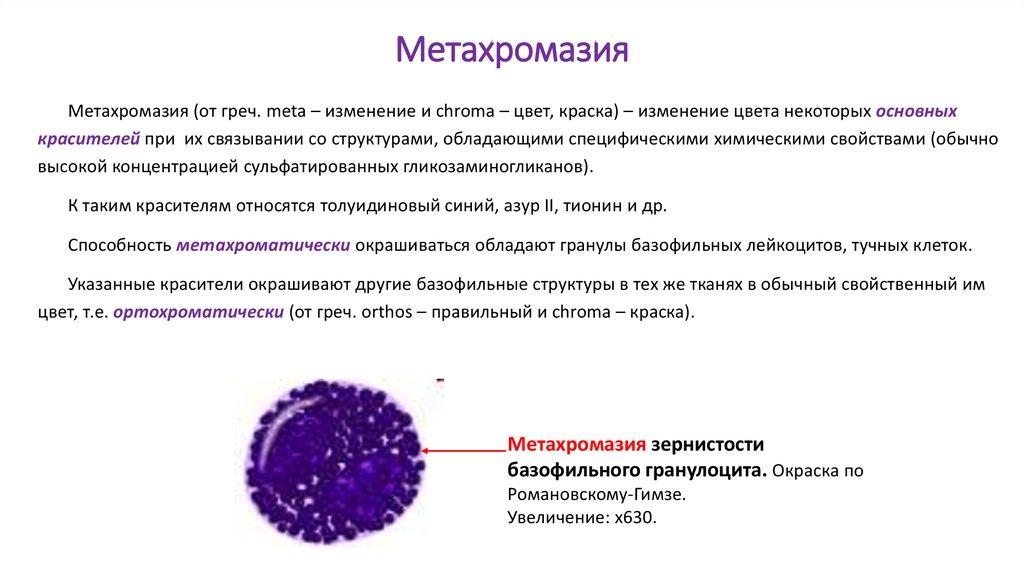
МетахромазияМетахромазия (от греч. meta – изменение и chroma – цвет, краска) – изменение цвета некоторых основных
красителей при их связывании со структурами, обладающими специфическими химическими свойствами (обычно
высокой концентрацией сульфатированных гликозаминогликанов).
К таким красителям относятся толуидиновый синий, азур II, тионин и др.
Способность метахроматически окрашиваться обладают гранулы базофильных лейкоцитов, тучных клеток.
Указанные красители окрашивают другие базофильные структуры в тех же тканях в обычный свойственный им
цвет, т.е. ортохроматически (от греч. orthos – правильный и chroma – краска).
Метахромазия зернистости
базофильного гранулоцита. Окраска по
Романовскому-Гимзе.
Увеличение: х630.
61.
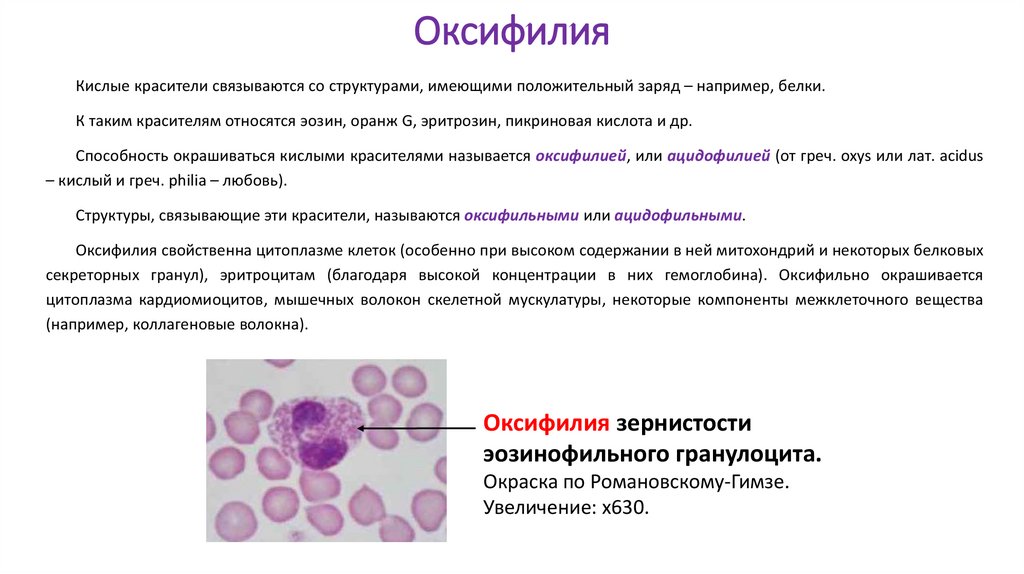
ОксифилияКислые красители связываются со структурами, имеющими положительный заряд – например, белки.
К таким красителям относятся эозин, оранж G, эритрозин, пикриновая кислота и др.
Способность окрашиваться кислыми красителями называется оксифилией, или ацидофилией (от греч. oxys или лат. acidus
– кислый и греч. philia – любовь).
Структуры, связывающие эти красители, называются оксифильными или ацидофильными.
Оксифилия свойственна цитоплазме клеток (особенно при высоком содержании в ней митохондрий и некоторых белковых
секреторных гранул), эритроцитам (благодаря высокой концентрации в них гемоглобина). Оксифильно окрашивается
цитоплазма кардиомиоцитов, мышечных волокон скелетной мускулатуры, некоторые компоненты межклеточного вещества
(например, коллагеновые волокна).
Оксифилия зернистости
эозинофильного гранулоцита.
Окраска по Романовскому-Гимзе.
Увеличение: х630.
62.
НейтрофилияНейтрофилия (от лат. neutrum – ни тот, ни другой, и philia предрасположение, любовь) – способность гистологических структур
окрашиваться и кислыми, и основными красителями.
Нейтрофилия зернистости
нейтрофильного гранулоцита.
Окраска по Романовскому-Гимзе.
Увеличение: х630.
63.
Заключение препаратовЗаключение препаратов – этап подготовки препарата к
последующему архивированию.
Препарат заключают под покровное стекло
с помощью прозрачные сред, которые
предохраняют его от воздействия
влажности, УФ лучей и других факторов,
влияющих на качество препарата в процессе
архивирования.
Заключение препарата = Сохранение препарата
64.
Среды для заключенияТрадиционные среды
Готовые среды
Канадский бальзам
Очень долго сохнет (до трех дней)
Дорогой ( 1 л стоит 120 EUR)
Био маунт
Hi Mo, Маунт квик
Tissue-Mount
Полистирол
Необходимо готовить
При архивировании белеет и трескается
ТОКСИЧЕН!
65.
Заключение препаратовВручную
66.
АвтоматическоеЗаключение под стекло
Заключение под пленку
67.
Аппарат Tissue-Tek Prismaдля заключения
Аппарат Tissue-Tek Film для окрашивания
68.
МИКРОСКОПИЯ69.
АрхивированиеАрхивирование препаратов предполагает их длительное хранение в специально отведенных
помещениях (архивах)
Препарат может быть востребован как в течение первых двух лет, так и через 15 лет после
проведения гистологического исследования.
70.
Система влажного архиваБиоматериал, который необходимо сохранить помещают в полиэтиленовый рукав,
заливают формалином, запаивают на специальном устройстве для запайки. Затем
маркируют и помещают в шкаф.
71.
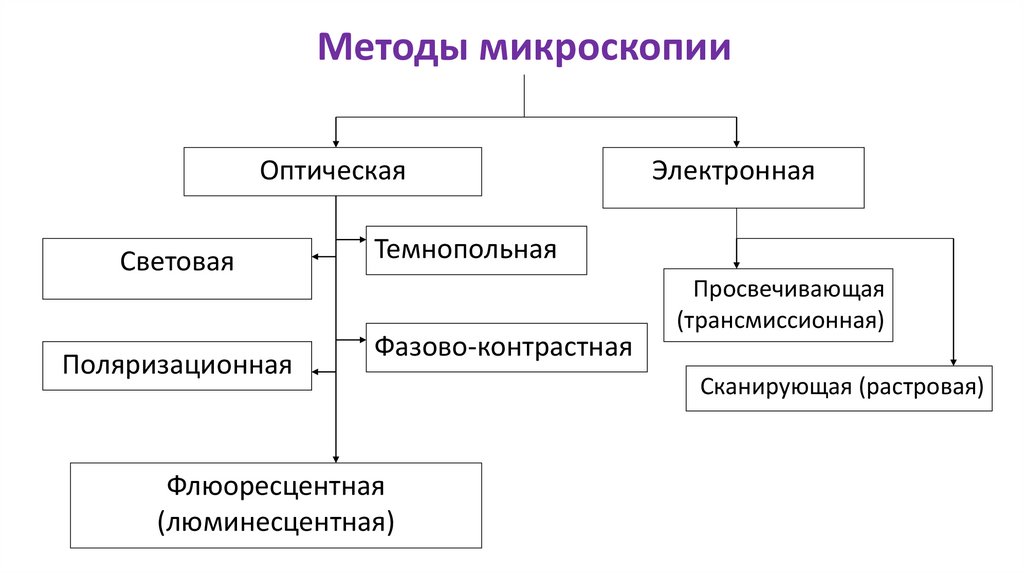
Методы микроскопииОптическая
Световая
Поляризационная
Электронная
Темнопольная
Фазово-контрастная
Флюоресцентная
(люминесцентная)
Просвечивающая
(трансмиссионная)
Сканирующая (растровая)
72.
Световая микроскопияИзучение гистологического препарата осуществляется в проходящем свете с помощью светового
микроскопа.
Источник света естественный или искусственный (различные лампы). Свет собирается в конденсор и
далее направляется через препарат в объектив. Окуляр дополнительно увеличивает это изображение.
Качество изображения (четкость) определяется разрешающей способностью микроскопа, т.е.
минимальным (разрешающим) расстоянием, на котором оптика микроскопа позволяет различить раздельно
две близко расположенные точки. Эта величина пропорциональна длине световой волны и для обычного
светового микроскопа равна приблизительно 0,2 мкм.
Чем меньше разрешающее расстояние, тем выше разрешающая способность микроскопа и тем более мелкие
объекты можно исследовать.
Увеличение микроскопа – это соотношение между истинными размерами исследуемого объекта и
размерами его изображения, получаемого с помощью микроскопа. Ориентировочно оно оценивается как
произведение увеличений объектива и окуляра и может достигать 2500 раз.
73.
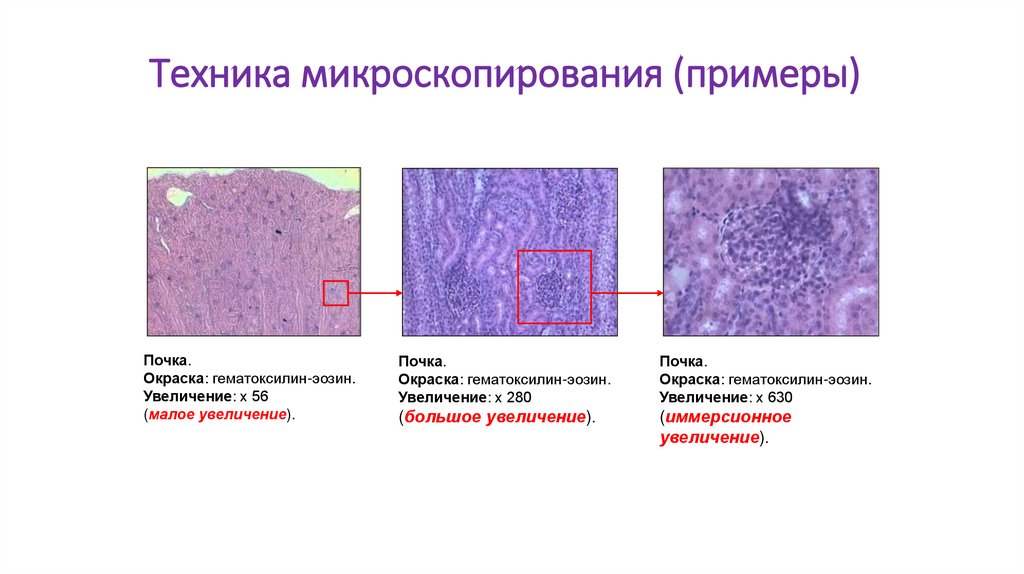
Техника микроскопирования (примеры)Почка.
Окраска: гематоксилин-эозин.
Увеличение: х 56
(малое увеличение).
Почка.
Окраска: гематоксилин-эозин.
Увеличение: х 280
(большое увеличение).
Почка.
Окраска: гематоксилин-эозин.
Увеличение: х 630
(иммерсионное
увеличение).
74.
Темнопольная микроскопияОснована на использовании специального конденсора, освещающего препарат
«косыми» лучами, не попадающими в объектив.
При наличии объекта в поле зрения свет отражается от него и направляется в
объектив.
Метод часто используется для изучения живых неокрашенных клеток.
75.
Поляризационная микроскопияПозволяет обнаружить двойное лучепреломление – анизотропию.
На объект исследования направляется поляризованный пучок света, т.е. лучи света направлены строго в одной плоскости.
Это обеспечивает особый фильтр – поляризатор. Такой свет направляется на объект исследования.
Второй фильтр – анализатор расположен между объективом и окуляром и позволяет регистрировать угол отклонения плоскости
поляризации света.
Микроскопия позволяет регистрировать пространственное расположение молекул в объективе или кристаллические структуры.
Кристаллы оксалатов.
Поляризационная
микроскопия.
Увеличение х100
76.
Фазово-контрастная микроскопияМетод служит для получения контрастных изображений прозрачных и бесцветных объектов, в частности, позволяет
изучать живые неокрашенные препараты.
Даже при очень малых различиях в показателях преломления разных элементов препарата световая волна,
проходящая через них, претерпевает разные изменения по фазе (приобретает фазовый рельеф). Эти фазовые изменения,
не воспринимаемые глазом, преобразуются с помощью специального оптического устройства (кольцевой диафрагмы в
конденсоре и фазовой пластинки в объективе) в изменения амплитуды световой волны, т. е. в изменения яркости
(«амплитудный рельеф»), которые уже различимы глазом.
Иными словами, в получаемом видимом изображении распределение яркостей (амплитуд) воспроизводит фазовый
рельеф. Получаемое таким образом изображение называется фазово-контрастным.
Pseudotrichonympha grassi.
Неокрашенный препарат.
Фазовый контраст
Семенники крысы.
Неокрашенный препарат.
Фазовый контраст
Семенники крысы.
Окраска: гематоксилин-эозин
Световая микроскопия
77.
Флюоресцентная (люминесцентная) микроскопияИспользует принцип свечения объекта исследования при освещении его ультрафиолетовыми лучами.
Источником света служат специальные лампы.
Существует аутофлюоресценция – собственная или первичная флюоресцен-ция. Например, свечение
эластических волокон в стенке артерий.
Вторичная флюоресценция возникает после обработки препаратов специальными красителями –
флюорохромами (акридин оранжевый, родамин, флюоресцин и др.).
Например: после обработки акридиновым оранжевым в клетке очень четко обнаруживается ядерная
ДНК (ярко-зеленое свечение) и РНК (ярко-красное свечение). После фиксации тканей в парах формальдегида
(метод Фалька) обнаруживается ярко-зеленое свечение серотонина, катехоламинов (адреналин,
норадреналин).
Если флюоресцентные красители связать со специфическими антителами – можно будет выявить их
антигены. Этот метод получил название иммуноцитохимического.
78.
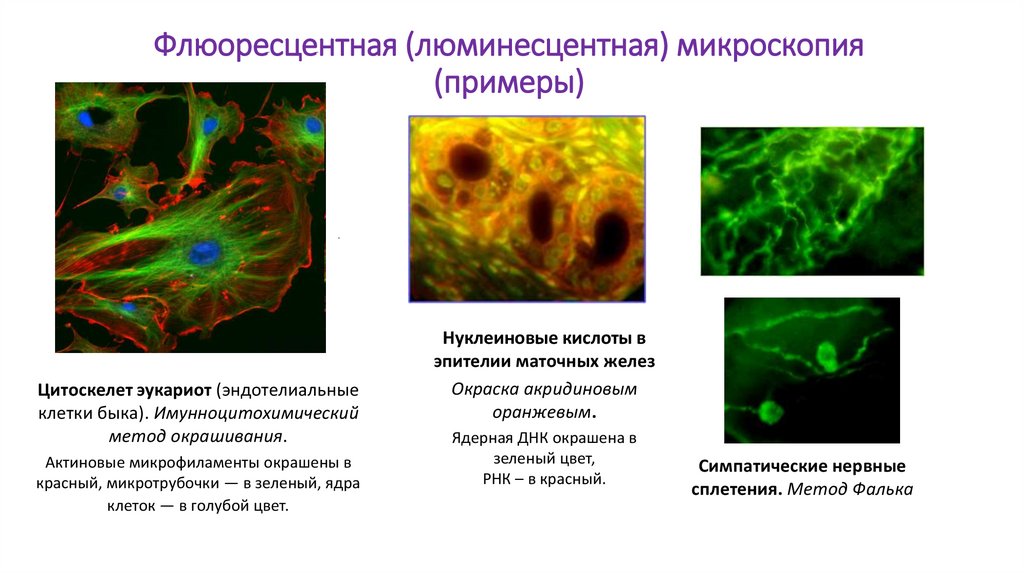
Флюоресцентная (люминесцентная) микроскопия(примеры)
.
.
.
.
Цитоскелет эукариот (эндотелиальные
клетки быка). Имунноцитохимический
метод окрашивания.
Актиновые микрофиламенты окрашены в
красный, микротрубочки — в зеленый, ядра
клеток — в голубой цвет.
Нуклеиновые кислоты в
эпителии маточных желез
Окраска акридиновым
оранжевым.
Ядерная ДНК окрашена в
зеленый цвет,
РНК – в красный.
Симпатические нервные
сплетения. Метод Фалька
79.
Электронная микроскопияЭлектронный микроскоп — прибор, позволяющий получать изображение объектов с максимальным
увеличением до 106 раз. Это стало возможно благодаря использованию вместо светового потока пучка
электронов, длина волны которого во много раз короче длины волны фотонов видимого света.
Электронный микроскоп состоит из электронной пушки (устройства для получения пучка электронов)
и системы электромагнитных линз, размещенных в колонне микроскопа в условиях вакуума.
Разрешающая способность электронного микроскопа в 1000÷10000 раз превосходит разрешение
светового микроскопа и для лучших современных приборов может составлять менее 0,1 нм (10-10м).
Существуют две основные разновидности электронной микроскопии: трансмиссионная
(просвечивающая) и сканирующая (растровая).
80.
Трансмиссионная (просвечивающая) электроннаямикроскопия
Электроны, проходя через объект, расположенный вблизи объективной линзы, взаимодействуют с его
атомами и отклоняются от первоначального направления падения пучка (рассеиваются). Далее они
попадают в систему магнитных линз, которые формируют на флуоресцентном экране (и на фотопленке)
изображение внутренней структуры объекта. При этом удается достичь разрешения порядка 0,1 нм, что
соответствует увеличениям до 1,5•106 раз.
Разрешение и информативность ТЭМ-изображений во многом определяются характеристиками объекта
и способом его подготовки. Для получения контрастного изображения применяют ультратонкие срезы (не
более 0,01 мкм), обработанные соединениями тяжелых металлов (импрегнация солями свинца, урана,
осмия и др.), избирательно взаимодействующими с компонентами микроструктуры (химическое
контрастирование). При этом чем большей рассеивающей способностью обладает участок исследуемого
объекта (участки повышенной плотности, увеличенной толщины и пр.), тем более темным будет его
изображение.
81.
Сканирующая (растровая) электроннаямикроскопия
Принцип работы сканирующего электронного микроскопа (СЭМ) заключается в сканировании поверхности образца
сфокусированным электронным пучком и анализе отраженных от нее частиц и рентгеновского излучения, возникающего
в результате взаимодействия электронов с веществом.
В СЭМ пучок электронов (электронный зонда) фокусируется электромагнитными линзами конденсора и объектива.
Специальное устройство – дефлектор отклоняет электронный пучок (первичные электроны), который скользит по
поверхности (растр). Вторичные электроны (отраженные от поверхности) воспринимаются детектором и фокусируются на
экране СЭМ, создавая ее трехмерное изображение.
Современный СЭМ позволяет работать в широком диапазоне увеличений приблизительно от х10 (что эквивалентно
увеличению сильной ручной линзы)
до х1 000 000, что приблизительно в 500 раз превышает предел увеличения лучших оптических микроскопов.
Поверхность сканирования обязательно напыляется металлом: платина, золото, палладий и др.
82.
Электронная микроскопия (примеры)трансмиссионная
сканирующая
.
.
.
Эритроциты в артериоле
.
.
Тучная клетка
.
Эритроцит, тромбоцит,
лейкоцит
83.
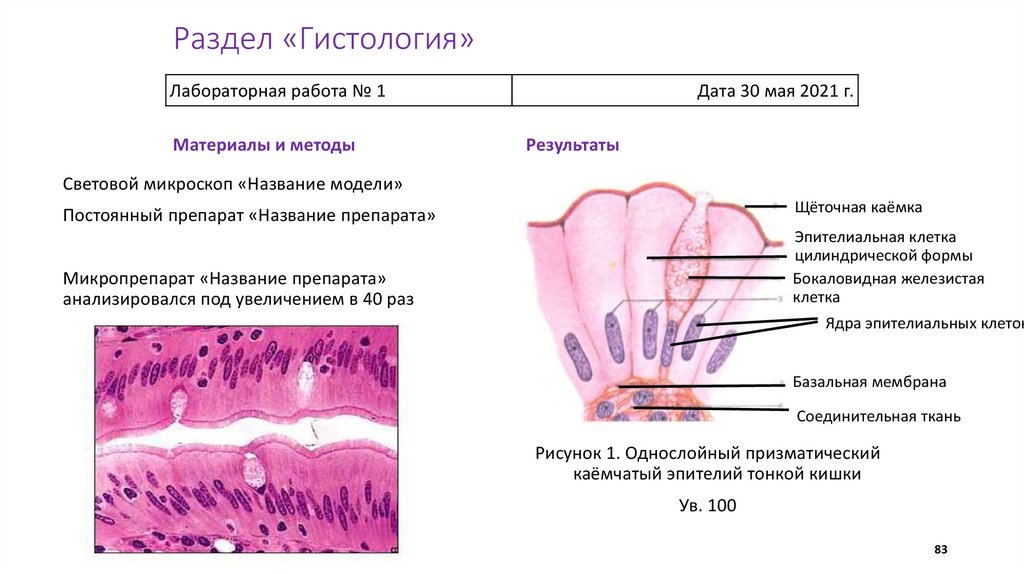
Раздел «Гистология»Лабораторная работа № 1
Материалы и методы
Дата 30 мая 2021 г.
Результаты
Световой микроскоп «Название модели»
Щёточная каёмка
Постоянный препарат «Название препарата»
Эпителиальная клетка
цилиндрической формы
Бокаловидная железистая
клетка
Микропрепарат «Название препарата»
анализировался под увеличением в 40 раз
Ядра эпителиальных клеток
Базальная мембрана
Соединительная ткань
Рисунок 1. Однослойный призматический
каёмчатый эпителий тонкой кишки
Ув. 100
83
84.
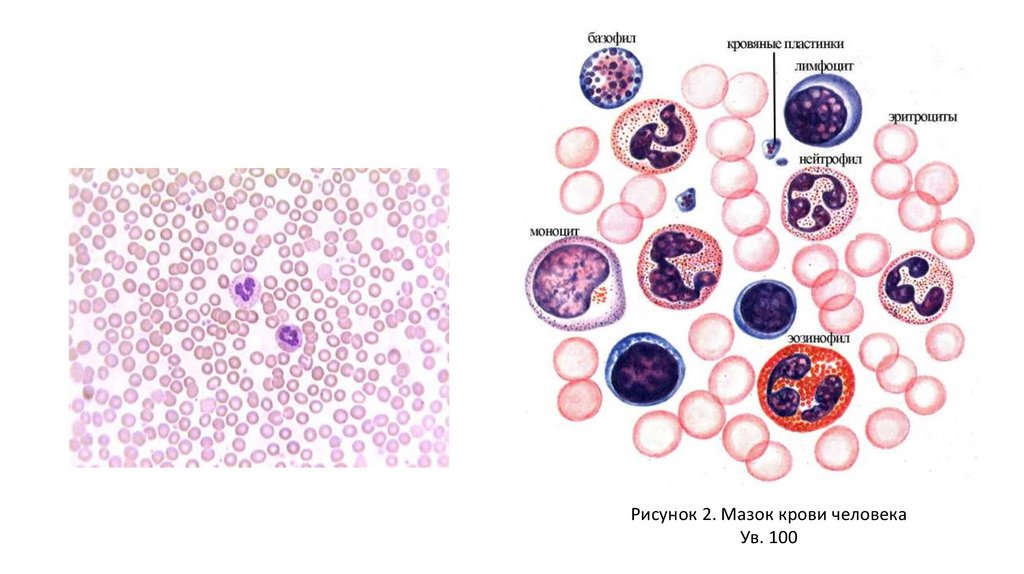
Рисунок 2. Мазок крови человекаУв. 100
85.
Рисунок 3. Просвет артерии и вены человекаУв. 100
86.
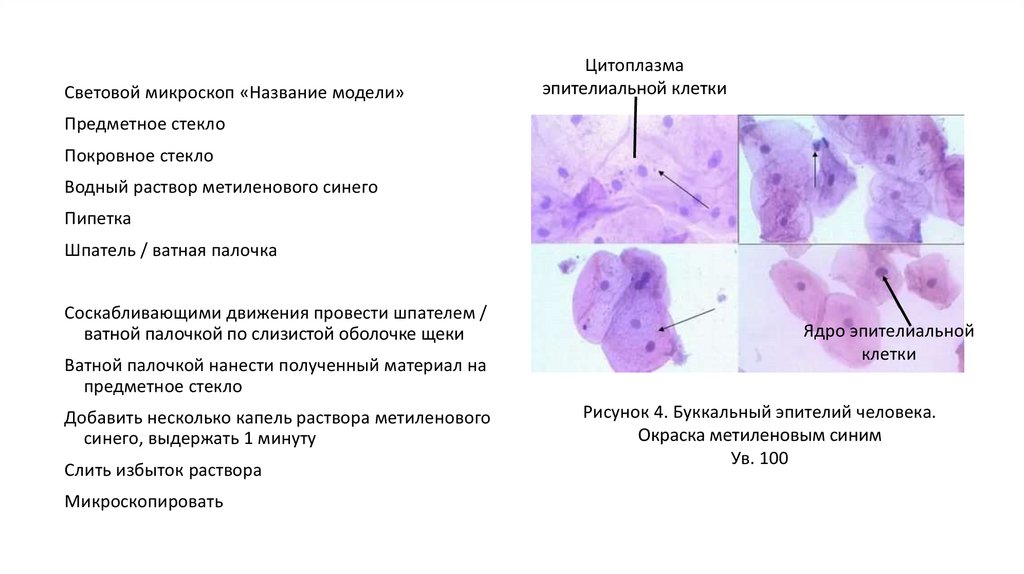
Световой микроскоп «Название модели»Цитоплазма
эпителиальной клетки
Предметное стекло
Покровное стекло
Водный раствор метиленового синего
Пипетка
Шпатель / ватная палочка
Соскабливающими движения провести шпателем /
ватной палочкой по слизистой оболочке щеки
Ватной палочкой нанести полученный материал на
предметное стекло
Добавить несколько капель раствора метиленового
синего, выдержать 1 минуту
Слить избыток раствора
Микроскопировать
Ядро эпителиальной
клетки
Рисунок 4. Буккальный эпителий человека.
Окраска метиленовым синим
Ув. 100
87.
Раздел «Гистология»Лабораторная работа № 2
Дата 31 мая 2021 г.
• Материалы и методы
• Результаты
Серое вещество
Световой микроскоп
Задние рога
Постоянный препарат «Поперечный срез
спинного мозга»
Спинномозговой
канал
Микропрепарат «Поперечный срез спинного
мозга» анализировался под увеличением в 40 раз
Передние рога
Рисунок 1. Поперечный срез спинного мозга
Ув. 40
Белое вещество
88.
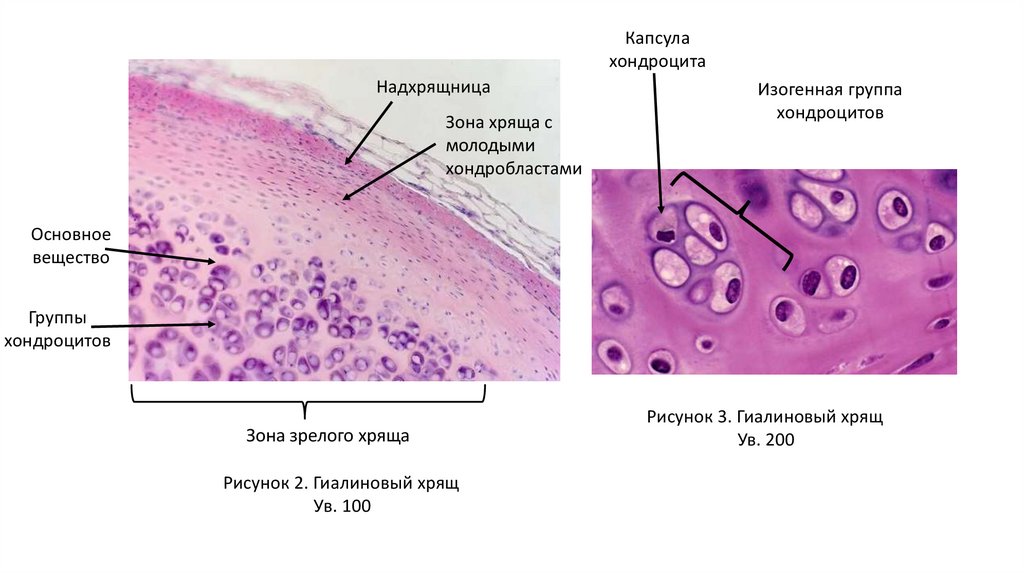
Капсулахондроцита
Надхрящница
Зона хряща с
молодыми
хондробластами
Изогенная группа
хондроцитов
Основное
вещество
Группы
хондроцитов
Зона зрелого хряща
Рисунок 2. Гиалиновый хрящ
Ув. 100
Рисунок 3. Гиалиновый хрящ
Ув. 200
89.
ОстеонГаверсов канал с
кровеносным
сосудом
Рисунок 4. Костная ткань. Поперечный срез
Ув. 100
Отростчатый Костная пластинка
остеоцит
Рисунок 5. Костная ткань. Поперечный срез
Ув. 200
90.
МиоцитЯдро миоцита
Рисунок 6. Гладкая мышечная ткань. Продольный срез
Ув. 100
91.
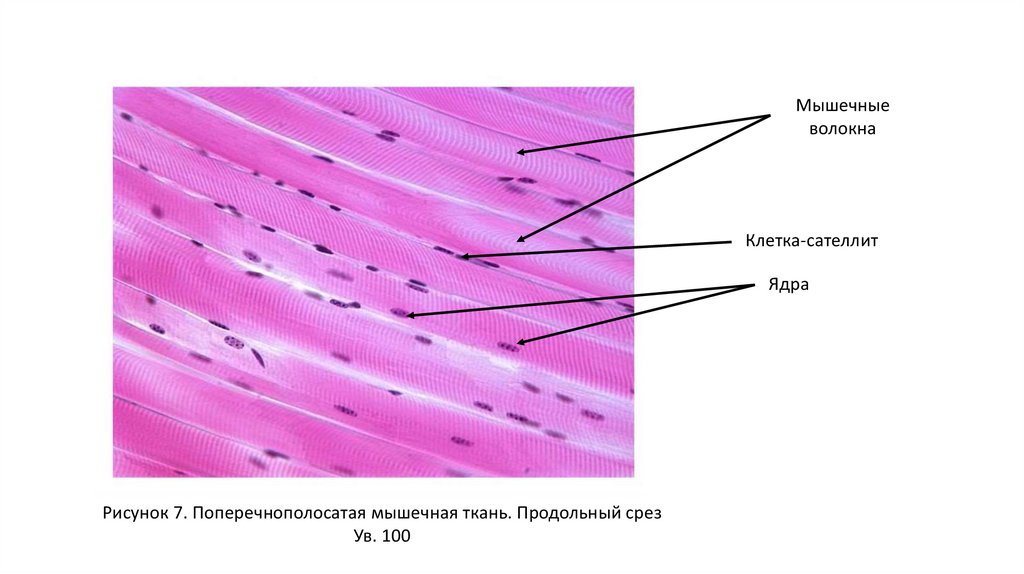
Мышечныеволокна
Клетка-сателлит
Ядра
Рисунок 7. Поперечнополосатая мышечная ткань. Продольный срез
Ув. 100







































































 Медицина
Медицина Биология
Биология