Похожие презентации:
Физико-химические методы анализа. Лекция №1
1.
Российский химико-технологический университет им. Д. И. МенделееваКафедра аналитической химии
Курс «Физико-химические методы анализа»
Лекция № 1:
Физико-химические методы
анализа
профессор Жуков А. Ф.
2.
КЛАССИФИКАЦИЯ МЕТОДОВ АНАЛИЗАВ основе всех методов анализа лежит измерение либо
химического,
либо
физического
свойства
вещества,
называемого аналитическим сигналом, зависящего от природы
вещества и его содержания в пробе.
Все методы анализа принято разделять на:
химические;
физические;
физико-химические.
3.
В химических методах анализа для полученияаналитического сигнала используется химическая
реакция. В качестве аналитического сигнала в
химических методах выступает либо масса вещества
(гравиметрический метод анализа), либо объем
реактива – титранта (титриметрические методы).
4.
Физико-химические методы анализаоснованы на регистрации аналитического
сигнала какого-либо физического свойства
(потенциала, тока, количества электричества,
интенсивности излучения света или его
поглощения и т. д.) при проведении
химической реакции.
5.
Физическиеметоды
–
методы,
при
реализации
которых
регистрируется
аналитический сигнал каких-либо физических
свойств (ядерные, спектральные, оптические) без
проведения химической реакции.
В последнее время в отдельную группу
методов анализа выделяют так называемые
биологические методы, в которых для
получения аналитического сигнала используются
реакции, протекающие в живых организмах или с
участием выделенных из них биологических
субстратов (ферментов, антител и др.).
6.
Физико-химические методы анализа:электрохимические;
спектральные;
термические;
хроматографические.
7.
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗАСогласно
рекомендациям
ИЮПАК
электрохимические
методы
анализа
можно
классифицировать следующим образом:
1)
методы без протекания электродной реакции, в
которых строение двойного электрического
слоя
в
расчет
не
принимается
(кондуктометрия);
2)
методы, основанные на электродных реакциях
в отсутствие тока (потенциометрия) или под
током (вольтамперометрия, кулонометрия,
электрогравиметрия).
8.
В состав электролитической ячейки входятдва или три электрода,
один из которых — индикаторный или
рабочий,
второй— электрод сравнения
и третий — вспомогательный.
9.
Электрод,действующий как датчик, реагируя на
фактор возбуждения и на состав раствора (не
оказывая влияния на состав раствора за время
измерения), является индикаторным.
Если под действием тока, протекающего через
ячейку, происходит значительное изменение
состава раствора, то электрод — рабочий.
Электрод
сравнения служит для создания
измерительной цепи и поддержания постоянного
значения потенциала индикаторного (рабочего)
электрода.
10.
ПОТЕНЦИОМЕТРИЯПотенциометрический метод используют
для определения содержания веществ в растворе
и измерения различных физико-химических
величин.
Потенциометрический метод основан на
измерении
электродвижущих
сил
(э.д.с.)
обратимых гальванических элементов,
11.
ПОТЕНЦИОМЕТРИЯВ
потенциометрии обычно применяют
гальванический элемент, включающий два
электрода, которые могут быть погружены в
один и тот же раствор (элемент без переноса)
или в два различных по составу раствора,
имеющих между собой жидкостной контакт
(цепь с переносом).
12.
Достоинства метода:1.
быстрота;
2.
возможность измерения в мутных,
окрашенных растворах, вязких пастах;
3.
возможность измерения в микрообъемах
(измерения в биологических клетках);
4.
автоматизация;
5.
несложное, недорогое оборудование;
6.
неразрушающий метод анализа.
13.
1.2.
3.
4.
5.
6.
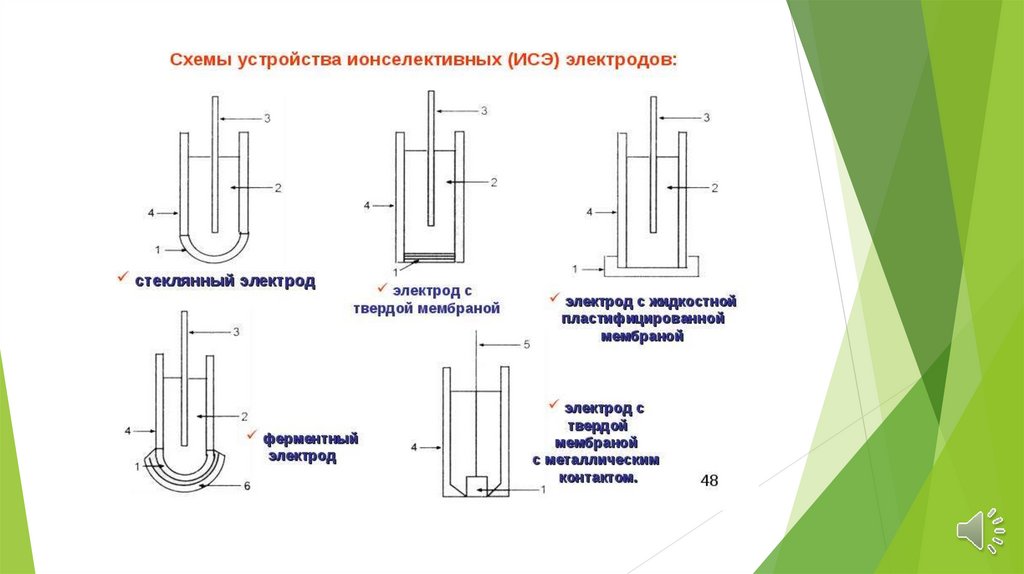
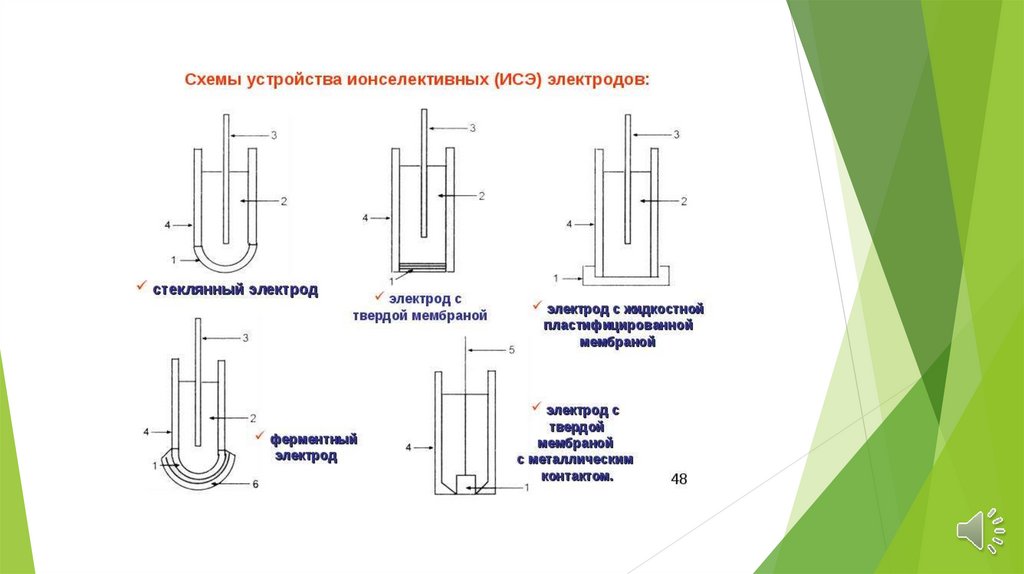
Ионселективные электроды делятся на группы:
Стеклянные электроды;
Электронообменные электроды;
Твердые электроды с гомогенной или гетерогенной мембраной;
Жидкостные электроды (на основе жидких
катионитов, ионных ассоциатов и нейтральных
лигандов);
Газовые электроды;
Электроды
для
измерения
активности
(концентрации)
биологических
веществ
(энзимные).
14.
Уравнение Нернста:Е = const + RT/zF lg aион,
где z — заряд потенциалопределяющего иона или число
электронов, участвующих в реакции; а — активность
потенциалопределяющих ионов (для электронообменных электродов
отношение активностей окисленной и восстановленной форм).Rгазовая постоянная, Т – температура, F –число Фарадея
Е = const + (0,059/z)lga,
Уравнение Никольского:
где ах — активность определяемого иона; ау — активность мешающего иона; zх заряд определяемого иона; zу — заряд мешающего иона; Кx,y — коэффициент
селективности электрода по отношению к определяемому иону X на фоне
мешающего иона Y.
15.
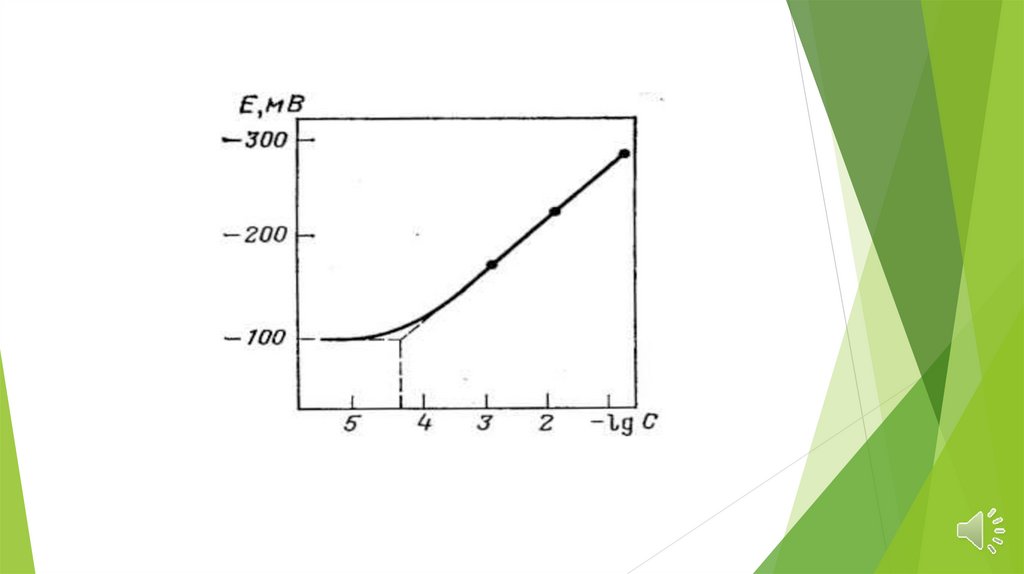
Основные характеристики электродовПредел
обнаружения
—
минимальное
количество вещества, определяемое с заданной
достоверностью
с
помощью
данного
ионоселективного электрода.
Для
ионоселективных электродов предел
обнаружения
зависит
прежде
всего
от
растворимости
материала
мембраны
в
анализируемом растворе и обычно составляет
10-5 - 10-7 моль/л.
16.
17.
Коэффициент селективности позволяетколичественно оценить влияние мешающих ионов Y
на результаты измерения концентрации
определяемых ионов Х с помощью
ионоселективного электрода. Численное значение
его рассчитывается по уравнению Никольского.
Коэффициент селективности электродов в общем
случае определяется константой скорости
гетерогенной реакции обмена определяемого и
мешающего иона и подвижностью этих ионов в фазе
мембраны.
18.
КX.Y-коэффициент селективности электрода по
отношению к иону X на фоне мешающего иона Y
КX.Y =
10-3 – 1000 кратный избыток ионов Y не
влияет на работу данного электрода (электрод
селективен к ионам X)
19.
Времяотклика — время отклика τ90
определяется как время, в течение которого
потенциал ионоселективного электрода
изменяется от величины Е1 до величины Ех +
0,9(Е2 - Е1), т. е. достигает 90% величины
общего изменения (от Е1 до Е2, где Е1 и Е2 —
значения потенциала электрода,
устанавливаемые при перемещении его из
одного раствора в другой, отличающийся по
концентрации определяемого иона).
20.
Обычнодля относительно концентрированных
растворов (10-4-10-2 М) время отклика не
превышает 10-15 с, но для очень разбавленных
растворов (10-6 М) может достигать нескольких
минут.
Время
отклика зависит от типа электрода.
21.
Интервал определения содержания компонентовпотенциометрическим методом в различных
природных и промышленных объектах находится
в пределах от 0 до 14 pH для стеклянных
электродов, и от 100 до 10-5 (10-7) М
определяемого иона для других типов
ионселективных электродов.
22.
Иономер И-510 предназначен для определения в водных растворахактивности ионов водорода (рН), окислительно-восстановительного
потенциала, концентрации (активности) различных ионов,
а также для потенциометрического титрования.
23.
АТП-02 – автоматический высокоточный потенциометрическийтитратор.
Прибор позволяет проводить титрование,
используя следующие методы:
общий метод потенциометрического
титрования;
кислотно-основное титрование;
титрование по методу осаждения;
титрование по методу
комплексообразования.
24.
Стеклянный электродРабота стеклянного электрода основана на том,
что между тонкой стеклянной стенкой и водным
раствором возникает разность потенциалов,
величина которой зависит от концентрации ионов
водорода раствора.
25.
Стеклянный электродСтеклянный электрод представляет собой тонкостенную
мембрану из специального легкоплавкого стекла
[22% Na2O, 6% CaO и 72% SiO2 ], припаянную к
стеклянной трубке.
Внутрь трубки наливают раствор с известной
концентрацией ионов водорода и погружают ее в
испытуемый раствор.
Во внутренний и внешний растворы вводят два
сравнительных электрода и измеряют разность
потенциалов между ними.
Величина этой разности определяется концентрацией
ионов водорода раствора.
26.
Принцип действия стеклянного электрода основанна процессе ионного обмена.
При погружении стеклянного электрода в раствор
щелочные ионы из стекла (Na+ или Li+) переходят в
раствор, а их места занимают более подвижные ионы
водорода из раствора.
В результате этого процесса, поверхностный слой
стекла оказывается насыщенным ионами водорода и
стеклянный
электрод
приобретает
свойства
водородного электрода.
27.
28.
В последнее время большое распространение получили такназываемые комбинированные стеклянные электроды
Работает в диапазоне рН от 0 до 14
Нельзя применять во фторсодержащих растворах!!!
29.
Электронообменные электродыВ окислительно-восстановительных
электродах в качестве индикаторных электродов часто применяют инертные металлы,
например, платину, золото.
Потенциал, возникающий на платиновом
электроде, зависит от отношения
концентраций окисленной и восстановленной
форм одного или нескольких веществ в
растворе.
30.
Металлическиеиндикаторные электроды
изготавливают из плоской металлической
пластинки, скрученной проволоки или
металлизированного стекла.
Обычно при погружении в раствор такого
электрода быстро устанавливается
равновесие. Очень важно перед работой
тщательно очистить поверхность металла.
31.
Твердые электроды32.
Фторидселективный электродЧувствительный элемент: LaF3
Наиболее
совершенным
и
высокоселективным
электродом для определения F- ионов является
монокристаллический
лантанфторидный
электрод.
Потенциал LaF3-электрода подчиняется уравнению
Нернста в интервале концентраций 100-10-6 М.
Селективность LaF3-электрода в присутствии многих
других анионов может быть охарактеризована
возможностью определения активности ионов F- при
более чем 1000-кратных избытках галоген-ионов, NO3-,
PO43-, HCO3- и других анионов.
33.
34.
. Применяют лантанфторидный электрод дляопределения ионов F- в различных жидких
средах и твердых веществах, для анализа
биологических материалов, сточных вод,
минеральных удобрений, фармацевтических
средств.
35.
Сульфидсеребряные электродыСульфидсеребряные электроды - этот вид
электродов является универсальным, с одной
стороны Ag2S является основой одного из
первых
гомогенных
кристаллических
электродов с высокой избирательностью по
отношению к ионам Ag+ и S2-, с другой
стороны - Ag2S оказался превосходной
инертной матрицей для кристаллических
галогенидов серебра и многих сульфидов
двузарядных металлов. Ag2S-электрод в
растворах AgNO3 обладает полной Ag+функцией в интервале концентраций 100-10-7М
Ag+.
36.
Нижний концентрационный предел обусловленнестабильностью растворов при концентрации ниже
10-7 М Ag+. Однако, можно измерить очень низкие
концентрации свободных ионов Ag+ в присутствии
комплексообразователей, которые создают буфер
раствора относительно измеряемого иона.
S2--функция экспериментально выполняется в
интервале от 10-2 до 10-7 М в сильнощелочных
сульфидных растворах. На потенциал
рассматриваемого электрода влияют Hg2+ и CNионы. Влияние ионов CN- обусловлено реакцией:
6CN- + Ag2S = S2- + 2Ag(CN)32-
37.
В обычной конструкции ионселективного электрода ствердой
мембранной
внутренняя
поверхность
мембраны контактирует со стандартным раствором
электролита, в который погружен вспомогательный
электрод, создающий обратимый переход от ионной
проводимости
в
электролите
к
электронной
проводимости в металлическом проводнике. Однако
удобнее внутренний контакт создавать с помощью
твердых веществ (графит, металлы) - такие электроды
называются твердофазными.
38.
Галогенид-селективные электродыГалогенид-селективные электроды
- для
определения концентрации галогенид-ионов на
основе солей серебра (гомогенные электроды с
твердыми мембранами или монокристаллами,
принципиально
не
отличаются
от
так
называемых гетерогенных, мембраны которых
содержат такие же труднорастворимые соли,
внедренные в пластическую матрицу).
39.
Галогенид-селективные электродыВ
данных электрода используют смеси
твердых электролитов AgХ (Х = Cl-, Br-, I-) с
Ag2S. Проводимость в AgХ-мембранах
осуществляется ионами Ag+ по дырочному
механизму Френкеля. Мембранная фаза имеет
постоянный состав, и диффузионный
потенциал внутри мембраны равен нулю.
Потенциал галогенид-селективных
электродов подчиняется уравнению Нернста.
40.
С AgCl- Ag2S электродом можно определять ионы Cl- винтервале концентраций 10-5-10-1 М. Для AgI- Ag2S
электродов нернстовская зависимость потенциала
наблюдается до 10-6 М I-. На работу галогенидселективных электродов оказывают влияние ионы
тиосульфата и цианида Кроме галогенсеребряных
электродов используют и ионселективные CN- и SCN- электроды. AgCl-электрод используют для
определения Cl- ионов в молоке, минеральных
фосфатах, фармацевтическом производстве, при
анализе гидроокиси калия, равновесных смесей.
41.
Электроды на основе сульфидов некоторыхдвузарядных металлов
Электроды на основе сульфидов (халькогенидов)
некоторых двузарядных ионов металлов мембраны для этого вида электродов получают из
смесей
сульфида
серебра
и
сульфида
(халькогенида)
соответствующего
металла.
Наибольшее значение для практики имеют:
медный, свинцовый и кадмиевый электроды.
42.
Медь-селективныйэлектрод - Электрод
создан на основе сульфидов меди и серебра.
Ионы Cl- (и Br-) влияют на потенциал
электрода из-за реакции, которая может
протекать
на
поверхности
мембраны:
Ag2S + Cu2+ + 2Cl- = 2AgCl + CuS
43.
Обратимый кионам Cu2+ электрод может
быть изготовлен также из низшего окисла
меди Cu2-хS. Твердые Cu2+-электроды
применимы для изучения систем,
содержащих окислители и восстановители.
Медь-селективный электрод работает в
интервале концентраций - от насыщенных до
10-7 М. Интервал рН в котором могут
функционировать электроды лежит в области
2-8 и зависит от концентрации Cu2+ ионов.
44.
Свинец-селективныйэлектрод
поликристаллическая
мембрана
свинцового
электрода получена из смеси PbS и Ag2S .
Концентрационный интервал характерный для
данного электрода - 100-10-7 М.. Халькогенидные
электроды используют при потенциометрическом
титровании
свинца
ионами,
Pb2+-электрод
используют для определения SO42- ионов. Кроме
потенциометрического титрования сульфатов Pb2+электрод можно применять для определения ионов
C2O42-, CrO42-, Fe(CN)64-, WO42-. Pb2+-электрод
используют при определения свинца в морской воде,
а так же в медицине.
45.
Кадмий-селективный электрод- электрод с
твердой мембраной, селективный по
отношению к ионам Cd2+, получают
прессованием смеси CdS и Ag2S. Диапазон
определения ионов Cd2+ - 100-10-5 М Cd2+.
Cd2+-электроды используют при
потенциометрическом титровании и для
определения сульфидов в жидкостях
бумажного производства.
46.
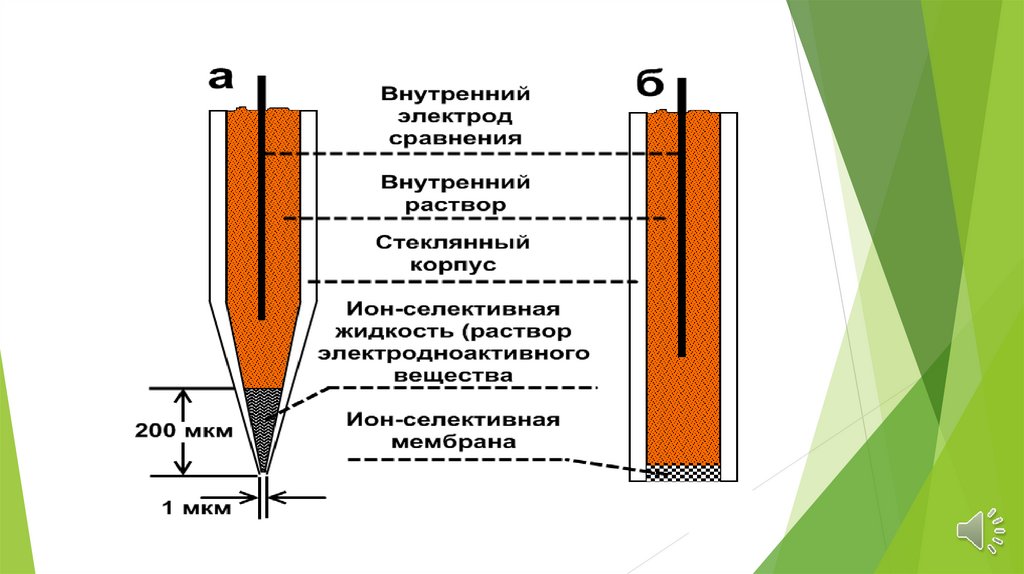
Электроды с жидкими мембранамиЖидкая мембрана - это слой растворителя,
который не должен растворяться в исследуемом
растворе. Устойчивость мембраны повышается,
если к тому же органическая жидкость обладает
высокой вязкостью. Низкая диэлектрическая
проницаемость жидкого органического вещества
способствует ассоциации ионов в фазе мембраны.
47.
Высокаяселективность к определяемому
иону требует большой стабильности ионного
комплекса, на которую влияет растворитель...
Жидкие мембраны разделяют две водные
фазы. На границе между мембраной и
раствором происходит обмен между
свободными ионами в растворе и ионами,
связанными органическими группами в фазе
мембраны
48.
49.
Селективностьжидких мембран будет
определяться ограничением внедрения
посторонних ионов в поверхность мембраны.
Так как жидкая фаза находится в контакте с
водными растворами, она должна быть
нерастворимой в воде и иметь низкое
давление паров, чтобы избежать
интенсивного ее испарения. Этим
требованиям могут отвечать жидкие
органические вещества обладающие
сравнительно большим молекулярным весом
и низкими диэлектрическими
50.
Электроды на основе жидких катионитовЭлектродно-активными веществами,
определяющими катионную функцию
мембранных жидкостных электродов,
являются органические высокомолекулярные
кислоты и их соли с карбоксильной, сульфо-,
фосфорно- и тиофосфорнокислыми группами.
Низкая катионная селективность электродов
присуща мембранам содержащим
органические сульфокислоты.
51.
Гораздобольшую селективность проявляют
жидкие катионообменные мембраны,
полученные на основе солей фосфорных и
тиофосфорных органических кислот в
органических растворителях. Жидкостные
электроды на основе дитизонатов проявляют
нернстовскую зависимость потенциалов и
высокую селективность по отношению к
ионам Cu2+, Pb2+, Zn2+, Hg2+, Ag+.
52.
Кальций-селективный электрод -наиболее
широко исследованы Са2+-электроды на
основе кальциевых солей диэфиров
фосфорной кислоты, в качестве
растворителей используют
диоктилфенилфосфонат. Этот электрод
функционирует в концентрационном
интервале 10-1-10-5 М Са2+, при рН=6-11. Са2+электрод действует в присутствии ПАВ,
анионов гуминовой кислоты, салицилата,
фталата, фенола, мочевины.
53.
Область применения Са2+-электродов - определение коэффициентовактивности ионов Са2+; определение жесткости воды; определение
растворимости СаSO4 и СаСО3; исследование ассоциации СаSO4 и
MgSO4 в морской воде.
Электрод, селективный по отношению к сумме катионов кальция
и магния - в качестве жидкостных ионообменников применяют
фосфорорганические кислоты, в качестве растворителя - дециловый
спирт. Эти электроды способны обнаруживать нернстовскую
зависимость потенциала от суммарной концентрации ионов Са2+ и
Mg2+ в интервале 10-1-10-4 М. Данный электрод используют для
определения жесткости воды.
Жидкие иониты с активными группами, содержащими серу, должны
были бы обладать высокой селективностью относительно ионов
тяжелых металлов, которые образуют труднорастворимые сульфиды.
54.
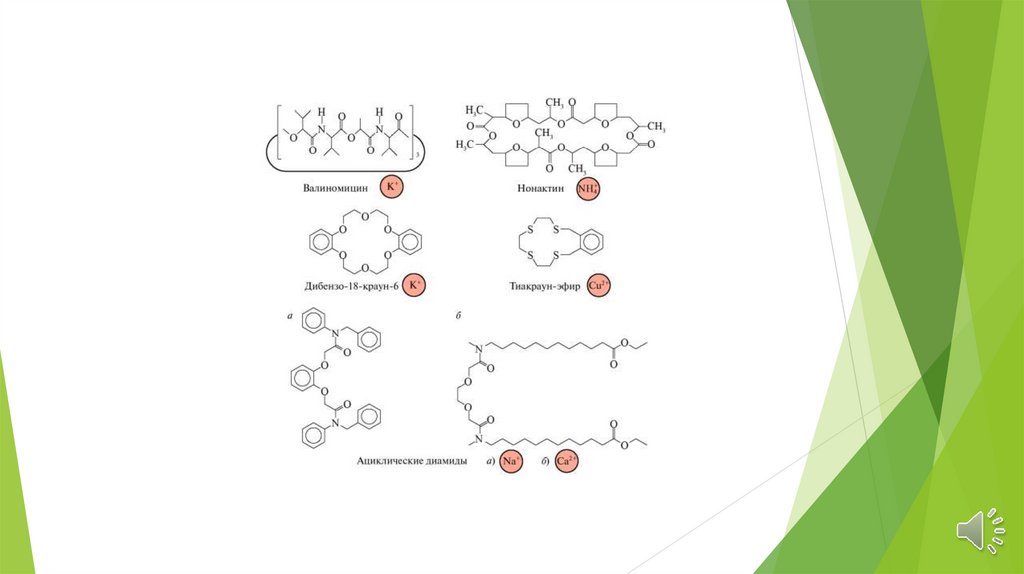
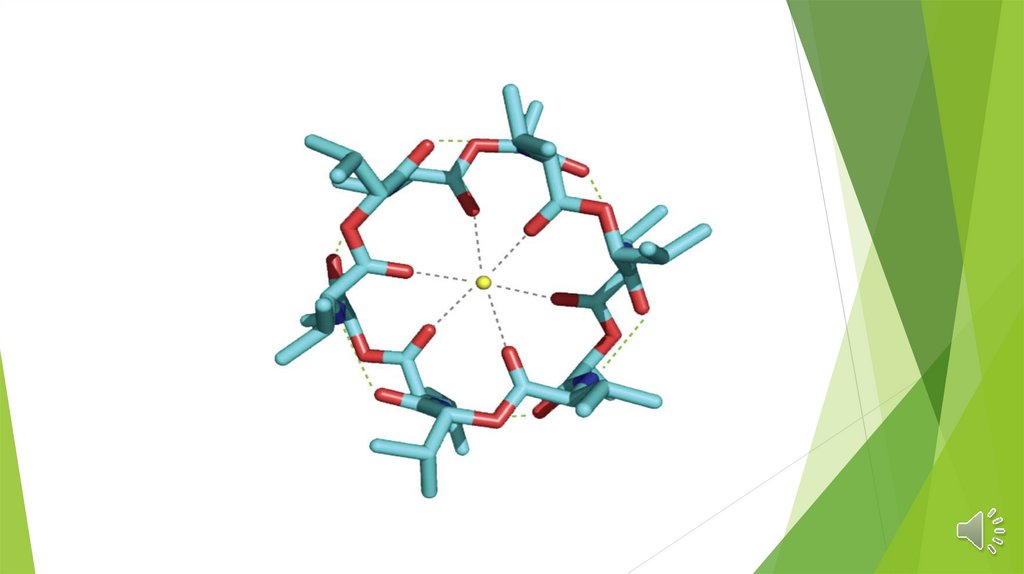
Электроды на основе нейтральных лигандовИспользуются нейтральные макроциклические соединения.
Избирательность определяется устойчивостью комплексов в
водных растворах.
Имеют высокую селективность, порядка 10 -5
В настоящее время синтезированы электроды, селективные к
ионам щелочных и щелочноземельных элементов, кадмия,
уранила, свинца и ряда других ионов.
55.
56.
57.
Электроды на основе жидких анионитовЕсли
использовать
активные
группы
с
положительным зарядом, то можно получить
селективные электроды с анионной функцией. В
отличие от катионселективных электродов, почти
все анионоселективные электроды получены на
основе солей аминов и четвертичных аммониевых
оснований, являющихся типичными жидкими
анионообменниками. Эти электроды могут быть
использованы для следующих анионов: ClO4-, SCN, I-, NO3-, Br-, Cl-.
58.
Внастоящее время в основном используются
так называемые пластифицированные
электроды, в которых электродноактивное
вещество распределено в
поливинилхлоридной матрице с
соответствующим пластификатором.
59.
Перхлорат-селективныйэлектрод
электрод
функционирует как обратимый по отношению к ClO4- иону в
интервале
концентраций
10-1-10-5
при
рН=4-11.
Концентрацию ClO4- ионов нельзя обнаружить в присутствии
следующих ионов: MnO4-, IO4-, ReO4-, SCN-.
Тетрафторборат-селективный электрод - некоторые
электроды, содержащие фенантролиновую хелатную группу,
можно использовать для определения BF4- в растворах. В
области концентраций 10-1-10-5 М потенциал электрода
отвечает на изменение концентрации BF4-. Электроды с
мембранами, содержащими о-фенантролиновую группу,
применяют для потенциометрического определения бора,
предварительно переведенного в тетрафторборат.
60.
Нитрат-селективный электродДля ионометрического определения нитрат-иона как
сильногидрофобного аниона мембрана должна содержать
сильногидрофобный катион. В первом нитратном электроде в
качестве
такого
катиона
использовался
металлфенантролиновый комплексный катион V (мембранный
растворитель нитро-n-цимол). Этот электрод можно
применять для определения нитрат-ионов в интервале рН 4-7.
В других нитратных электродах ионообменниками служат
соли тетраалкиламмония.
Нитратные электроды находят
применение главным образом для контроля объектов
окружающей среды. Определения нитратов в растворе мешает
присутствие больших количеств хлоридов, удалить которые
можно,
пропуская
анализируемый
раствор
через
ионообменную смолу.
61.
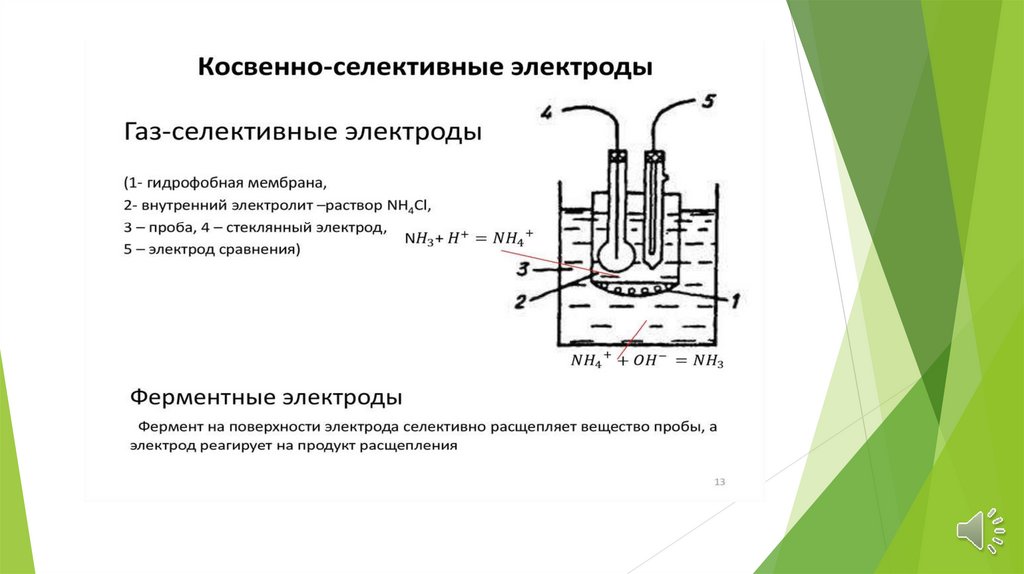
Газовые электродыГазовый
электрод
включает
ионоселективный
электрод
и
электрод
сравнения, контактирующие с небольшим
объемом вспомогательного раствора, который
отделен от исследуемого раствора газовой
прослойкой
или
гидрофобной
газопроницаемой мембраной. Существует два
вида газовых электродов.
62.
Первый - ионоселективный и сравнительныйэлектрод погружены в небольшой объем раствора
определенного состава, отделенного от
исследуемого раствора гидрофобной
газопроницаемой мембраной. Для этого вида
электродов используют два вида мембран гомогенные, представляющие собой пленку
полимера, в которой растворяется диффузионный
газ, и гетерогенные, микропористые, в которых газ
диффундирует фактически через воздух,
заполняющий поры. В качестве мембран используют
- силиконовый каучук, тефлон, полипропилен.
Микропористые мембраны обладают лучшими
диффузионными характеристиками по сравнению с
гомогенными.
63.
. Второйтип - в нем газопроницаемая мембрана
заменена газовой прослойкой. В этом электроде для
удержания электролита на поверхности
индикаторного электрода и создания стандартной по
толщине пленки в электролит вводят ПАВ или весь
раствор впитывается слоем геля. Одним из наиболее
распространенных электродов является электрод с
чувствительным элементом на аммиак. Эта
электродная система включает катионоселективный
электрод и гидрофобную мембрану, проницаемую
для аммиака, но не проницаемую для таких ионов,
как Na+, K+, NH4+.
64.
Мембранаотделяет исследуемый щелочной
раствор от внутреннего раствора 0,1М NH4Cl,
в который погружен стеклянный рН-электрод
и хлорсеребряный электрод сравнения.
Диффузия аммиака через мембрану вызывает
изменение рН раствора, находящегося между
мембраной и стеклянным электродом,
который регистрирует это изменение рН.
Электроды для определения кислорода и
углекислого газа используют
преимущественно в медицине.
65.
66.
Энзимные электродыЭнзимные электроды подобны мембранным электродным
системам, чувствительным к газам. Существенное различие
заключается в иммобилизации энзимов на индикаторной
поверхности электрода.
Энзимный электрод для оценки концентрации
мочевины - энзимный электрод для определения мочевины в
растворах или биологических жидкостях может быть
сконструирован на основе NH4+-селективного стеклянного
электрода., внешняя поверхность мембраны которого
обрабатывается соответствующим образом для удержания
фермента. Один из типов энзимного электрода сконструирован
с применением слоя акриламидного геля, в котором
фиксировалась уреаза, на поверхности стеклянной мембраны.
67.
68.
Когда такой электрод помещают в раствор, содержащий мочевину,субстрат диффундирует в гелевый слой иммобилизованного энзима
и подвергается гидролизу в соответствии с уравнением:
CO(NH2)2 + H3O+ + H2O (уреаза) 2NH4+ + HCO3 Образующийся NH4+ регистрируется NH4+ -селективным
стеклянным электродом. Уреазный электрод (содержащий фермент уреаза) обладает хорошей стабильностью, но на его работу влияют
ионы Na+, K+. С помощью газового NH3-чувствительного электрода
определяли аммиак, получающийся при гидролизе мочевины в
присутствии уреазы. Подобный же электрод применяли при
измерении количества мочевины в сточных водах, а также в водных
растворах и сыворотке крови автоматизированным методом в
потоке.
69.
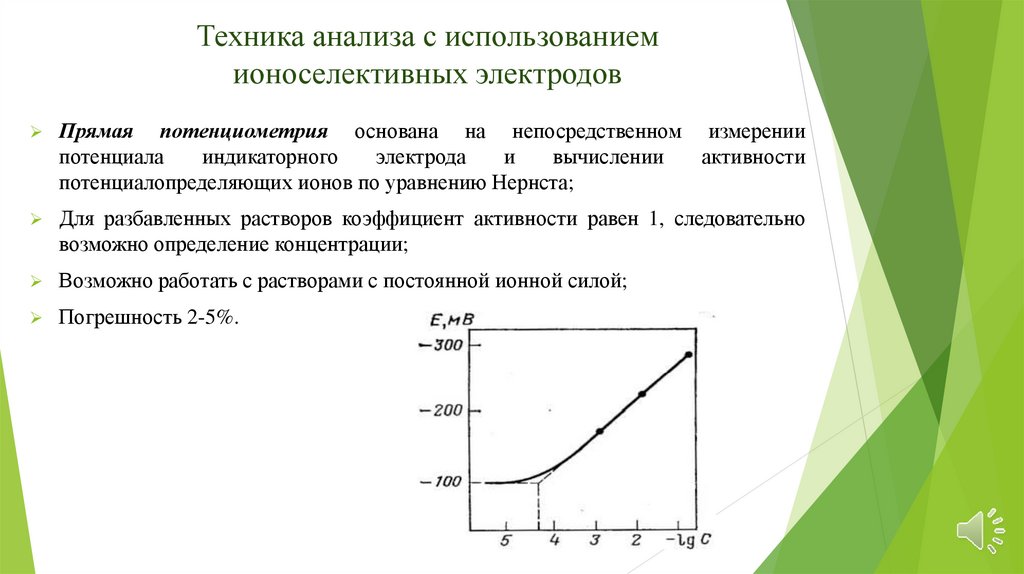
Техника анализа с использованиемионоселективных электродов
Прямая потенциометрия основана на непосредственном измерении
потенциала
индикаторного
электрода
и
вычислении
активности
потенциалопределяющих ионов по уравнению Нернста;
Для разбавленных растворов коэффициент активности равен 1, следовательно
возможно определение концентрации;
Возможно работать с растворами с постоянной ионной силой;
Погрешность 2-5%.
70.
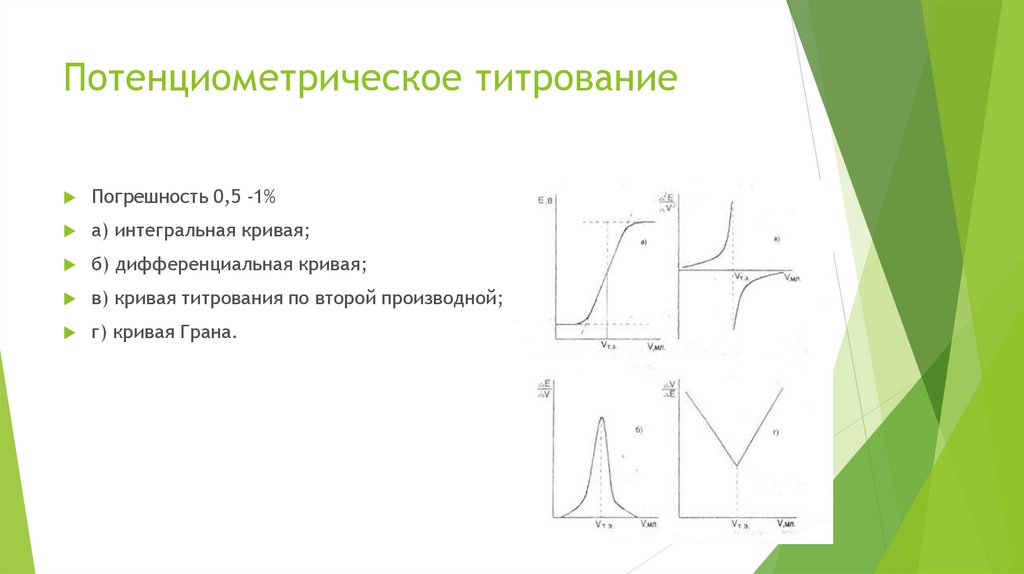
Потенциометрическое титрованиеПогрешность 0,5 -1%
а) интегральная кривая;
б) дифференциальная кривая;
в) кривая титрования по второй производной;
г) кривая Грана.
71.
Метод ГранаВ методе Грана (рис. г) точка эквивалентности определяется по
графику в координатах: ∆V/∆E - V. Перед точкой эквивалентности и
после нее кривая Грана линейна. Точка эквивалентности находится
как точка пересечения этих прямых. Достоинства и удобства
метода Грана особенно заметны при анализе разбавленных
растворов, позволяющих определить точку эквивалентности с
достаточной точностью вследствие линейности графика, а также в
тех случаях, когда кривая титрования выражена плохо.
В потенциометрическом титровании могут быть использованы
любые известные типы химических реакций, протекающие быстро
и количественно.
72.
Кислотно-основное потенциометрическоетитрование основано на протекании химической реакции
нейтрализации. В качестве индикаторного применим любой
электрод с водородной функцией: водородный, хингидронный,
стеклянный. Чаще всего используется стеклянный электрод.
Метод позволяет провести количественное определение
компонентов в смеси кислот, если константы их диссоциации
различаются не менее чем на три порядка (например, в смеси
соляной и уксусной кислот); многоосновных кислот
(оснований), так как удается достичь разделения конечных точек
многоступенчатого титрования (на кривой титрования при этом
наблюдается несколько скачков).
73.
В окислительно-восстановительном потенциометрическомтитровании наибольшее распространение нашел платиновый
индикаторный электрод. Величина скачка определяется
разностью
формальных
потенциалов
полуреакций.
Желательно, чтобы одна из полуреакций была обратимой. При
титровании не рекомендуется измерять потенциал до
добавления титранта и вблизи точки эквивалентности, т. к.
приобретаемый электродом смешанный потенциал неустойчив,
поэтому его трудно измерить.
Все большее значение приобретает проведение редокститрования в органических растворителях. Одним из таких
методов является определение воды по методу Фишера.
74.
Комплексонометрическоепотенциометрическое
титрование используется для определения катионов металлов
при титровании их комплексоном (ЭДТА) с применением в
качестве индикаторного соответствующего металлического
электрода: титрование солей меди с медным электродом, солей
свинца - со свинцовым электродом и т. д. Также используют
ионоселективные
электроды,
обратимые
относительно
определяемого компонента. В ряде случаев необходимо
добавление в анализируемый раствор потенциометрических
индикаторов – потенциалопределяющих ионов, вводимых в
небольшом
количестве
и
обеспечивающих
отклик
индикаторного электрода либо до, либо после достижения
конечной точки титрования (так, при титровании железа (III)
вводят железа(II) в небольшом количестве).
75.
В осадительном потенциометрическом титровании индикаторнымиэлектродами служат металлические или мембранные электроды,
чувствительные к определяемому иону или иону-осадителю.
Например, можно определять галогенид-ионы (Сl‾, Вr‾, I‾) на серебряном
электроде титрованием нитратом серебра. До точки эквивалентности
потенциал электрода зависит от активности галогенид-ионов и
серебряный электрод является электродом II рода. За точкой
эквивалентности при избытке ионов серебра потенциал электрода зависит
от активности собственных ионов (электрод I рода). Величина скачка
зависит от растворимости осадка. Можно провести дифференцированное
титрование смеси хлорид-, бромид - и иодид-ионов.
По методу осаждения могут быть также определены катионы серебра,
ртути, цинка, свинца и т. д.
76.
Существует несколько вариантов потенциометрическоготитрования в зависимости от инструментальных особенностей.
С применением неполяризованных электродов можно провести
титрование а) с одним индикаторным электродом и одним
электродом сравнения; б) с двумя различными индикаторными
электродами.
Варианты
титрования
с
применением
поляризованных электродов (титрование под током): а)с одним
индикаторным электродом и одним электродом сравнения; б) с
двумя одинаковыми электродами сравнения.
77.
Методпотенциометрического
титрования
имеет
ряд
преимуществ перед прямой потенциометрией и титрованием с
визуальными индикаторами: отсутствие искажения результатов
за счет диффузионного потенциала; нет необходимости знать
коэффициент активности определяемого иона; исключение
субъективных ошибок за счет инструментального фиксирования
конечной точки; возможность анализа мутных и окрашенных
растворов; сравнительно легкая автоматизация; возможность
дифференцированного титрования компонентов смеси, в том
числе с использованием неводных растворителей. Результаты
определений методом потенциометрического титрования более
точны, чем при использовании прямой потенциометрии.




































































 Физика
Физика Химия
Химия








