Похожие презентации:
Механизмы органических реакций (лекция 1)
1.
Лекция 1Введение в курс
Механизмы органических реакций
2.
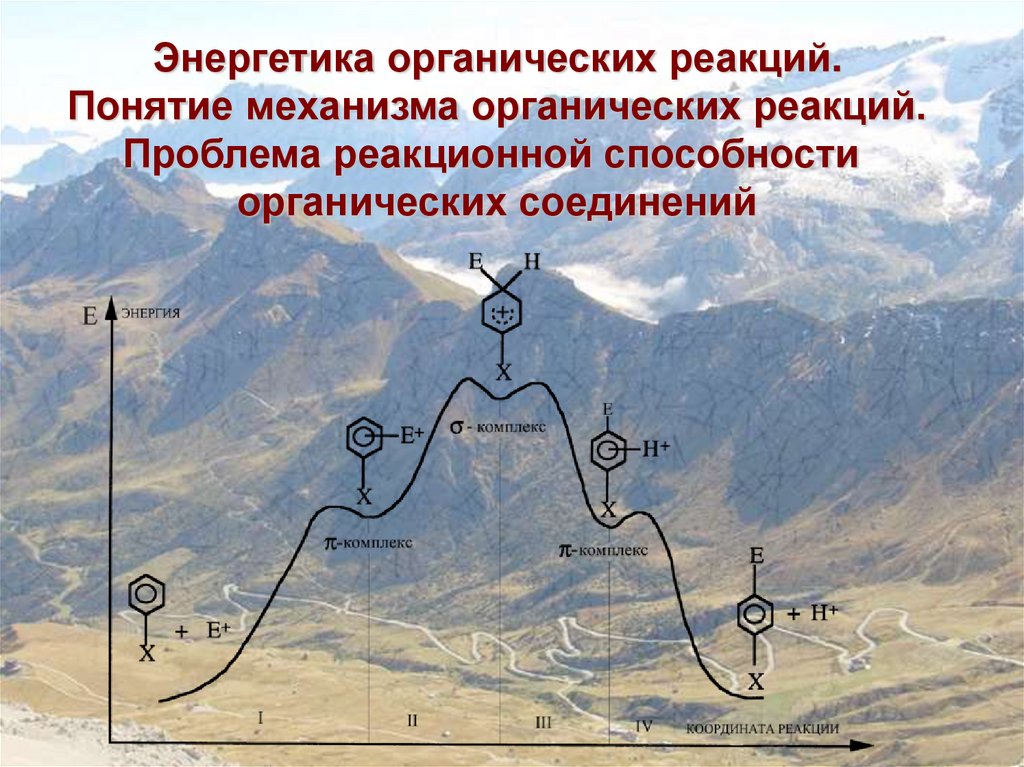
Энергетика органических реакций.Понятие механизма органических реакций.
Проблема реакционной способности
органических соединений
3.
Энергетика органических реакцийДвижущей силой химической реакции является стремление реагирующих
молекул занять наиболее устойчивое состояние, т.е. состояние с наименьшей
свободной энергией, или энергией Гиббса (G):
∆ G= ∆ H - T ∆ S
G
A+ B
C+D
∆ G>0, Кр<1;
∆ G<0, Кр>1;
∆ G=0, Кр=1.
A+ B
-
lnКр= ∆G/RT
Джозайя-Уиллард Гиббс
(11.02I.1839 - 28.04.1903)
G
C+D
координата реакции
(C6H10O2)n + 6nO2
целлюлоза
6nCO2 + 5nH2O
∆ G<0
4.
5.
Энергетика органических реакцийДвижущей силой химической реакции является стремление реагирующих
молекул занять наиболее устойчивое состояние, т.е. состояние с наименьшей
свободной энергией, или энергией Гиббса (G):
∆ G= ∆ H - T ∆ S
∆ G>0, Кр<1;
∆ G<0, Кр>1;
∆ G=0, Кр=1.
lnКр=-∆G/RT
ΔH < 0
ΔS > 0
ΔG < 0
C2H5–O–C2H5 + 6O2 = 4CO2 + 5H2O
(реакция возможна при любой температуре)
ΔH > 0
ΔS < 0
ΔG > 0
реакция невозможна
ΔH < 0
ΔS < 0
ΔG > 0, ΔG < 0
N2 + 3H2 = 2NH3 (возможна при низкой температуре)
ΔH > 0
ΔS > 0
ΔG > 0, ΔG < 0
N2O4(г) = 2NO2(г) (возможна при высокой температуре
Джозайя-Уиллард Гиббс
(11.02I.1839 - 28.04.1903)
6.
Энергетика органических реакцийДвижущей силой химической реакции является стремление реагирующих
молекул занять наиболее устойчивое состояние, т.е. состояние с наименьшей
свободной энергией, или энергией Гиббса (G):
∆ G= ∆ H - T ∆ S
ДжозайяУиллард Гиббс
(11.02I.1839 28.04.1903)
7.
Термодинамический анализ не дает ответа на вопрос:как быстро протекает реакция
A + B
[C]
[D]
X
[C] и [D] - устойчивые промежуточные
соединения, либо интермедиаты
Органические реакции
многостадийны, т.е. протекают через
ряд элементарных стадий.
Наука, изучающая факторы, влияющие на скорость химических реакций, называется химическая кинетика
HCl
H
H2C
CH2 + H
+ Cl
медлен.
H2C
CH3
Cl
ClH 2C
CH3
Каждый акт элементарной стадии – результат взаимодействия и превращения
частиц - участников этого акта (молекул, атомов, ионов или свободных радикалов).
Число взаимодействующих частиц, которые принимают участие в реакции на
данной стадии, называют молекулярностью этой стадии
Реакции или отдельные стадии этих реакций могут быть мономолекулярными,
бимолекулярными или тримолекулярными
Лимитирующая стадия – самая медленная стадия всей сложной реакции.
Закономерности всего процесса определяются кинетическими закономерностями этой стадии
8.
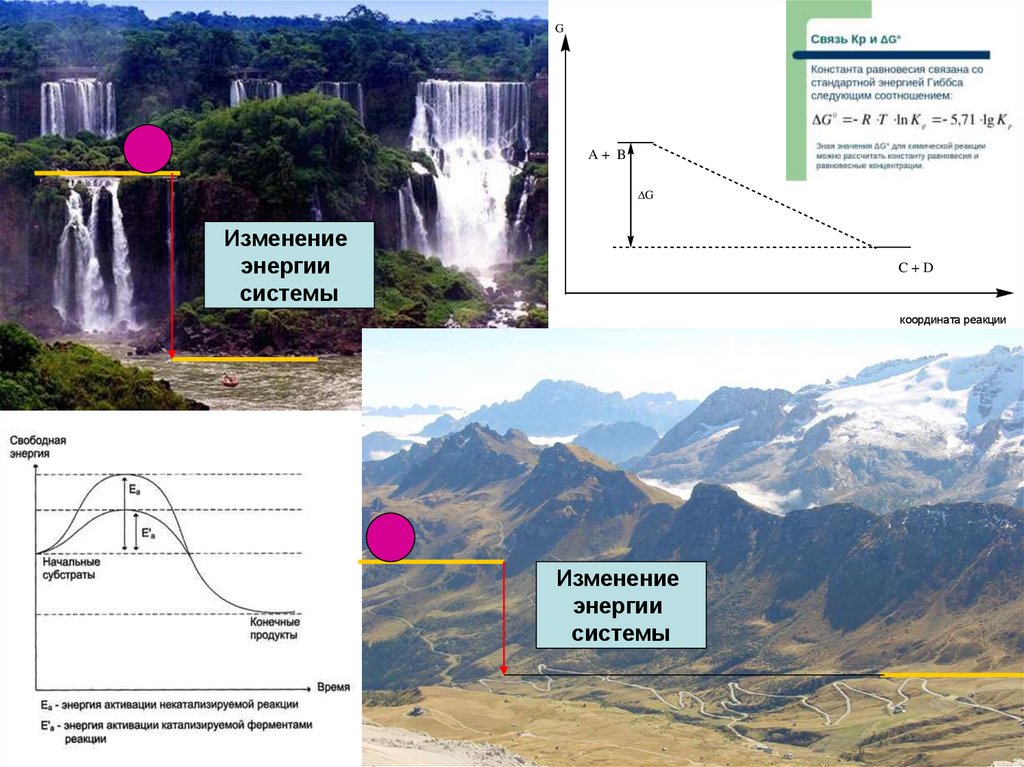
GA+ B
G
Изменение
энергии
системы
C+D
координата реакции
Изменение
энергии
системы
9.
GA+ B
G
Изменение
энергии
системы
C+D
координата реакции
Изменение
энергии
системы
10.
Понятие о механизмах органических реакцийСовокупность и последовательность реакций из элементарных
стадий называется механизмом реакции
Таким образом, чтобы ответить на вопрос о механизме реакции необходимо,
как минимум, определить:
а) последовательность стадий;
б) строение промежуточных продуктов или тип интермедиатов (карбокатионы,
карбанионы, свободные радикалы или карбены);
в) лимитирующую стадию
Исходные
продукты
Продукты
реакции
11.
Теория активных столкновений. Теория активированногокомплекса или переходного состояния
Химическое взаимодействие осуществляется только при столкновении активных
частиц, обладающих энергией (энергия активации Еа) для преодоления
потенциального барьера реакции (теория активированных столкновений)
Переходное состояние (#)) – некое промежуточное состояние, когда старые связи еще
не разорвались, а новые еще не образовались. Это предельно неустойчивое сочетание
реагирующих молекул – активированный
комплекс
Распад активированного комплекса может сопровождаться как образованием
исходных, так и образованием конечных продуктов реакции
12.
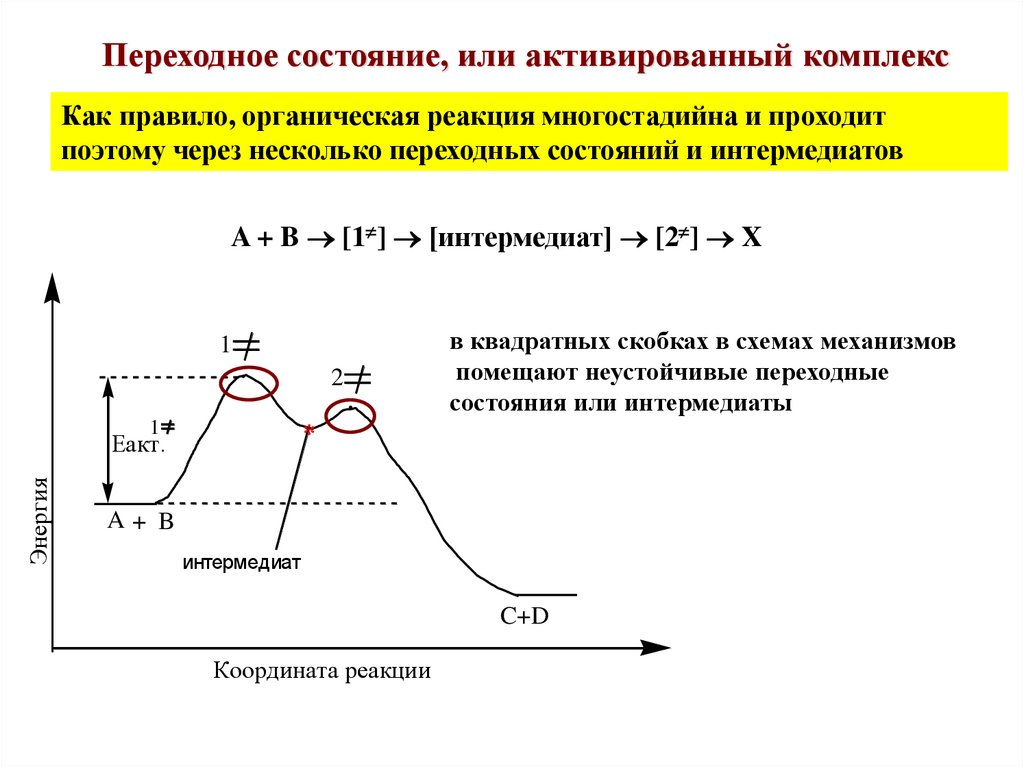
Переходное состояние, или активированный комплексКак правило, органическая реакция многостадийна и проходит
поэтому через несколько переходных состояний и интермедиатов
A + B [1 ] [интермедиат] [2 ] X
1
2
1
*
акт.
Энергия
в квадратных скобках в схемах механизмов
помещают неустойчивые переходные
состояния или интермедиаты
A+ B
интермедиат
C+D
Координата реакции
13.
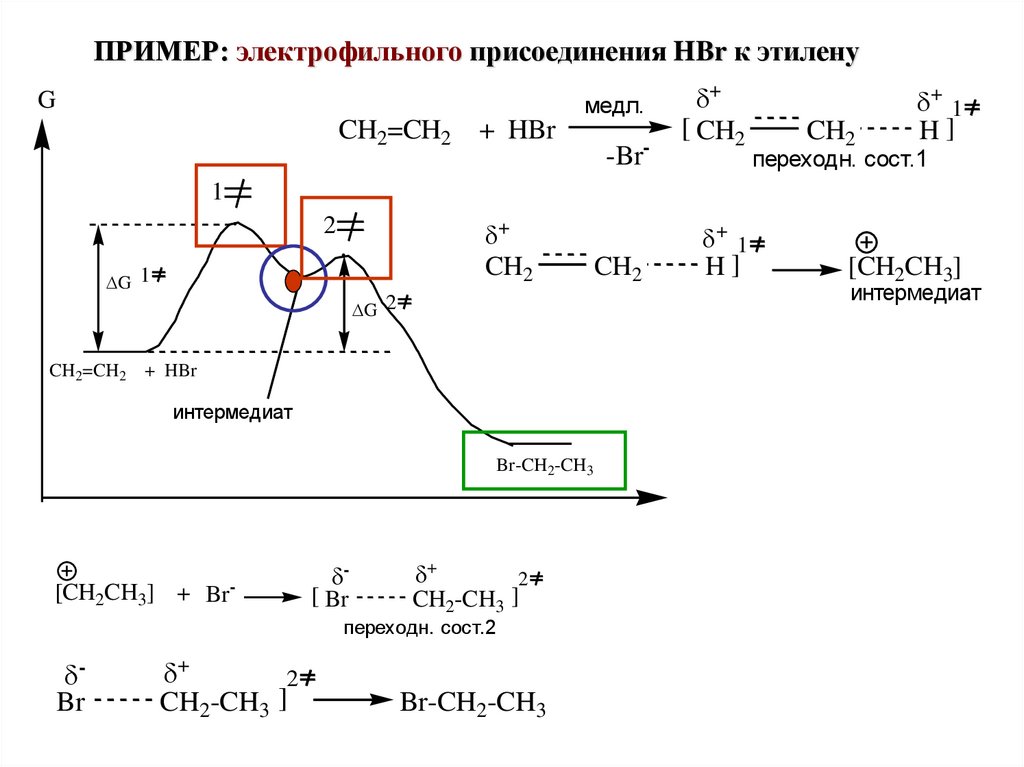
ПРИМЕР: электрофильного присоединения HBr к этиленуG
медл.
CH2=CH2
+ HBr
-
-Br
+
[ CH2
CH2
+ 1
H]
переходн. сост.1
1
2
+
CH2
G 1
G 2
CH2=CH2 + HBr
интермедиат
Br-CH2-CH3
[CH2CH3] + Br-
[ Br
+
2
]
CH2-CH3
переходн. сост.2
Br
+
2
CH2-CH3 ]
Br-CH2-CH3
CH2
+ 1
H]
[CH2CH3]
интермедиат
14.
Переходное состояние, или активированный комплекс1
2
1
*
акт.
Энергия
Считают, что переходное состояние в отличие
от интермедиатов принципиально не наблюдаемо
A+ B
интермедиат
C+D
Координата реакции
Переходное состояние лежит близко к интермедиату по координате реакции,
но находится выше него.
Переходное состояние, как правило, "похоже" на интермедиат, следовательно,
все факторы стабилизирующие интермедиат (понижающие внутреннюю энергию),
будут стабилизировать и переходное состояние. Факторы, дестабилизирующие
интермедиат, будут дестабилизировать и переходное состояние
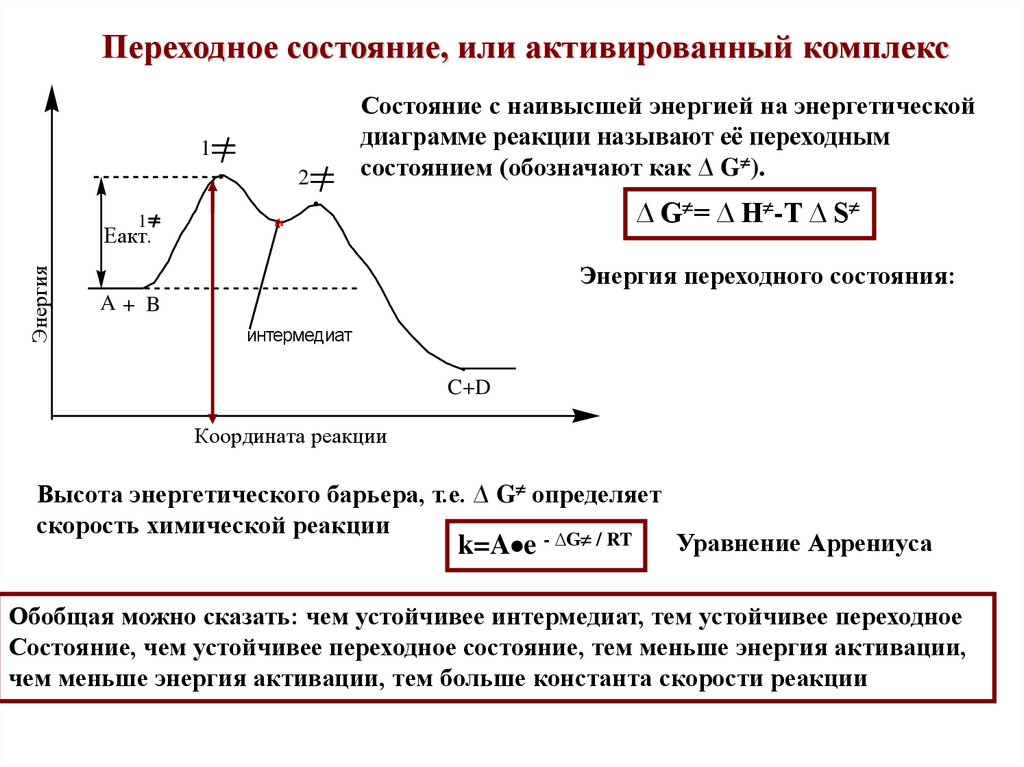
15.
Переходное состояние, или активированный комплекс1
2
1
Энергия
акт.
Состояние с наивысшей энергией на энергетической
диаграмме реакции называют её переходным
состоянием (обозначают как ∆ G ).
∆ G = ∆ H -T ∆ S
*
Энергия переходного состояния:
A+ B
интермедиат
C+D
Координата реакции
Высота энергетического барьера, т.е. ∆ G определяет
скорость химической реакции
- ∆G / RT
k=A e
Уравнение Аррениуса
Обобщая можно сказать: чем устойчивее интермедиат, тем устойчивее переходное
Состояние, чем устойчивее переходное состояние, тем меньше энергия активации,
чем меньше энергия активации, тем больше константа скорости реакции
16.
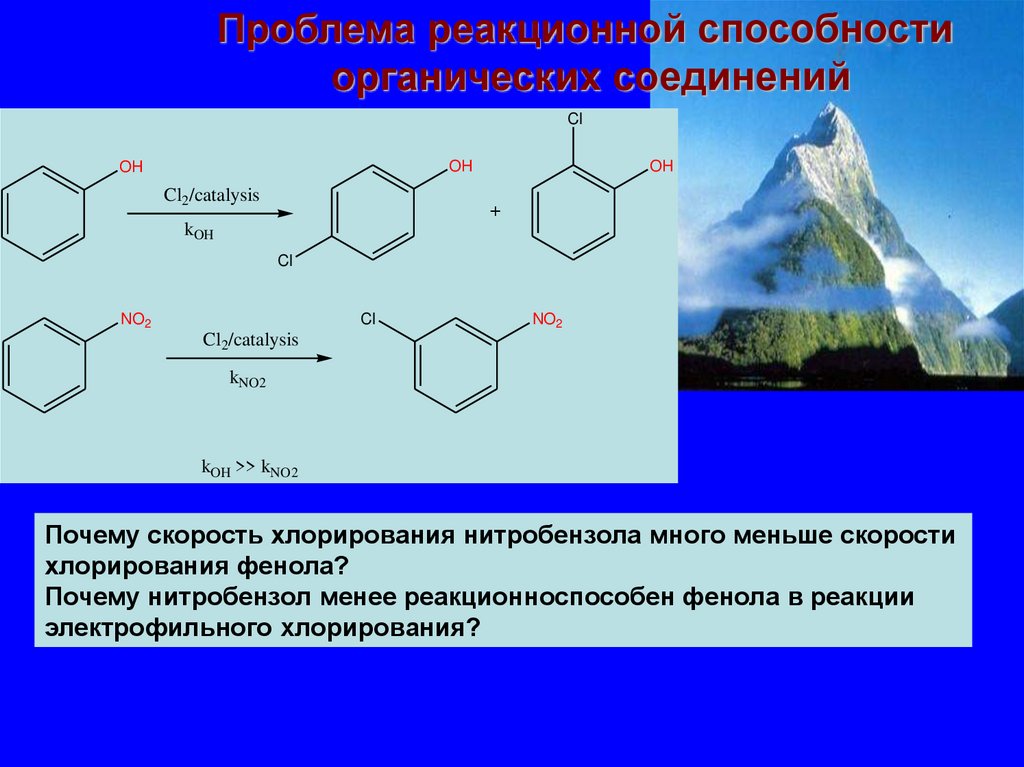
Проблема реакционной способностиорганических соединений
Cl
OH
OH
Cl2/catalysis
OH
+
kOH
Cl
NO2
Cl
NO2
Cl2/catalysis
kNO2
kOH >> kNO2
Почему скорость хлорирования нитробензола много меньше скорости
хлорирования фенола?
Почему нитробензол менее реакционноспособен фенола в реакции
электрофильного хлорирования?
17.
Почему скорость хлорирования нитробензола много меньше скоростихлорирования фенола?
Cl
OH
OH
Cl2/catalysis
OH
+
kOH
Cl
NO2
Cl
NO2
Cl2/catalysis
kNO2
kOH >> kNO2
Почему нитробензол менее реакционноспособен фенола в реакции
электрофильного хлорирования?
18.
σ-Комплекс (интермедиат в лимитирующей стадии), образованный вслучае фенола более устойчивый, чем σ-комплекс, образованный
при хлорировании нитробензола.
Следовательно, # при хлорировании фенола более устойчиво, чем при
хлорировании нитробензола.
Еа хлорирования фенола <, чем Еа хлорирования
нитробензола.
Хлорирование нитробензола
Хлорирование фенола
*
Энергия
акт.
интермедиат
Координата реакции
kхлорирования фенола >> k хлорирования нитробензола
19. Суммируем:
Любая химическая реакция должна рассматриваться спозиций термодинамики и кинетики.
Термодинамика указывает на возможность протекания
процесса в данных условиях, но термодинамическое
описание ничего не говорит о скорости протекания
реакции, времени достижения равновесия.
Скорость же реакции определяется энергией ее
переходного состояния, которая описывается в терминах
кинетики.
20. Механизмы реакций в органической химии
• По типу разрыва химической связи органическиереакции подразделяют на радикальные (с
изменением спинового состояния) и не
радикальные (ионные, без изменения спина ).
• При радикальных реакциях происходит
гомолитический разрыв общей электронной пары,
образующей связь. При этом образуются свободные
радикалы, имеющие неспаренный электрон.
• В ионных реакциях происходит гетеролитический
разрыв связи. Образуются две частицы: нуклеофил
(-) и электрофил (+).
изменение или сохранение S
21. Механизмы реакций в органической химии
• В каждой органической реакции различают:объект воздействия и реагент.
• Реагент – вещество, действующее на объект и
вызывающее в нём изменение химических
связей.
• Реагенты подразделяют на: радикальные,
электрофильные и нуклеофильные.
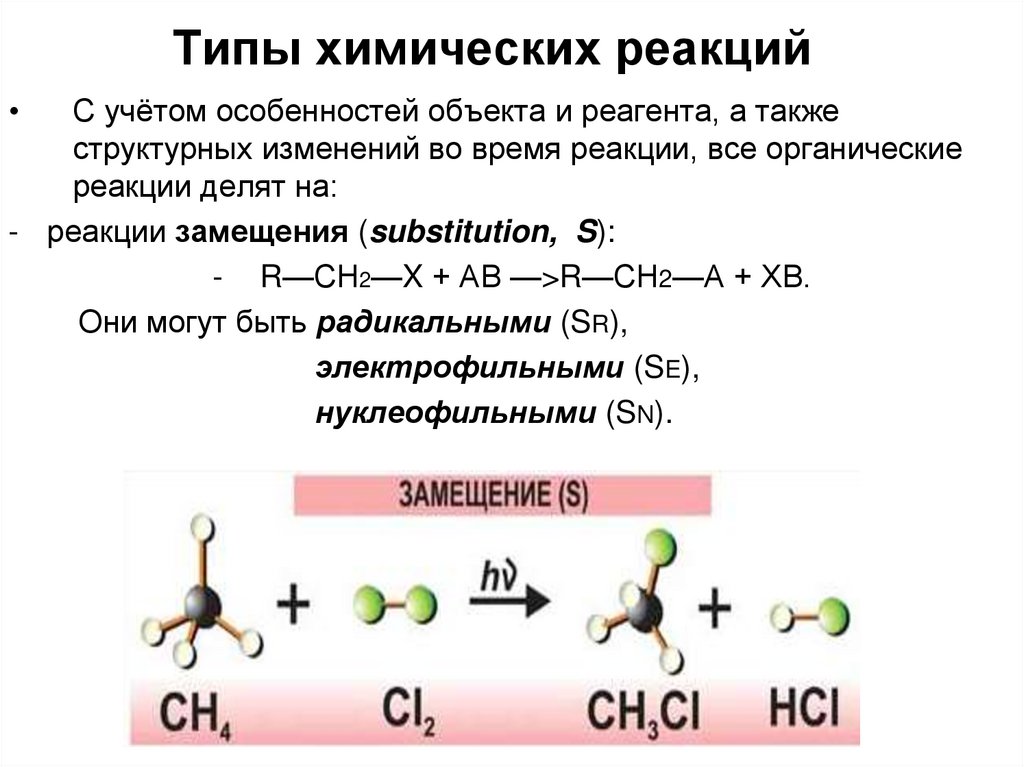
22. Типы химических реакций
С учётом особенностей объекта и реагента, а также
структурных изменений во время реакции, все органические
реакции делят на:
- реакции замещения (substitution, S):
- R—СН2—X + АВ —>R—СН2—А + ХВ.
Они могут быть радикальными (SR),
электрофильными (SE),
нуклеофильными (SN).
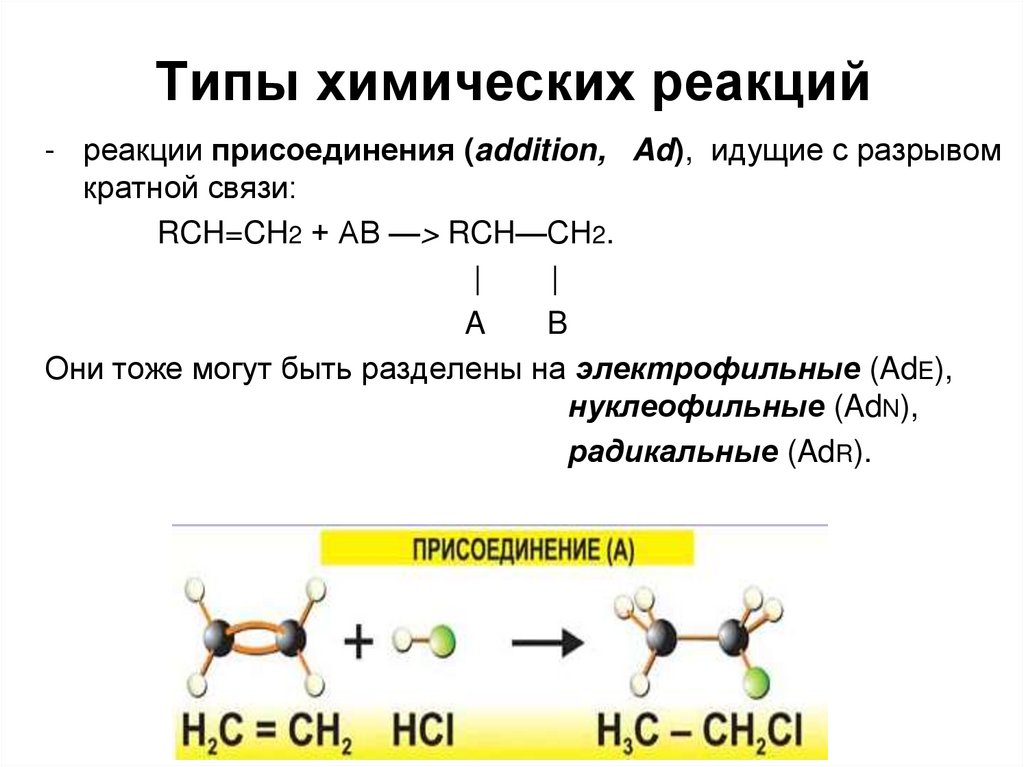
23. Типы химических реакций
- реакции присоединения (addition, Ad), идущие с разрывомкратной связи:
RCH=CH2 + АВ —> RCH—СН2.
|
|
A
B
Они тоже могут быть разделены на электрофильные (AdE),
нуклеофильные (AdN),
радикальные (AdR).
24. Типы химических реакций
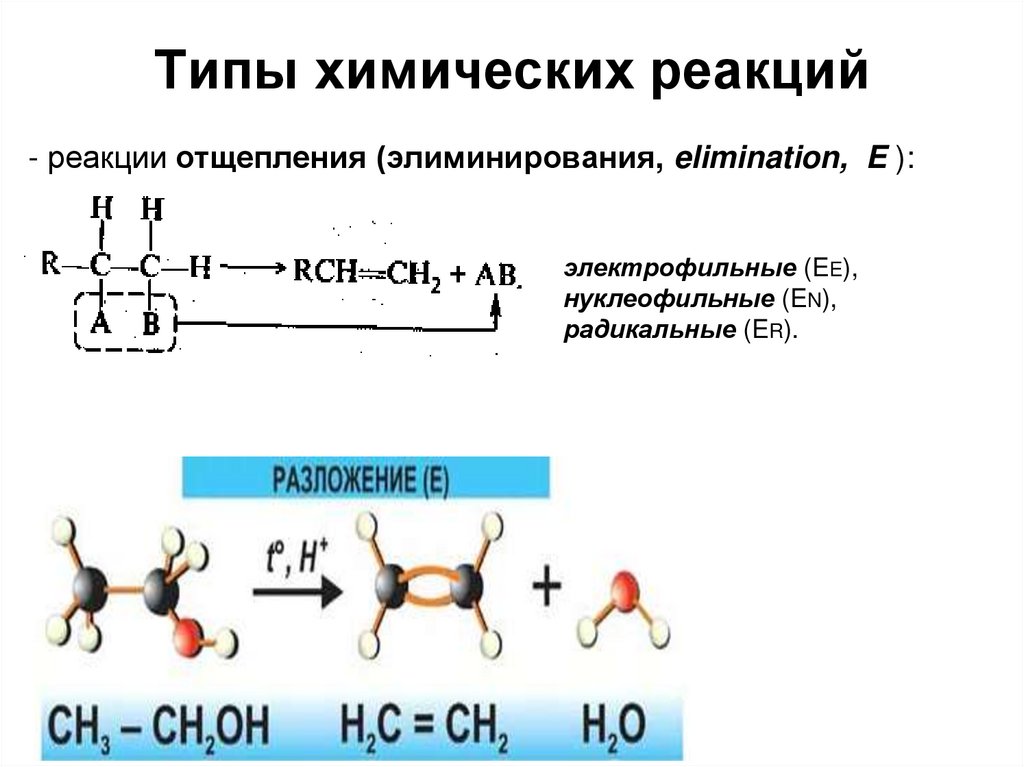
- реакции отщепления (элиминирования, elimination, E ):электрофильные (EE),
нуклеофильные (EN),
радикальные (ER).
25. Типы химических реакций
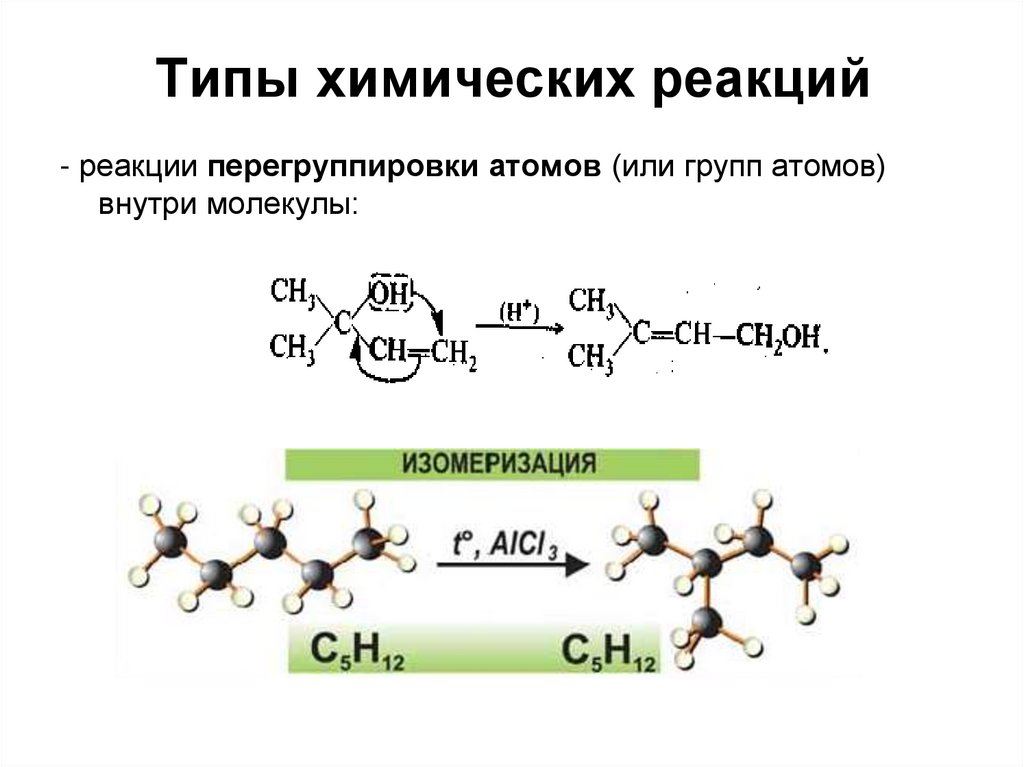
- реакции перегруппировки атомов (или групп атомов)внутри молекулы:
26. Типы химических реакций
- реакции окисления и восстановления:- реакции этерификация:
27. Типы химических реакций
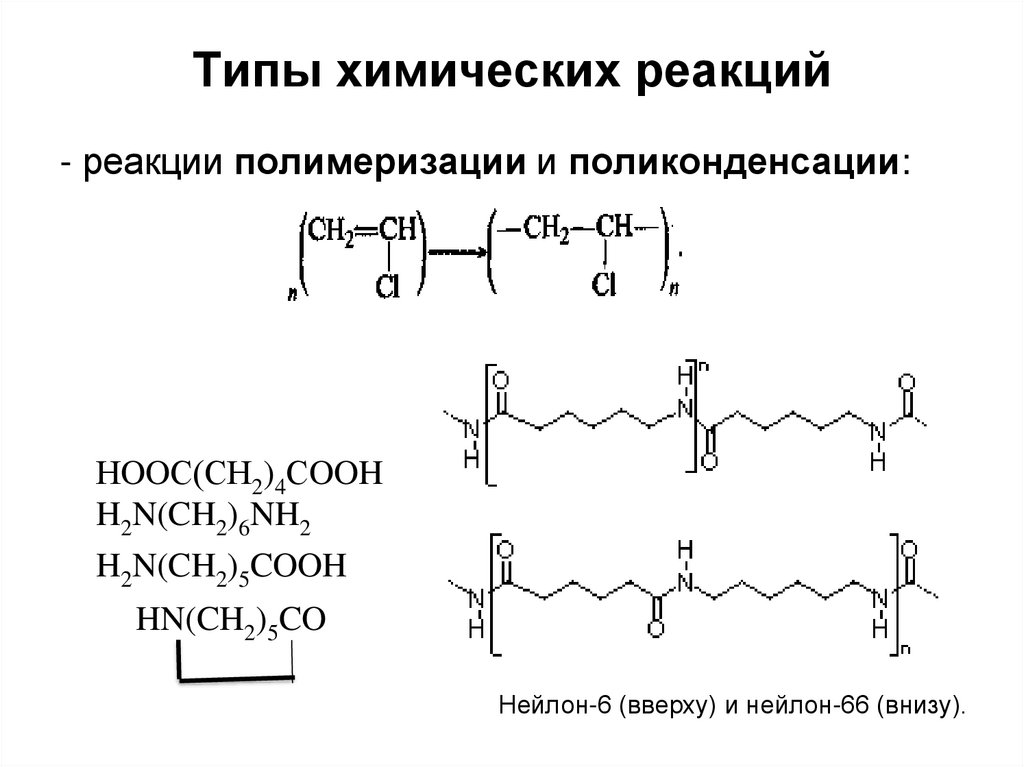
- реакции полимеризации и поликонденсации:НOOС(СН2)4СOOH
H2N(CH2)6NH2
H2N(CH2)5COOH
HN(CH2)5CO
Нейлон-6 (вверху) и нейлон-66 (внизу).
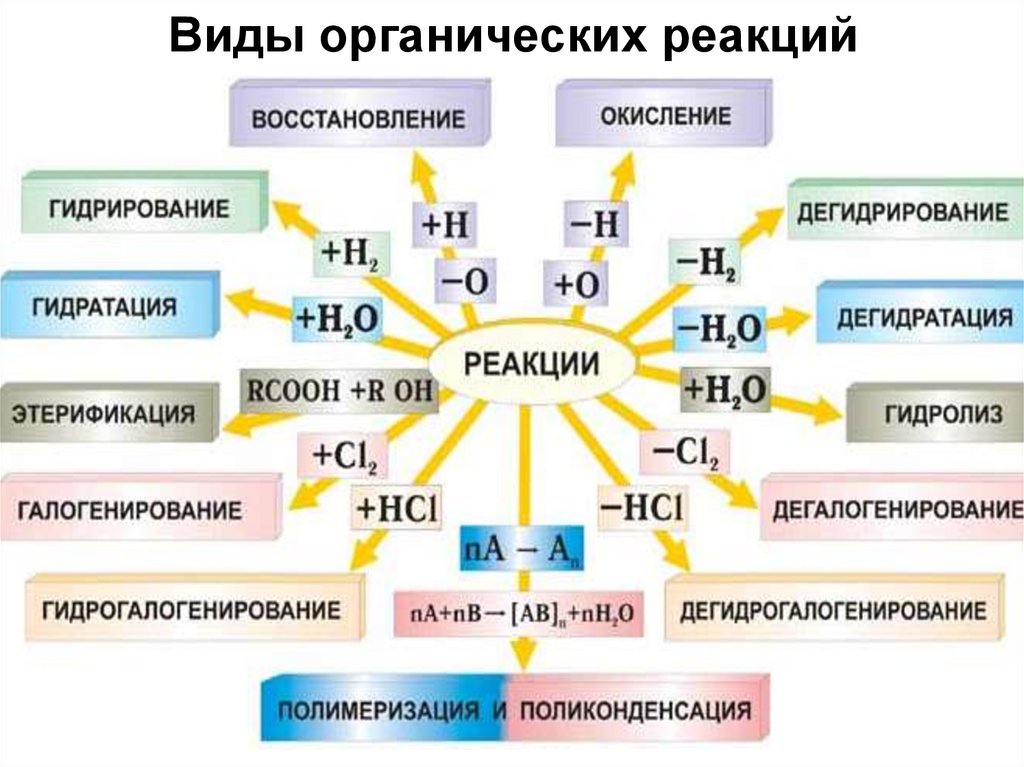
28. Виды органических реакций
29.
1. ОБЩИЕ ПОНЯТИЯХимическая реакция – процесс превращения одних веществ (исходные
соединения) в другие (продукты реакции).
Исходные соединения в химических реакциях иногда называют «реагентами»,
однако чаще (особенно в органической химии) термин «реагент» используют по
отношению к одному, наиболее активному исходному соединению, определяющему
направление химических реакций.
Обычно, реагенты различают по своим основным свойствам:
- нуклеофил – молекула или ион, предоставляющий для реакции с реагентом
свою электронную пару; поскольку нуклеофилы отдают электроны, они являются
основаниями (основания Льюиса): [OH]-, NH3, H2O, амины, Cl-, Br- и т.д.
- электрофил – молекула или ион, принимающий для реакции от реагента его
электронную пару; поскольку электрофилы принимают электроны, они являются
кислотами (кислоты Льюиса): [H]+, AlCl3, R3C+ и т.д.
- радикал – частицы с неспаренными электронами, могут быть нейтральными
или заряженными (ион-радикал), иметь один или более неспаренных электронов:
Н3С*, Сl*, O2** и пр.
В зависимости от природы реагента различают
нуклеофильные, электрофильные и радикальные
реакции.
30.
1. ОБЩИЕ ПОНЯТИЯМолекулярность элементарной реакции – число частиц, которые, согласно
экспериментально установленному механизму реакции, участвуют в элементарном
акте химического взаимодействия.
Мономолекулярные реакции – реакции, в которых происходит химическое
превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции – реакции, элементарный акт которых
осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Химические реакции могут осуществляться как один элементарный акт
(стадия) или через последовательность отдельных стадий, составляющих в
совокупности механизм реакции
гомогенные и гетерогенные реакции,
простые и сложные реакции,
элементарные и неэлементарные,
последовательные, параллельные и цепные реакции
31.
1. ОБЩИЕ ПОНЯТИЯГомофазными называются реакции, все компоненты которых (кроме катализаторов)
находятся в пределах одной фазы:
газовой (газофазные процессы) или жидкой (жидкофазные процессы).
Гетерофазными являются реакции, компоненты которых находятся в двух или
более фазах (системы газ–жидкость, две несмешивающихся жидкости и др.).
Гомогенные и гетерогенные реакции различают по зоне протекания самой
химической реакции:
гомогенные осуществляются в объеме какой-либо фазы;
гетерогенные – на поверхности раздела фаз.
С этим связана и классификация катализаторов.
При гомогенном катализе
реакция протекает в объеме, где находится и сам катализатор,
при гетерогенном катализе – на поверхности контакта фаз.
32.
1. ОБЩИЕ ПОНЯТИЯПростыми называются реакции, в которых не образуются количества других
веществ, кроме тех, что фигурируют в стехиометрическом уравнении:
γAA + γBB + … ↔ γYY +γZZ
Сложные (неэлементарные) реакции имеют ряд химических микростадий, в
которых участвуют промежуточные комплексы или частицы, не фигурирующие в
стереохимическом уравнении, например:
А → А* → (+Y ) → А*Y → B + Z
Простые реакции могут быть обратимыми и необратимыми.
Реакции, идущие сразу по нескольким направлениям, получили название
параллельных.
Последовательные реакции протекают через ряд последовательных стадий.
Очень часто встречаются процессы, одновременно включающие протекание
параллельных и последовательных реакций, т.е. параллельнопоследовательные
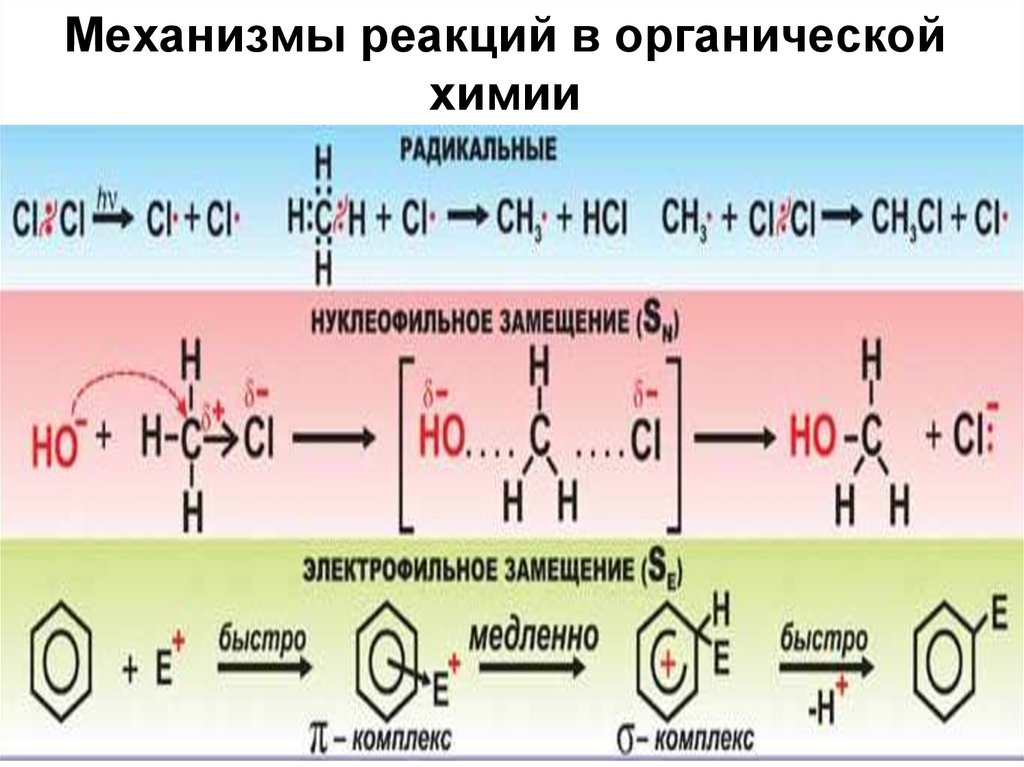
33. Механизмы реакций в органической химии
34. Механизмы реакций в органической химии
Некоторые примеры35. Механизмы реакций в органической химии
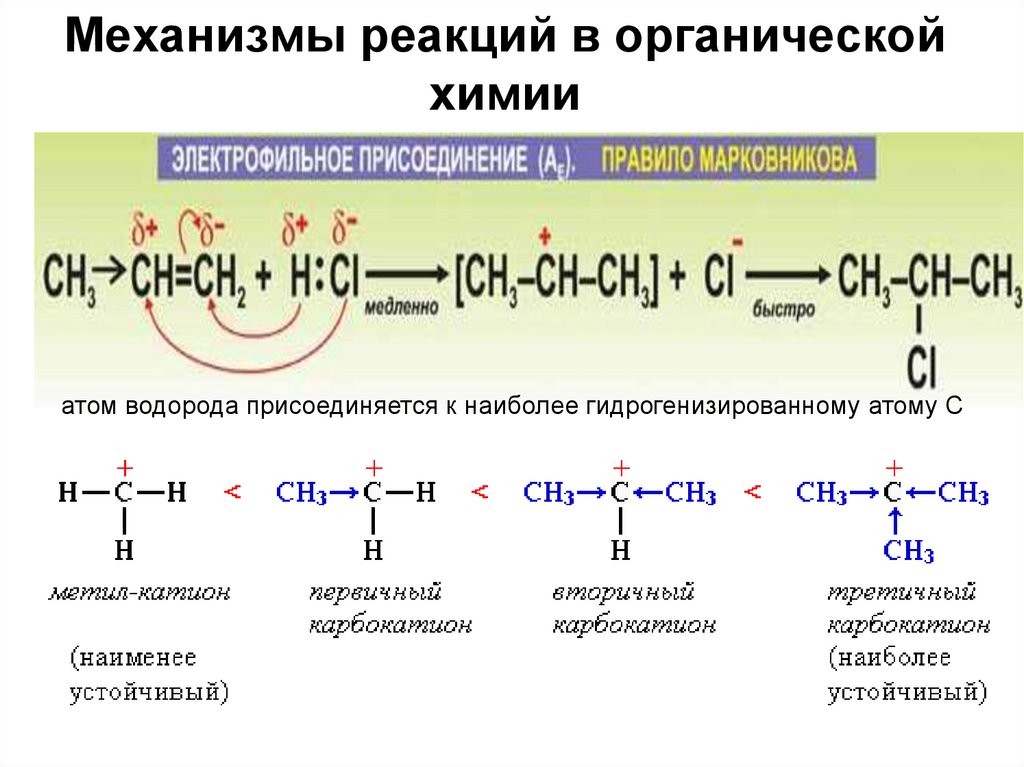
атом водорода присоединяется к наиболее гидрогенизированному атому С36.
Правило Марковникова нарушается также в реакциях присоединенияHBr к олефинам в присутствии перекисей Эффект КАРАША (ХАРАША),
так как механизм реакции в этом случае радикальный























 Химия
Химия








