Похожие презентации:
Химическая реакция
1. Химическая реакция
Химическая реакция –процесс взаимодействия, при
котором происходит
перераспределение атомов,
т.е. разрыв старых и
образование новых связей в
реагирующих молекулах.
2. Движущая сила реакции – это возможность образования новой более стабильной системы, обладающей минимальной потенциальной энергией.
Факторы, определяющие реакционнуюспособность - причина появления реакционного
центра:
Статические:
электронный – неравномерное распределение
электронной плотности;
пространственный – при объемных заместителях
затруднен подход реагента к реакционному
центру – реакция может идти по другому
направлению.
3. Химическая реакция характеризуется 2 факторами:
Термодинамическим изменениемсвободной энергии;
Кинетическим– скоростью превращения
и
его
механизмом,
т.е.
стадиями
превращения, при которых происходит
разрыв и образование отдельных связей.
Термодинамический фактор характеризует
позиций ее принципиальной возможности:
- Δ G =G кон.- G исх.
-ΔG <0
реакция возможна
- Δ G =0
равновесие
реакцию
с
4.
В соответствии с уравнением Гиббса:-Δ G = ΔH-T ΔS
∆Н – изменение энтальпии (разность энергий
разрывающихся и вновь образующихся связей);
∆S– изменение энтропии (характеризует степень
упорядоченности системы).
Предпочтительны процессы, при которых
энтальпия низка, а энтропия высока,
поэтому в реагирующих системах
энтальпия спонтанно уменьшается,
а энтропия возрастает.
5.
Реакционная способность вещества – способность веществавступать в ту или иную реакцию и реагировать с большей или
меньшей скоростью. Каждая химическая реакция проходит
через определенные стадии, которые называют
механизмом реакции.
Большинство органических реакций протекает через
ряд промежуточных стадий, причем скорость
суммарной реакции определяется V самой медленной стадии,
которая называется лимитирующей.
Каждая промежуточная стадия называется элементарным актом
реакции. Реакции, в элементарном акте которых участвует 1 частица,
называются мономолекулярными; 2 частицы - бимолекулярными.
Обратимые реакции протекают одновременно и независимо
в прямом и обратном направлениях,
а в одном направлении – необратимые.
6. Теория переходного состояния
• При переходе от исх. реагентов к продуктамреагирующая система должна пройти через
некоторое состояние, отвечающее маx. энергии,
т.е. пройти через энергетический барьер:
C + A-B
C + A-B
C-A + B
C...A...B
C-A
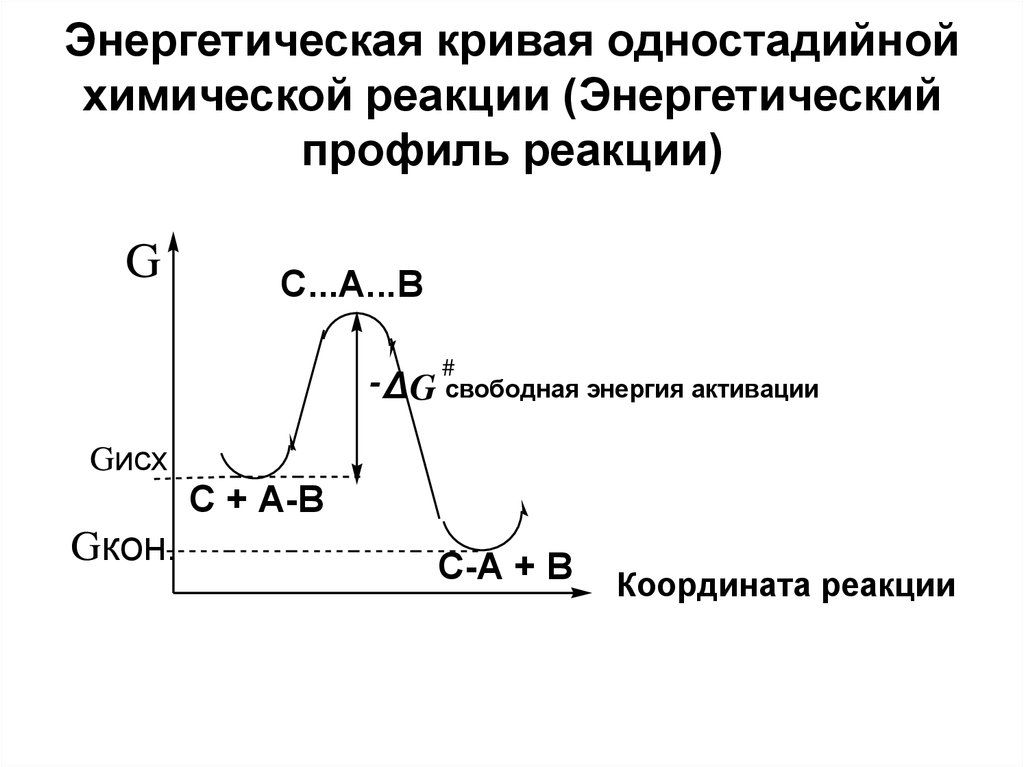
7. Энергетическая кривая одностадийной химической реакции (Энергетический профиль реакции)
GC...A...B
-Δ G #свободная энергия активации
Gисх
C + A-B
Gкон.
C-A + B
Координата реакции
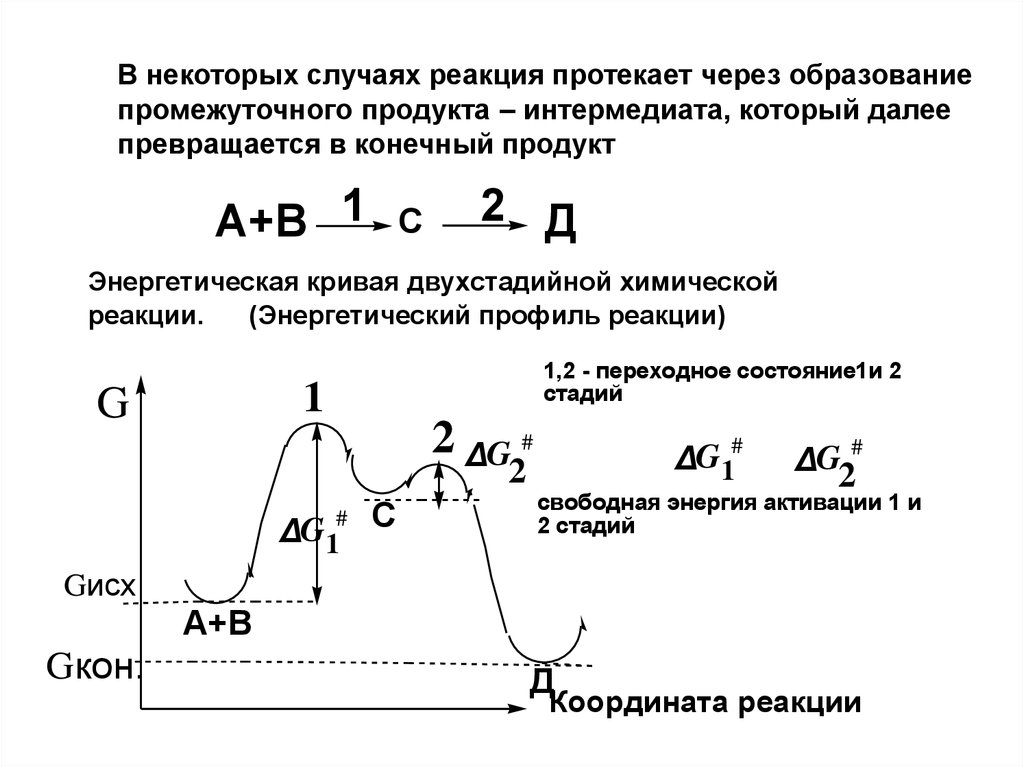
8. В некоторых случаях реакция протекает через образование промежуточного продукта – интермедиата, который далее превращается в конечный п
В некоторых случаях реакция протекает через образованиепромежуточного продукта – интермедиата, который далее
превращается в конечный продукт
A+B 1
C
2 Д
Энергетическая кривая двухстадийной химической
(Энергетический профиль реакции)
реакции.
1,2 - переходное состояние1и 2
стадий
1
G
2 ΔG #
2
#
ΔG1
C
ΔG1#
ΔG2#
свободная энергия активации 1 и
2 стадий
Gисх
A+B
Gкон.
Д
Координата реакции
9. Первая стадия будет скоростьлимитирующей, так как:
#ΔG 1
#
> ΔG2
Скорость химических реакций определяется
относительной
стабильностью
интермедиатов,
образующихся
в
лимитирующей
стадии
химического
превращения.
Чем выше стабильность промежуточных
частиц или молекул, тем легче протекает в
этом направлении химическая реакция.
10.
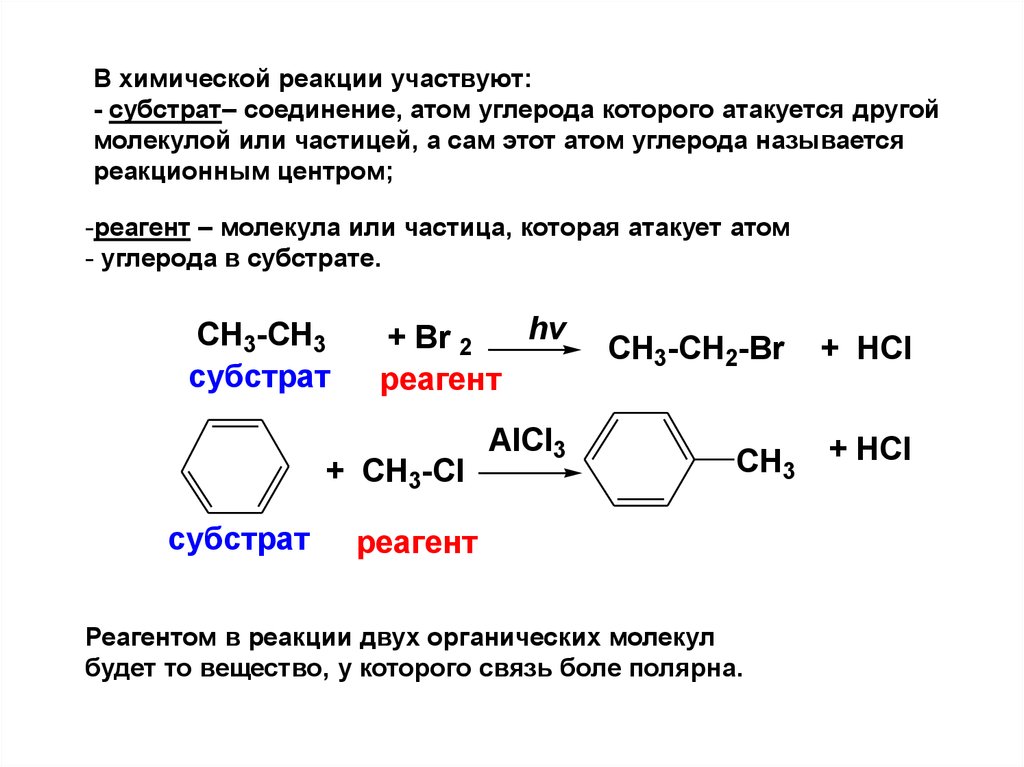
В химической реакции участвуют:- субстрат– соединение, атом углерода которого атакуется другой
молекулой или частицей, а сам этот атом углерода называется
реакционным центром;
-реагент – молекула или частица, которая атакует атом
- углерода в субстрате.
CH3-CH3
субстрат
hv
+ Br 2
реагент
+ CH3-Cl
субстрат
AlCl3
CH3-CH2-Br
+ HCl
CH3 + HCl
реагент
Реагентом в реакции двух органических молекул
будет то вещество, у которого связь боле полярна.
11. Типы реагентов
Радикальные – свободные атомыили частицы с неспаренным электроном.
Электрофильные – частицы, которые принимают
электронную пару (любят электроны).
Нуклеофильные – реагенты, которые
отдают электронную пару (любят ядро).
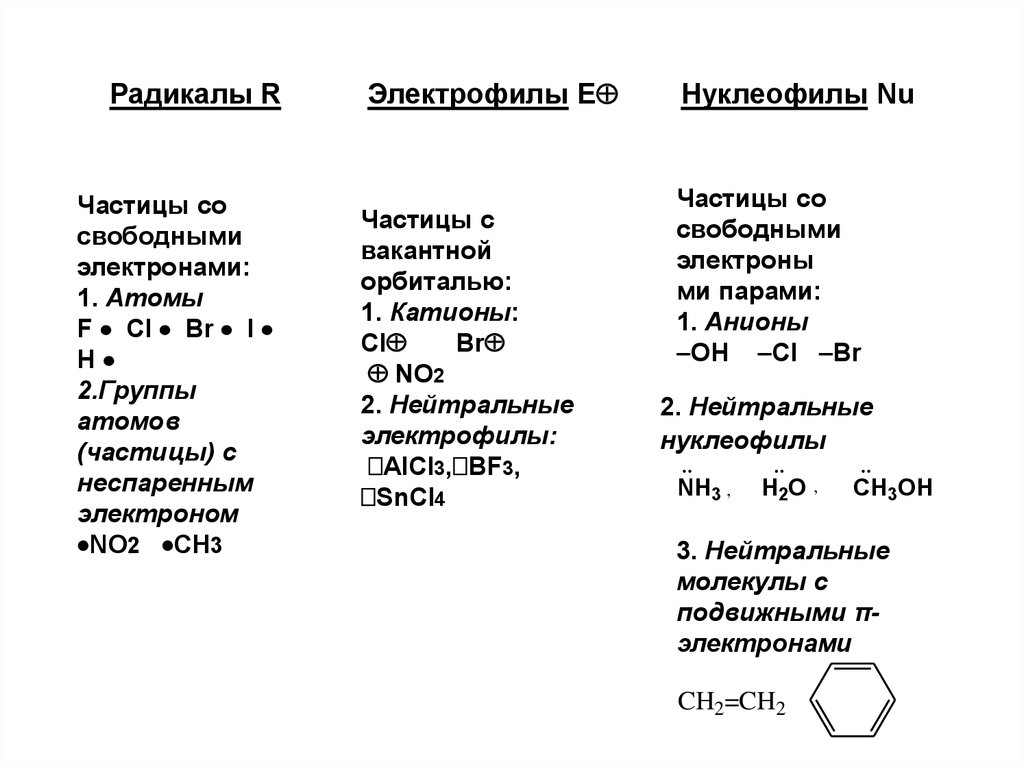
12. Радикалы R Электрофилы Е Нуклеофилы Nu
Радикалы RЧастицы со
свободными
электронами:
1. Атомы
F Cl Br I
H
2.Группы
атомов
(частицы) с
неспаренным
электроном
NO2 CH3
Электрофилы Е
Частицы с
вакантной
орбиталью:
1. Катионы:
Cl
Br
NO2
2. Нейтральные
электрофилы:
AlCl3, BF3,
SnCl4
Нуклеофилы Nu
Частицы со
свободными
электроны
ми парами:
1. Анионы
OH Cl Br
2. Нейтральные
нуклеофилы
NH3 ,
H2O ,
CH3OH
3. Нейтральные
молекулы с
подвижными πэлектронами
CH2=CH2
13. Классификация органических реакций
• А). По способу разрыва иобразованию ковалентной связи в
субстрате:
а) радикальные: гомолитический
разрыв связей;
CH3 CH3
Br
Br
to
hv
CH3
Br
CH3
Br
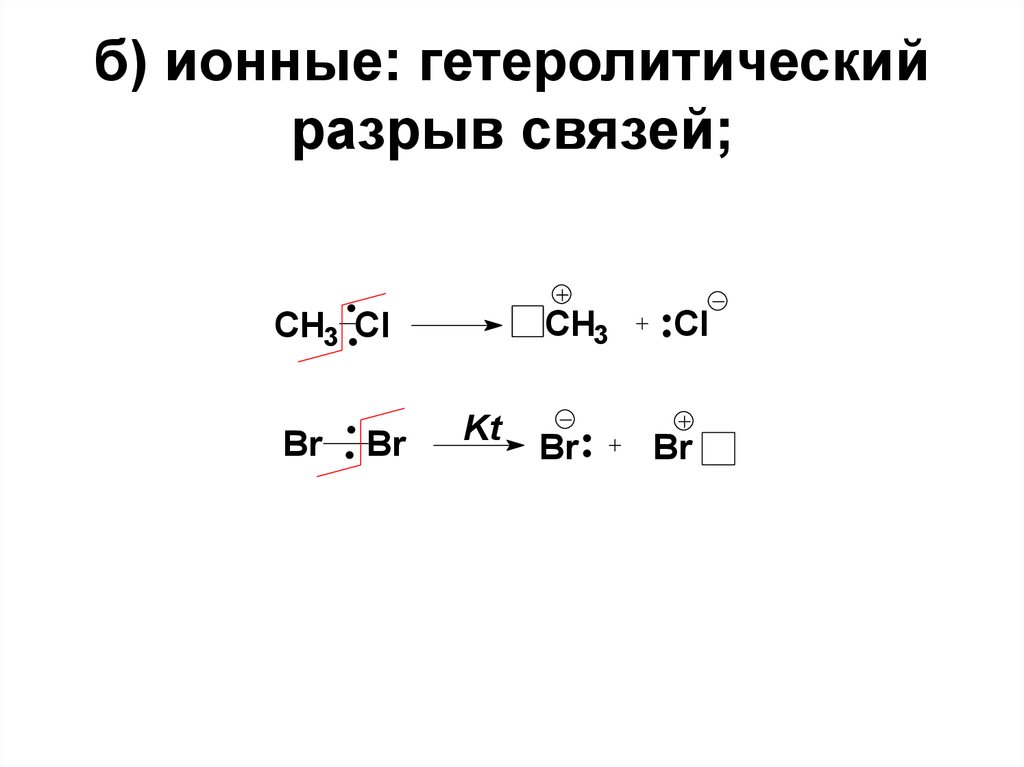
14. б) ионные: гетеролитический разрыв связей;
CH3CH3 Cl
Br
Br
Kt
Br
Cl
Br
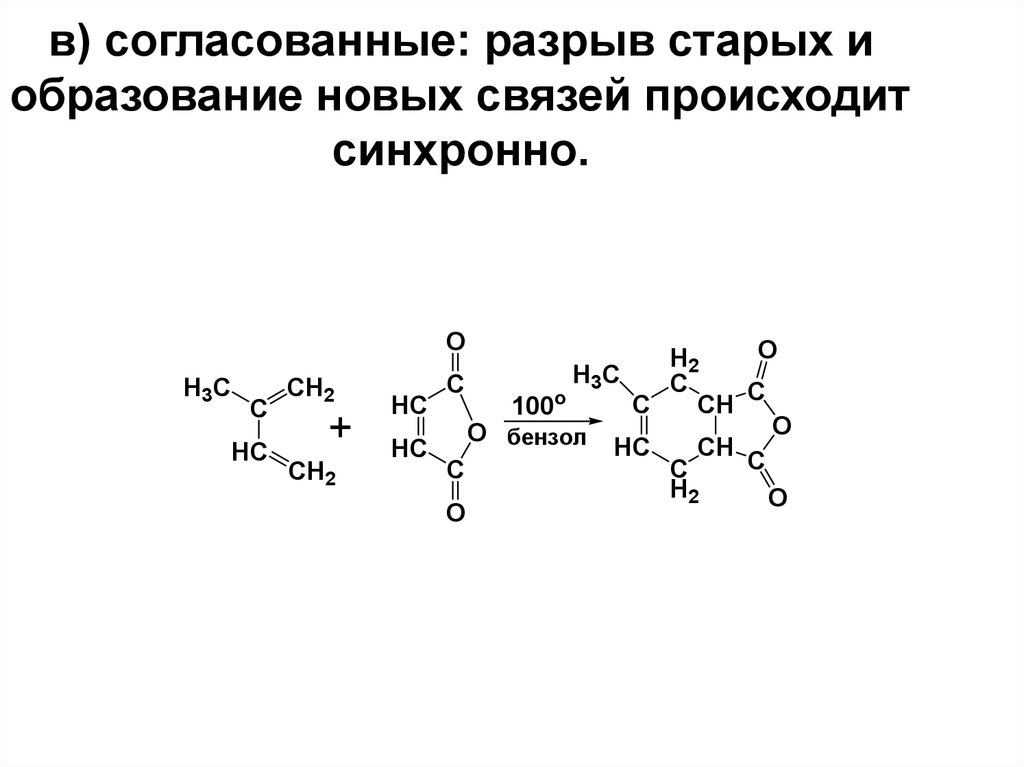
15. в) согласованные: разрыв старых и образование новых связей происходит синхронно.
OH3C
C
HC
CH2
+
CH2
O
H2
H3C
C
C
C
C
CH
HC
100o
O
O бензол
HC
CH
HC
C
C
C
H2
O
O
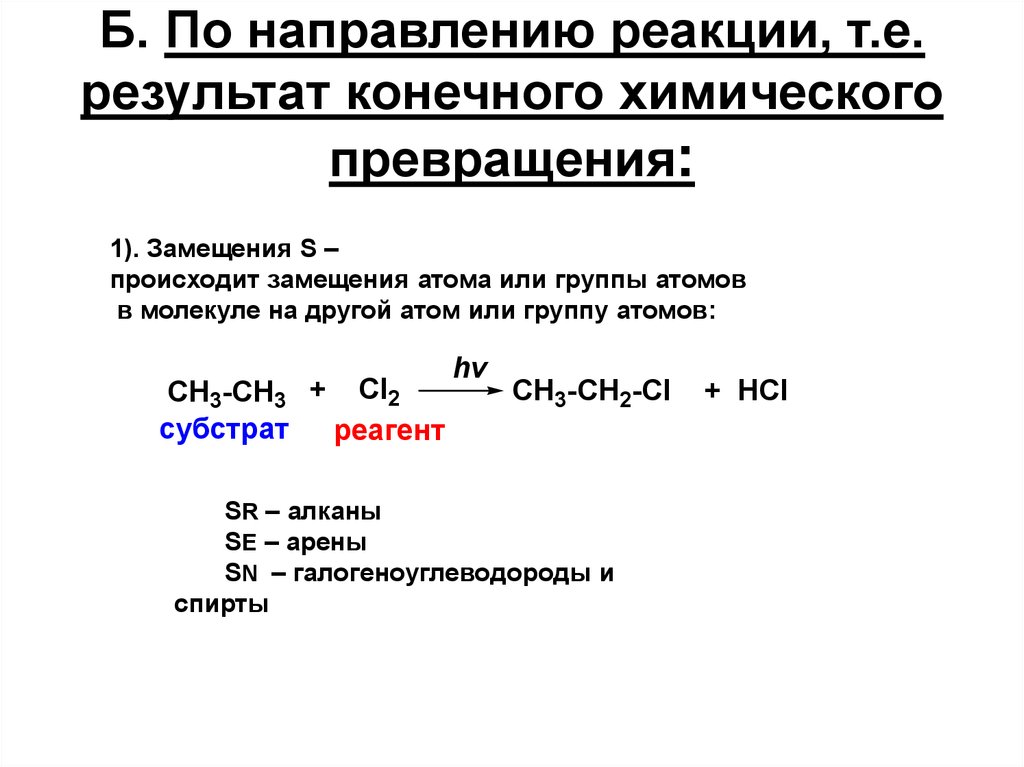
16. Б. По направлению реакции, т.е. результат конечного химического превращения:
1). Замещения S –происходит замещения атома или группы атомов
в молекуле на другой атом или группу атомов:
CH3-CH3 + Cl2
субстрат реагент
hv
CH3-CH2-Cl
SR – алканы
SE – арены
SN – галогеноуглеводороды и
спирты
+ HCl
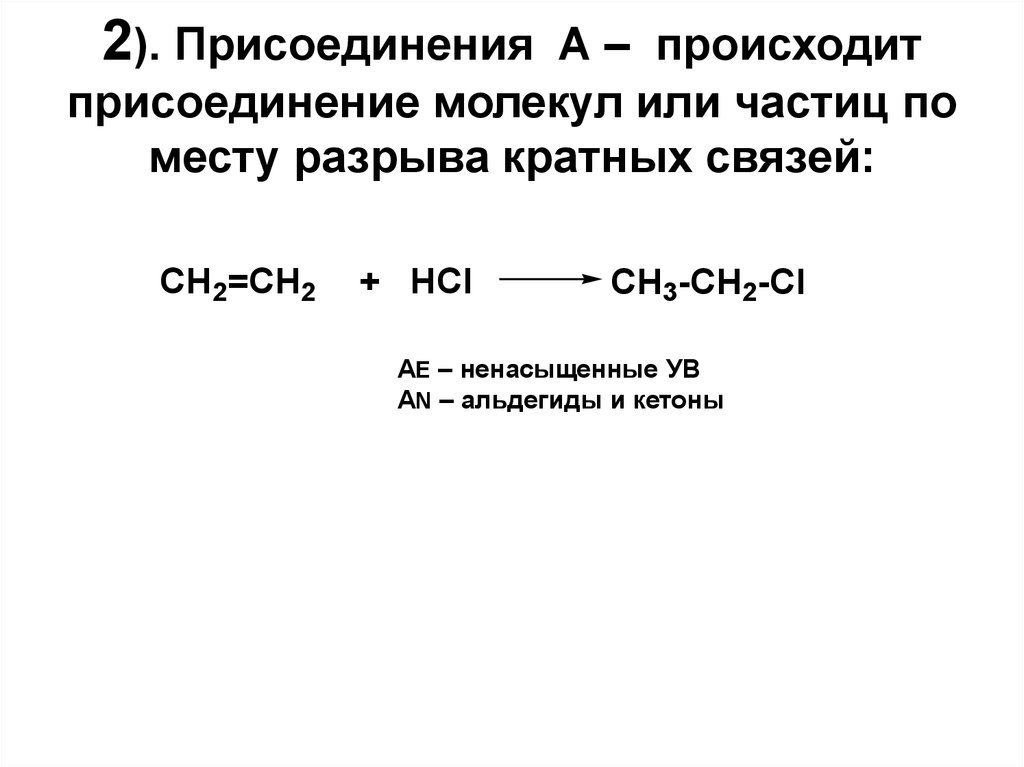
17. 2). Присоединения А – происходит присоединение молекул или частиц по месту разрыва кратных связей:
CH2=CH2+ HCl
CH3-CH2-Cl
АЕ – ненасыщенные УВ
АN – альдегиды и кетоны
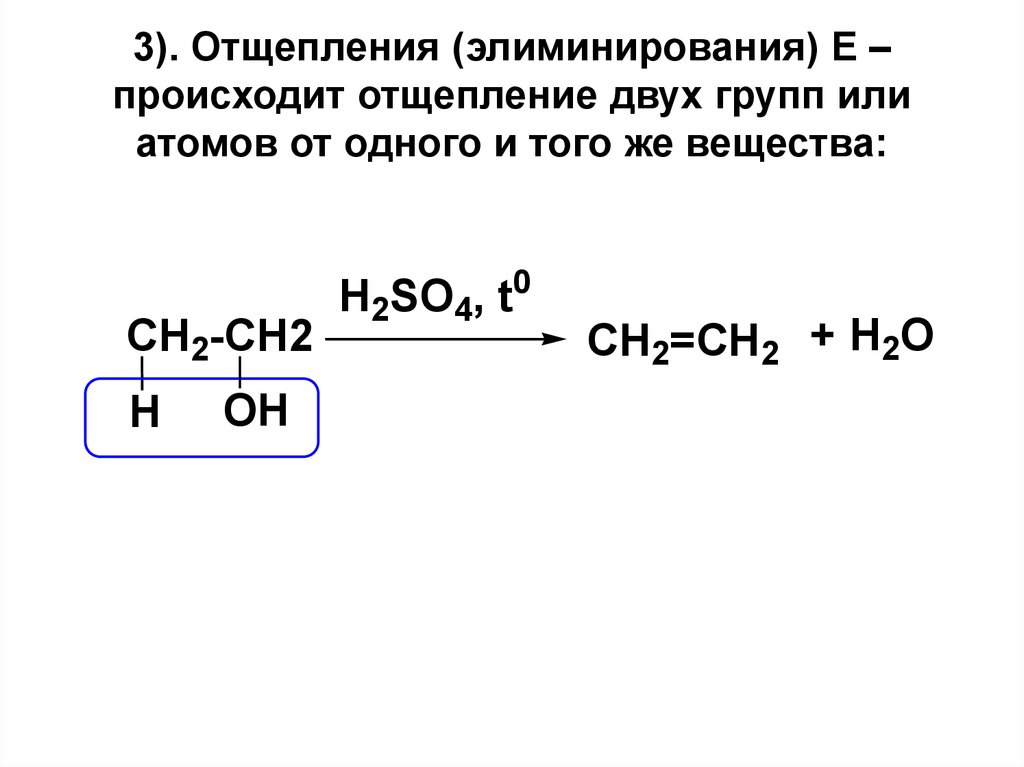
18. 3). Отщепления (элиминирования) Е – происходит отщепление двух групп или атомов от одного и того же вещества:
CH2-CH2H
OH
H2SO4, t0
CH2=CH2 + H2O
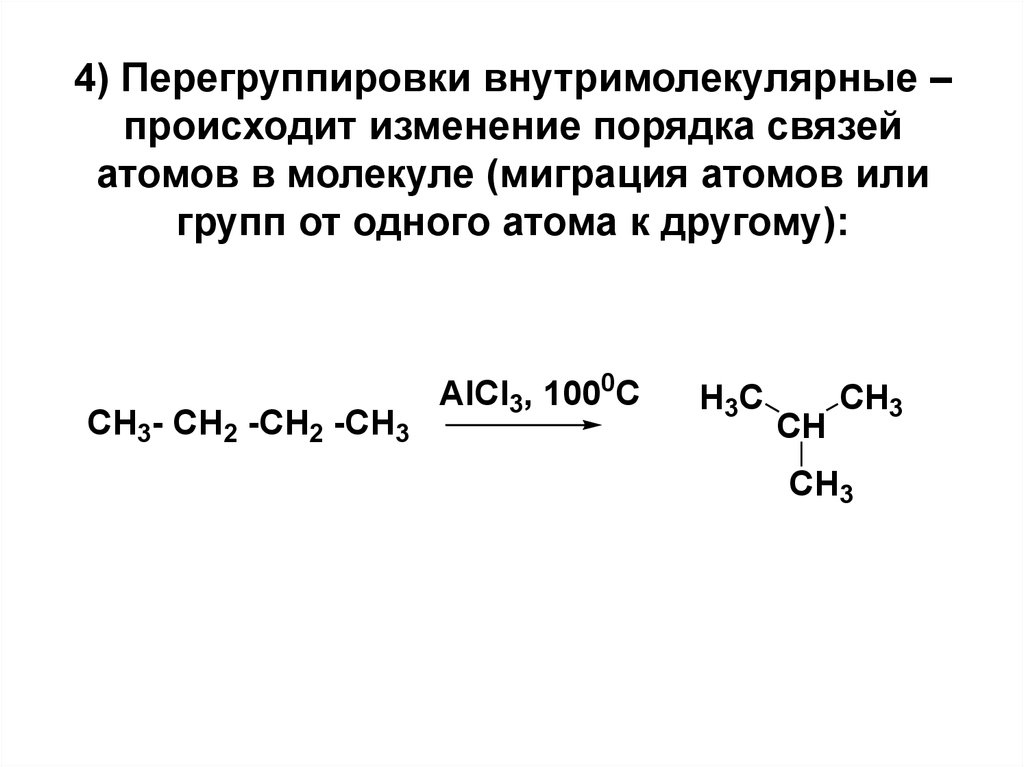
19. 4) Перегруппировки внутримолекулярные – происходит изменение порядка связей атомов в молекуле (миграция атомов или групп от одного атома
4) Перегруппировки внутримолекулярные –происходит изменение порядка связей
атомов в молекуле (миграция атомов или
групп от одного атома к другому):
CH3- CH2 -CH2 -CH3
AlCl3, 1000C
H3C
CH
CH3
CH3
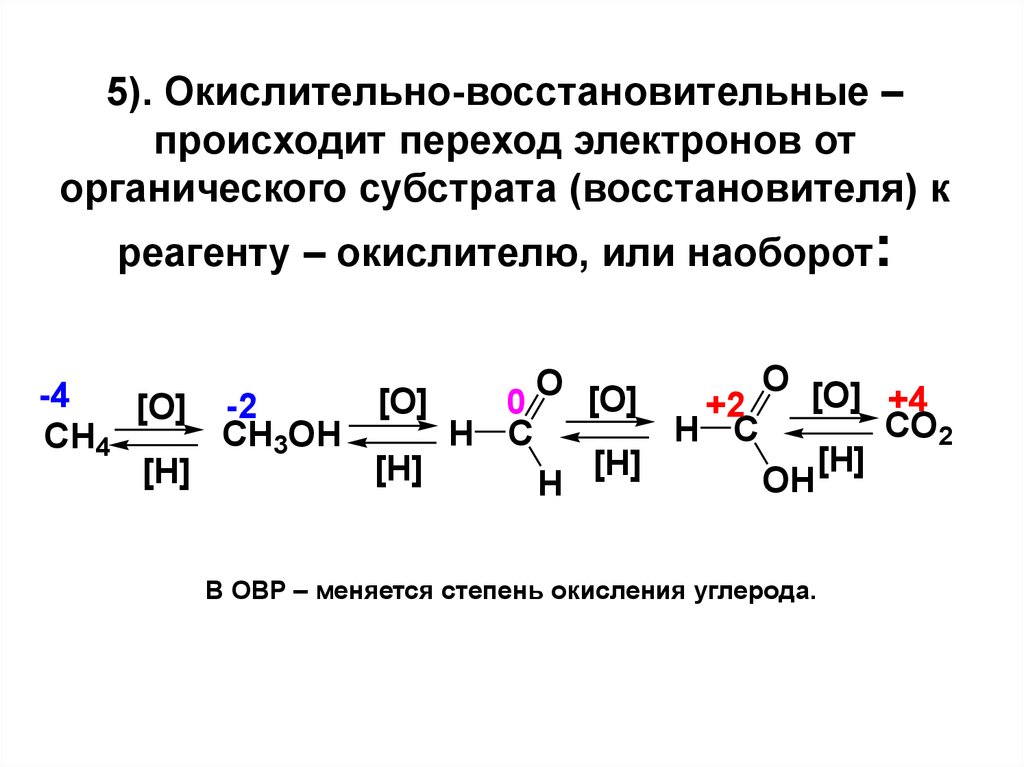
20. 5). Окислительно-восстановительные – происходит переход электронов от органического субстрата (восстановителя) к реагенту – окислителю, и
5). Окислительно-восстановительные –происходит переход электронов от
органического субстрата (восстановителя) к
реагенту – окислителю, или наоборот:
O [O]
O [O]
-4
+4
[O]
0
+2
[O] -2
CO2
H C
H C
CH3OH
CH4
[H]
[H]
[H]
[H]
OH
H
В ОВР – меняется степень окисления углерода.
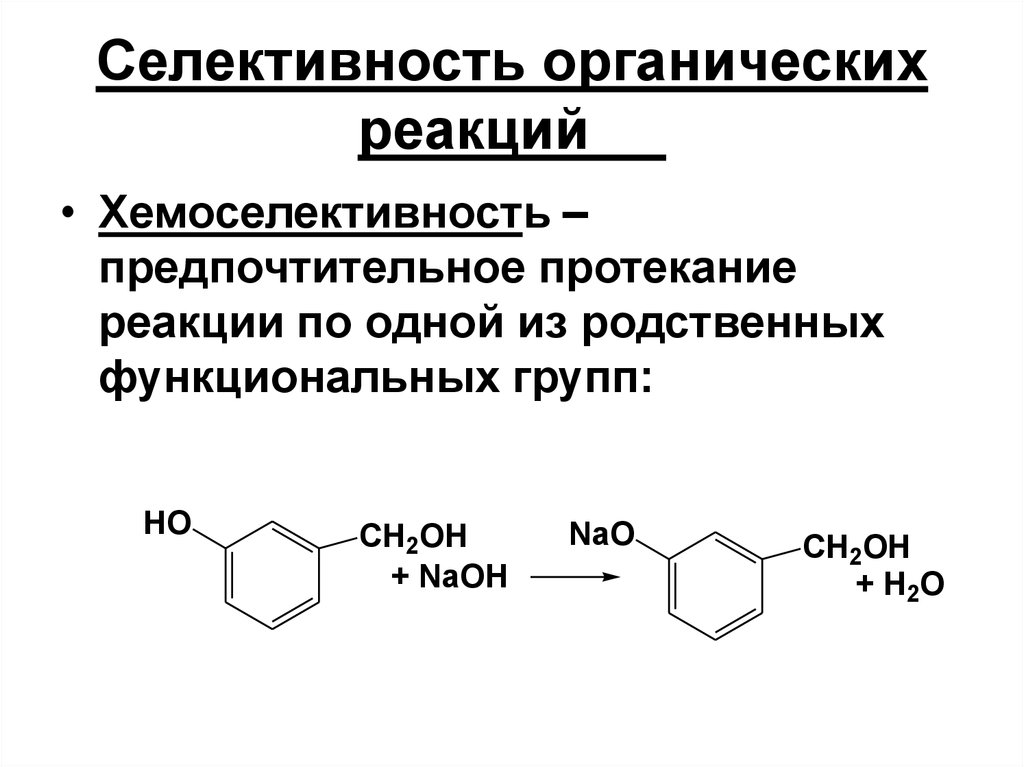
21. Селективность органических реакций
• Хемоселективность –предпочтительное протекание
реакции по одной из родственных
функциональных групп:
HO
CH2OH
+ NaOH
NaO
CH2OH
+ H2O
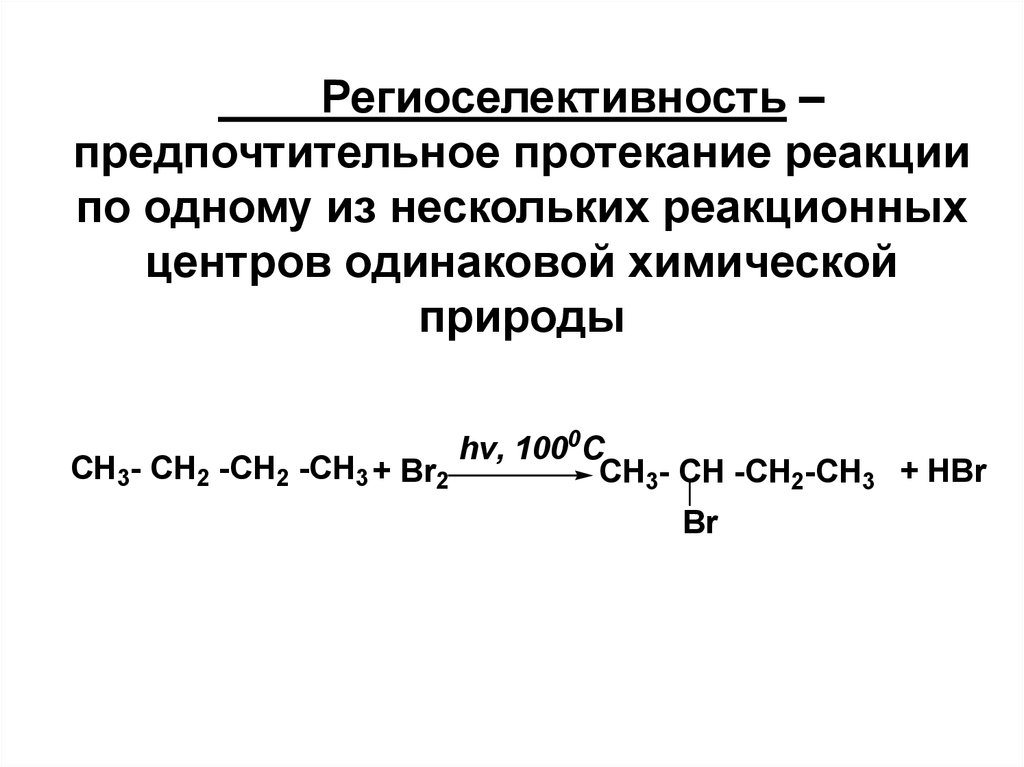
22. Региоселективность – предпочтительное протекание реакции по одному из нескольких реакционных центров одинаковой химической природы
hv, 1000CCH3- CH2 -CH2 -CH3 + Br2
CH3- CH -CH2-CH3 + HBr
Br
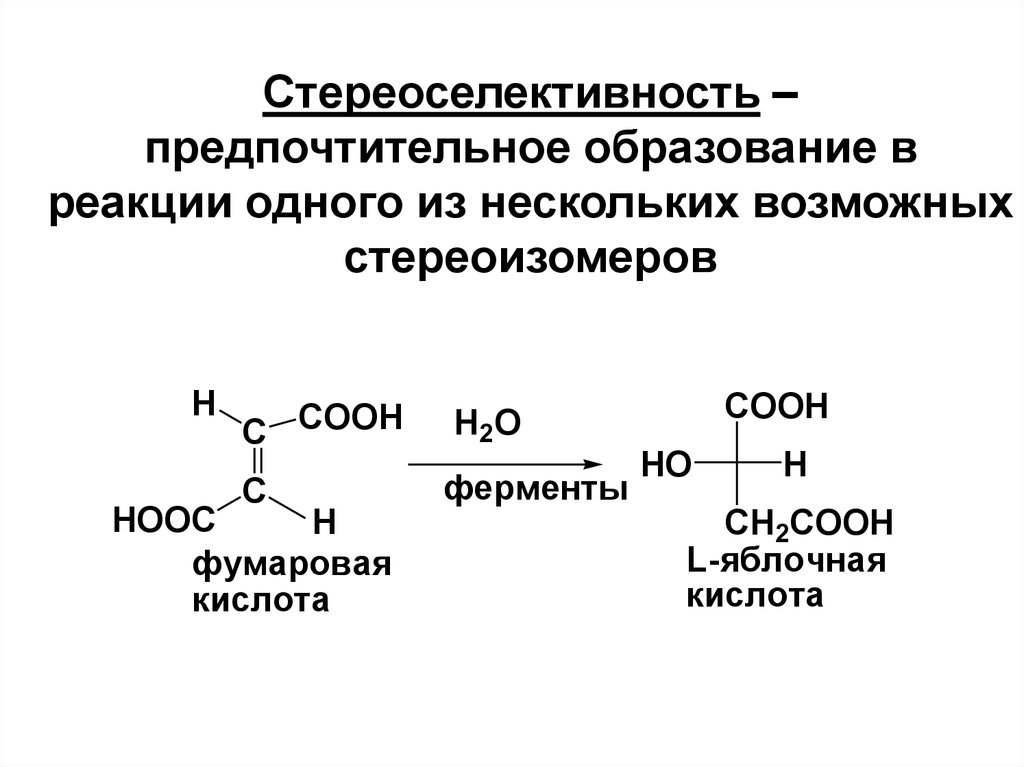
23. Стереоселективность – предпочтительное образование в реакции одного из нескольких возможных стереоизомеров
HC COOH
C
HOOC
H
фумаровая
кислота
H2O
ферменты
COOH
HO
H
CH2COOH
L-яблочная
кислота
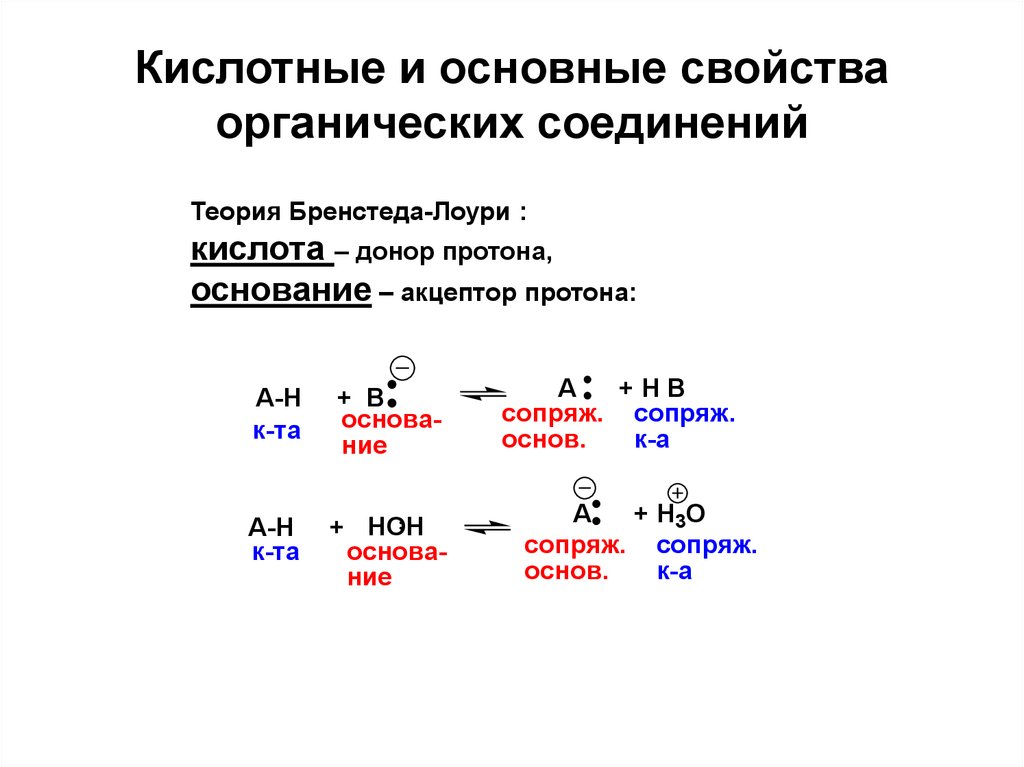
24. Кислотные и основные свойства органических соединений
Теория Бренстеда-Лоури :кислота – донор протона,
основание – акцептор протона:
A-H
к-та
+ B
основание
A-H
к-та
+ HOH
основание
A
+HB
сопряж. сопряж.
основ.
к-а
A
+ H3O
сопряж. сопряж.
основ.
к-а
25. Ка –характеризует силу кислоты. Показатель кислотности рКа = – lg Ka.
Ka =[A] [H3O]
[A-H][HOH]
Чем меньше показатель кислотности, тем сильнее
кислота.
Кислота
рКа
Неорганические кислоты
2
Органические кислоты
3,7
5,0
Угольная кислота Н2СО3
6,4
Фенолы
8 – 11
Спирты
16 – 18
–
26.
CH3COOH + H2OCH3COO + H3O
Вода более сильная кислота, чем спирты.
CH3OH + H2O
CH3O + H3O
В зависимости от природы элемента,
с которым связан протон, кислоты Бренстеда-Лоури делятся на :
ОН – кислоты (карбоновые кислоты, фенолы, спирты);
SН – кислоты – тиолы;
NН – кислоты: амины, амиды, имины;
СН – кислоты: УВ и их производные
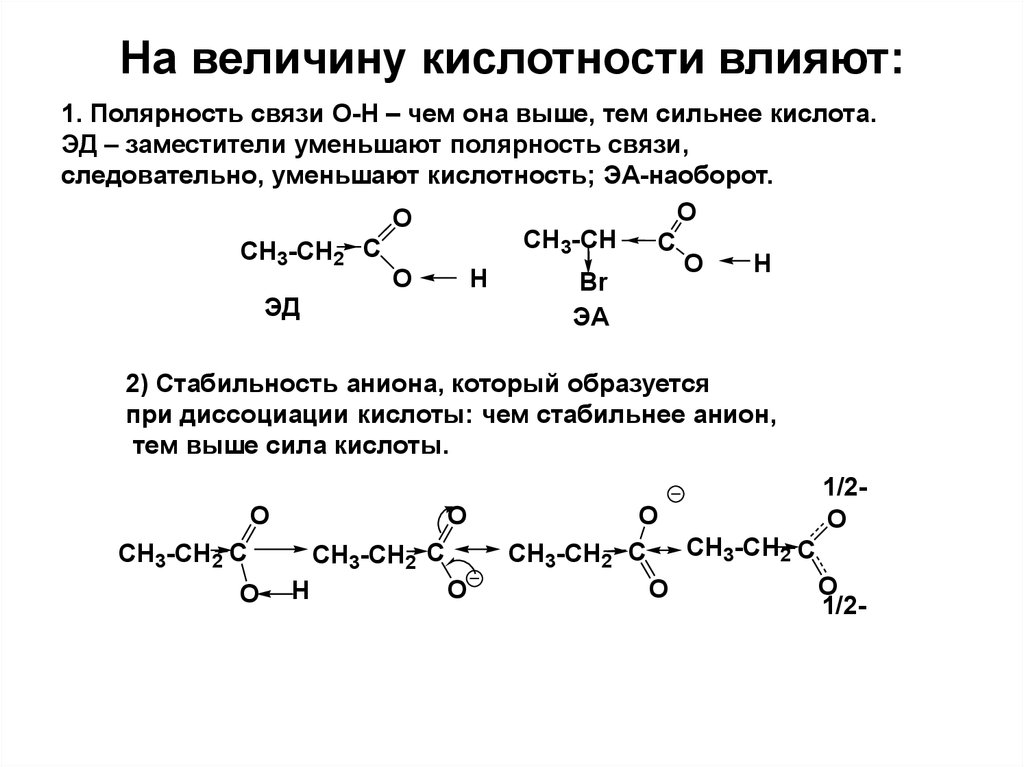
27. На величину кислотности влияют:
1. Полярность связи О-Н – чем она выше, тем сильнее кислота.ЭД – заместители уменьшают полярность связи,
следовательно, уменьшают кислотность; ЭА-наоборот.
O
O
CH3-CH
C
CH3-CH2 C
O
H
O
H
Br
ЭД
ЭА
2) Стабильность аниона, который образуется
при диссоциации кислоты: чем стабильнее анион,
тем выше сила кислоты.
O
O
CH3-CH2 C
O
1/2O
CH3-CH2 C
H
CH3-CH2
O
O
CH3-CH2 C
C
O
O
1/2-
28.
3) Тип гибридизации атома углерода: С-Н кислота:ЭО sp3 ЭО sp2 ЭО sp
Чем выше ЭО атома углерода, тем сильнее кислота.
Н–СН3 СН2=СН–Н НС С–Н
CH3C
C-H + NaNH2
CH3C
C-Na +NH3
4) Влияние растворителя:
сольватированный растворителем анион будет более стабильным,
следовательно сила кислоты будет выше.
29. Основания Бренстеда-Лоури:
• n– основания, которые содержат неподеленнуюпару электронов:
нейтральные
молекулы
анионы
HOH ROH ROR NH3 RNH2 ArNH2
OH
OR NH2
– основания: алкены, алкины, алкадиены,
арены.
Для оценки силы основания используют показатель
основности его сопряженной кислоты рКB = - lg КB:
Чем выше рКB , тем сильнее основание
30.
CH3NH2основание
Основание
рКB
HOH
- 1,7
ROH
-2
ArOH
-6
ROR
-3,5
NH3
9,2
RNH2
10,6
R2NH
10,7
R 3N
9,8
+ HOH
к-та
CH3NH3
Уравнение показывает, что аминосоединения
более сильные основания, чем вода.
+ OH
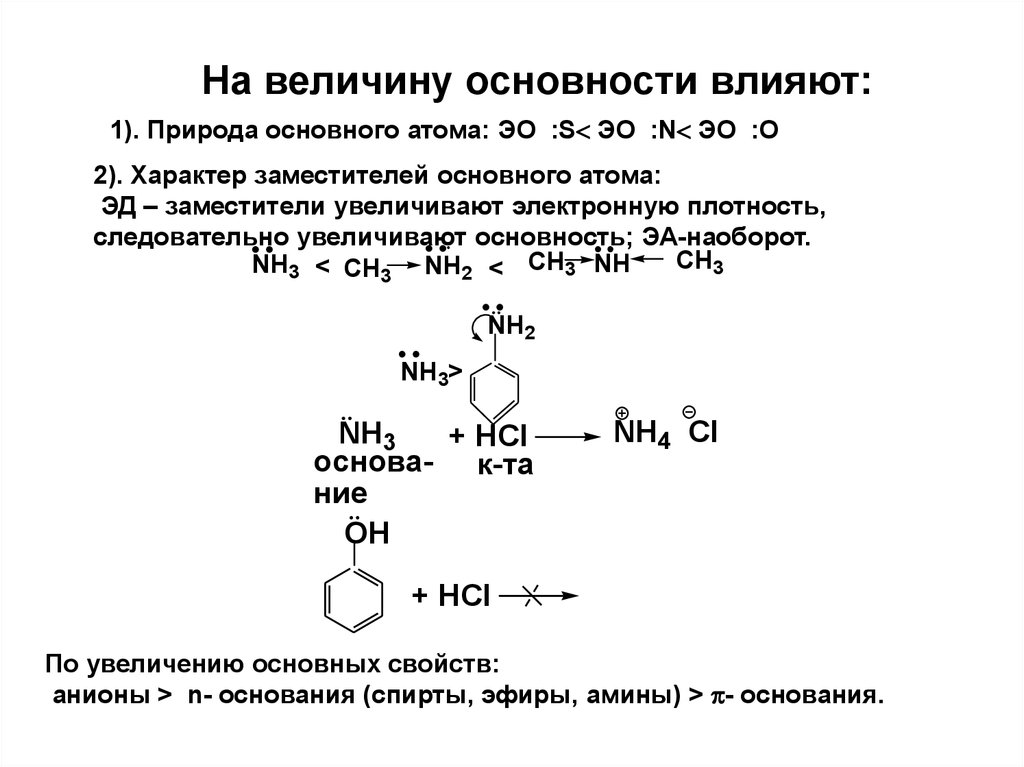
31. На величину основности влияют:
1). Природа основного атома: ЭО :S ЭО :N ЭО :O2). Характер заместителей основного атома:
ЭД – заместители увеличивают электронную плотность,
следовательно увеличивают основность; ЭА-наоборот.
CH3
NH3 < CH3 NH2 < CH3 NH
NH2
NH3>
NH3
+ HCl
основа- к-та
ние
OH
NH4 Cl
+ HCl
По увеличению основных свойств:
анионы > n- основания (спирты, эфиры, амины) > - основания.
32. Кислоты и основания Льюиса
Кислоты (электрофилы) – акцепторы парыэлектронов:
1). Галогениды элементов второй и третьей группы (вакантная
орбиталь):
BF3 AlCl3 FeCl3 ZnCl2
2). Катионы металлов, протон.
Основания Льюиса – доноры электронной
пары:
-анионы;
-молекулы с невалентными электронами;
-нейтральные молекулы с -электронами.
Теория Льюиса охватывает больший круг кислот и
оснований.















 Физика
Физика Химия
Химия








