Похожие презентации:
Лекция 4. Классификация и механизмы органических реакций
1. ЛЕКЦИЯ 4 Классификация и механизмы органических реакций
ЛЕКЦИЯ 4Классификация и
механизмы
органических реакций
2.
План4.1. Классификация органических
реакций
4.2. Классификация реагентов
4.3.Реакции
щения (SR)
радикального
заме-
4.4 Реакции электрофильного присоединения (АЕ)
3. 4.1 Классификация органических реакций
4.1 Классификацияорганических реакций
• по направлению
• по молекулярности
Реакции замещения S
Реакции присоединения A
Реакции элиминирования
E
Молекулярные
перегруппировки
Мономолекулярные
Бимолекулярные
Тримолекулярные
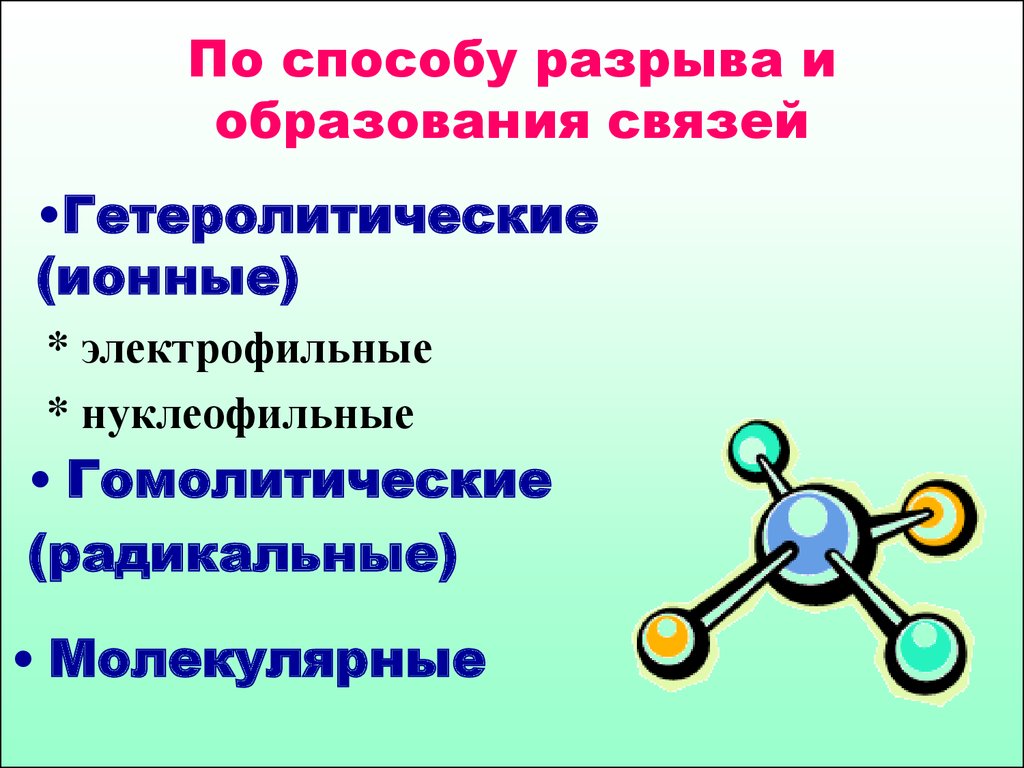
4. По способу разрыва и образования связей
•Гетеролитические(ионные)
* электрофильные
* нуклеофильные
• Гомолитические
(радикальные)
• Молекулярные
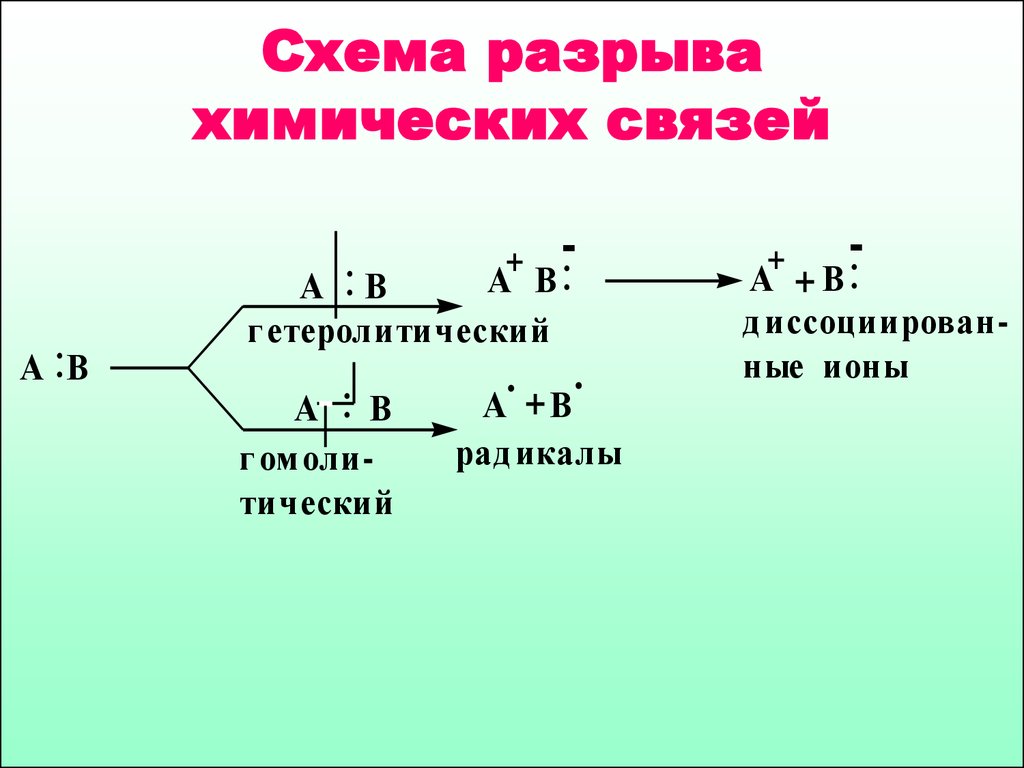
5. Схема разрыва химических связей
А :В+
В:
.
.
А
А :В
г етеролитический
А : В
г ом олитический
А +В
рад икалы
+
+ В:
А
д иссоциированные ионы
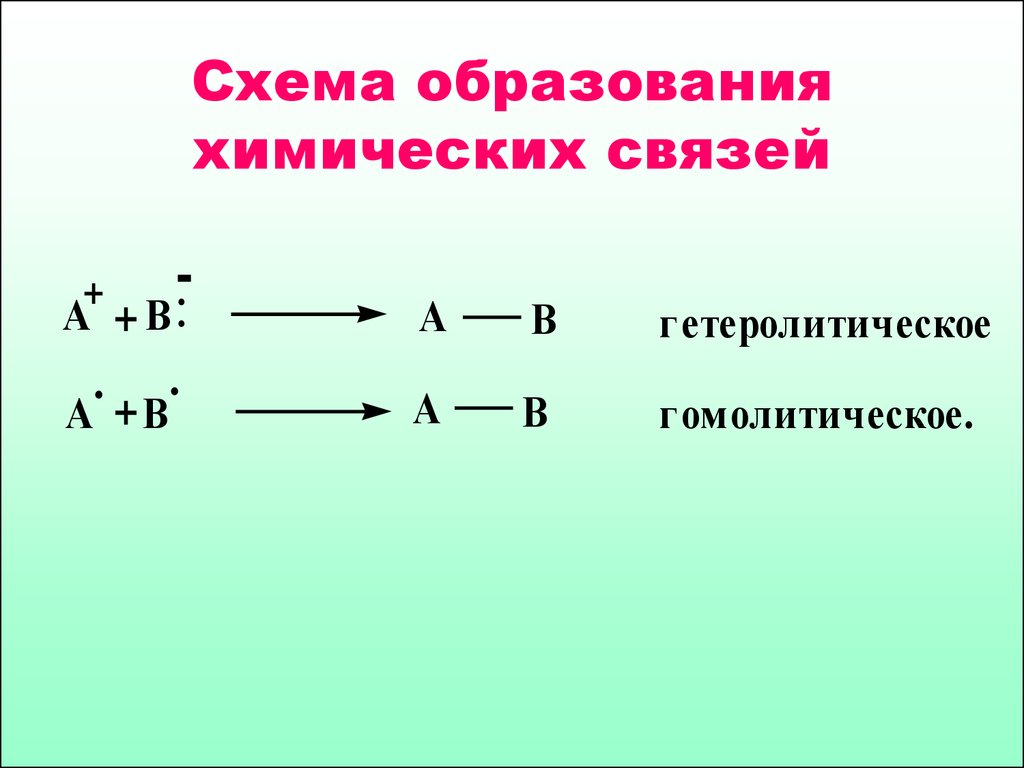
6. Схема образования химических связей
+А
.
+ В:
А +В
.
А
В
гетеролитическое
А
В
гомолитическое.
7.
Гетеролитические реакцииназывают ионными, поскольку
они сопровождаются
образованием органических
ионов, протекают в
органических растворителях
Гомолитические реакции
протекают преимущественно в
газовой фазе
8.
Гетеролитические реакции взависимости от электронной
природы атакующей частицы
делят на нуклеофильные (символ
N) и электрофильные (символ Е).
При этом условно принято считать
одну из взаимодействующих частиц
реагентом, а другую субстратом,
на которую действует реагент
9.
Субстрат – молекула, котораяпоставляет атом углерода для
образования новой связи
Тип реакции (нуклеофильный
или электрофильный) определяется характером реагента
10.
Реагент с неподеленнойэлектронной парой,
взаимодействующий с
субстратом, имеющим
недостаток электронов,
называют «нуклеофильным»
(любящим, ищущим ядро), а
реакции нуклеофильными
11.
Реагент с электронным дефицитом,взаимодействующий с
субстратом, обладающим избытком электронов,
называют
«электрофильным», а
реакцию электрофильной
12.
Нуклеофильные иэлектрофильные реакции всегда
связаны между собой
Реакции, сопровождающиеся
одновременным
(согласованным) разрывом и
образованием связей, называют
молекулярными (синхронными,
согласованными)
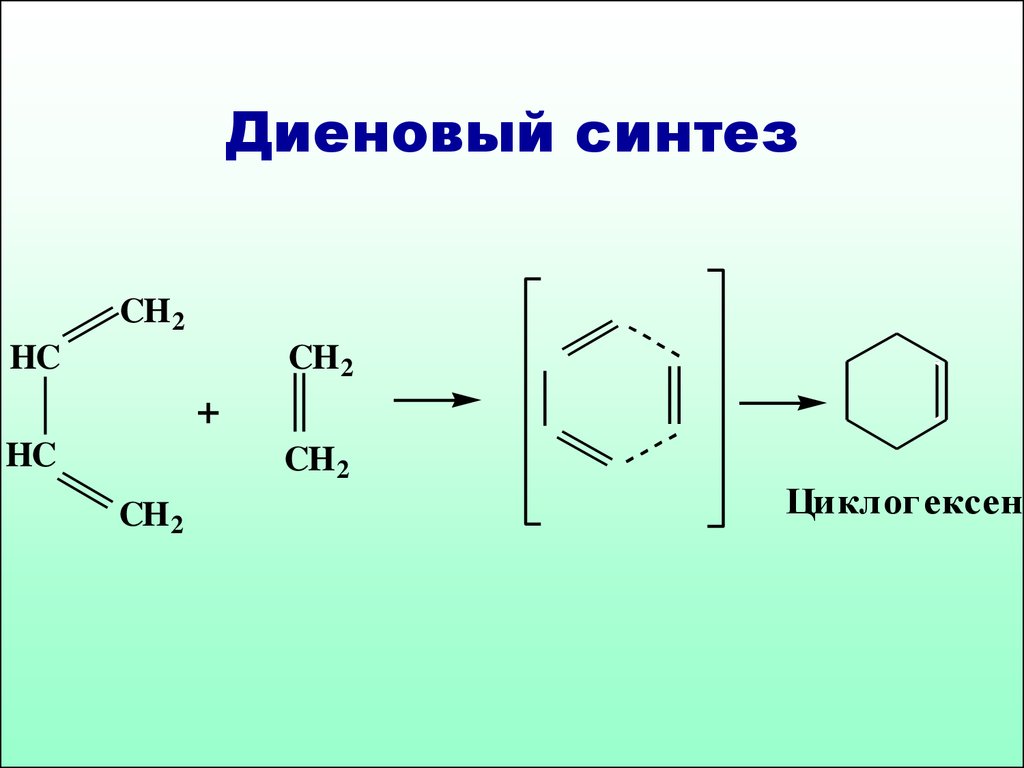
13. Диеновый синтез
CH 2HC
CH 2
+
HC
CH 2
CH 2
Циклог ексен
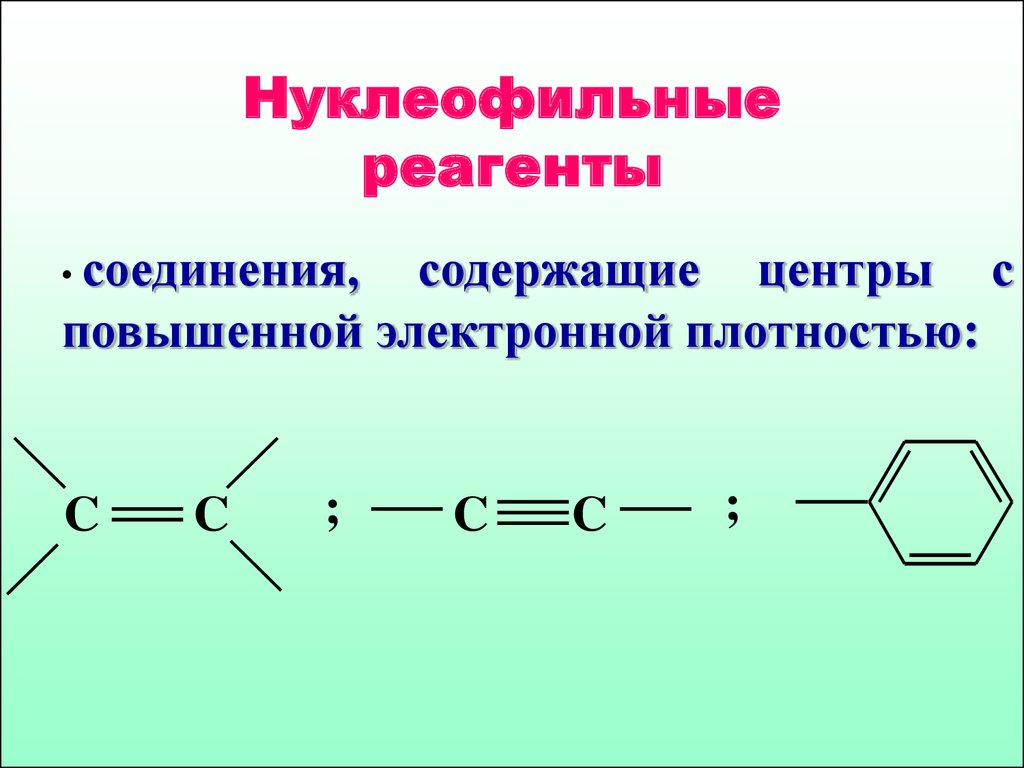
14. 4.2. Классификация реагентов
4.2. Классификация реагентовК нуклеофильным реагентам
относят молекулы, содержащие
одну или более неподеленных
пар электронов; ионы, несущие
отрицательный заряд (анионы);
молекулы, имеющие центры с
повышенной плотностью
15. Нуклеофильные реагенты
• нейтральные молекулы,имеющие неподеленные пары
электронов:
..
..
..
..
NH3 ; R - NH2; R2 - NH; R3N;
..
H2O;
..
..
R - OH;
..
..
;
R-O
R
..
• анионы:
OH— ; CN—; NH2—; RCOO—; RS—; Cl—;
Br—; I—; HSO3—;
16. Нуклеофильные реагенты
• соединения,содержащие центры с
повышенной электронной плотностью:
C
C
;
C
C
;
17. Электрофильные реагенты
• нейтральные молекулы,имеющие вакантную орбиталь:
SO3, кислоты Льюиса (AlCl3,
SnCl4, FeBr3, BF3)
• катионы: протон (Н+), ионы
металлов (Меn+), SO3H+, NO2+, NO+
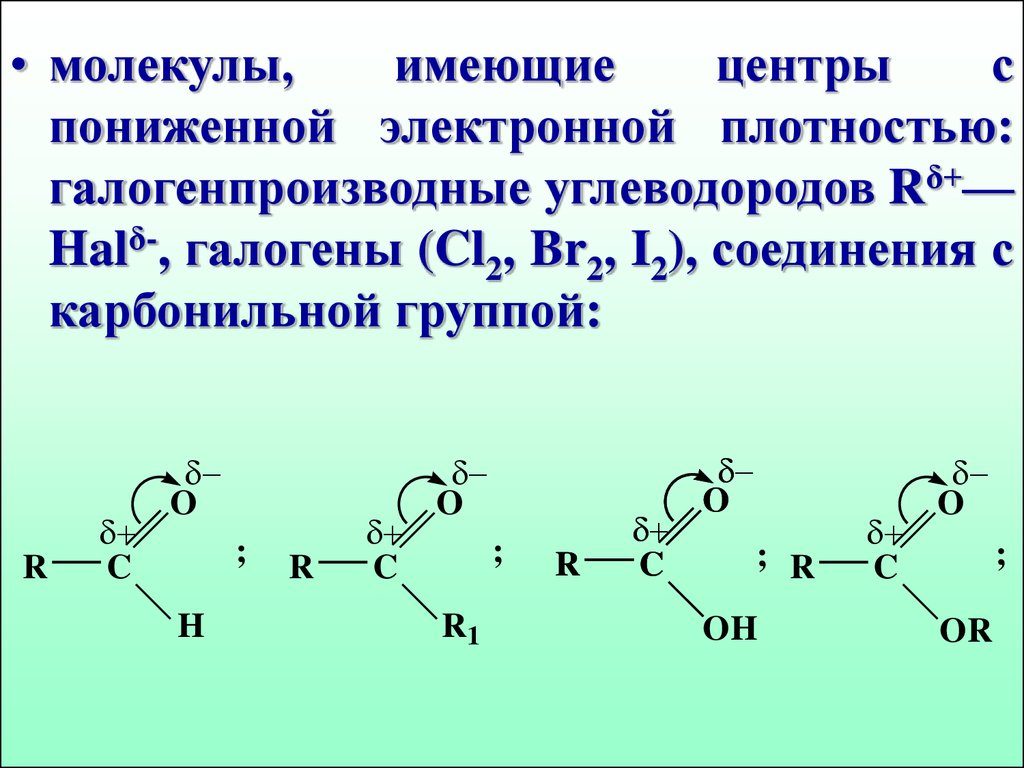
18.
• молекулы,имеющие
центры
с
пониженной электронной плотностью:
галогенпроизводные углеводородов Rδ+—
Halδ-, галогены (Cl2, Br2, I2), соединения с
карбонильной группой:
R
C
O
;
H
R
C
O
;
R1
R
C
O
; R
OH
C
O
;
OR
19.
В органической химии реакции,как правило протекают в
несколько стадий, т.е. с
образованием промежуточных,
короткоживущих частиц
(интермедиаты): карбкатионы,
карбанионы, радикалы
20.
Карбкатионы – положительнозаряженные частицы, атом
углерода, несущий положительный
заряд находится в sр2 –
гибридизации.
Атом углерода с приобретением
положительного заряда изменяет
свое валентное состояние от sр3 до
sр2, что энергетически более
выгодно.
21.
Важной характеристикойкарбкатионов является их
устойчивость, которая
определяется степенью
делокализации
положительного заряда
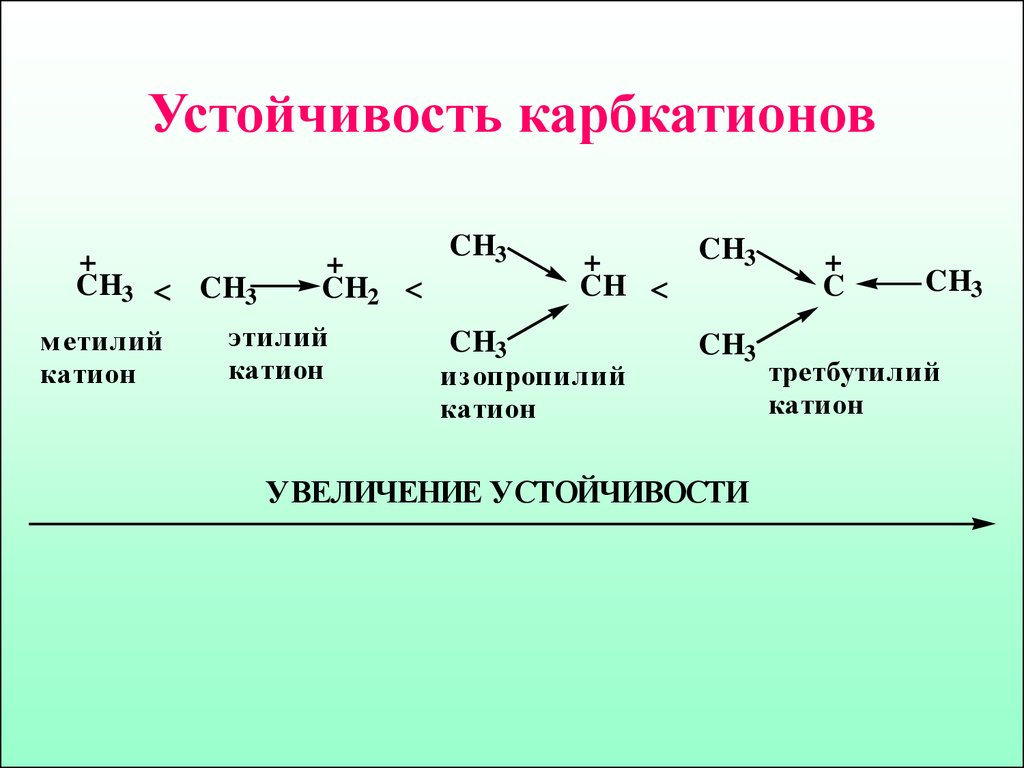
22.
Устойчивость карбкатионовпадает в ряду:
третичный
атом С
>
вторичный
атом С
>
первичный
атом С
23. Устойчивость карбкатионов
+CH3 CH3
м етилий
катион
+
CH2
этилий
катион
CH3
CH3
+
CH
изопропилий
катион
CH3
CH3
УВЕЛИЧЕНИЕ УСТОЙЧИВОСТИ
+
C
CH3
третбутилий
катион
24.
Карбанионы – отрицательнозаряженные частицы, заряд
которых обусловлен наличием в их
структуре атома С с неподеленной
электронной парой. При этом атом
углерода, несущий отрицательный
заряд, может быть как в sp2, так и
в sр3-гибридизации
25.
Устойчивость карбанионов зависит отстепени делокализации отрицательного
заряда на атоме углерода. Чем она
выше, тем выше их устойчивость и тем
ниже их реакционная способность.
Наиболее устойчивы циклические
карбанионы, в структуре которых
имеется общая π-электронная
плотность, включающая в себя
4n+2 π-электрона
26. циклопентадиенил анион
27.
Свободные радикалы – любаяэлектронейтральная активная
частица, содержащая
одноэлектронную орбиталь.
К свободным радикалам могут
быть отнесены частицы,
содержащие неспаренный электрон
не только на атоме углерода (С·), но
и на других атомах: R2N· ; RО·
28. 4.3. Реакции радикального замещения (SR)
4.3. Реакции радикальногозамещения (SR)
Реакции SR характерны для
соединений алифатического и
алициклического рядов. Как
правило, они протекают по
цепному механизму, основными
стадиями которого являются:
инициирование, развитие (рост
цепи) и обрыв цепи.
29.
На стадии инициированияобразуются свободные радикалы,
дающие начало цепному
процессу
Свободные радикалы могут
возникать за счет термического
или фотохимического
инициирования, а также в
результате ОВ реакций
30. Реакции радикального замещения (SR)
R-H + A-Aсубстрат
реаг ент
h
R-A + HA
прод укт
реакции
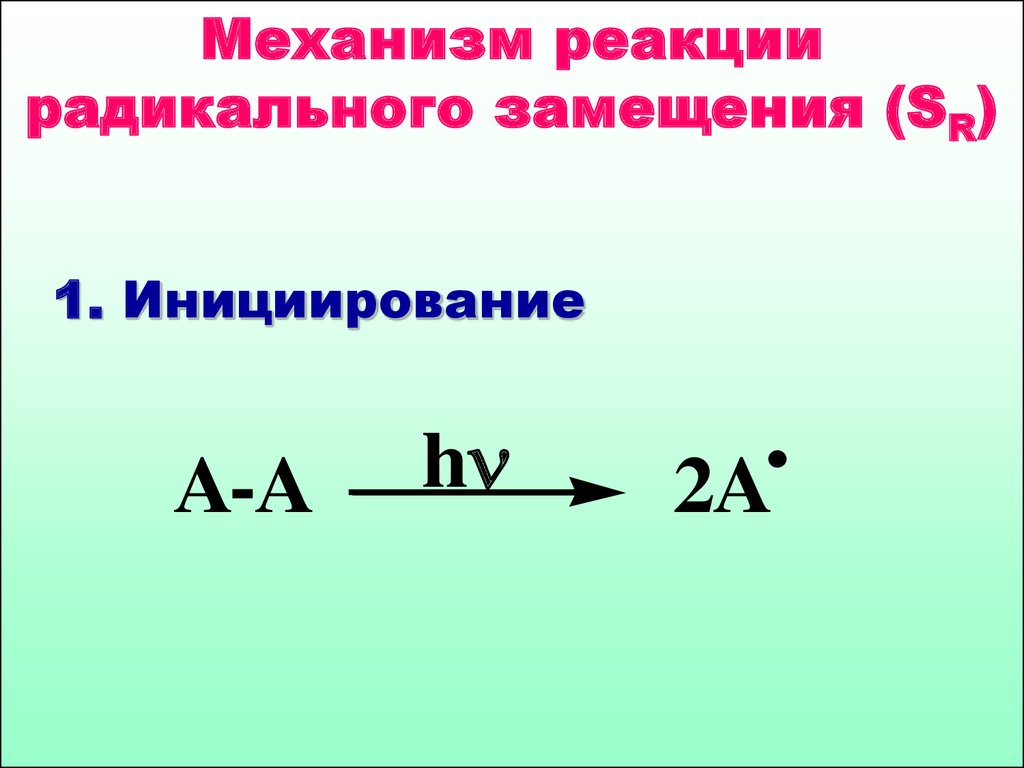
31.
Механизм реакциирадикального замещения (SR)
1. Инициирование
A-A
h
.
2A
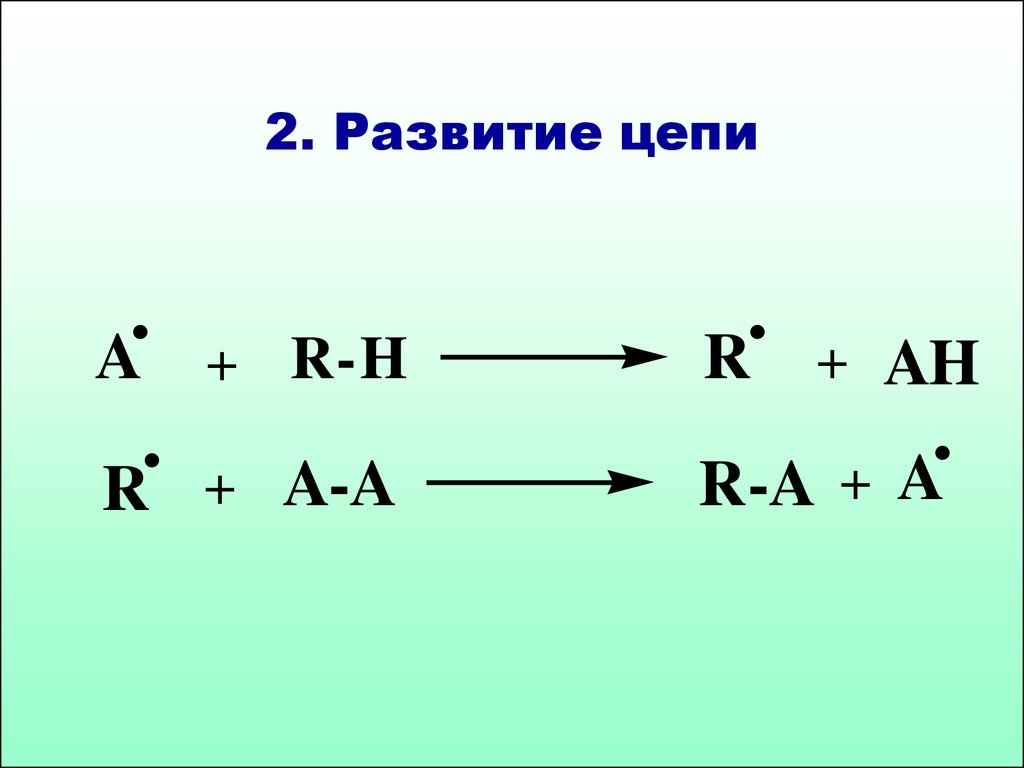
32. 2. Развитие цепи
.A
.
+ R-H
R + A-A
.
R
+ AH
R-A +
.
A
33.
3. Обрыв цепи.
R
.
A
.
A
+
.
R
R-R
+
.
R
R-A
+
.
A
A-A
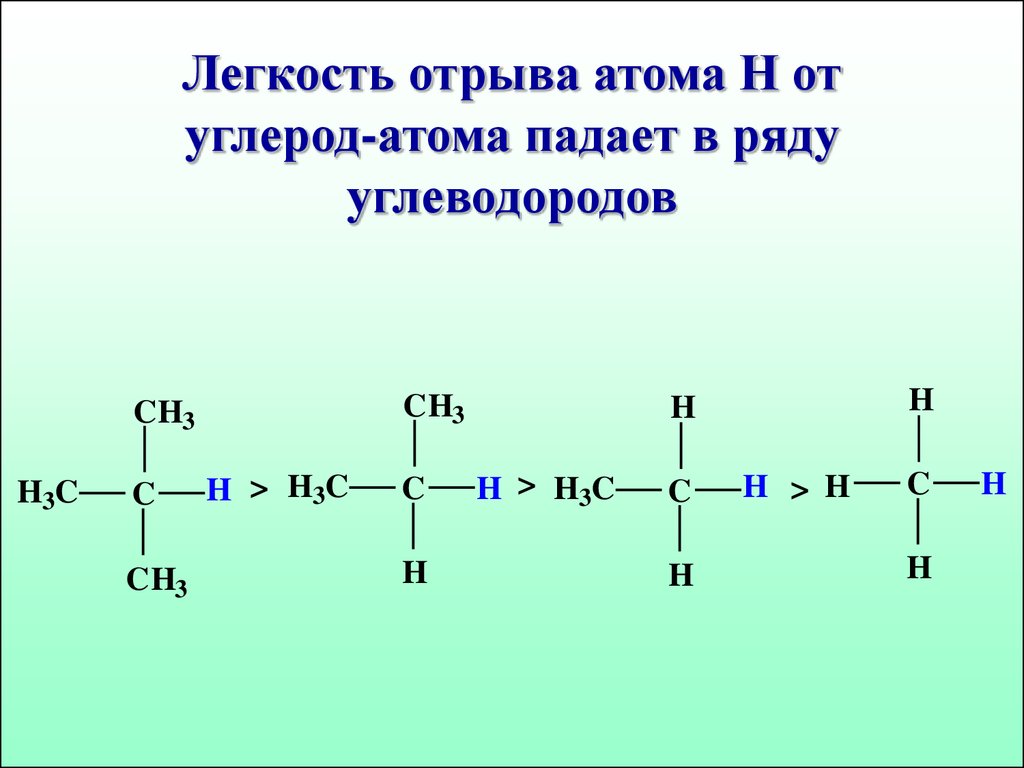
34. Легкость отрыва атома Н от углерод-атома падает в ряду углеводородов
CH3CH3
H3C
C
CH3
H > H3C
C
H
H
H
H > H3C
C
H
H > H
C
H
H
35.
Радикалы брома (Вr˙) обладаютвысокой избирательностью: если в
молекуле имеются вторичный, а
тем более третичный атом углерода,
то бромирование преимущественно
идет у третичного (вторичного)
атома углерода. Такие реакции
называются региоселективными
(избирательными по месту
действия) реакциями
36. Бромирование алканов (региоселективные реакции)
H3CCH
H
CH3 + Br2
h
H3C
CH
CH3 + HBr
Br
2-бромпропан
37.
Механизм реакциибромирования алканов
1. Инициирование
Br2
h
.
2Br
38.
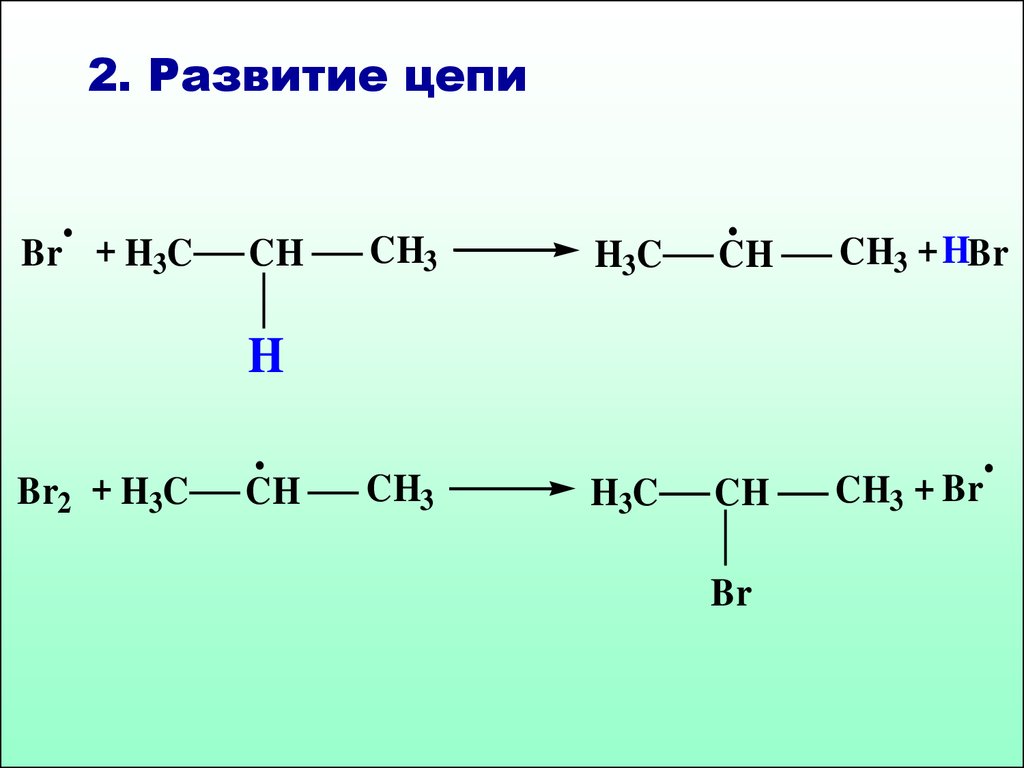
2. Развитие цепи.
Br + H3C
CH
CH3
H3C
.
CH
CH3 + HBr
H
Br2 + H3C
.
CH
CH3
H3C
CH
Br
.
CH3 + Br
39.
3. Обрыв цепи.
.
H3C
CH3 + Br
CH
H3C
CH
CH3
Br
.
Br
H3C
.
Br2
+ Br
.
.
CH + H3C
CH
CH3
CH3
H3C
CH
CH
CH3
CH3
2,3-д им етилбутан
CH3
40. 4.4. Реакции электрофильного присоединения
Электрофильное присоединение (АЕ)характерно для ненасыщенных систем,
содержащих двойные или тройные связи.
Нуклеофильный характер таких
соединений обусловлен наличием π-связи,
которая представляет собой область с
повышенной электронной плотностью,
обладает поляризуемостью и легко
разрывается под действием
электрофильных реагентов
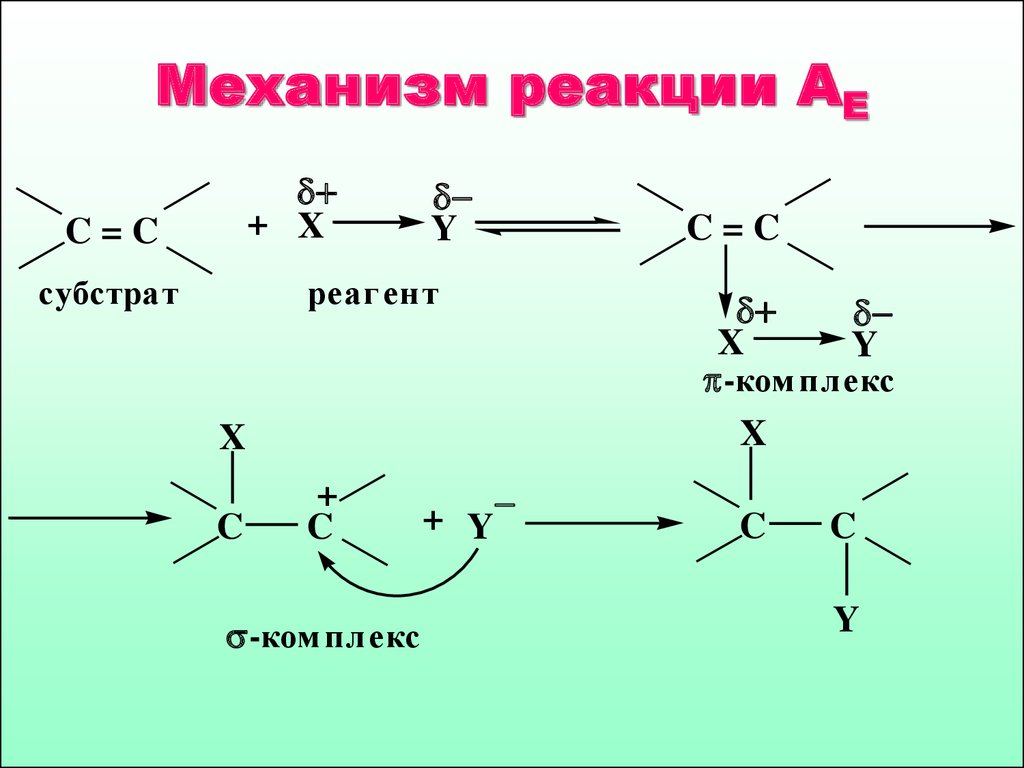
41. Механизм реакции АЕ
+ XC=C
субстрат
Y
реаг ент
X
C
+
C
-ком плекс
+ Y
C=C
X
Y
-ком плекс
X
C
C
Y
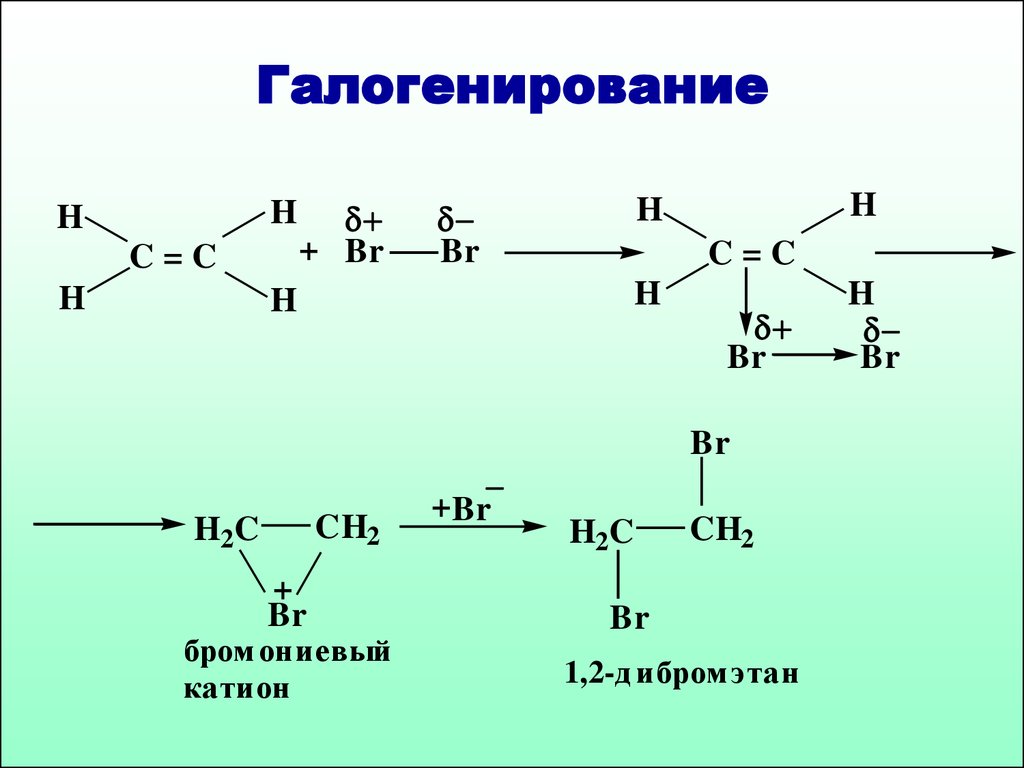
42. Галогенирование
HH
C=C
H
+ Br
Br
H
H
C=C
H
H
Br
Br
CH2
H2C
+
Br
бром ониевый
катион
+Br
H2C
CH2
Br
1,2-д ибром этан
H
Br
43.
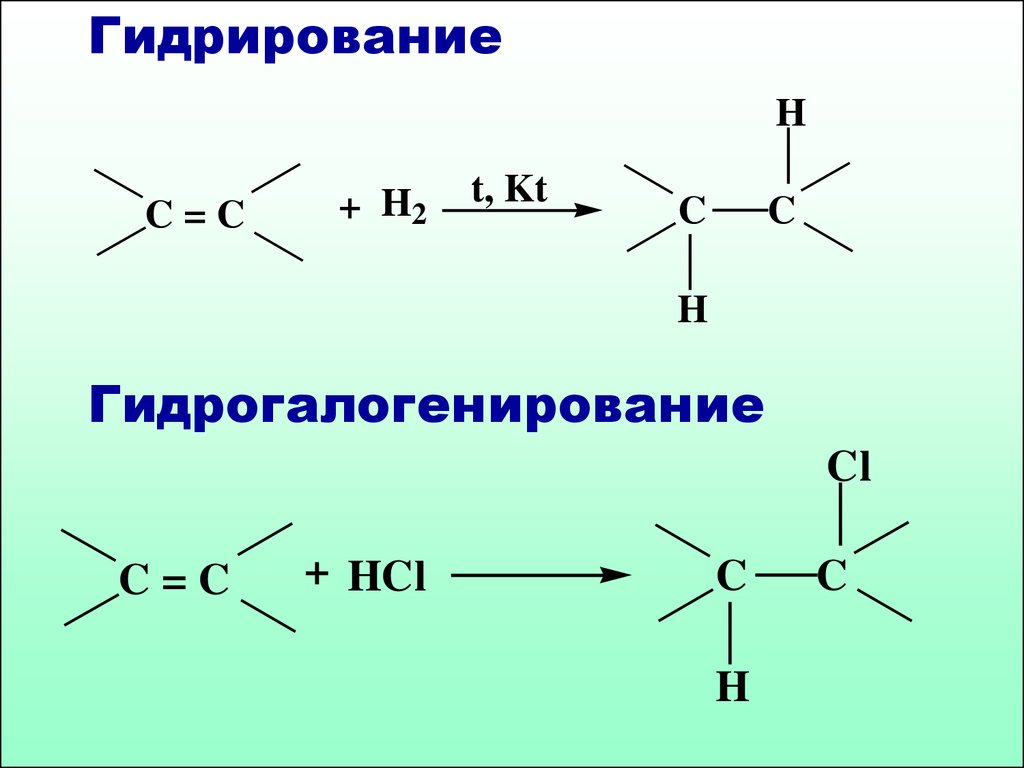
ГидрированиеH
C=C
+ H2
t, Kt
C
C
H
Гидрогалогенирование
Cl
C=C
+ HCl
C
H
C
44.
ГидратацияOH
C=C
+ HOH
H
+
C
H
C
45.
Правило Марковникова:при взаимодействии
реагентов типа НХ с
несимметричными
алкенами, водород
присоединяется к
наиболее
гидрогенизированному Владимир
Марковников
атому углерода
( 1837 – 1904)
46.
Гидрогалогенирование алкенов поправилу Морковникова
CH3 CH = CH2 + HCl
CH3
CH
Cl
2-хлорпропан
CH3
47.
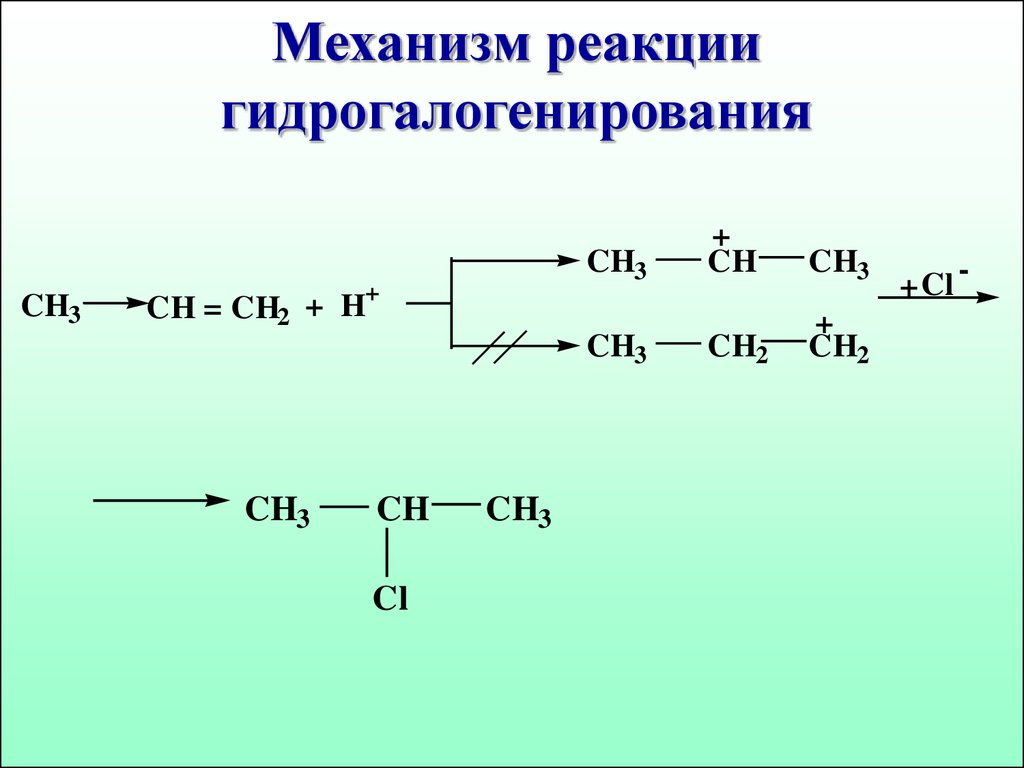
Механизм реакциигидрогалогенирования
CH3
CH3
+
+
CH
CH3
CH2
+
CH2
CH = CH2 + H
CH3
CH3
CH
Cl
CH3
+ Cl
-
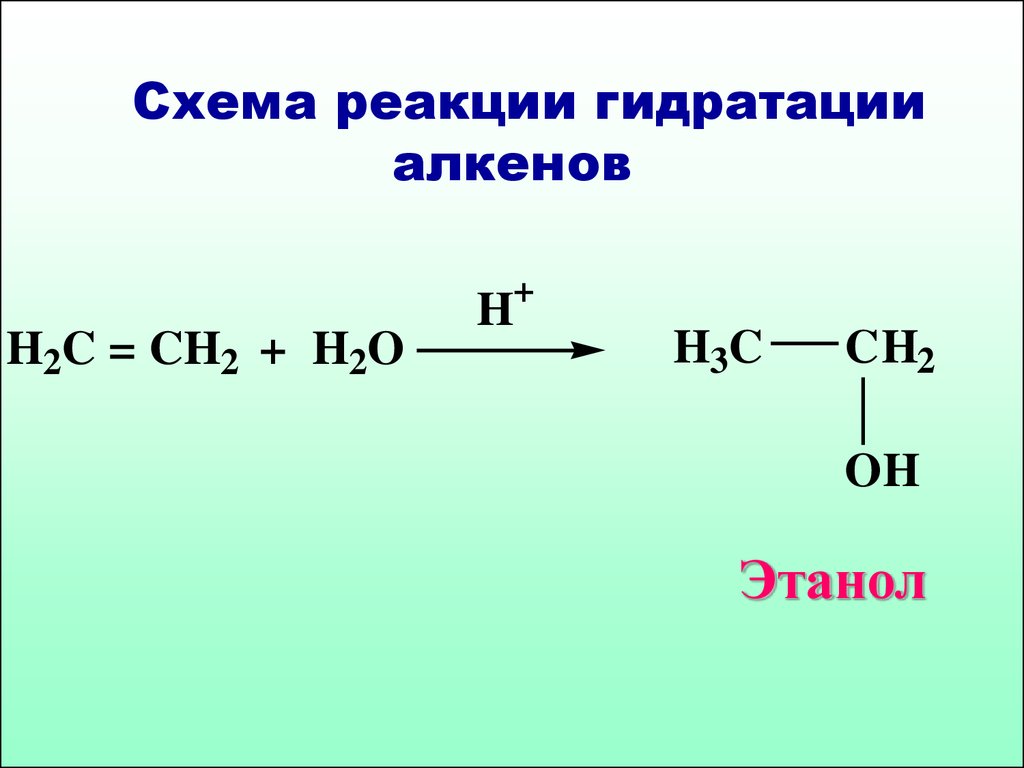
48. Схема реакции гидратации алкенов
Схема реакции гидратацииалкенов
+
H2C = CH2 + H2O
H
H3C
CH2
OH
Этанол
49.
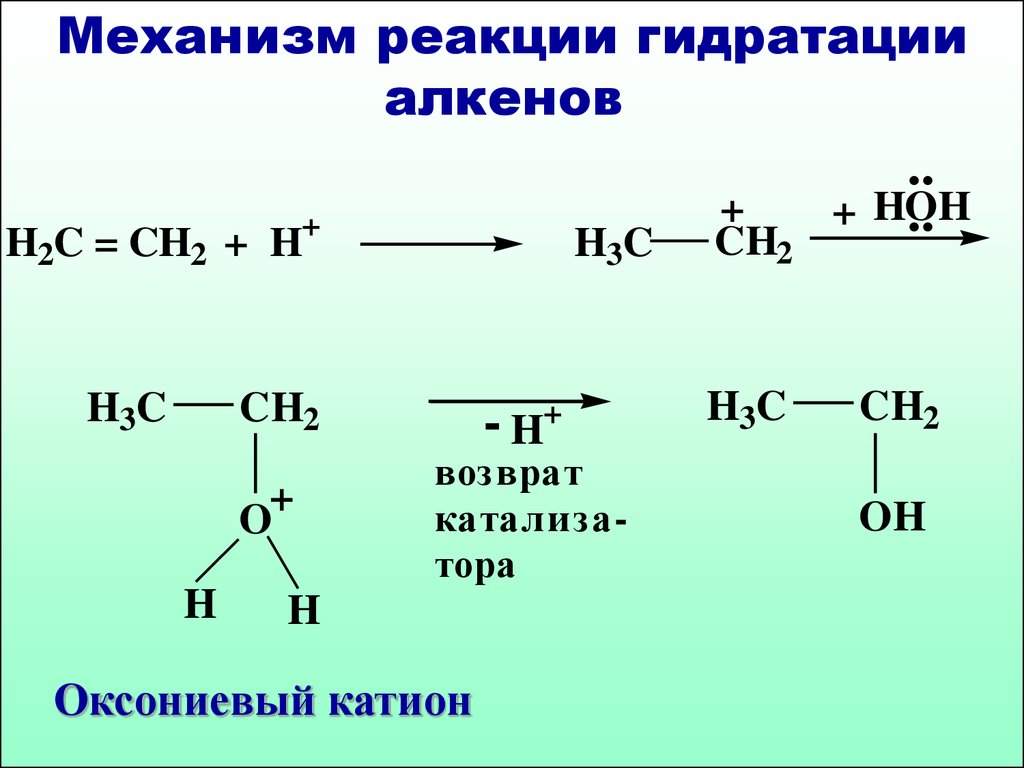
Механизм реакции гидратацииалкенов
..
+
+ HOH
..
+
H C = CH + H
H C CH
2
2
H3C
3
CH2
+
O
H
+
-H
возврат
катализатора
H
Оксониевый катион
2
H3C
CH2
OH
50.
Классическое правилоМарковникова идеально
применимо только к самим
алкенам, в случае их
производных необходимо
учитывать и механизм
реакции и устойчивость
образующихся интермедиатов
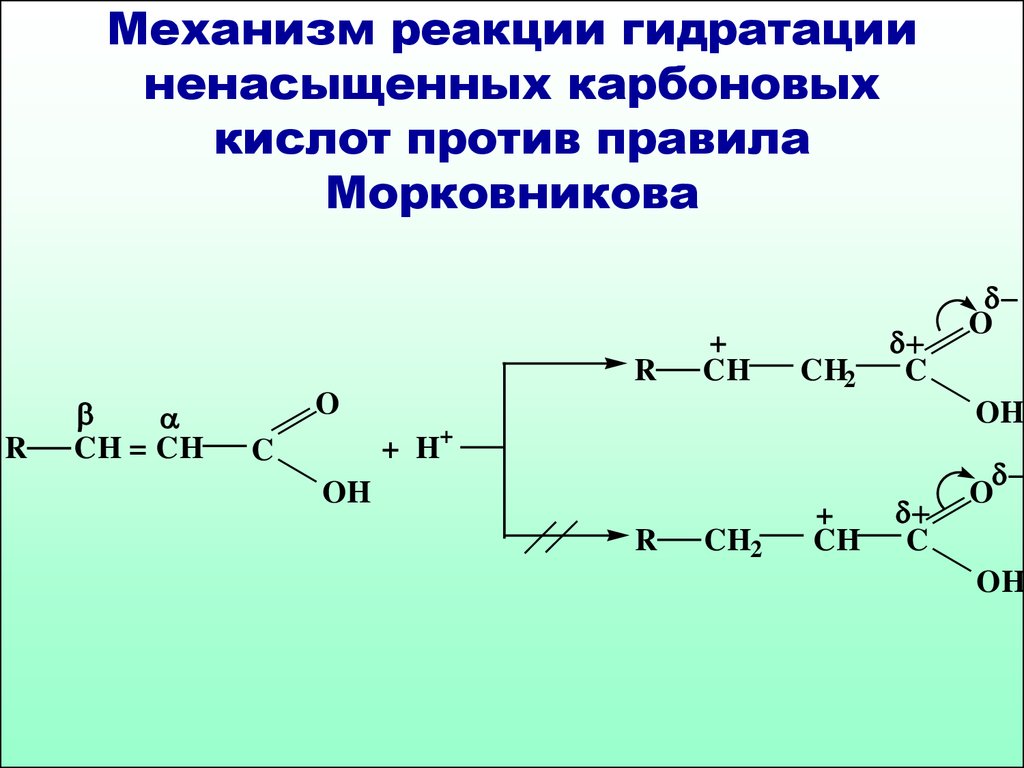
51. Механизм реакции гидратации ненасыщенных карбоновых кислот против правила Морковникова
RR
CH = CH
+
CH
O
CH2
C
OH
+
+ H
C
O
OH
R
CH2
+
CH
C
O
OH
52.
..HOH
..
O
R
CH
+
O
H
H
CH2
C
O
R
- H+
CH
CH2
C
OH возврат
катализатора
OH
OH
-гидрокси кислота
53.
Такого типа гидратация invivo является частью процесса
β-окисления ненасыщенных
жирных кислот в организме
54.
Сопряженные системы(алкадиены)
термодинамически наиболее
устойчивы, поэтому часто
встречаются в природе.
Реакции АЕ с такими диенами
протекают с образованием двух
продуктов
1,4- и 1,2-присоединения
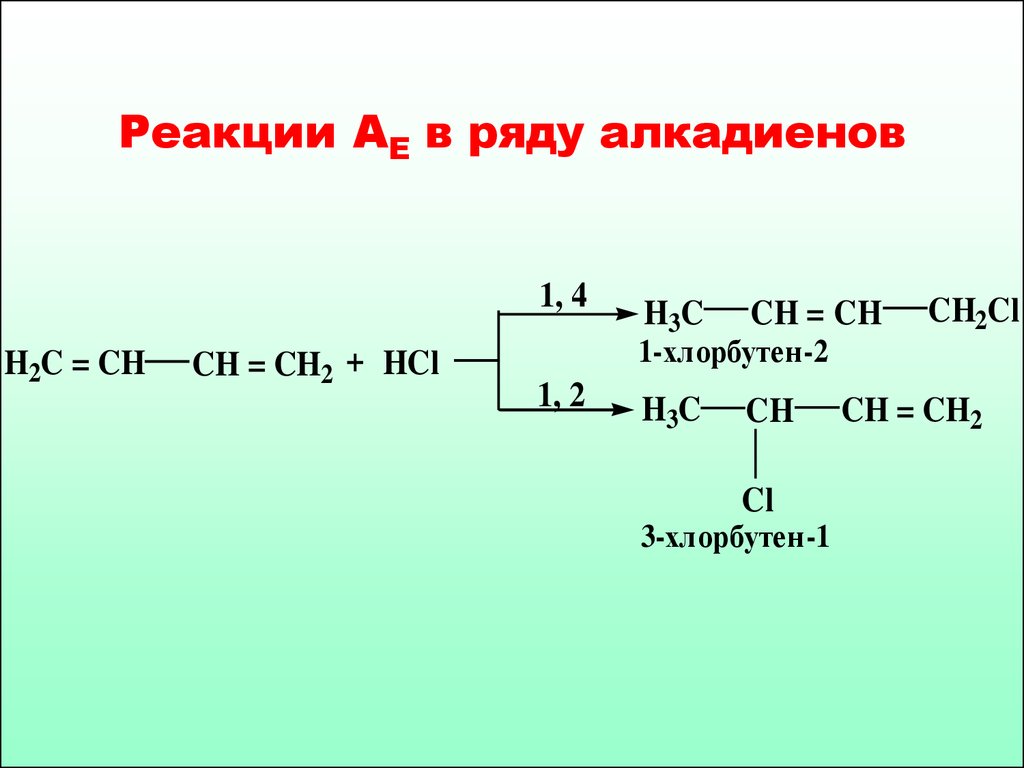
55. Реакции АЕ в ряду алкадиенов
1, 4H2C = CH
CH = CH2 + HCl
H3C
CH = CH
CH2Cl
1-хлорбутен-2
1, 2
H3C
CH
Cl
3-хлорбутен-1
CH = CH2
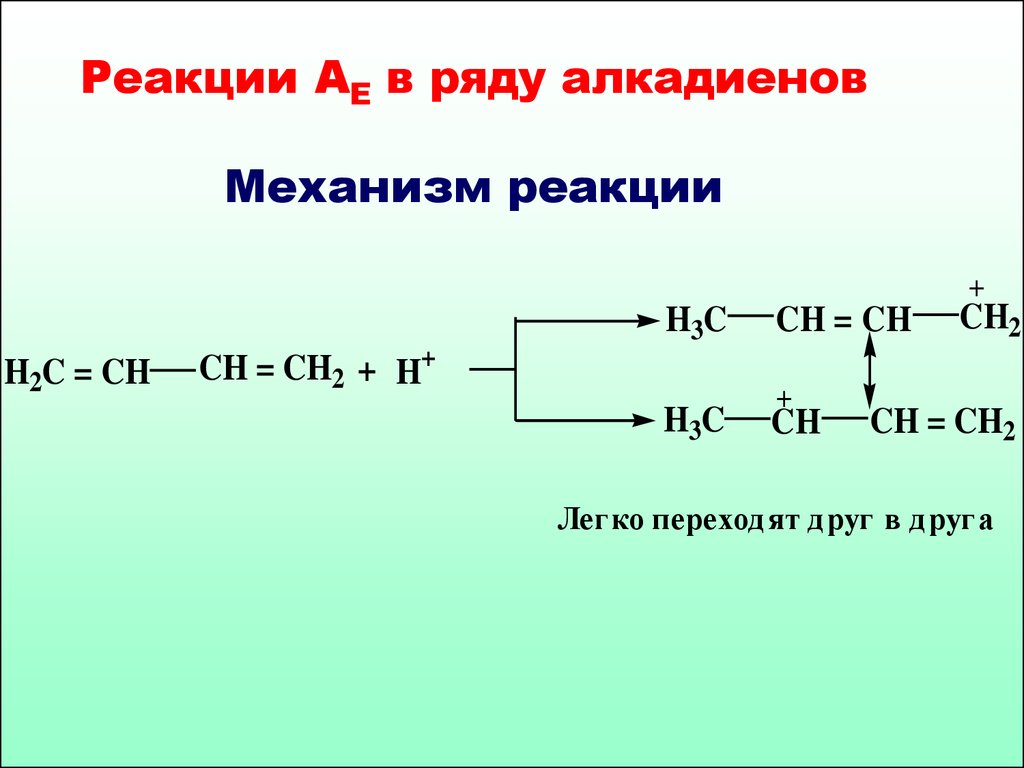
56. Реакции АЕ в ряду алкадиенов Механизм реакции
+H3C
H2C = CH
CH = CH2 + H+
H3C
CH = CH
+
CH
CH2
CH = CH2
Легко переход ят д руг в д руга
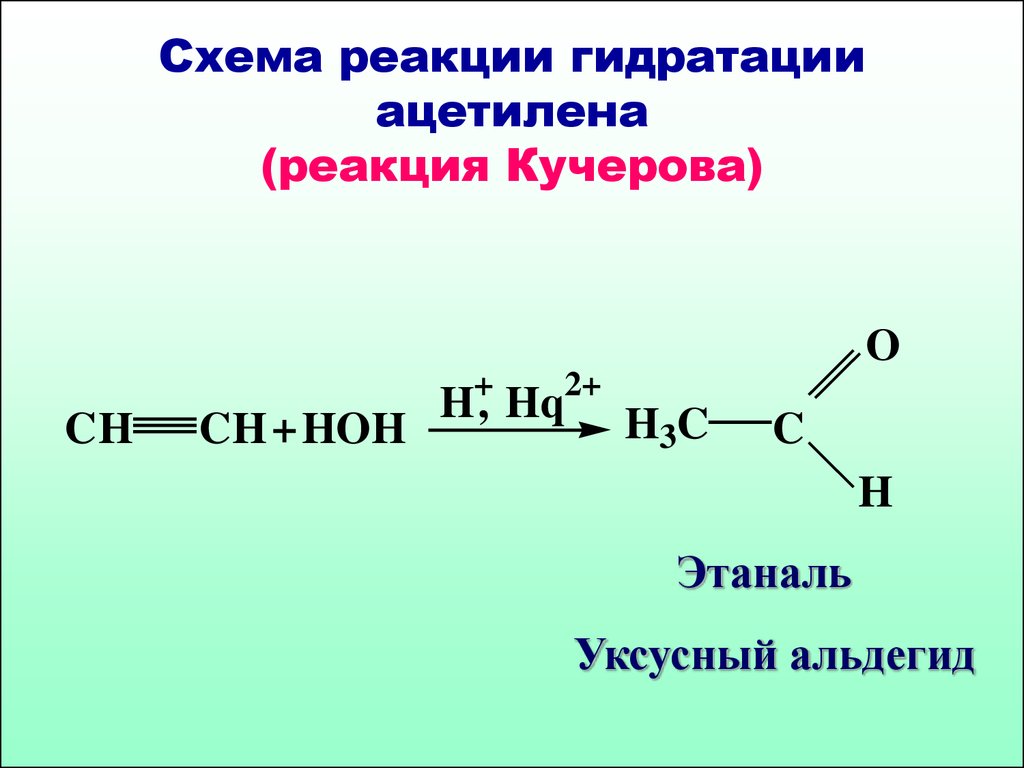
57. Схема реакции гидратации ацетилена (реакция Кучерова)
Схема реакции гидратацииацетилена
(реакция Кучерова)
O
+
CH
CH + HOH
H , Hq
2+
H3C
C
H
Этаналь
Уксусный альдегид
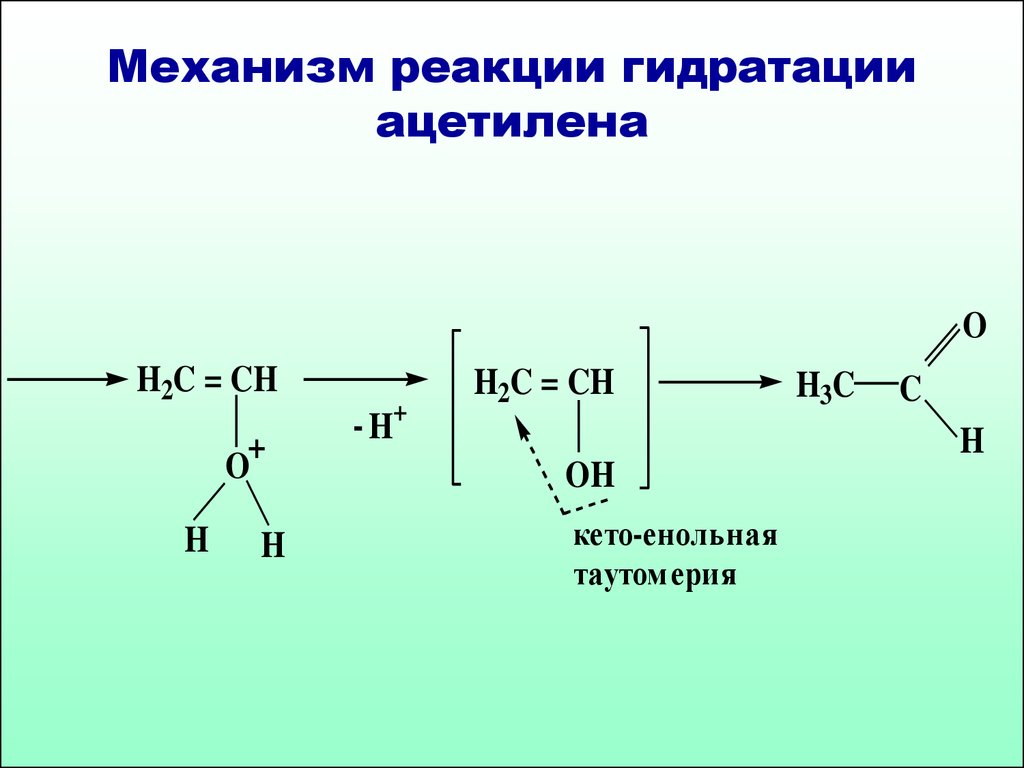
58.
Механизм реакции гидратацииацетилена
CH
+
CH + H
+
H2C = CH
..
+ HOH
..
59.
Механизм реакции гидратацииацетилена
O
H2C = CH
+
O
H
H
+
H2C = CH
-H
H3C
C
H
OH
кето-енольная
таутом ерия
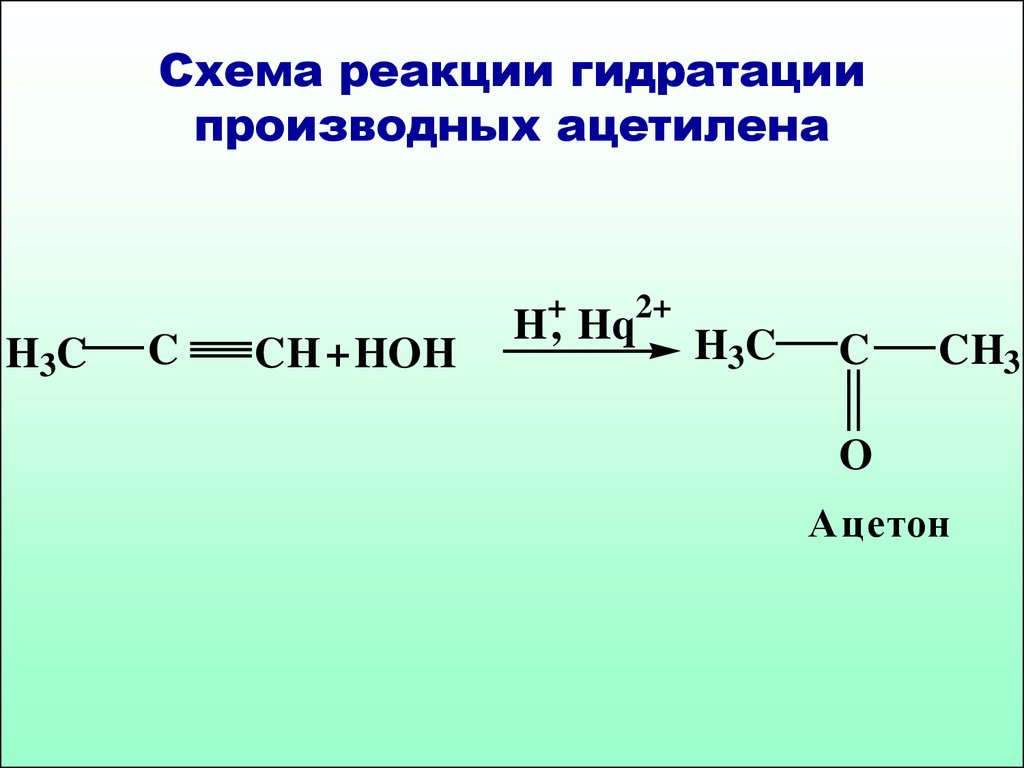
60. Схема реакции гидратации производных ацетилена
+H3C
C
CH + HOH
H , Hq
2+
H3C
C
CH3
O
Ацетон
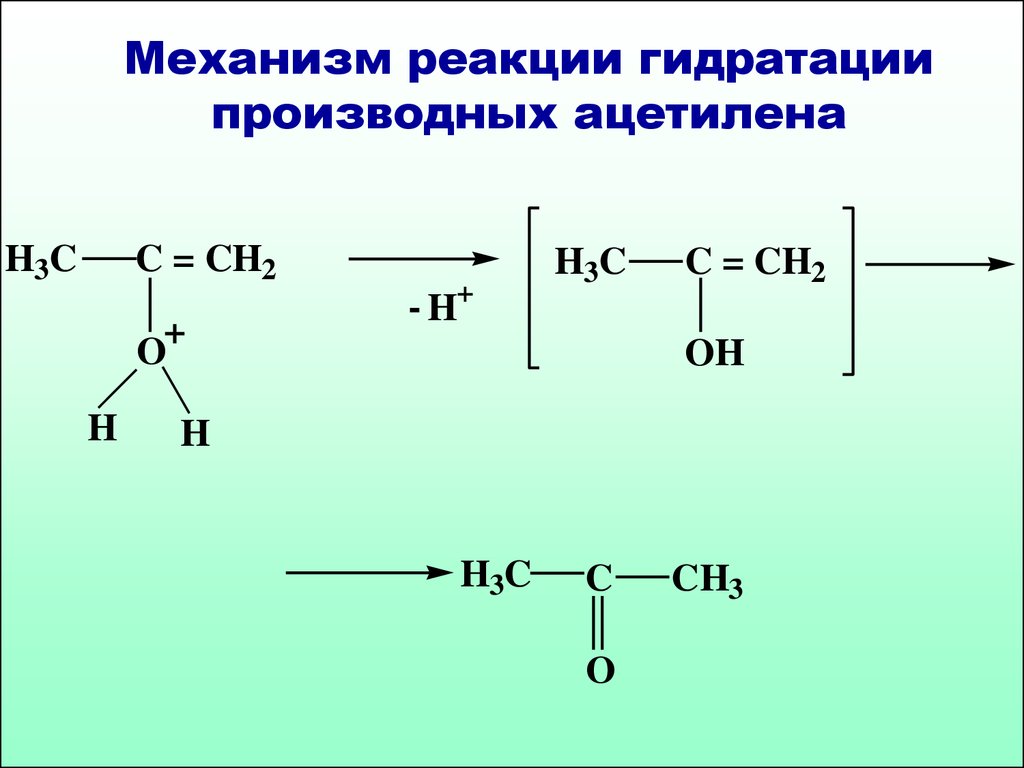
61. Механизм реакции гидратации производных ацетилена
Механизм реакции гидратациипроизводных ацетилена
H3C
C
+
CH + H
H3C
+
C = CH2
..
+ HOH
..
62.
Механизм реакции гидратациипроизводных ацетилена
H3C
C = CH2
+
O
H
- H+
H3C
C = CH2
OH
H
H3C
C
O
CH3
63.
Благодаримза внимание !







































 Химия
Химия








