Похожие презентации:
Виды химической связи. Типы кристаллических решеток
1. Виды химической связи. Типы кристаллических решеток.
2.
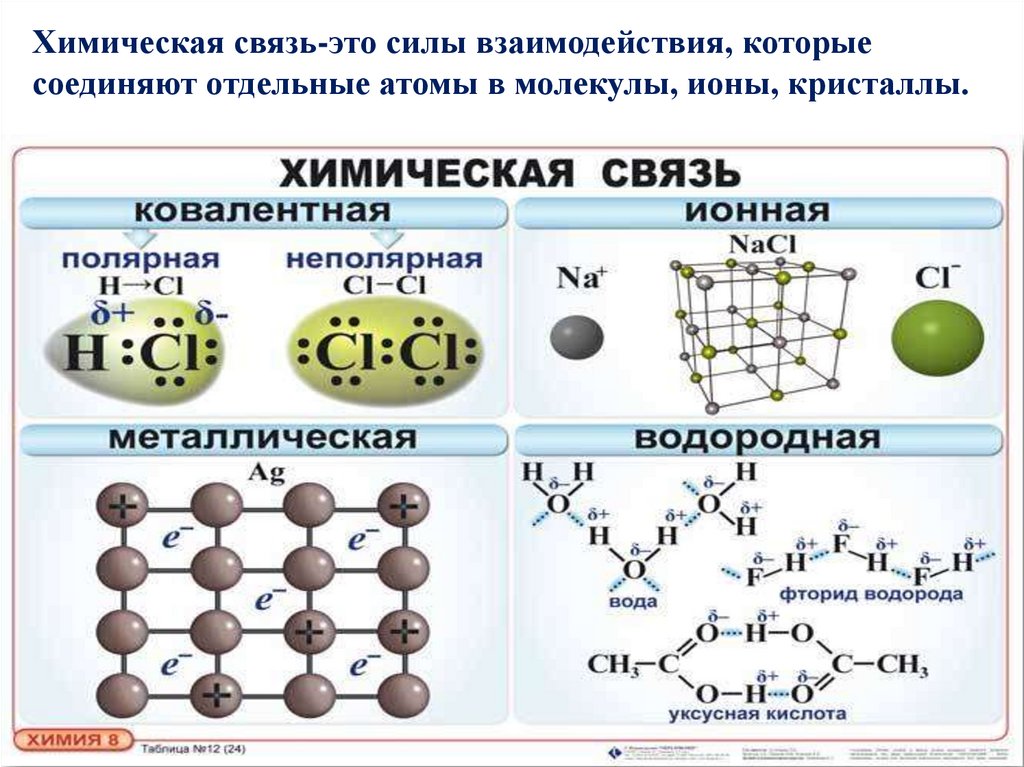
Химическая связь-это силы взаимодействия, которыесоединяют отдельные атомы в молекулы, ионы, кристаллы.
3.
Ковалентная неполярная связьХимическая связь, возникающая в результате образования
общих электронных пар, называется ковалентной.
Связь возникающая между одинаковыми
называется ковалентной неполярной.
Пример:
Н2
Н + Н
Н Н
неметаллами
4.
17/09/23Ковалентная полярная связь
Ряд неметаллов.
F, O, N, Cl, Br, S, C, P, Si, H.
ЭО уменьшается
Пример:
НCl
+δ
+
Н Cl
-δ
5.
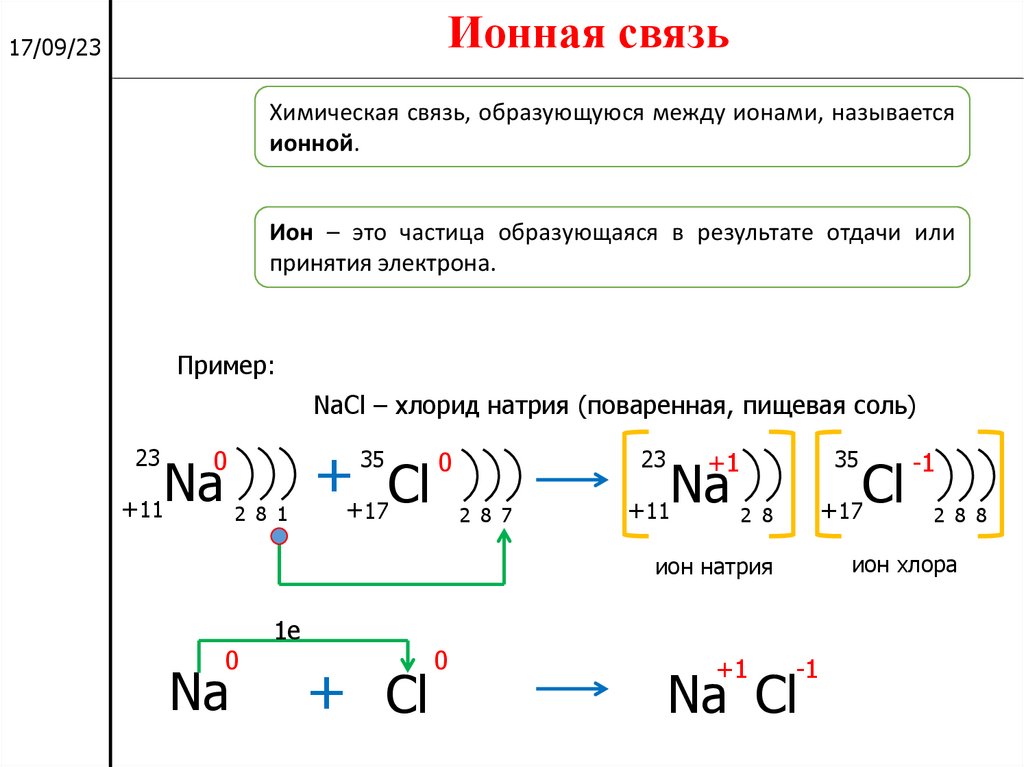
Ионная связь17/09/23
Химическая связь, образующуюся между ионами, называется
ионной.
Ион – это частица образующаяся в результате отдачи или
принятия электрона.
Пример:
NaCl – хлорид натрия (поваренная, пищевая соль)
23
0
Na
+11
++ Cl
35
2 8 1
23
0
17
2 8 7
35
+1
Na
+11
0
Na
+ Cl
0
+1
2 8 8
ион хлора
ион натрия
1e
Cl
+17
2 8
-1
-1
Na Cl
6.
ионная связь17/09/23
Ионная связь образуется между металлом и неметаллом.
Частица, отдающая
положительный ион.
1e
Na
атом
0
электроны,
в
+1
Na
ион
Частица, принимающая
отрицательный ион.
0
превращается
электроны,
-1
Cl + 1e
Cl
атом
ион
превращается
в
7.
17/09/23Металлическая связь
Связь в металлах и сплавах между атом – ионами посредством
обобществленных электронов называют металлической.
Схема металлической связи:
Условные обозначения:
- атом металла
- ион металла
- электрон
8. Водородная связь
МежмолекулярнаяВозникает между
молекулами
17.09.2023
Внутримолекулярная
Возникает внутри
молекулы
9. Сравнение различных видов связи
Сходство: любой вид связи образуется за счетперехода электронов
Различие: способ образования
( передача электронов,
образование общих
электронных пар,
переход электронов в
свободное пространство)
17.09.2023
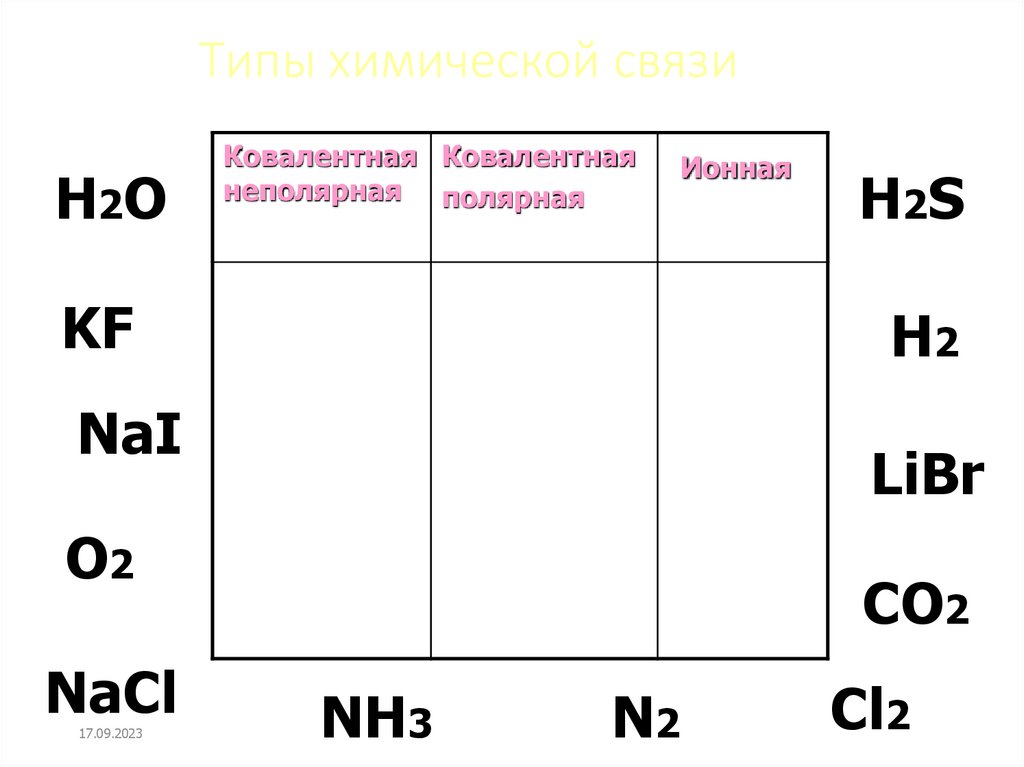
10. Типы химической связи
H2OКовалентная Ковалентная
неполярная полярная
Ионная
KF
H2
NaI
LiBr
О2
NaCl
17.09.2023
Н2S
CO2
NH3
N2
Cl2
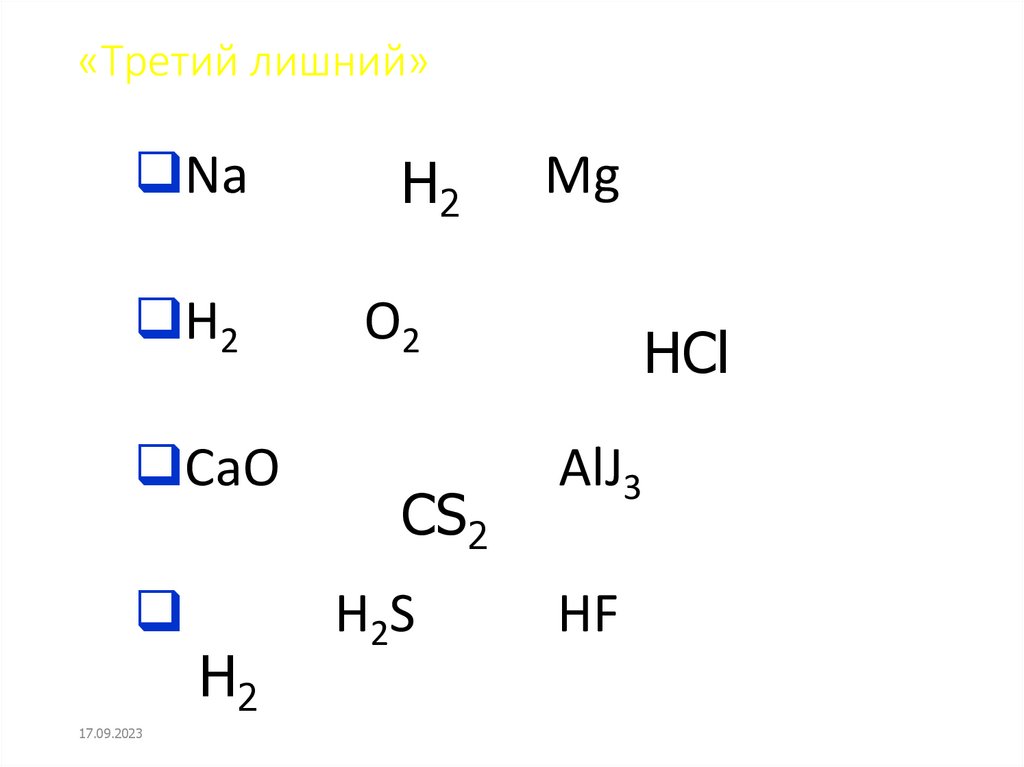
11. «Третий лишний»
NaН2
H2
O2
CaO
17.09.2023
H2
CS2
H2S
Mg
HCl
AlJ3
HF
12.
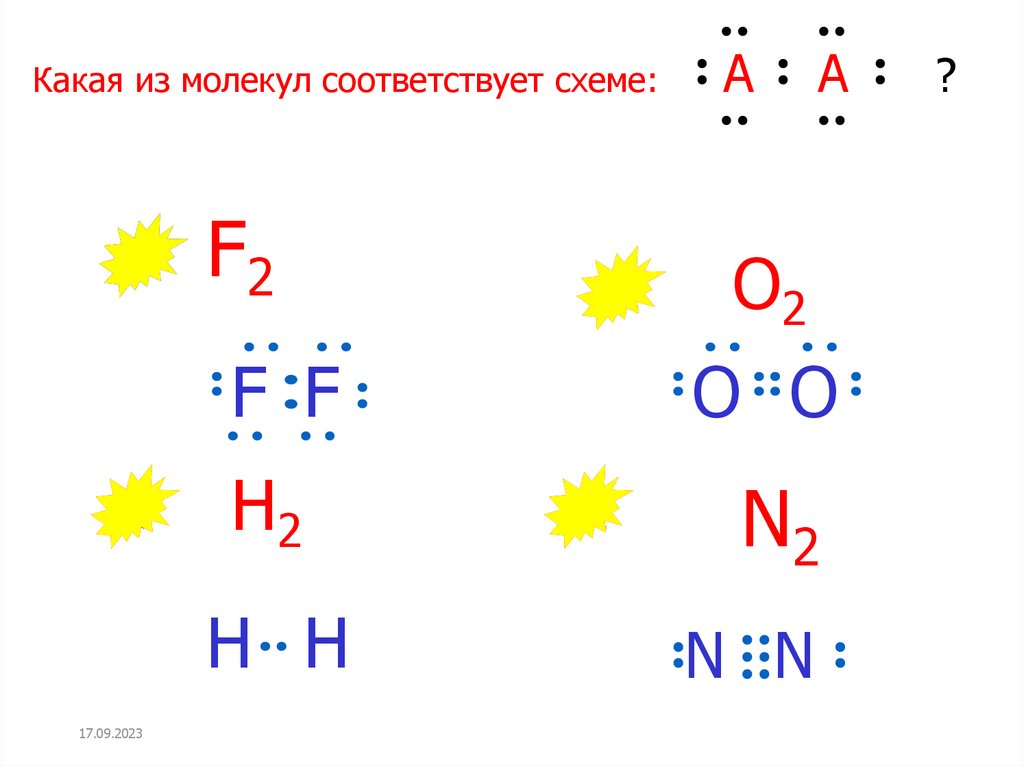
Какая из молекул соответствует схеме:17.09.2023
A
A
F2
O2
F F
O O
H2
N2
H H
N N
?
13.
17/09/23Кристаллические решетки
Твердые вещества
Аморфные
Кристаллические
Не имеют четкой,
упорядоченной
структуры.
Имеют четкую, упорядоченную
структуру (кристаллическую решетку)
1. Атомную
3. Молекулярную
2. Ионную
4. Металлическую
14.
17.09.202315.
17/09/23Кристаллические решетки.
1. Атомная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- атом
- ковалентная связь
-Прочные и твердые, практически
нерастворимые, имеют высокие
температуры плавления и кипения,
не проводят электрический ток.
- Пример: алмаз, кремний
германий, бор, оксид
кремния(кварц)
16.
17/09/23Кристаллические решетки.
2. Ионная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- ионы
- электростатическое
притяжение
- Прочные и твердые, тугоплавкие и
нелетучие, растворимы в воде,
растворы и расплавы проводят
электрический ток.
- Пример: соли, основания.
17.
17/09/23Кристаллические решетки.
3. Молекулярная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- диполь (молекула)
- электростатическое
притяжение
- Непрочные, хрупкие,
легкоплавкие и летучие, некоторые
растворяются в воде, не проводят
электрический ток.
- Пример: вода, лёд, газы, S8 ,P4,
органические вещества
18.
17/09/23Кристаллические решетки.
4. Металлическая кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- ион металла
- атом металла
-электрон
- Ковкие, пластичные, электро- и
теплопроводные, обладающие
металлическим блеском.
- Пример: все металлы.
19. Вывод:
Строение атомаЭО
Вид химической связи
Тип кристаллической решетки
Свойства веществ
17.09.2023
20. Установите соответствие
• Между названием вещества ивидом химической связи в нем
• Между названием вещества и
типом кристаллической
решётки в нем
А) NO
1.Ковалентная
неполярная
А) CaCl2
1.металлическая
Б) Na2S
2.Ковалентная
полярная
Б) Al
2.ионная
В)Ca
3.Металлическая
В) NH3
3.атомная
Г) Cl2
4.ионная
Г) Si
4.молекулярная
17.09.2023















 Химия
Химия








