Похожие презентации:
Виды химической связи. Типы кристаллических решеток
1. Виды химической связи. Типы кристаллических решеток.
2.
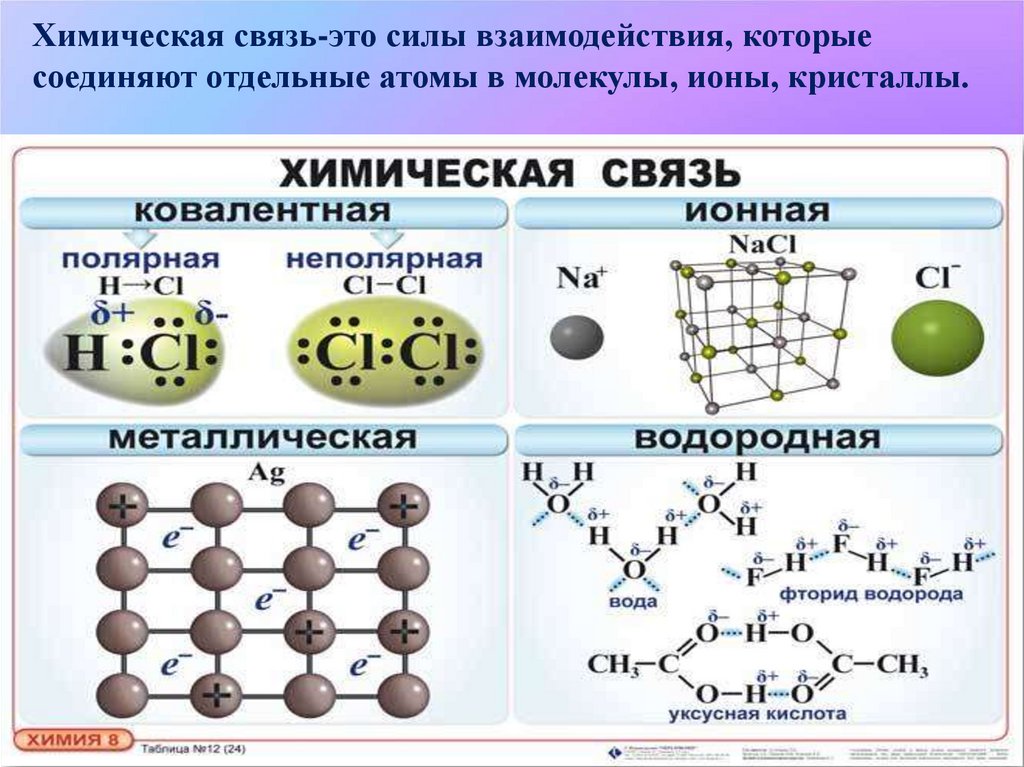
Химическая связь-это силы взаимодействия, которыесоединяют отдельные атомы в молекулы, ионы, кристаллы.
3.
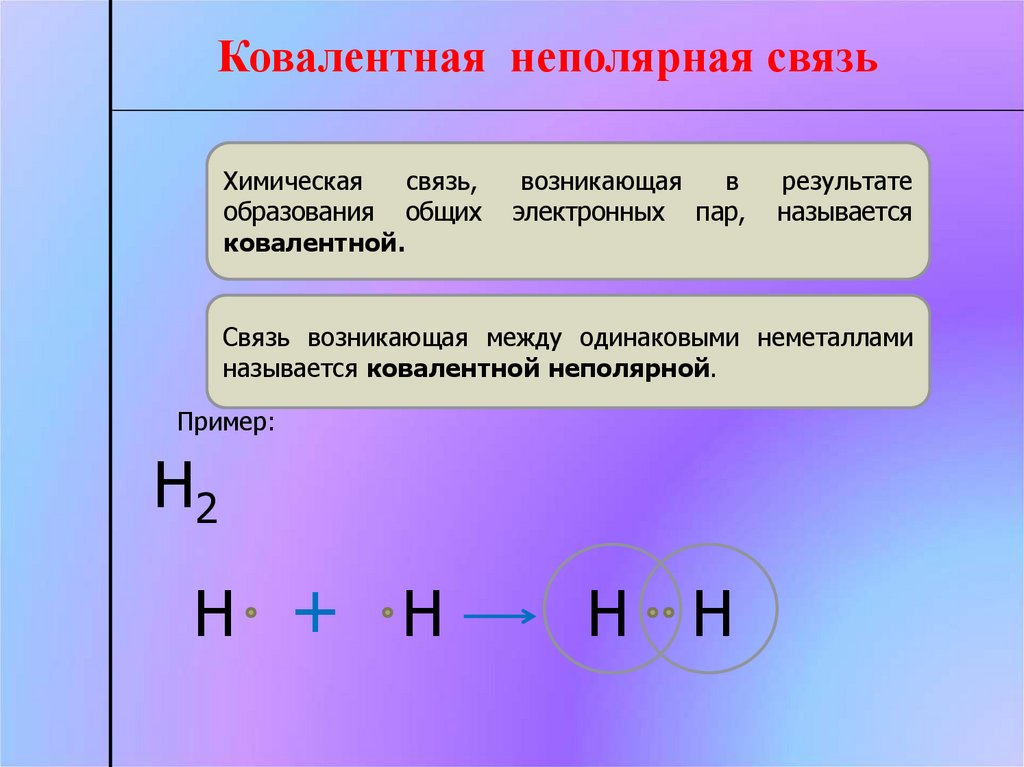
Ковалентная неполярная связьХимическая
связь,
образования общих
ковалентной.
возникающая
в
электронных пар,
результате
называется
Связь возникающая между одинаковыми неметаллами
называется ковалентной неполярной.
Пример:
Н2
Н + Н
Н Н
4.
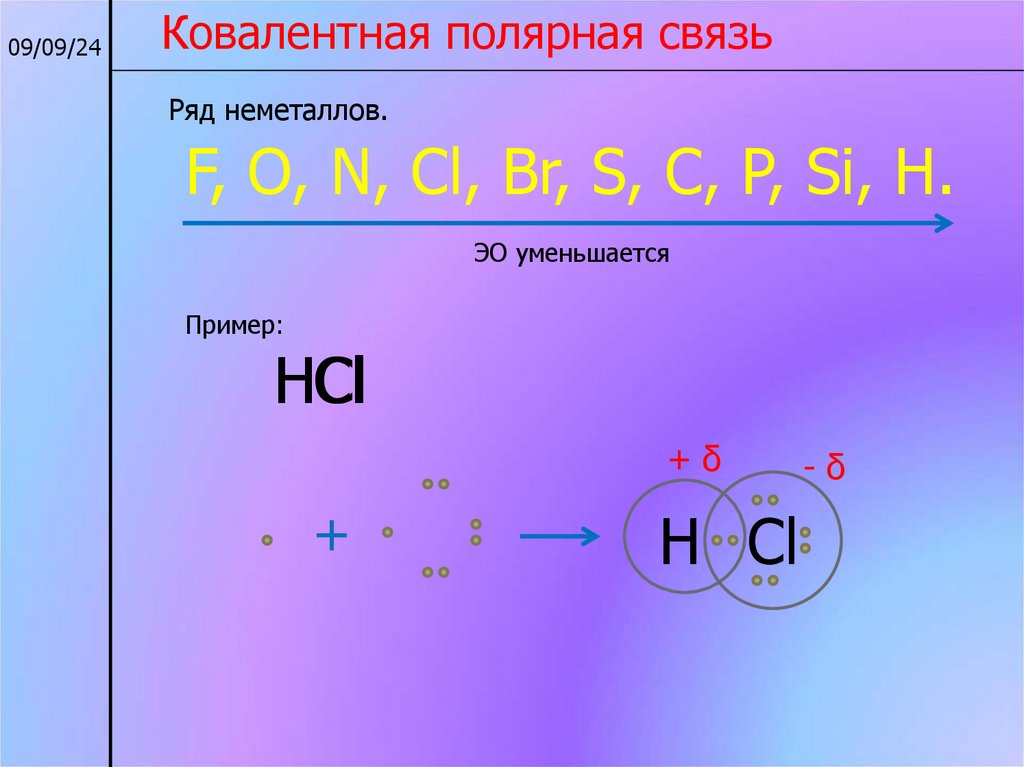
09/09/24Ковалентная полярная связь
Ряд неметаллов.
F, O, N, Cl, Br, S, C, P, Si, H.
ЭО уменьшается
Пример:
НCl
+δ
+
Н Cl
-δ
5.
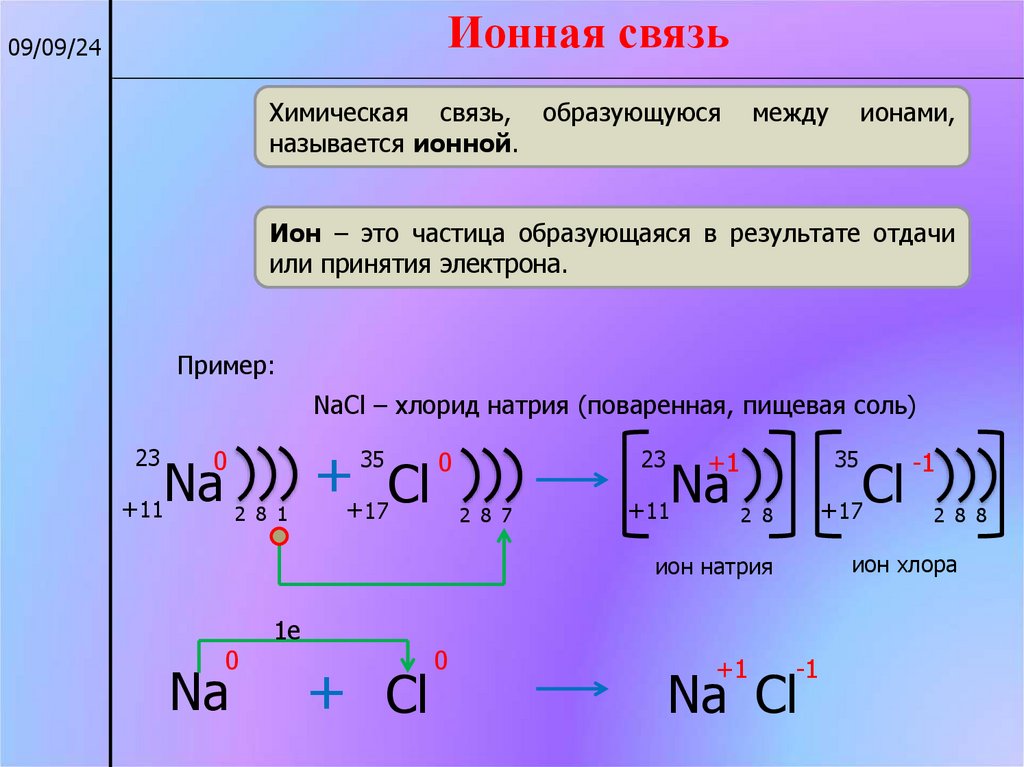
Ионная связь09/09/24
Химическая связь, образующуюся
называется ионной.
между
ионами,
Ион – это частица образующаяся в результате отдачи
или принятия электрона.
Пример:
NaCl – хлорид натрия (поваренная, пищевая соль)
23
0
Na
+11
++ Cl
35
2 8 1
23
0
17
2 8 7
35
+1
Na
+11
0
Na
+ Cl
0
+1
2 8 8
ион хлора
ион натрия
1e
Cl
+17
2 8
-1
-1
Na Cl
6.
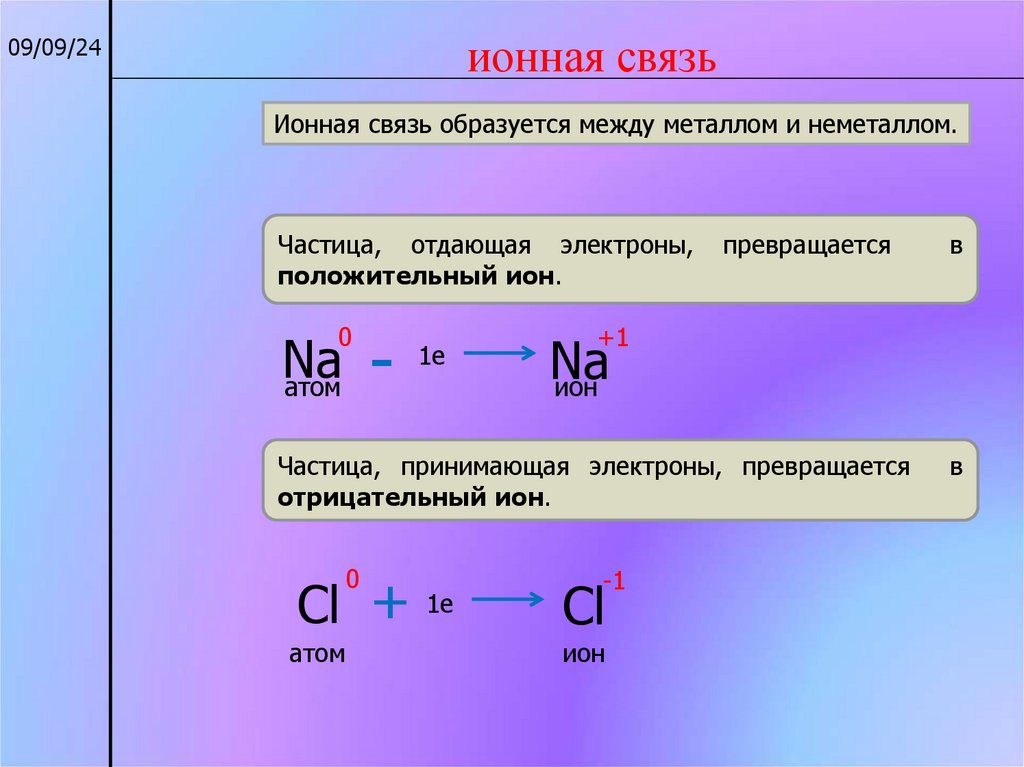
ионная связь09/09/24
Ионная связь образуется между металлом и неметаллом.
Частица, отдающая электроны,
положительный ион.
1e
Na
атом
0
превращается
+1
Na
ион
Частица, принимающая электроны, превращается
отрицательный ион.
0
в
-1
Cl + 1e
Cl
атом
ион
в
7.
09/09/24Металлическая связь
Связь в металлах и сплавах между атом
посредством
обобществленных
электронов
металлической.
Схема металлической связи:
Условные обозначения:
- атом металла
- ион металла
- электрон
– ионами
называют
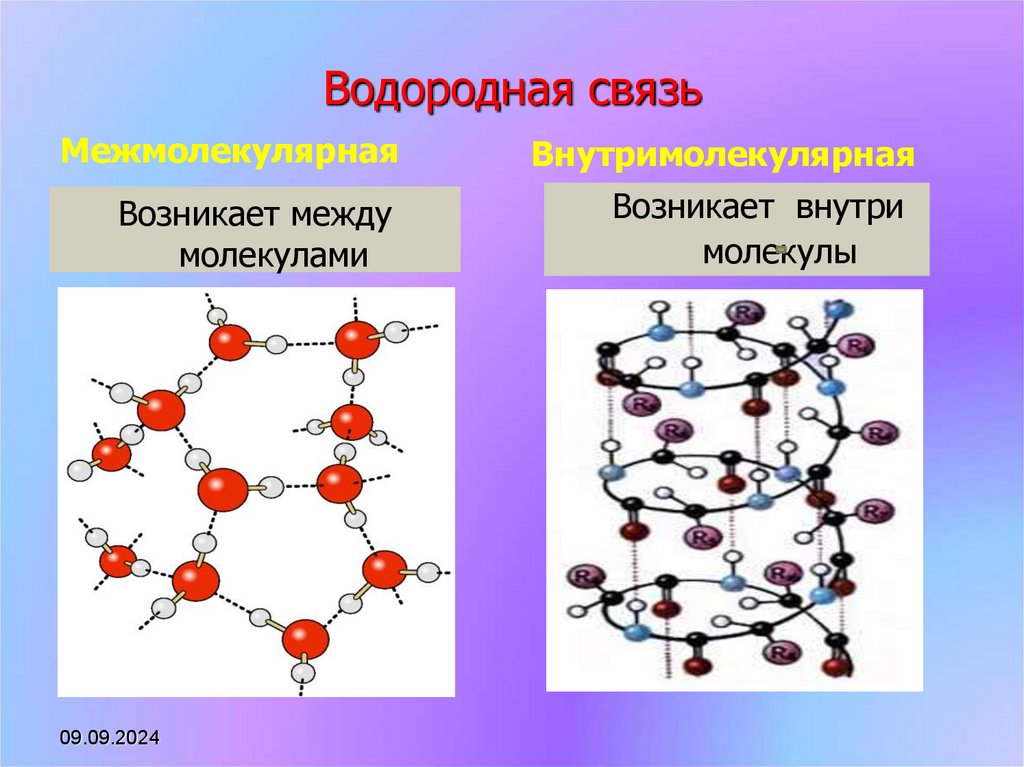
8. Водородная связь
МежмолекулярнаяВнутримолекулярная
Возникает между
молекулами
Возникает внутри
молекулы
09.09.2024
9. Сравнение различных видов связи
Сходство: любой вид связиобразуется за счет перехода
электронов
Различие: способ образования
( передача электронов,
образование общих
электронных пар,
переход электронов в
свободное пространство)
09.09.2024
10. Типы химической связи
H2OКовалентная Ковалентная
неполярная полярная
Ионная
KF
H2
NaI
LiBr
О2
NaCl
09.09.2024
Н2S
CO2
NH3
N2
Cl2
11.
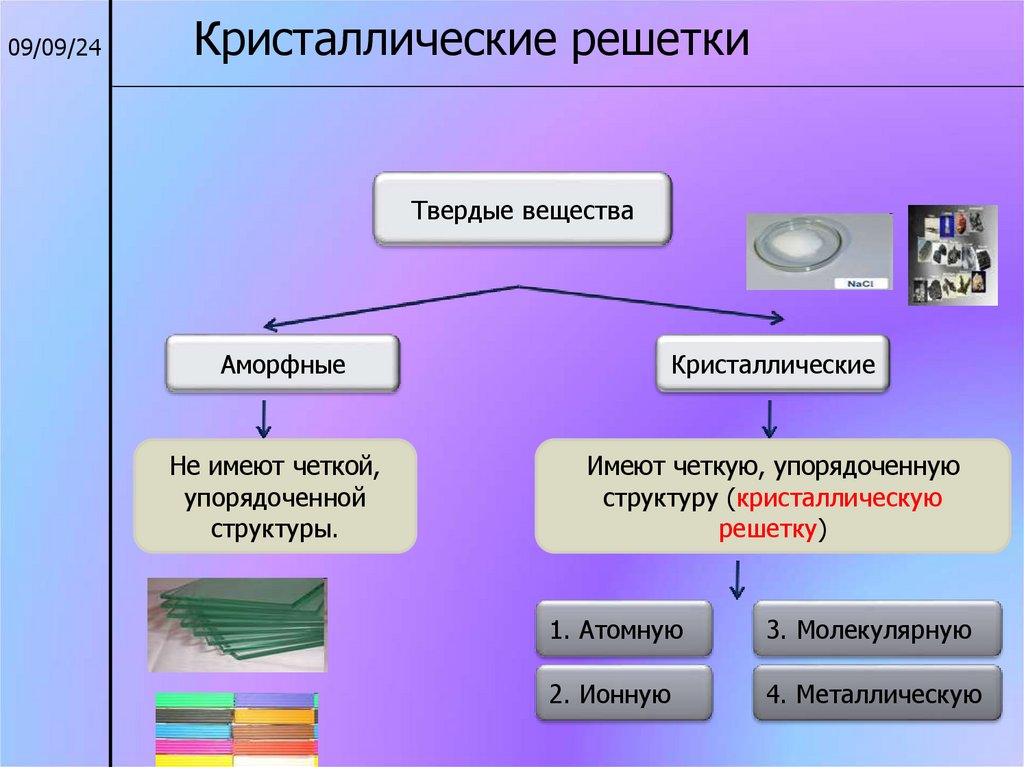
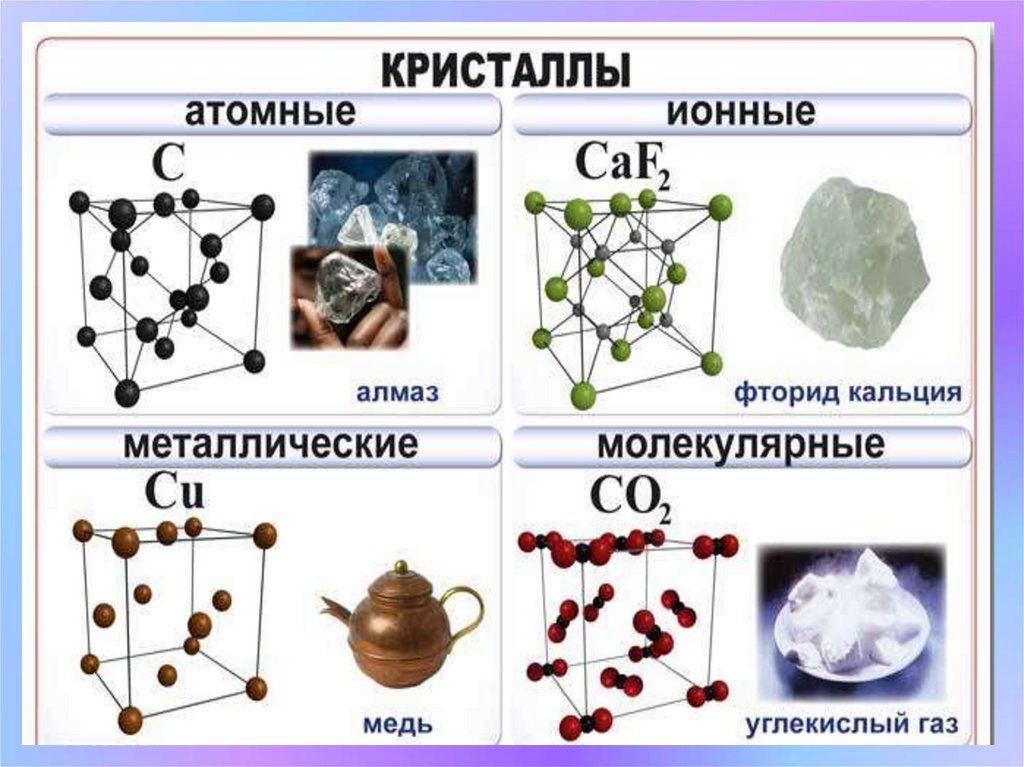
09/09/24Кристаллические решетки
Твердые вещества
Аморфные
Кристаллические
Не имеют четкой,
упорядоченной
структуры.
Имеют четкую, упорядоченную
структуру (кристаллическую
решетку)
1. Атомную
3. Молекулярную
2. Ионную
4. Металлическую
12.
09.09.202413.
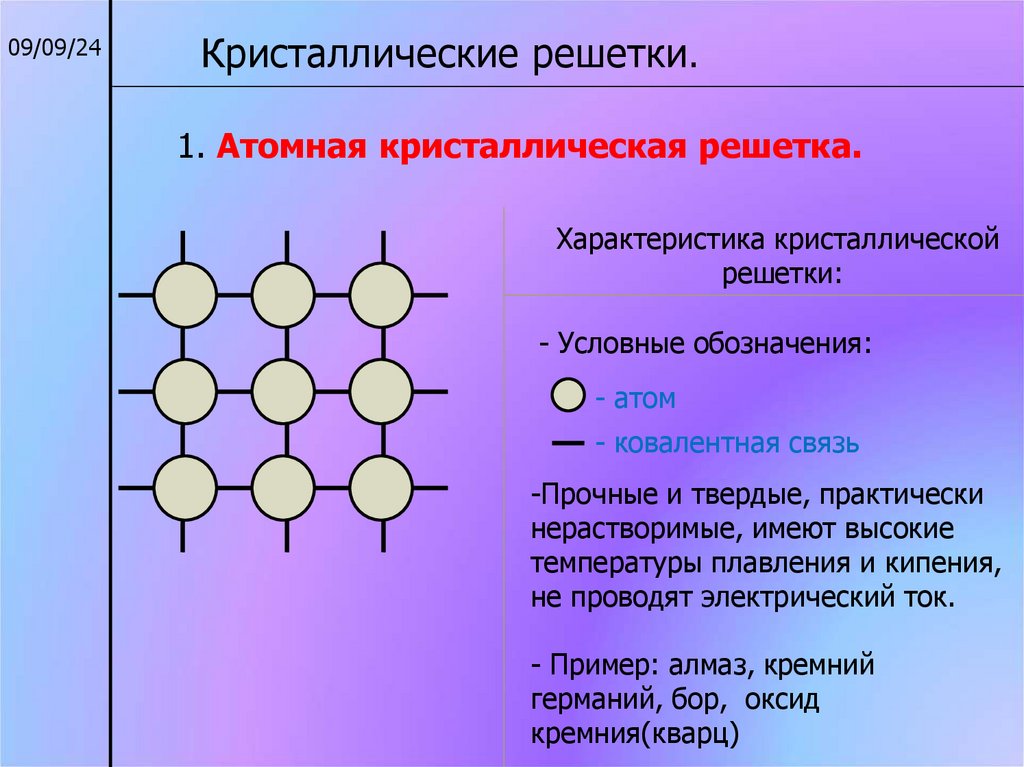
09/09/24Кристаллические решетки.
1. Атомная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- атом
- ковалентная связь
-Прочные и твердые, практически
нерастворимые, имеют высокие
температуры плавления и кипения,
не проводят электрический ток.
- Пример: алмаз, кремний
германий, бор, оксид
кремния(кварц)
14.
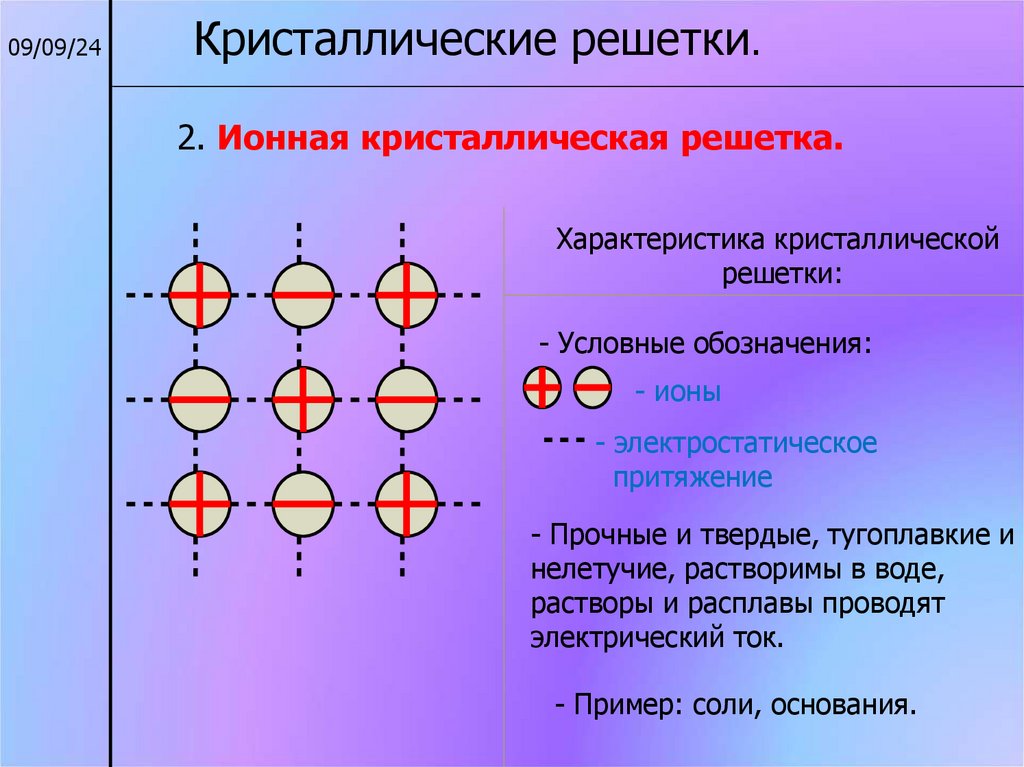
09/09/24Кристаллические решетки.
2. Ионная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- ионы
- электростатическое
притяжение
- Прочные и твердые, тугоплавкие и
нелетучие, растворимы в воде,
растворы и расплавы проводят
электрический ток.
- Пример: соли, основания.
15.
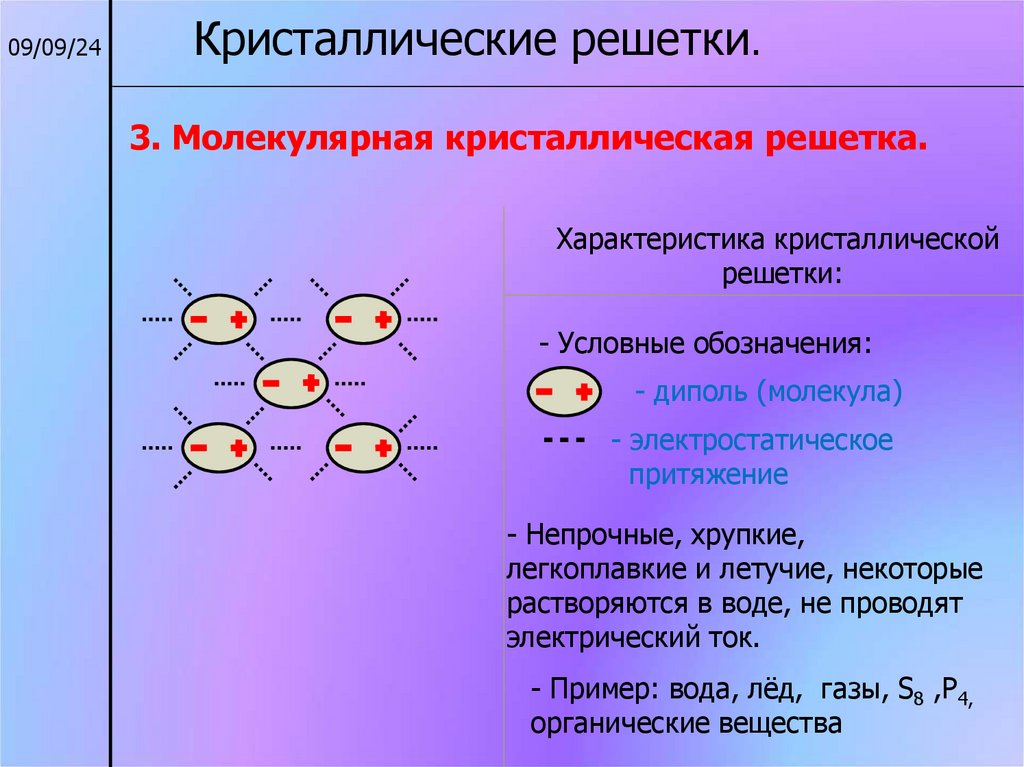
09/09/24Кристаллические решетки.
3. Молекулярная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- диполь (молекула)
- электростатическое
притяжение
- Непрочные, хрупкие,
легкоплавкие и летучие, некоторые
растворяются в воде, не проводят
электрический ток.
- Пример: вода, лёд, газы, S8 ,P4,
органические вещества
16.
09/09/24Кристаллические решетки.
4. Металлическая кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- ион металла
- атом металла
-электрон
- Ковкие, пластичные, электро- и
теплопроводные, обладающие
металлическим блеском.
- Пример: все металлы.
17. Вывод:
Строение атомаЭО
Вид химической связи
Тип кристаллической решетки
Свойства веществ
09.09.2024
18. Установите соответствие
Между названиемвещества и видом
химической связи в
нем
А) NO
1.Ковалентная
неполярная
Б) Na2S 2.Ковалентная
полярная
Между названием
вещества и типом
кристаллической
решётки в нем
А) CaCl2 1.металлическая
Б) Al
2.ионная
В)Ca
3.Металлическая
В) NH3
3.атомная
Г) Cl2
4.ионная
Г) Si
4.молекулярная
09.09.2024






 Химия
Химия








