Похожие презентации:
Виды химической связи и типы кристаллических решеток
1. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ И ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
2. Для чего атомы образуют химические связи?
«Предел мечтаний» каждого атома этозавершить внешний электронный слой, как
у благородных газов (гелий, неон и т.д.)
Для этого атомы отдают или присоединяют
электроны.
Отдают электроны металлы, проявляя
восстановительный свойства, превращаясь
в катионы. О-О-В
Присоединяют электроны неметаллы,
проявляя окислительные свойства,
превращаясь в анионы. В-В-О
3.
4.
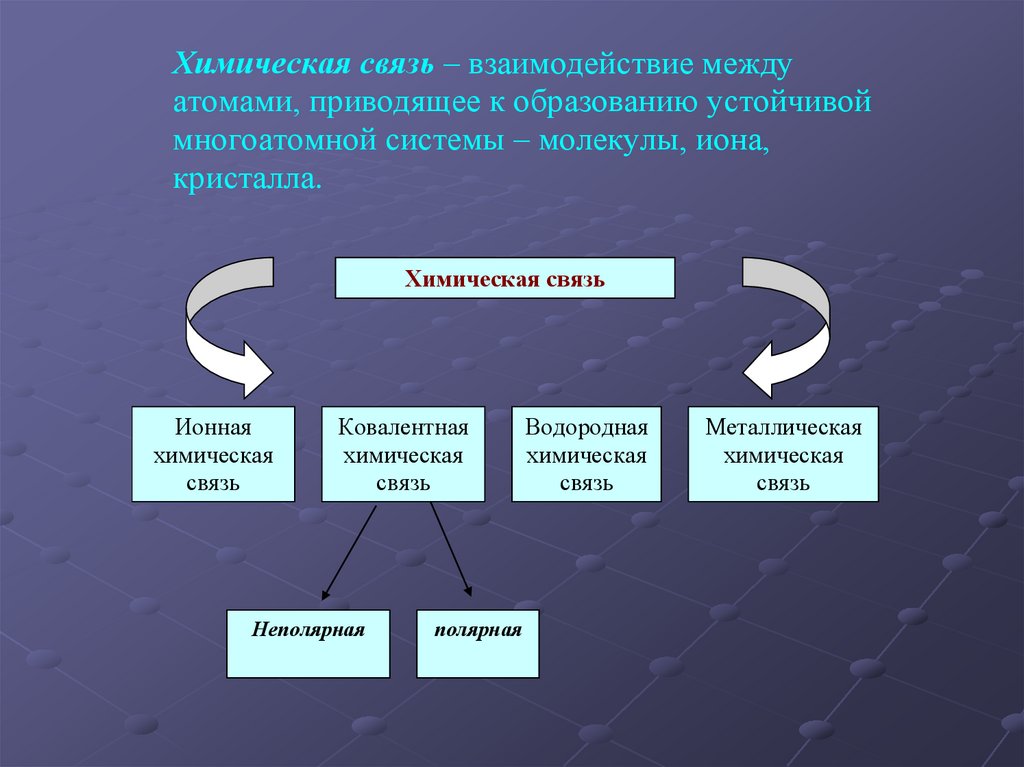
Химическая связь – взаимодействие междуатомами, приводящее к образованию устойчивой
многоатомной системы – молекулы, иона,
кристалла.
Химическая связь
Ионная
химическая
связь
Ковалентная
химическая
связь
Неполярная
полярная
Водородная
химическая
связь
Металлическая
химическая
связь
5. Ионная связь – это связь, образовавшаяся между катионами и анионами за счет их электростатического притяжения.
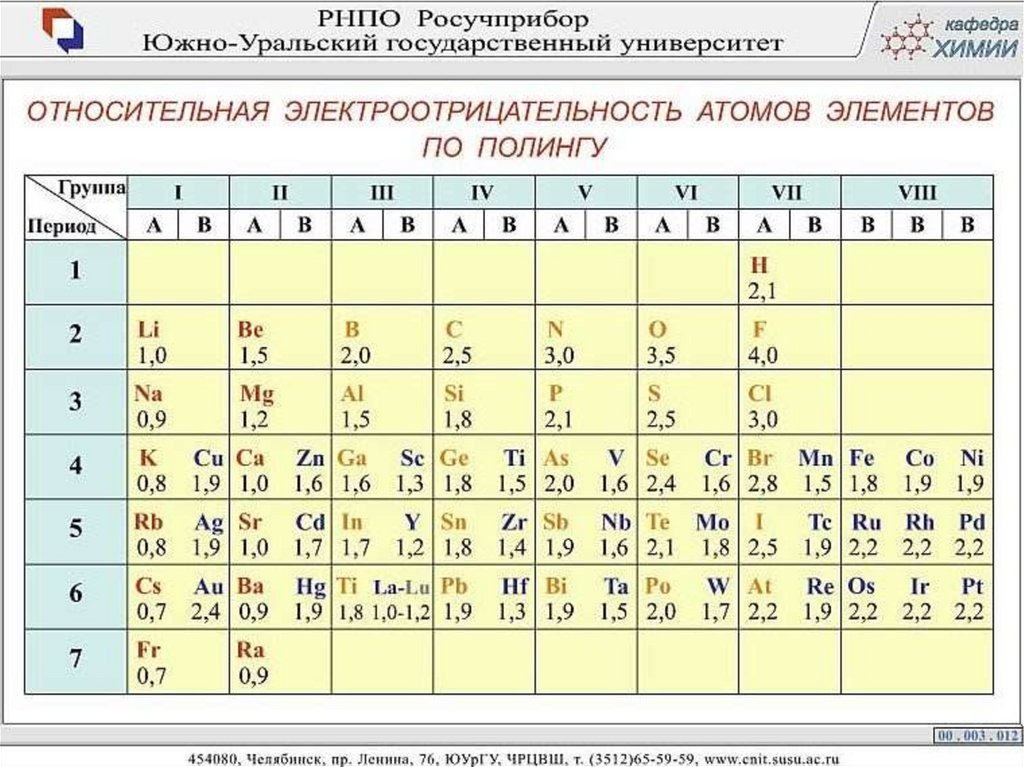
Возникает между атомами, имеющими большую разность вэлектроотрицательности более 2 (ЭО).
ЭО – свойство атома оттягивать на себя электроны (пары электронов).
Образуется обычно между атомами наиболее активных металлов и
неметаллов;
При образовании ионной связи атом металла отдает свои электроны
атому неметалла, при этом каждый из атомов получает завершенный
энергетический уровень.
+
-
катион
анион
Вещества с ионной связью: галогениды, оксиды,
соли, гидроксиды.
CuSO4
6.
https://fs00.infourok.ru/images/doc/133/155035/640/img22.jpg
7.
8. Вещества с ионной связью при н.у. находятся в твердом агрегатном состоянии и образуют кристаллы с ионной кристаллической
решеткойВ узлах ионной кристаллической
решетки находятся ионы, между
которыми присутствует ионная
связь
Физические свойства:
тугоплавкие, нелетучие, твердые,
но хрупкие, многие растворимы, в
растворах и расплавах проводят
электрический ток (щелочи, соли
и др.)
Ионная связь относительна и
является крайним случаем
ковалентной полярной связи
9.
Задание 1Из списка веществ выберите вещества с
ионной связью: Ag, NaOH, O2, NH3, HI, Br2,
CuSO4,Cu, N2, K3N, CO2, Ca.
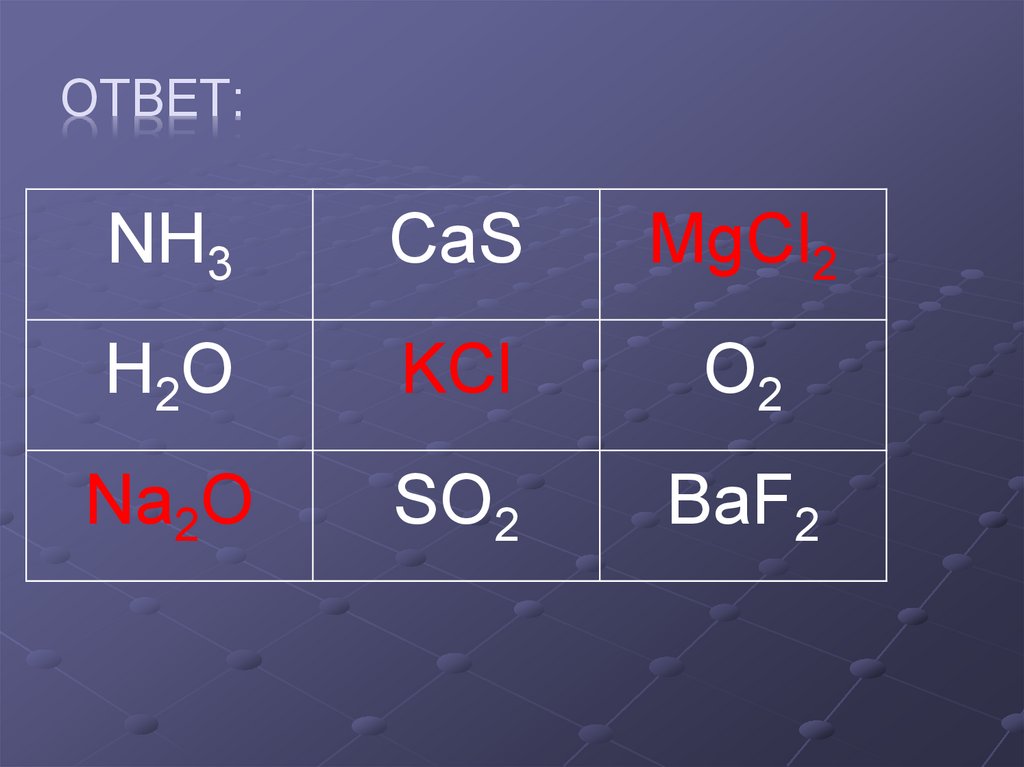
Задание 2. «Крестики-нолики».Покажите
выигрышный путь веществ с ионной связью.
NH3
CaS
MgCl 2
H2O
KCl
O2
Na2O
SO2
BaF2
10. Ответ:
ОТВЕТ:NH3
CaS
MgCl2
H2O
KCl
O2
Na2O
SO2
BaF2
11. Ковалентная связь – это связь между атомами, возникающая за счет образования общих электронных пар.
По обменному механизму: каждый атом предоставляет в общуюэлектронную пару один неспаренный электрон:
H.+.H
H:H
H-H H2
..
..
..
..
:F.+.F:
..
..
..
..
:F : F:
F-F F2
Связь, которая образуется между атомами одного и того же элемента, называется ковалентная
неполярная связь.
По донорно-акцепторному механизму: один атом предоставляет
электронную пару (донор), а другой – пустую орбиталь (акцептор)
12.
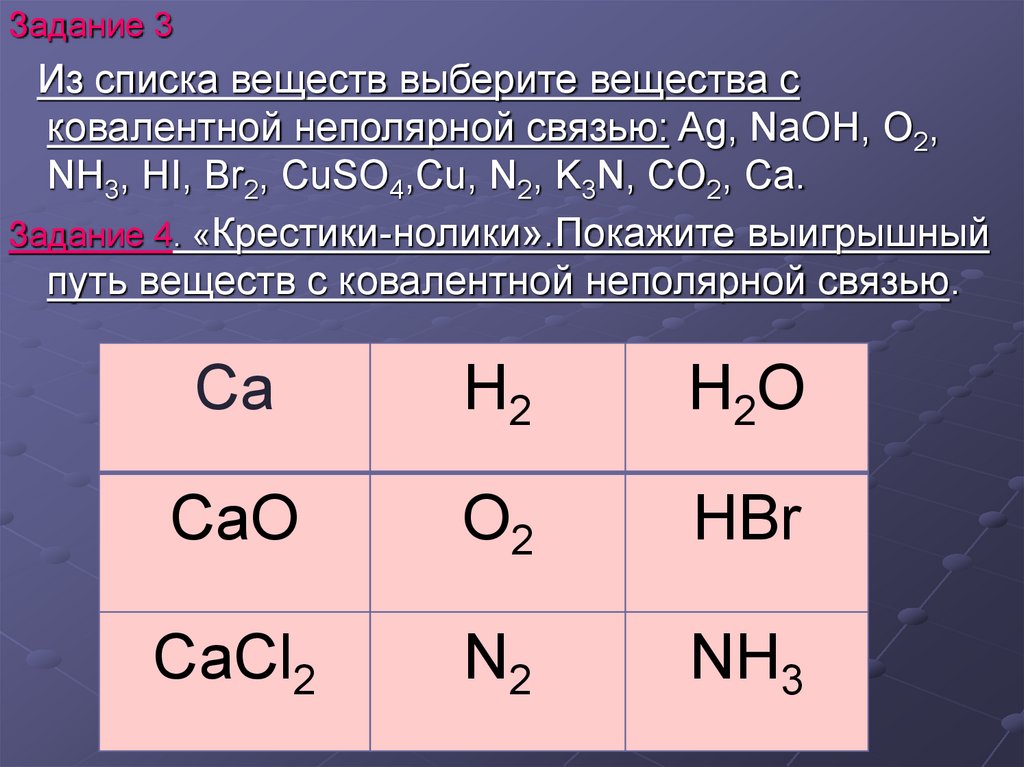
Задание 3Из списка веществ выберите вещества с
ковалентной неполярной связью: Ag, NaOH, O2,
NH3, HI, Br2, CuSO4,Cu, N2, K3N, CO2, Ca.
Задание 4. «Крестики-нолики».Покажите выигрышный
путь веществ с ковалентной неполярной связью.
Ca
H2
H2O
CaO
O2
HBr
CaCl2
N2
NH3
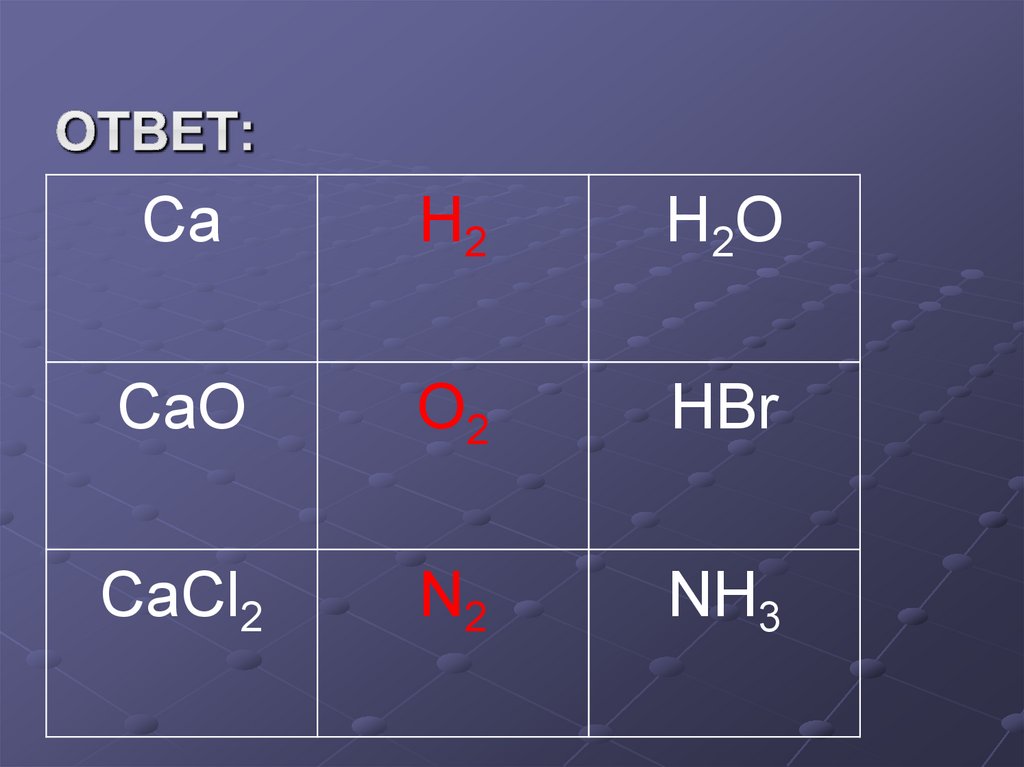
13. Ответ:
CaH2
H2 O
CaO
O2
HBr
CaCl2
N2
NH3
14.
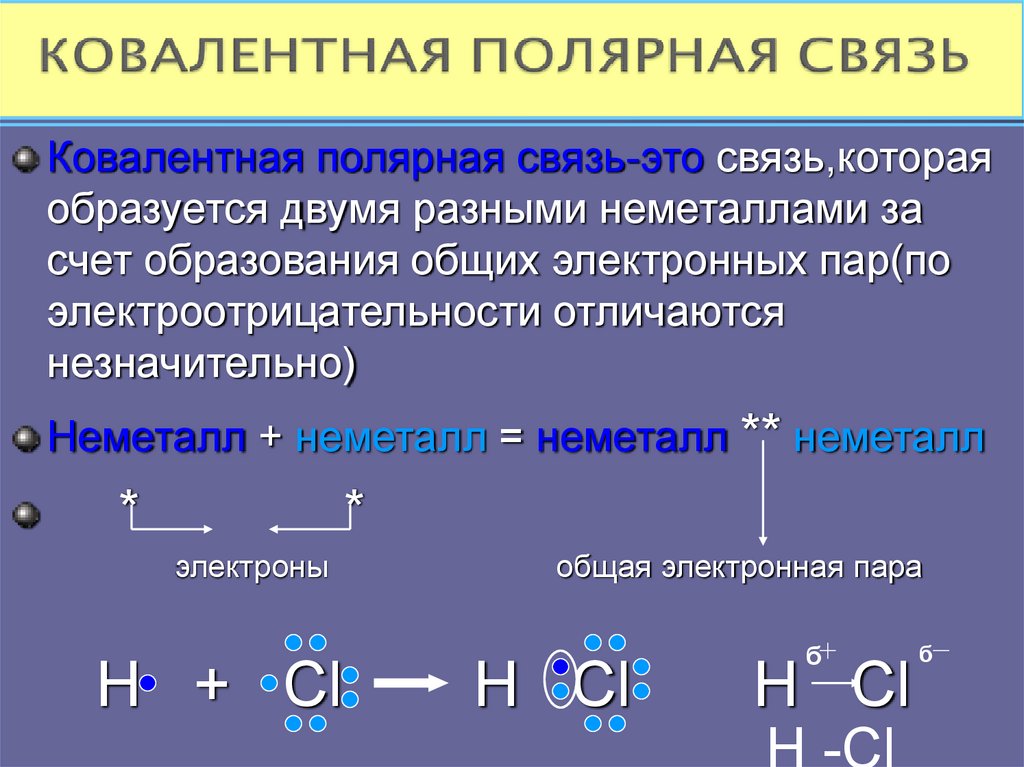
Ковалентная полярная связь-это связь,котораяобразуется двумя разными неметаллами за
счет образования общих электронных пар(по
электроотрицательности отличаются
незначительно)
Неметалл + неметалл = неметалл ** неметалл
*
*
электроны
H + Cl
общая электронная пара
H Cl
б
H Cl
H -Cl
б
15.
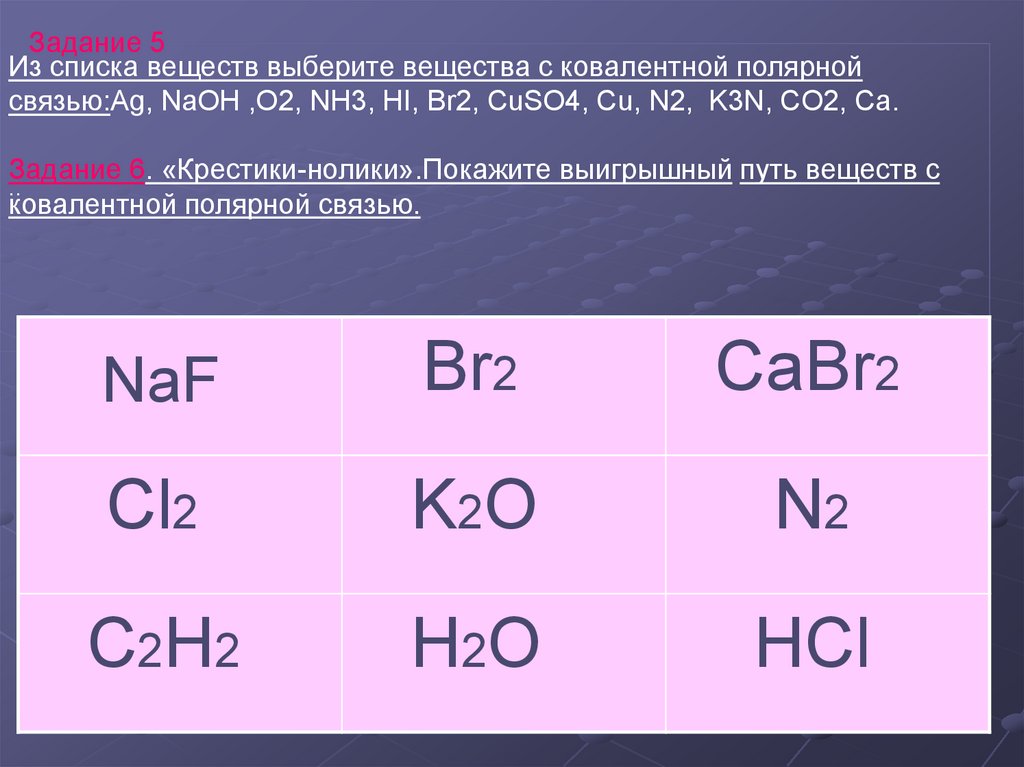
Задание 5Из списка веществ выберите вещества с ковалентной полярной
связью:Ag, NaOH ,O2, NH3, HI, Br2, CuSO4, Cu, N2, K3N, CO2, Cа.
Задание 6. «Крестики-нолики».Покажите выигрышный путь веществ с
..
ковалентной полярной связью.
NaF
Br2
CaBr2
Cl2
K2O
N2
C 2H 2
H2O
HCl
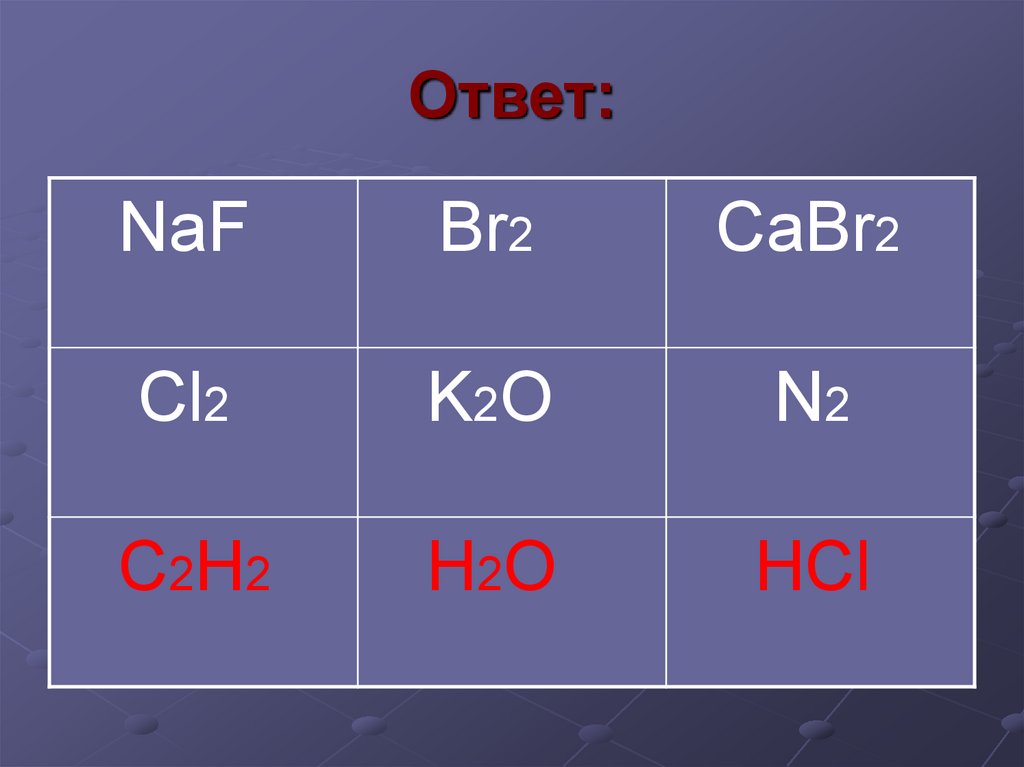
16. Ответ:
NaFBr2
CaBr2
Cl2
K2O
N2
C 2H 2
H 2O
HCl
17. Вещества с ковалентной связью бывают при обычных условиях:
газамижидкостями
твердыми
-- аморфные (расположение частиц в них
неупорядоченное, например – стекло, смола,
полимеры и др.)
-- кристаллические (характеризуются
упорядоченной структурой – NaCl, KNO3 ….)
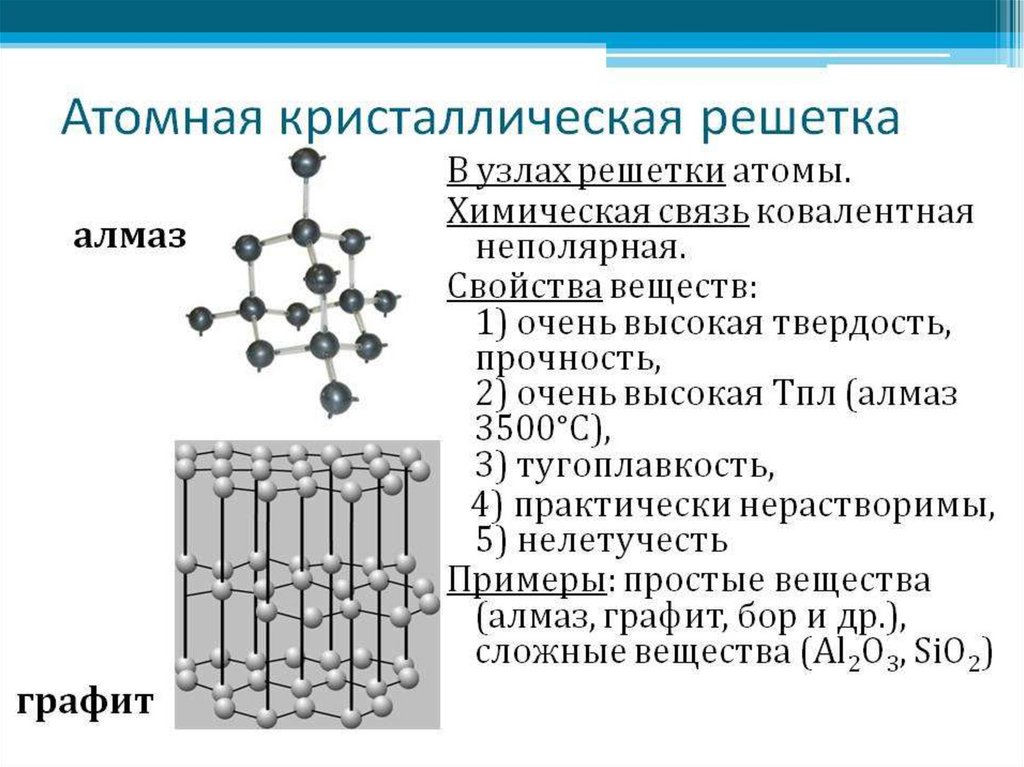
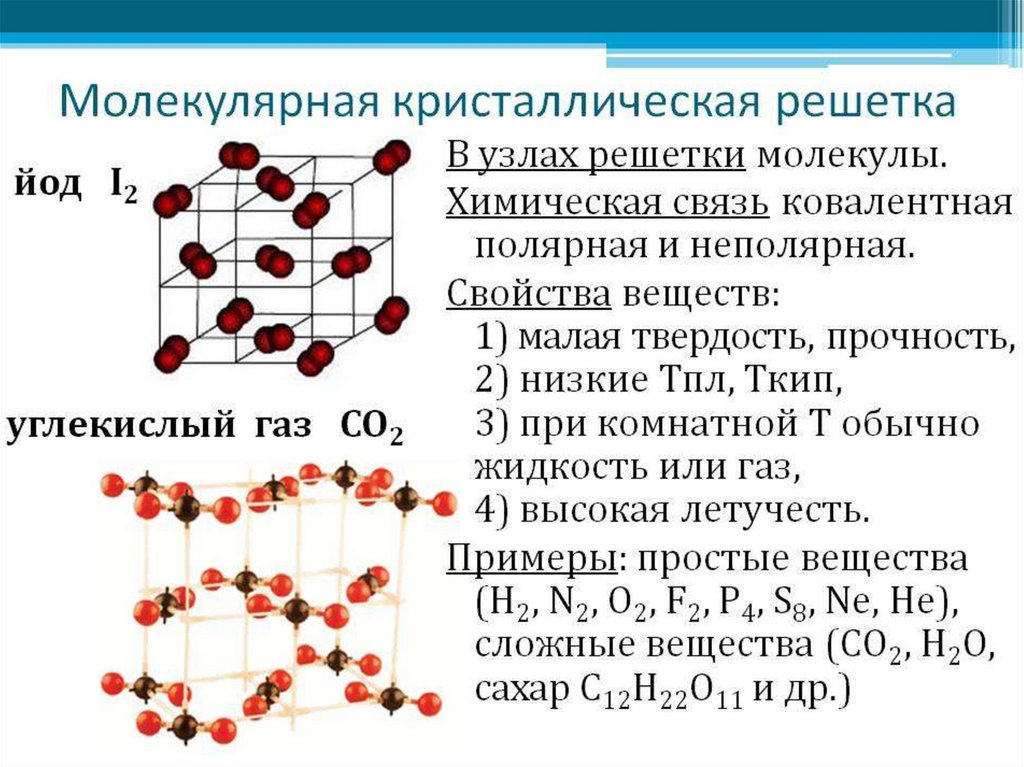
18. Типы кристаллических решеток
Молекулярная(например,Атомная(С,Si,S)
О2, Н2О)
Модель
кристаллической
решетки
йода.
Алмаз
Графит
Кристаллы йода
19.
20.
21. Число общих электронных пар равно числу связей между двумя атомами, или кратности связи
Простая (одинарная связь) образуется за счет перекрыванияэлектронных облаков на линии, соединяющей центры атомов (ϭ-связь)
Н2
ϭ (s – s)
Сl2
ϭ (р – р)
НCl
ϭ (s – р)
Двойная связь содержит ϭ и π – связи. π – связи образуются за счет
бокового перекрывания р и d облаков:
Тройная связь содержит ϭ и две π – связи.
Полуторная связь (электронные облака «размазаны» между тремя и
четырьмя атомами)
Н О N
О
О
22. Параметры ковалентной связи:
Длина связи – расстояние между центрами двухсоседних атомов (зависит от радиуса атома и
кратности связи);
Энергия связи – количество энергии, которую нужно
затратить на разрыв 1 моля связи;
Кратность связи – число общих электронных пар
между двумя атомами;
Валентный угол – угол между лучами, выходящими
из центра одного атома к центрам двух соседних
атомов;
Полярность связи – неравномерное распределение
электронной плотности между атомами в молекуле
23. Металлическая химическая связь осуществляется свободными электронами, общими для всего кристалла.
Металлы образуют металлические кристаллическиерешетки, в узлах которых находятся катион-атомы, а
между ними «электронный газ», определяющий такие
физические свойства металлов, как металлический блеск,
тепло и электропроводность.
Свойства веществ:Твердость, ковкость, электрическая
проводимость и теплопроводность,
ковкость, пластичность,
металлический блеск.
24. Водородная химическая связь – это электростатическое притяжение между положительно поляризованными атомами водорода одной
молекулы и отрицательно поляризованнымиатомами (F, O, N) другой молекулы.
Механизм образования водородной связи близок к донорноакцепторному ( R –Н δ+ …. Э δ- – R)
Межмолекулярная водородная связь (значительно влияет на
агрегатное состояние, плотность, температуры кипения и
плавления, теплоту парообразования и т.д.)
δ-
δ+
О
Н
С
Н
δ+
О
δ-
С
Н
О
Н
О
Внутримолекулярные водородные связи играют большую
роль в формировании вторичной структуры белков,
поддержании двойной спирали ДНК, сложной формы т-РНК
25. Особенности водородной химической связи.
1. Связь относится к межмолекулярной;возможно образование внутримолекулярной
водородной связи.
2. Водородная связь вторая по образованию в
веществе, поэтому более слабая.
3. Тем не менее она ответственна за
ассоциацию молекул.
4. Водородная связь оказывает влияние на
свойства вещества, т.к. нужна
дополнительная энергия для разрыва
водородной связи.















 Химия
Химия








